Значение комплексного подхода в диагностике аутоиммунного гастрита: клиническое наблюдение
- Аннотация
- Статья
- Ссылки
- English



Введение
На настоящий момент хронический атрофический гастрит (ХАГ) рассматривается как первый этап многоступенчатой модели канцерогенеза желудка (каскад Correa), что обусловливает его клиническое значение в рамках реализации программ скрининга и ранней диагностики [1]. Два последних систематических обзора и метаанализа демонстрируют, что обобщенная распространенность ХАГ в специально проведенных исследованиях составляет 25–25,4% [2, 3]. Инфекция H. pylori является абсолютно доминирующим этиологическим фактором ХАГ во всем мире [1, 4]. По последним данным, около 43,1% глобальной популяции и 36,4% населения России инфицировано данным микроорганизмом [5, 6]. Второе место в этиологической структуре ХАГ занимает аутоиммунная агрессия к париетальным клеткам эпителия желудка [7].
Аутоиммунный гастрит (АИГ) – это заболевание, которое поражает преимущественно тело и дно желудка с последующей атрофией слизистой оболочки вследствие выработки аутоантител к париетальным клеткам желудка против Н+,К+-АТФазы и аутоантител к внутреннему фактору Касла, что в дальнейшем приводит к ахлоргидрии, гипергастринемии и, как следствие, железодефицитной анемии (ЖДА), В12-дефицитной анемии и развитию нейроэндокринных опухолей желудка I типа [8, 9]. В настоящее время считается, что АИГ не связан с аденокарциномой желудка, за исключением случаев одновременного или предшествующего инфицирования H. pylori [10]. Глобальная распространенность АИГ варьирует от 0,5 до 4,6% и имеет тенденцию к росту [9]. При этом АИГ преимущественно встречается у женщин, в соотношении 3:1 [8]. В настоящее время доказана связь АИГ с другими аутоиммунными заболеваниями, такими как сахарный диабет первого типа, витилиго, целиакия, миастения и др. [9, 11]. Наиболее часто (более чем в 50% случаев) АИГ сочетается с аутоиммунным тиреоидитом [12].
Как правило, АИГ и Н. pylori имеют разные модели поражения желудка. В отличие от АИГ, который поражает исключительно тело и дно желудка, Н. pylori затрагивает антральный отдел. Существует гипотеза, согласно которой Н. pylori может быть триггером АИГ у генетически предрасположенных лиц вследствие молекулярной мимикрии между антигенами бактерии и H+,K+-АТФазой [13]. Ряд проведенных эпидемиологических исследований показывают, что у большого числа пациентов с установленным диагнозом АИГ в настоящий момент времени выявлена инфекция Н. pylori или была в анамнезе. Однако эта гипотеза все еще обсуждается. Согласно другой гипотезе, АИГ является самостоятельным заболеванием [8].
В связи с тем что АИГ протекает малосимптомно либо бессимптомно, он часто диагностируется на поздних стадиях заболевания. При этом для верификации диагноза необходимо комплексное клиническое, лабораторное и инструментальное обследование пациента. При подозрении на АИГ одним из основных методов неинвазивной диагностики атрофии слизистой оболочки желудка является анализ крови на гастропанель. Клинически значимым является снижение уровня пепсиногена I и отношения пепсиногенов I/II, так как уровень пепсиногена II остается зачастую без изменений в связи с его секрецией железами антрального отдела желудка, которые не поражаются при АИГ [1]. Следует отметить, что атрофический гастрит – это прежде всего диагноз морфологический и при выявлении маркеров атрофии по данным анализа крови на гастропанель рекомендовано проведение эзофагогастродуоденоскопии (ЭГДС) с биопсией из пяти стандартных точек по Сиднейской системе с последующим гистоморфологическим исследованием биоптатов слизистой желудка по системе OLGA (Operative Link for Gastritis Assessment) для уточнения стадии атрофии и степени воспаления слизистой оболочки желудка [14, 15]. Диагноз подтверждается при выявлении антител к париетальным клеткам и внутреннему фактору [16].
Клинический случай
Больная Е., 48 лет, в июне 2022 г. проходила обследование в рамках эпидемиологического исследования распространенности Н. pylori в Москве (грант АНО «Московский центр инновационных технологий в здравоохранении», соглашение № 0903-1/22 от 21.032022), включавшее в себя проведение 13С-уреазного дыхательного теста на наличие инфекции Н. pylori, а также анализа крови на гастропанель для выявления антител IgG к Н. pylori и маркеров атрофии слизистой оболочки желудка (пепсиноген I, пепсиноген II, гастрин 17).
Пациентка предъявляла жалобы на чувство тяжести, распирания в эпигастрии при переедании. Из анамнеза заболевания известно, что жалобы на тяжесть, дискомфорт в эпигастральной области после приема пищи беспокоят пациентку в течение восьми лет, после набора веса (после второй беременности). Эпизодически принимала прокинетики, ингибиторы протонной помпы с положительным эффектом, симптомы диспепсии купировались, но на непродолжительное время. Ранее не обследовалась. Аллергические реакции на лекарственные препараты отрицает. Наследственность не отягощена.
Данные физикального обследования: общее состояние удовлетворительное. Кожные покровы и видимые слизистые обычной окраски и влажности, тургор кожи не снижен. Повышенного питания (индекс массы тела – 28,3 кг/м2). В легких дыхание везикулярное, хрипов нет. Частота дыхания – 16 в минуту, частота сердечных сокращений – 68 в минуту, артериальное давление – 130/90 мм рт. ст. Живот не вздут. При пальпации живот мягкий, безболезненный. Печень у края реберной дуги. Селезенка не пальпируется. Стул ежедневный оформленный, без патологических примесей.
Показатели клинического и биохимического анализа крови в пределах референсных значений.
13С-уреазный дыхательный тест свидетельствовал об отсутствии инфекции Н. pylori (степень обсеменения – Delta over Baseline, DOB – 0,8‰). Антитела IgG к Н. pylori также были в пределах референсных значений. Однако обращали на себя внимание низкий уровень пепсиногена I – 1,40 мкг/л (норма – 30,00–160,00 мкг/л) и отношение пепсиногенов I/II – 0 (норма – 3–20) (табл. 1). В связи с наличием у больной маркеров атрофии слизистой желудка ей было предложено проведение ЭГДС с биопсией из пяти стандартных точек по Сиднейской системе с последующим гистоморфологическим исследованием биоптатов слизистой желудка по системе OLGA.
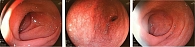
При ЭГДС: слизистая желудка умеренно диффузно гиперемирована, в теле местами атрофична, складки сглажены, в антральном отделе прослеживается подслизистый сосудистый рисунок (рис. 1). Перистальтика удовлетворительная, симметричная. Угол не изменен. Привратник округлый, не деформирован, смыкается полностью, открывается достаточно. Эндоскопические признаки атрофического гастрита 2-p по Kimura and Takemoto.
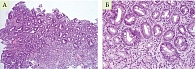
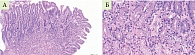
Была произведена биопсия с последующей интерпретацией патоморфологом по системе OLGA: флакон 1 – два фрагмента – большая и малая кривизна антрального отдела желудка; флакон 2 – один фрагмент – угол желудка; флакон 3 – два фрагмента – тело желудка – большая и малая кривизна тела желудка (рис. 2 и 3).
Заключение по морфологическому исследованию от 08.09.2022:
- В препарате два фрагмента слизистой оболочки антрального отдела желудка – гиперплазия клеток поверхностного и ямочного эпителия. На поверхности эпителия скопления желчных мицелл. Зоны субнуклеарной вакуолизации цитоплазмы и участки десквамации клеток поверхностного эпителия. Желудочные ямки глубокие. Очаги атрофии концевых отделов пилорических желез. Зоны неполной кишечной метаплазии. Собственная пластинка отечна и умеренно инфильтрирована лимфоцитами и плазмоцитами с примесью эозинофилов, в ней наблюдается разрастание пучков коллагеновых и гладкомышечных волокон. Н. pylori не обнаружено.
- Слизистая оболочка антрального отдела желудка – дистрофия и участки десквамации клеток поверхностного эпителия. Дистрофия клеток концевых отделов пилорических желез. Собственная пластинка неравномерно инфильтрирована лимфоцитами и плазмоцитами. В ней наблюдается разрастание пучков гладкомышечных волокон. Н. pylori не обнаружено.
- В препарате два фрагмента слизистой оболочки тела желудка – дистрофия и участки десквамации клеток поверхностного эпителия. Атрофия концевых отделов главных желез. Участки пилорической и неполной кишечной метаплазии. Собственная пластинка отечна и неравномерно инфильтрирована лимфоцитами и плазмоцитами с примесью эозинофилов. Н. pylori не обнаружено.
OLGA: степень III, стадия III.
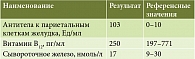
В связи с подозрением на наличие у пациентки АИГ было выполнено иммунологическое исследование для определения уровня витамина В12 и антител к париетальным клеткам желудка (табл. 2).
В связи с повышением уровня антител к париетальным клеткам более чем в 10 раз пациентке было проведено ультразвуковое исследование (УЗИ) щитовидной железы и взят анализ крови на гормоны щитовидной железы. По данным УЗИ щитовидной железы выявлены УЗ-признаки диффузных изменений и повышение васкуляризации паренхимы щитовидной железы, узлов обеих долей щитовидной железы (слева TI-RADS 3, справа TI-RADS 3).
Пациентка консультирована эндокринным хирургом. Пункционная биопсия в настоящее время не рекомендована. Анализ крови на гормоны щитовидной железы патологических изменений не выявил (табл. 3).
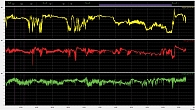
Для оценки секреторной функции желудка пациентке была проведена длительная рН-метрия. Датчики установлены в антральном отделе, теле желудка и кардии. В желудке регистрировали в основном гипоацидные значения рН и кратковременно нормоацидные значения рН в кардии; процент времени с рН в диапазоне от 0,8 до 3,9 – 16,3% (рис. 4). Не исключено потребление кислых продуктов. На основании полученных данных сделано заключение о сниженной кислотопродуцирующей функции желудка.
Для последующего ведения пациентки была выбрана тактика длительного назначения ребамипида (Ребагит) по 100 мг три раза в сутки в течение года.
При контрольной ЭГДС от 15.01.2024: слизистая желудка истончена, местами прослеживается подслизистый сосудистый рисунок, складки сглажены. Перистальтика удовлетворительная, симметричная. Угол не изменен. Привратник округлый, не деформирован, смыкается полностью, открывается достаточно. Эндоскопические признаки атрофического гастрита 0-p по Kimura and Takemoto.
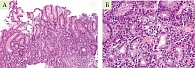
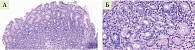
Пациентке повторно выполнена биопсия по системе OLGA (рис. 5, 6).
Заключение по морфологическому исследованию от 15.01.2024:
- В препарате два фрагмента слизистой оболочки антрального отдела желудка. Гиперплазия клеток поверхностного и ямочного эпителия. Желудочные ямки глубокие. Очаги атрофии концевых отделов пилорических желез. Собственная пластинка отечна и умеренно инфильтрирована лимфоцитами и плазмоцитами с примесью эозинофилов. В ней наблюдается разрастание пучков коллагеновых и гладкомышечных волокон. Н. pylori не обнаружено.
- Слизистая оболочка антрального отдела желудка. Гиперплазия клеток поверхностного и ямочного эпителия. Шеечные отделы желез удлинены и имеют извилистый ход. Концевые отделы пилорических желез – без изменений. Участки гиперплазии нейроэндокринных клеток. Собственная пластинка слабо инфильтрирована лимфоцитами и плазмоцитами. В ней наблюдается разрастание пучков гладкомышечных волокон. Н. pylori не обнаружено.
- В препарате два фрагмента слизистой оболочки тела желудка. Гиперплазия клеток поверхностного и ямочного эпителия. Атрофия концевых отделов главных желез. Участки пилорической метаплазии и гиперплазии нейроэндокринных клеток. Собственная пластинка отечна и неравномерно инфильтрирована лимфоцитами и плазмоцитами с примесью эозинофилов. В ней расположены небольшие фолликулоподобные скопления лимфоцитов. Н. pylori не обнаружено.
OLGA: степень II, стадия III.
При сравнении с препаратами № 22.2.14345 за 2022 г. отмечается положительная динамика, что проявляется в уменьшении выраженности воспалительной инфильтрации и исчезновении участков кишечной метаплазии в антральном отделе и теле желудка.
Кроме того, пациентке выполнено молекулярно-генетическое исследование методом полимеразной цепной реакции в режиме реального времени с последующим секвенированием по Сэнгеру, которое показало наличие полиморфизма гена TLR2 (rs111200466), ассоциированного с более высоким риском развития рака желудка (табл. 4) [17].
Обсуждение и заключение
Представленный клинический случай демонстрирует, что АИГ является диагностически сложным заболеванием в связи с его мало- или бессимптомным течением, а также необходимостью проведения ряда дорогостоящих методов обследования пациентов (ЭГДС с биопсией по OLGA, иммунологические исследования). Кроме того, в повседневной клинической практике врачи эндоскописты и гастроэнтерологи проявляют недостаточную настороженность в отношении АИГ [18–20]. По данным многочисленных исследований, риск развития нейроэндокринных опухолей желудка первого типа у пациентов с АИГ в два – четыре раза выше, чем в популяции. АИГ является заболеванием с неспецифической симптоматикой, в связи с чем пациенты с АИГ нуждаются в длительном динамическом амбулаторном наблюдении с обязательным эндоскопическим контролем и оценкой степени и стадии гастрита по OLGA, проведением иммуногистохимического исследования для оценки рисков развития рака желудка и своевременного осуществления необходимых мер канцеропревенции [21–23].
На настоящий момент специфической долгосрочной терапии АИГ не разработано. Рекомендована заместительная терапия при выявлении дефицита витамина В12 и железа. С учетом того что АИГ является формой ХАГ, важными целями терапии являются разрешение воспалительных процессов и предотвращение прогрессирования атрофических изменений в слизистой оболочке желудка [14, 24]. В настоящем клиническом примере продемонстрировано, что длительное применение ребамипида (Ребагит)
100 мг три раза в сутки в течение 12 месяцев способствовало регрессу патоморфологических изменений слизистой оболочки желудка: уменьшению выраженности воспалительной инфильтрации и исчезновению участков кишечной метаплазии в антральном отделе и теле желудка. Действительно, терапия ребамипидом обеспечивает нейтрализацию перекисного окисления липидов, способствует улучшению кровоснабжения и восстановлению эпителиального барьера слизистой, что позволяет рассматривать данный препарат как средство для лечения ХАГ, включая АИГ [25, 26]. Помимо этого, ребамипид способствует регрессу синдрома повышенной эпителиальной проницаемости, который наблюдается у пациентов с ХАГ и является кофактором персистирования воспалительного процесса в слизистой желудка [27]. В двух независимых исследованиях K. Haruma и соавт. (2002) и T. Kamada и соавт. (2015) с длительным периодом наблюдения (12 месяцев) показано, что терапия ребамипидом приводит к регрессу морфологических признаков хронического гастрита, выражающихся в уменьшении лимфоцитарно-нейтрофильной инфильтрации слизистой оболочки желудка [28, 29]. Недавнее пилотное рандомизированное плацебо-контролируемое исследование (53 пациента, перенесших эндоскопическую резекцию по поводу дисплазии желудка или раннего рака желудка) показало достоверный регресс степени ХАГ по данным гистологии через год в группе лиц, получавших ребамипид (до лечения – 1,870 ± 0,932, после лечения – 1,430 ± 0,986; p = 0,013) [30]. Согласно практическим рекомендациям совета экспертов «Эпителий-протективная терапия при коморбидных заболеваниях» (2022), ребамипид обладает доказанной клинической эффективностью при ряде органических заболеваний желудочно-кишечного тракта, включая хронические гастриты, и курсовая терапия данным препаратом способствует редукции симптоматики и позитивно влияет на течение этих заболеваний [31].
M.V. Chebotareva, K.A. Nikolskaya, PhD, D.S. Bordin, PhD, Prof., E.V. Parfenchikova, PhD, S.G. Khomeriki, PhD, Prof., N.A. Neyasova, L.A. Tsapkova, PhD, D.N. Andreev, PhD
A.S. Loginov Moscow Clinical Scientific Center
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Russian University of Medicine, Moscow
Tver State Medical University
Contact person: Margarita V. Chebotareva, m.chebotareva@mknc.ru
Chronic atrophic gastritis (CAG) is the first stage of gastric carcinogenesis, which is why early diagnosis of the disease is important. The main etiological factors of CAG are Helicobacter pylori infection and autoimmune gastritis (AIG).
The prevalence of H. pylori in the world is up to 43.1%, and in Russia – 36.4%. The prevalence of AIG is significantly lower and ranges from 0.5 to 4.6% and tends to increase. AIG is often diagnosed in the late stages of the disease due to an asymptomatic or low-symptomatic course, which should increase the alertness of endoscopists and gastroenterologists regarding this disease. Patients need long-term dynamic follow-up with EGDS and assessment of the stage of atrophy and the degree of inflammation according to OLGA (Operational Link for Gastritis Assessment). With AIG, the risk of developing neuroendocrine gastric tumors of the first type increases two to four times in comparison with healthy people. At the moment, there is no etiopathogenetic treatment for AIG. Symptomatic therapy with vitamin B12 and iron preparations is recommended if their deficiency is detected.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.