Первичная медиастинальная В-крупноклеточная лимфома, имитирующая кардиальную патологию: сложности ранней диагностики
- Аннотация
- Статья
- Ссылки
- English
Цель представленной работы – анализ клинического случая ПМВКЛ с редким дебютом и обсуждение роли междисциплинарного подхода в постановке диагноза и ведении пациента.
Основные положения. Пациентка 29 лет обратилась с жалобами на выраженную брадикардию и головокружение. По результатам ЭКГ диагностирована атриовентрикулярная блокада 3-й степени. После установки временного электрокардиостимулятора и проведения лучевой диагностики выявлено объемное образование в переднем средостении. При гистологическом и иммуногистохимическом исследовании биоптата подтвердился диагноз ПМВКЛ IV стадии. На фоне комплексного обследования и участия врачей различных специальностей пациентке начата терапия по протоколу R-DA-EPOCH.
Заключение. Данный клинический случай подчеркивает важность онконастороженности при интерпретации нетипичных симптомов у молодых пациентов, а также демонстрирует значимость мультидисциплинарного взаимодействия в ранней диагностике и инициации лечения.
Цель представленной работы – анализ клинического случая ПМВКЛ с редким дебютом и обсуждение роли междисциплинарного подхода в постановке диагноза и ведении пациента.
Основные положения. Пациентка 29 лет обратилась с жалобами на выраженную брадикардию и головокружение. По результатам ЭКГ диагностирована атриовентрикулярная блокада 3-й степени. После установки временного электрокардиостимулятора и проведения лучевой диагностики выявлено объемное образование в переднем средостении. При гистологическом и иммуногистохимическом исследовании биоптата подтвердился диагноз ПМВКЛ IV стадии. На фоне комплексного обследования и участия врачей различных специальностей пациентке начата терапия по протоколу R-DA-EPOCH.
Заключение. Данный клинический случай подчеркивает важность онконастороженности при интерпретации нетипичных симптомов у молодых пациентов, а также демонстрирует значимость мультидисциплинарного взаимодействия в ранней диагностике и инициации лечения.
Введение
Первичная медиастинальная (тимическая) В-крупноклеточная лимфома (ПМВКЛ) представляет собой редкий и отдельный подтип неходжкинских лимфом, который выделяется уникальными клиническими, гистологическими и молекулярно-генетическими особенностями.
ПМВКЛ преимущественно поражает молодых людей (средний возраст – около 35 лет) и демонстрирует более высокую частоту встречаемости у женщин. Заболевание составляет около 2–4% всех случаев неходжкинских лимфом и около 7% среди диффузных крупных В-клеточных лимфом, что подчеркивает его редкость и важность изучения [1].
Клиническая картина ПМВКЛ характеризуется объемным образованием в переднем средостении, которое может вызывать симптомы, связанные с компрессией или инвазией окружающих структур: кашель, боль в грудной клетке, одышку и синдром верхней полой вены (ВПВ) [2].
Гистологически заболевание проявляется диффузной пролиферацией средних и крупных В-клеток на фоне различной степени фиброза, с неоднородной экспрессией CD30 и маркеров В-клеток [2]. На молекулярном уровне ПМВКЛ выделяется специфическими генетическими изменениями, такими как амплификация региона 9p24.1, что приводит к сверхэкспрессии PD-L1 и PD-L2, играющих ключевую роль в механизмах уклонения опухоли от иммунного ответа. Также значительная роль в патогенезе отводится конститутивной активации JAK-STAT и NF-κB сигнальных путей, которые способствуют выживанию и пролиферации опухолевых клеток [3].
Прогностически ПМВКЛ отличается благоприятным исходом при своевременном лечении. Комбинация химиотерапии (схема CHOP) и лучевой терапии позволяет достигать 5-летней выживаемости у 65% пациентов. Однако наличие факторов риска, таких как низкая работоспособность человека, перикардиальный выпот, объемное образование или высокий уровень лактатдегидрогеназы (ЛДГ), ассоциируется с худшими результатами [2].
Заболеваемость ПМВКЛ растет с каждым годом. Но благодаря достижениям в понимании биологических особенностей ПМВКЛ за последние десятилетия, были разработаны и внедрены современные подходы к терапии, включая таргетные препараты, что значительно улучшило прогноз заболевания для пациентов [4].
Цель представленного исследования – анализ редкого клинического случая первичной медиастинальной В-крупноклеточной лимфомы с атипичным началом в виде полной атриовентрикулярной (АВ) блокады, с акцентом на сложности диагностики и значимости междисциплинарного подхода в лечении.
Клинический случай
Женщина, 29 лет, мать троих детей, обратилась в поликлинику г. Москвы в октябре 2024 г.
Этап 1 – первичное обращение. 8 октября пациентка обратилась к терапевту филиала № 5 Клинико-диагностического центра (КДЦ) № 4 Департамента здравоохранения г. Москвы с признаками острой инфекции дыхательных путей. На приеме жаловалась на урежение пульса до 32 уд/мин в ночные часы и до 45 уд/мин в дневное время на протяжении около двух недель; головокружение при ортостазе и отдельные предобморочные эпизоды и одышку. По результатам консультации терапевта, учитывая характер жалоб, пациентке сделана электрокардиограмма (ЭКГ), а сама она направлена на прием к кардиологу. На ЭКГ-пленке от 08.10.2024 г. описана АВ-блокада 1-й степени с PQ 410 мс. Со слов пациентки, она росла и развивалась согласно возрасту, наследственность не отягощена, аллергический анамнез без особенностей. Результаты физикального осмотра: на момент первичного осмотра общее состояние удовлетворительное. Положение тела активное. Температура тела – 37 °С. Подкожные лимфатические узлы не увеличены. Тоны сердца ясные, ритмичные, шумов не выявлено. Артериальное давление – 110/70 мм рт. ст. Одышка смешанная, возникает при физической нагрузке. Частота дыхательных движений – 18 в минуту. Перкуторный звук притупленный. В легких при аускультации дыхание ослаблено. Хрипы отсутствуют.
В ходе опроса на приеме у кардиолога КДЦ 11 октября пациентка вспомнила, что в момент урежения пульса вызывала скорую медицинскую помощь. С ее слов, приехавший по вызову врач сделал ЭКГ, но нарушения ритма и проводимости не были зарегистрированы. Кардиолог КДЦ дал направления на эхокардиографию (ЭхоКГ) и холтеровское мониторирование ЭКГ (ХМ-ЭКГ). В течение пяти дней – состояние без изменений. Предварительный диагноз – нарушение ритма и проводимости, АВ-блокада 1-й степени, острая респираторная вирусная инфекция легкой степени тяжести, реконвалесценция.
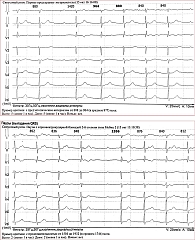
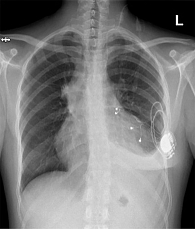
Этап 2 – углубленное кардиологическое обследование. 16 октября ХМ-ЭКГ выявило шесть эпизодов наджелудочкового эктопического ритма с АВ-блокадой 2-й степени 2-го типа с максимальной паузой 1932 мс, со средней частотой сердечных сокращений (ЧСС) 59 уд/мин, длительностью около 10 минут, возникших в покое; пароксизм предсердной тахикардии с АВ-блокадой 2-й степени 2-го типа с ЧСС до 51 уд/мин, длительностью 6 с; удлинение корригированного QT-интервала от 450 до 506 мс в течение 15 минут (рис. 1). На ЭхоКГ – признаки тромбоэмболии легочной артерии (ТЭЛА), выраженная легочная гипертензия, значительный гидроперикард, недостаточность трикуспидального клапана 3-й степени и митрального клапана 2-й степени. Снята повторно ЭКГ, показавшая АВ-блокаду 3-й степени. Срочно вызвана бригада скорой медицинской помощи, пациентка госпитализирована в реанимационное отделение городской клинической больницы им. В.В. Вересаева. С целью устойчивого контроля за ЧСС установлен временный электрокардиостимулятор (ЭКС). В результате проведенного обследования диагностирована АВ-блокада 3-й степени. Эквиваленты синдрома Морганьи – Адамса – Стокса (МАС). Установка временного однокамерного нечастотно-адаптивного ЭКС от 17.10.2024 г. (рис. 2).
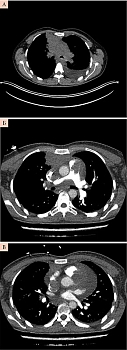
Этап 3 – компьютерная томография (КТ) и онконастороженность. В стационарных условиях выполнена КТ органов грудной клетки с внутривенным контрастированием для исключения ТЭЛА (рис. 3). Описано объемное образование примерными размерами до 64 × 32 × 103 мм в переднем верхнем средостении с распространением в S3 правого легкого и вероятностью вовлечения перикарда. В структуре образования открывается просвет субсегментарных бронхов S3 справа. Гиповентиляция базальных отделов легких. Утолщение междолькового интерстиция в обоих легких, на этом фоне определяются нечеткие субсолидные очаги субплеврально с обеих сторон. Трахея, крупные бронхи проходимы. Состояние после установки центрального венозного катетера, дистальный конец катетера в просвете ВПВ. Дефект контрастирования просвета ВПВ протяженностью до 65 мм. Дефект контрастирования просвета легочного ствола протяженностью до 46 мм. Скопление выпота в полости перикарда толщиной слоя до 32 мм. Внутригрудные лимфоузлы не дифференцируются. Выпот в плевральных полостях не определяется. Аксиллярные лимфоузлы не увеличены. «Свежих» костных травматических изменений в зоне контрастирования не выявлено.
Выполнено ультразвуковое исследование органов брюшной полости, признаков патологии не выявлено.
Выполнена биопсия под ультразвуковым наведением. При проведении гистологического исследования обнаружен фрагмент фиброзной ткани с инфильтрацией умеренно полиморфными клетками с крупными гиперхромными ядрами и очаговыми скоплениями ксантомных клеток.
Этап 4 – морфологическая верификация. В результате иммуногистохимического исследования того же образца определен фенотип – клетки опухолевого инфильтрата представлены CD20/CD23/Bc2/Bc6, Pax5 позитивными В-лимфоцитами, экспрессия CD 30 слабо позитивная в единичных клетках, отсутствует экспрессия Td, Oc3/4, CD15, CD3 в активированных Т-лимфоцитах, CD не информативно. Заключение: морфологическая картина и иммунофенотип ПМВКЛ.
Этап 5 – окончательная диагностика. Выполнена позитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ/КТ), выявлены опухолевые массы во всех отделах средостения без четких границ с инфильтрацией перикарда, формированием тромбов в ВПВ, с инфильтрацией правого легкого в парамедиастинальных отделах с SUVmax 15,3. Образование в левом надпочечнике – 25 × 10 мм с SUVmax 11,8. Образование в левом яичнике – 58 × 50 мм с SUVmax 14,4. Выпот в плевральной полости – до 20 мм.
Лабораторные исследования крови проводились на каждом этапе. Общий анализ крови – без отклонений; в биохимическом анализе крови уровни ЛДГ – 324,8 Ед/л; креатинина – 79 мкмоль/л; мочевой кислоты – 341 мкмоль/л.
Клинический диагноз. ПМВКЛ с поражением средостения, левого надпочечника, левого яичника, IV стадия. ТЭЛА. Тромб в области устья легочной артерии. Тромбоз ВПВ, легочного ствола (онкоассоциированный). Окклюзионный тромбоз глубокой бедренной вены, поверхностной бедренной вены с обеих сторон. Гипертоническая болезнь 3-й стадии, артериальная гипертензия 3-й степени, риск 4-й (очень высокий). Камни желчного пузыря без холецистита. Желчнокаменная болезнь, ремиссия. Остеохондроз позвоночника. Варикозная болезнь правой нижней конечности.
Дифференциальная диагностика. При первичном выявлении АВ-блокады с целью исключения других нарушений ритма и проводимости, а также уточнения диагноза ТЭЛА рассматривалась как основной диагноз с учетом пола, возраста и характера жалоб. Однако после проведения дополнительных исследований стало очевидно, что первичным было новообразование средостения. Проведение биопсии служит стандартом для верификации диагноза, по ее результатам и был установлен окончательный диагноз.
Медицинские вмешательства. Изначально после госпитализации был установлен временный однокамерный нечастотно-адаптивный ЭКС. Затем, через две недели, выполнена имплантация двухкамерного ЭКС Medtronic Attesta DR MRI SNFNB211604G.
Лечение. Проведено пять курсов полихимиотерапии (ПХТ) по схеме R-DA-EPOCH. Терапия проводилась на фоне сопроводительного лечения (аллопуринол 100 мг/сут, ривароксабан 15 мг/сут, ко-тримоксазол 480 мг/сут). С целью профилактики нейтропении введен гранулоцитарный колониестимулирующий фактор (эмпэгфилграстим 7,5 мг подкожно).
Динамика и исходы. После второго курса ПХТ в январе 2025 г. проведена ЭхоКГ. Относительно исследования, выполненного в октябре 2024 г., до начала терапии, наблюдается положительная динамика, а именно: полости сердца не расширены, отмечены уменьшение размеров тромба ствола легочной артерии, а также незначительная легочная гипертензия и следы жидкости в перикарде. Пациентка демонстрирует высокую приверженность к проводимому лечению. На фоне курса ПХТ по схеме R-DA-EPOCH у нее развился апластический гемопоэтический синдром, проявляющийся панцитопенией 3-й степени, что потребовало проведения поддерживающей терапии и коррекции дозы химиопрепаратов.
Обсуждение
Представленный клинический случай иллюстрирует редкий и диагностически сложный дебют ПМВКЛ, манифестировавшей изолированными нарушениями ритма и проводимости сердца. Согласно действующим клиническим рекомендациям, типичная картина ПМВКЛ включает симптомы компрессии структур средостения (одышка, кашель, синдром ВПВ), тогда как кардиологические проявления, особенно без выраженного увеличения лимфатических узлов, встречаются крайне редко и не входят в перечень ведущих признаков заболевания [5–7].
Данный случай выделяется отсутствием типичной лимфаденопатии и наличием признаков ТЭЛА и массивного тромбоза ВПВ, что может быть связано как с объемом опухоли, так и с онкоассоциированной гиперкоагуляцией – важным компонентом в патогенезе ПМВКЛ, который требует своевременной профилактики тромбоэмболических осложнений [8]. Такой ход событий подчеркивает необходимость соблюдения рекомендаций по профилактике венозных тромбоэмболий у пациентов с лимфопролиферативными заболеваниями, особенно при массивных опухолевых поражениях.
Постановка диагноза в данном случае стала возможной благодаря полному алгоритму диагностики, включающему визуализирующие методы (КТ, ПЭТ/КТ), биопсию и иммуногистохимическое исследование, что полностью соответствует российским и международным рекомендациям [6, 9]. Использование интенсивной схемы химиотерапии R-DA-EPOCH в данном случае позволило добиться положительной динамики, что также подтверждается результатами длительных наблюдений как отечественных, так и зарубежных авторов [10–12]. Подход к лечению ПМВКЛ зависит от стадии заболевания, клинического состояния пациента и иммуноморфологических характеристик опухоли. Ниже представлены основные схемы терапии, используемые в современной клинической практике:
- Иммунохимиотерапия R-CHOP (включает ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизолон). Применялась на ранних этапах, но в настоящее время не является предпочтительной схемой при ПМВКЛ, поскольку ассоциирована с высокой частотой рецидивов при массивных опухолях [13].
- Дозоадаптированная схема R-DA-EPOCH, выбранная для лечения данной пациентки (включает ритуксимаб, этопозид, преднизолон, винкристин, доксорубицин, циклофосфамид (дозоадаптировано)), является схемой выбора при ПМВКЛ (стадии II–IV). К преимуществам относятся высокая эффективность, возможность избежать лучевой терапии во многих случаях [14].
- Схема R-MACOP (включает ритуксимаб, метотрексат, доксорубицин, циклофосфамид, винкристин, преднизолон, блеомицин). Используется в европейской практике, более токсична, особенно у пожилых.
- Лучевая терапия. Назначается при резидуальных образованиях или ПЭТ-позитивных очагах после химиотерапии; после R-DA-EPOCH в большинстве случаев не требуется.
- К дополнительным подходам при осложненном течении или рецидиве относятся:
- высокодозная химиотерапия с аутологичной трансплантацией гемопоэтических стволовых клеток (применяется при рефрактерности или раннем рецидиве; схемы BEAM, BuCy и др.);
- иммунотерапия (ингибиторы PD-1) (используется при рефрактерной ПМВКЛ с гиперэкспрессией PD-L1);
- препараты – ниволумаб, пембролизумаб (в рамках клинических исследований);
- CAR-T-клеточная терапия (экспериментальный метод лечения рецидивирующей ПМВКЛ [15]; потенциально эффективен при устойчивости к стандартной терапии).
Выбор терапии должен учитывать стадию заболевания, молекулярный профиль опухоли и общую соматическую переносимость пациентом интенсивной химиотерапии. Специфика при IV стадии (как в данном случае): предпочтение отдается R-DA-EPOCH без лучевой терапии; обязательно проведение ПЭТ/КТ после 2–4 циклов, чтобы оценить метаболический ответ; в случае отсутствия полной ремиссии возможна эскалация терапии или добавление лучевой терапии.
В литературе описано немного случаев, где ПМВКЛ дебютировала с нарушений сердечного ритма, однако подобные проявления отмечаются как возможные, в основном при вовлечении перикарда или проводящей системы опухолевой массой [10, 11, 16]. Это делает представленный случай особенно ценным для практикующих врачей, подчеркивая важность онконастороженности при атипичных симптомах у молодых пациентов без установленной органной патологии.
Таким образом, надо отметить, что ПМВКЛ может дебютировать с атипичной кардиологической симптоматикой, включая АВ-блокаду 3-й степени, что затрудняет раннюю диагностику. При наличии нарушений проводимости сердца у молодых пациентов необходимо исключать объемные образования средостения, особенно если наблюдаются дополнительные симптомы. Диагностика ПМВКЛ требует комплексного подхода с обязательным участием специалистов смежных дисциплин (кардиологов, онкологов, гематологов, радиологов). Протокол R-DA-EPOCH является эффективной схемой терапии ПМВКЛ IV стадии, обеспечивая высокий уровень контроля над заболеванием.
Описанное наблюдение дополняет клиническую картину ПМВКЛ и демонстрирует значимость комплексного междисциплинарного подхода к пациентам с нехарактерной симптоматикой, особенно при подозрении на онкопатологию в условиях амбулаторной практики.
Заключение
ПМВКЛ относится к экстранодальным опухолям, происходящим из В-клеток мозгового слоя тимуса. Данное заболевание чаще встречается у молодых женщин и характеризуется преимущественно местнораспространенным ростом в пределах переднего верхнего средостения. Однако, как показал представленный клинический случай, возможны и запущенные формы заболевания.
Ввиду редкости ПМВКЛ в амбулаторной практике и ее способности маскироваться под заболевания дыхательной и сердечно-сосудистой систем данная патология представляет значительную диагностическую сложность, особенно для терапевтов. Раннее выявление отклонений по результатам рутинных методов диагностики, таких как ЭКГ (например, изменения сегмента ST или зубца T) и флюорография (расширение средостения), требует повышенной онконастороженности.
Таким образом, для улучшения диагностики ПМВКЛ необходимо повышать осведомленность врачей о данной патологии, активно использовать методы визуализации (КТ, магнитно-резонансная томография) при подозрении на объемное образование средостения, внедрять междисциплинарный подход с участием терапевтов, онкологов и радиологов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без задействования грантов и финансовой поддержки от общественных, некоммерческих и коммерческих организаций.
Этическая экспертиза. От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая 22.03.2025 г.
A.S. Ryazanov, PhD, Prof., T.A. Chebotareva, M.V. Makarovskaya, PhD, Z.S. Gevorkyan
Russian Medical Academy of Continuous Professional Education, Moscow
Clinical and Diagnostic Center No. 4 of the Moscow Department of Health
Contact person: Maria V. Makarovskaya, marja.makarovska@mail.ru
Primary mediastinal (thymic) large B-cell lymphoma (PMLBCL) is a rare, aggressive variant of non-Hodgkin's lymphoma and is most often diagnosed in young women. This clinical case demonstrates an atypical onset of the disease with cardiac symptoms, which hampered timely diagnosis.
Aim of this article is to analyze a clinical case of PMLBCL with a rare onset and discuss the role of a multidisciplinary approach in diagnosis and patient management.
Key points. A 29-year-old female patient presented with complaints of severe bradycardia and dizziness. An ECG revealed third-degree atrioventricular block. After placement of a temporary pacemaker and imaging, a space-occupying lesion was detected in the anterior mediastinum. Histological and immunohistochemical examination of the biopsy confirmed the diagnosis of stage IV PMLBCL. Following a comprehensive examination and the participation of physicians from various specialties, the patient was initiated on therapy using the R-DA-EPOCH protocol.
Conclusion. This clinical case highlights the importance of oncovigilance when interpreting atypical symptoms in young patients and demonstrates the significance of multidisciplinary collaboration in early diagnosis and treatment initiation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.