Развитие дистальной атриовентрикулярной блокады как осложнение многократно перенесенного COVID-19
- Аннотация
- Статья
- Ссылки
- English

Введение
Новая коронавирусная инфекция (COVID-19) привела к глобальной пандемии и оказалась в центре внимания всего медицинского сообщества. Вирус поражает прежде всего дыхательную систему. Между тем примерно у 20–30% госпитализированных пациентов с COVID-19 развиваются осложнения со стороны сердечно-сосудистой системы, среди которых наименее изучены нарушения ритма и проводимости [1–3]. Наличие двух- и трехпучковой блокады рассматривается как неблагоприятный фактор внезапной сердечной смерти. У пациентов с бифасцикулярной блокадой по сравнению с общей популяцией существенно выше риск прогрессирования до полной атриовентрикулярной (АВ) блокады и желудочковых аритмий, что приводит к увеличению сердечно-сосудистой смертности. Как показали результаты исследований, нарушение проводимости независимо от степени и уровня приводит к увеличению смертности от всех причин [4, 5].
Клинический случай
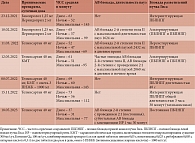
Пациент М., 1949 года рождения, в феврале 2022 г. обратился к кардиологу в Национальный медицинский исследовательский центр (НМИЦ) им. В.А. Алмазова с жалобами на перебои в работе сердца, дискомфорт в грудной клетке, одышку при минимальной физической нагрузке (ФН), снижение толерантности к нагрузке. В анамнезе ишемическая болезнь сердца (ИБС), в 1993 г. госпитализация в стационар по месту жительства по поводу нестабильной стенокардии, гипертонической болезни с максимальным уровнем артериального давления до 160/90 мм рт. ст., а также частая, симптомная предсердная экстрасистолия, в связи с чем долгое время принимал периндоприл 2 мг и бисопролол 1,25 мг с положительным эффектом. В период с 2020 по 2022 г. четырежды перенес COVID-19 (вирус идентифицирован), однократно с поражением легких (площадь поражения 35%), что потребовало госпитализации. При обследовании высокочувствительный тропонин отрицательный. Получал терапию азитромицином, дексаметазоном и фавипиравиром по схеме, рекомендованной для лечения COVID-19. При поступлении на электрокардиограмме (ЭКГ) впервые описана полная блокада левой ножки пучка Гиса (ПБЛНПГ), при выписке – синусовый ритм без нарушений проводимости. После третьего заражения и лечения симптоматическими средствами в домашних условиях появились жалобы на перебои в работе сердца. При проведении холтеровского мониторирования (ХМ) 23 декабря 2021 г. обращало на себя внимание появление интермиттирующей полной блокады правой ножки пучка Гиса (ПБПНПГ) (таблица). Пациент продолжал принимать бисопролол и периндоприл. В феврале 2022 г. перенес четвертое заражение COVID-19 (вирус идентифицирован). Лечился амбулаторно, однако через неделю после выздоровления появилась одышка при минимальной ФН, хотя поражение легких, по данным компьютерной томографии (КТ), исключалось.
На момент обращения в феврале 2022 г. в НМИЦ им. В.А. Алмазова при объективном осмотре: телосложение правильное, сердцебиение неритмичное, частота сердечных сокращений (ЧСС) – 65 в минуту, тоны сердца сохранены. В остальном без особенностей. Пациенту назначили дообследование с целью постановки диагноза и определения дальнейшей тактики ведения.
Результаты лабораторных обследований: в общем анализе крови показатели в пределах референсных значений, в биохимическом анализе крови – нецелевые значения липопротеинов низкой плотности (2,12 ммоль/л), уровень калия – 4,9 ммоль/л, высокочувствительный тропонин отрицательный, антимиокардиальные антитела отрицательные, острофазовые показатели в норме, эутиреоз.
Согласно результатам ХМ от 18 февраля 2022 г., на фоне приема 1,25 мг бисопролола сохранялась брадикардия, средняя ЧСС днем – 65 в минуту, ночью – 57 в минуту (максимальная ЧСС днем – 102 в минуту, снижение циркадного индекса до 114%), эпизоды ПБЛНПГ и ПБПНПГ в сочетании с АВ блокадой 2-й степени типа II в утренние часы с максимальной длительностью пауз 1624 мс (рис. 1). Эхокардиография (ЭхоКГ) не выявила значимой структурной патологии сердца: фракция выброса левого желудочка (ЛЖ) по Симпсону – 68%, умеренная дилатация левого предсердия (индекс объема – 40 мл/м²), концентрическое ремоделирование ЛЖ, зон нарушения локальной сократимости, диастолической дисфункции ЛЖ не выявлено, клапаны интактны, расчетное давление в легочной артерии не повышено. Данных о воспалительном поражении миокарда не получено. С учетом анамнеза 20 февраля 2022 г. была выполнена коронарография: стеноза коронарных артерий не выявлено. Для исключения транзиторной ишемии, вызывающей нарушения проведения в период бодрствования, 22 февраля проведена стресс-ЭхоКГ с отменой бисопролола: проба отрицательная, признаков преходящей ишемии, нарушений проведения на фоне нагрузки нет. Для исключения перенесенного миокардита пациенту 25 февраля выполнена магнитно-резонансная томография (МРТ) сердца с внутривенным контрастированием: признаков перенесенного миокардита и данных в пользу ИБС нет. На основании результатов обследований выставлен основной диагноз: гипертоническая болезнь II стадии. Контролируемая артериальная гипертензия. Риск 3 (высокий). Осложнения основного заболевания: хроническая сердечная недостаточность (с сохраненной фракцией выброса ЛЖ), II функциональный класс по NYHA. Транзиторная АВ блокада 2-й степени типа II. Альтернирующая внутрижелудочковая блокада (ПБПНПГ и ПБЛНПГ лекарственно-индуцированная?). Сопутствующие заболевания: дислипидемия. Гемодинамические незначимый атеросклероз брахиоцефальных артерий. Правосторонний нефроптоз. Эутиреоз. Коронавирусная инфекция от 2020 г. (№ 2), 2021 г. (поражение легких 35%), 2022 г. Постковидный синдром.
Для лечения основного заболевания назначены телмисартан 40 мг утром, аторвастатин 10 мг один раз на ночь.
Дистальный характер выявленных нарушений проводимости – показание для установки электрокардиостимулятора (ЭКС), но необходимо исключить влияние приема бета-блокаторов. Пациенту рекомендовано выполнить ХМ на фоне отмены бисопролола.
Через месяц после отмены бета-блокаторов 11 марта 2022 г. проведено ХМ: синусовый ритм с персистирующей ПБПНПГ, выраженная брадикардия в течение суток. АВ блокада 2-й степени типа II – преимущественно днем с максимальной паузой 2432 мс и общей длительностью 5 часов с ЧСС от 48 до 73 в минуту. Симптомы одышки, перебои в работе сердца сохранялись, синкопальных состояний не отмечалось. С учетом наличия симптомной синусовой брадикардии признаками дистальной трехпучковой блокады с нарушением АВ проведения пациенту показана имплантация двухкамерного ЭКС с функцией частотной адаптации, согласно национальным клиническим рекомендациям – IС (УУР А, УДД 3) [6]. Однако от установки ЭКС пациент отказался, сославшись на относительно удовлетворительное самочувствие. Назначена кардиометаболическая терапия (КМТ): этилметилгидроксипиридина сукцинат 100 мг три раза в день в течение месяца, далее по 100 мг два раза в день в течение двух месяцев, Коэнзим Q10 100 мг один раз в день, комбинированный препарат (в составе одной таблетки: инозин 0,05 г, никотинамид 0,025 г, рибофлавин 0,005 г, янтарная кислота 0,3 г) по две таблетки два раза в день, курс – один месяц. Выбор препаратов обусловлен проявлениями постковидного синдрома. В состав терапии включены антиоксидантные, антигипоксические, противоастенические и нейропротекторные средства.
Через месяц КМТ пациент отмечал улучшение состояния, повышение работоспособности, уменьшение одышки, синкопальных состояний не было. По данным трехсуточного мониторирования ЭКГ от 12 мая 2022 г., сохранялась брадикардия в течение суток, максимальная ЧСС днем – 81 в минуту, вновь зарегистрированы альтернирующие ПБПНПГ и ПБЛНПГ, АВ блокады 2-й степени с проведением 2:1 в дневное и ночное время с максимальной паузой 2060 мс. Таким образом, у пациента сохранялись показания к установке постоянного ЭКС, но он по-прежнему отказывался от имплантации, ссылаясь на улучшение самочувствия. Рекомендован вызов скорой медицинской помощи в случае ухудшения самочувствия, обморочного состояния. К терапии добавлены омега-3 полиненасыщенные жирные кислоты 1000 мг/сут.
Через три месяца КМТ при очередном осмотре сохранялась тенденция к улучшению самочувствия, эпизодов синкопальных или пресинкопальных состояний не было. ХМ от 8 июля 2022 г.: синусовый ритм с повышением среднесуточных значений ЧСС. В течение 48 с при ЧСС более 121 в минуту тахизависимая ПБЛНПГ. АВ проведение в норме. Впоследствии рекомендовано продолжить прием телмисартана, аторвастатина с контролем через три месяца. Самочувствие удовлетворительное, эпизодов головокружений, слабости, предобморочных состояний не наблюдалось, повседневные ФН пациент выполнял без ограничений, сердцебиения не беспокоили.
ХМ от 15 ноября 2022 г. показало синусовый ритм с транзиторной тахизависимой ПБЛНПГ общей длительностью 3 часа 30 минут. Брадикардии, нарушений АВ проведения не зафиксировано. Пациент оставался под наблюдением в поликлинике НМИЦ им. В.А. Алмазова, показаний к имплантации ЭКС не выявлено, рекомендовано продолжать прием телмисартана, аторвастатина, повторить курс КМТ через три месяца.
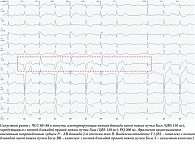
Спустя шесть месяцев пациент обратился за специализированной помощью в связи с ухудшением самочувствия: жалобы на редкий пульс до 35 ударов в минуту, выраженную слабость, одышку при ходьбе по квартире. При этом синкопальных состояний, новых эпизодов вирусных инфекций не зарегистрировано. ХМ от 18 мая 2023 г. показало прогрессирующий характер АВ проведения: в течение всего времени наблюдения регистрировался синусовый ритм с ПБЛНПГ и АВ блокадой 2-й степени с проведением 2:1, ЧСС – 31–49 в минуту, днем эпизоды субтотальной АВ блокады с замещающим идиовентрикулярным ритмом с ЧСС 30–33 в минуту, полиморфные желудочковые эктопические комплексы (2% всех QRS) (рис. 2). Зарегистрированные ПБЛНПГ и АВ блокада 2-й степени с проведением 2:1 свидетельствовали о дистальном характере блокады. Идиовентрикулярный ритм представлен относительно узкими комплексами QRS (105 мс), однако частота импульсов 30–33 в минуту указывала на локализацию водителя ритма в области ствола пучка Гиса. В кратчайшие сроки пациенту был имплантирован двухкамерный частотно-адаптированный ЭКС с положительным клиническим эффектом.
Обсуждение
Способность инфекции COVID-19 вызывать повреждение сердца стала предметом серьезной дискуссии. В литературе последних лет высказывается несколько предположений о потенциальных механизмах поражения сердечно-сосудистой системы, обусловленных инфекцией SARS-CoV-2: прямое повреждение миокарда с развитием миокардита, электролитные нарушения, цитокиновый шторм, микрососудистые тромбозы на фоне гиперкоагуляции, дестабилизация атеросклеротических бляшек с развитием острого коронарного синдрома. Отдельный вклад вносит лекарственная терапия в связи с кардиотоксическим и аритмогенным эффектом.
По данным аутопсии, в миокарде обнаружены воспалительные клетки и вирус SARS-CoV-2, что позволяет в ряде случаев предположить прямую инвазию в кардиомиоциты [7].
Нарушение проводимости возможно как во время заражения, так и после выздоровления. В одном из обзоров показано, что у 89,8% пациентов, госпитализированных по поводу тяжелой инфекции COVID-19, развились нарушения проводимости во время заболевания. При этом у 10,2% пациентов блокада сердца возникла после выздоровления [8].
Согласно имеющимся данным, коронавирус способен поражать вегетативную нервную систему. Проявления могут быть обусловлены недостаточностью либо избыточной активностью симпатических или парасимпатических систем, частота встречаемости – от 2,5 до 26% [9].
Не следует забывать и о других причинах появления АВ блокад и блокад ножек пучка Гиса, таких как ИБС, клапанный порок, кардиомиопатия, миокардит, дисфункция щитовидной железы, электролитные нарушения, прием некоторых лекарственных препаратов и иные инфекционные заболевания [10].
В представленном клиническом случае структурных изменений сердца не обнаружено, серийные маркеры тропонина отрицательные, уровень калия, натрия и магния в сыворотке крови, функциональные тесты щитовидной железы в норме, что исключало дисэлектролитные и дисгормональные изменения. Несмотря на наличие в анамнезе эпизода нестабильной стенокардии, при настоящем обследовании ИБС и, как следствие, нарушение проводимости были исключены на основании результатов коронарографии и стресс-ЭхоКГ. МРТ сердца не выявила критериев миокардита – дегенеративных, инфильтративных или воспалительных процессов. Исключено влияние лекарственных препаратов и какой-либо другой инфекции, кроме COVID-19. Таким образом, можно предположить, что основной причиной возникновения нарушения проводимости стала перенесенная инфекция COVID-19. Пациент М. долгое время до возникновения нарушений проводимости принимал бета-адреноблокаторы. В одном из обзоров семи клинических случаев подчеркивается, что два пациента также получали ритм-урежающие препараты до возникновения брадиаритмии, однако это не считалось основным фактором, провоцирующим брадикардию [11]. Кроме того, отмена препарата в представленном случае не привела к положительной динамике.
D. Kir и соавт. наблюдали брадикардию и интермиттирующую АВ блокаду высокой степени у пациента с COVID-19. При этом ЭхоКГ и биомаркеры повреждения миокарда находились в пределах нормы, что имело место и в нашем случае [12].
A. Malekrah и соавт. описали аналогичный клинический случай: мужчина, 71 год, госпитализирован по поводу новой коронавирусной инфекции. При поступлении выявлена АВ блокада 2-й степени с проведением 2:1 с интермиттирующей БЛНПГ, которая прогрессировала до персистирующей БЛНПГ и пароксизмальной формы фибрилляции/трепетания предсердий с брадикардией. При этом уровень тропонина был отрицательным. В течение 14 дней сохранялись АВ блокада 2-й степени и БЛНПГ, что послужило поводом для имплантации двухкамерного ЭКС. Указывается на необратимое повреждение сердца при COVID-19, возникающее в остром периоде в проводящей системе без воспаления и повреждения миокарда [13].
В литературе описаны разные варианты течения АВ блокады у пациентов с COVID-19. Некоторым пациентам требуется установка ЭКС, однако не исключено спонтанное разрешение АВ блокады [1].
В последнее время появляется все больше работ о влиянии КМТ на течение COVID-19. Так, омега-3-полиненасыщенные жирные кислоты облегчают сердечно-сосудистые осложнения, обусловленные COVID-19, в основном благодаря иммуномодулирующему и антиоксидантному потенциалам, а также способности поддерживать гомеостаз тканей [14].
Коэнзим Q10 является сильным противовоспалительным средством, снижающим уровни фактора некроза опухоли альфа, интерлейкина 6, С-реактивного белка и других провоспалительных цитокинов у пациентов с COVID-19 [15]. Упоминается также об эффективности этилметилгидроксипиридина сукцината как препарата, улучшающего автоматическую активность синусового узла и проводимость в АВ узле [15].
В других работах показано, что применение этилметилгидроксипиридина сукцината повышает уровень восстановленных нуклеотидов, способствует сохранению уровня эндогенных антиоксидантов и усиливает антиоксидантную защиту клетки, что может быть важно в условиях инфекционного процесса [16].
Многокомпонентный препарат с инозином, никотинамидом, рибофлавином, янтарной кислотой, обладая противовоспалительным, антиоксидантным и антигипоксантным эффектами, положительно влияет на энергообразование в клетке, уменьшает продукцию свободных радикалов, восстанавливает активность ферментов антиоксидантной защиты, активирует окислительно-восстановительные ферменты дыхательной цепи митохондрий, ресинтез макроэргов, способствуя утилизации глюкозы и жирных кислот. Это позволяет сделать вывод о целесообразности использования препарата при реабилитации пациентов с постковидным синдромом [17].
В представленном случае курсовая КМТ продемонстрировала положительный эффект. На момент осмотра в декабре 2022 г. показаний к установке ЭКС не было, но повреждения системы проведения, обусловленные COVID-19, носили необратимый характер. Нам удалось лишь отсрочить момент установки ЭКС. Временное восстановление проведения позволило пациенту психологически подготовиться к имплантации устройства, от которой он сначала категорически отказался.
В доступной литературе мы не нашли описания случаев АВ блокады после многократного заражения COVID-19. Возможно, этот факт также усугубил клиническое течение у пациента М. Многократность заражения скорее всего говорит об отсутствии стойкого иммунитета к часто мутирующему вирусу COVID-19 или повышенной восприимчивости пациента.
Особенностью данного клинического случая является волнообразное течение. После второго заражения зафиксирована транзиторная ПБЛНПГ, а спустя три месяца после последнего заражения – АВ блокада 2-й степени типа II и трехпучковая блокада. При этом значимых гемодинамических проявлений не отмечалось, пациент находился на амбулаторном наблюдении и отказывался от установки ЭКС. В течение полугода на фоне КМТ наблюдался постепенный регресс, что привело к снятию показаний к имплантации. Однако прогрессирование через шесть месяцев до постоянной ПБЛНПГ и субтотальной АВ блокады потребовало экстренной имплантации ЭКС.
Заключение
Механизм повреждения проводящей системы сердца, вызванный COVID-19, в значительной степени неизвестен. У пациентов с новой коронавирусной инфекцией в анамнезе следует в динамике оценивать поражения АВ соединения и системы Гиса – Пуркинье по данным мониторирования ЭКГ. Необходимы дополнительные исследования электрофизиологических нарушений проводящей системы, чтобы определить краткосрочное и долгосрочное влияние инфекции SARS-CoV-2, основные механизмы и факторы риска развития аритмий при COVID-19, их прогностическое значение, а также влияние кардиометаболической терапии.
Отношение и деятельность. Авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Благодарность. Авторы благодарят за помощь в подготовке клинического случая заведующую НИЛ электрокардиологии Т.В. Трешкур.
Источник финансирования. Исследование выполнено при финансовой поддержке государственного задания Минздрава России (ЕГИСУ НИОКТР 123021000126-0).
Т.Е. Ivanova, A.Yu. Sotskov
V.A. Almazov National Medical Research Center
Contact person: Tatyana E. Ivanova, tulinta@mail.ru
The pandemic of the new coronavirus infection has led to a wide range of complications, including cardiovascular ones. The article presents a clinical case of distal atrioventricular block in an elderly man who has repeatedly suffered COVID-19. The possible mechanisms of this complication and treatment options are analyzed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.