Пищевая анафилаксия: проблемы пациента, врача и общества
- Аннотация
- Статья
- Ссылки
- English



Определения и классификация
Любые неблагоприятные реакции, связанные с приемом пищи, контактом или ингаляцией пищевых продуктов либо пищевых добавок, называются побочными реакциями, вызванными пищевыми продуктами.
Основные определения неблагоприятных реакций на пищу, предложенные экспертами проблемной комиссии по номенклатуре EAACI (European Academy of Allergy and Clinical Immunology – Европейская академия аллергологии и клинической иммунологии) [1], включают в себя:
- пищевую гиперчувствительность – любую извращенную реакцию на пищу;
- пищевую аллергию – реакции гиперчувствительности к пище, обусловленные иммунологическими механизмами;
- IgE-опосредованную пищевую аллергию – случаи пищевой аллергии с установленной ролью IgE.
Все остальные реакции, ранее относимые к пищевой непереносимости (food intolerance), когда участие иммунных механизмов не доказано, следует считать неаллергической пищевой гиперчувствительностью [2].
Тяжелые аллергические генерализованные реакции на пищу рассматриваются как пищевая анафилаксия.
Наиболее часто используемые определения анафилаксии представлены в национальных клинических рекомендациях и позиционных статьях EAACI и WAO (World Allergy Organization – Всемирная организация по аллергии). В них указано следующее: «Анафилаксия – это тяжелая угрожающая жизни системная реакция гиперчувствительности; она характеризуется быстрым началом и жизнеугрожающими проблемами со стороны дыхательных путей, дыхания, кровообращения и обычно, но не всегда ассоциирована с изменениями на коже и слизистых» [3].
Существуют и другие определения анафилаксии:
- тяжелая жизнеугрожающая генерализованная или системная реакция гиперчувствительности;
- тяжелая аллергическая реакция, которая характеризуется быстрым началом развития и способна привести к смерти [4–11].
Пищевые аллергены
Пищевые аллергены – это белки гликопротеины молекулярной массой 10–70 kDa, содержащиеся в пищевых продуктах, реже – полипептиды, гаптены, которые соединяются с белками пищи. Пищевые аллергены имеют трехмерную структуру, хорошо растворимы в воде, некоторые термостабильны, устойчивы к воздействию протеолитических ферментов. Аллергенность пищевых белков зависит от множества эпитопов, а также от пространственной конфигурации молекулы, представляющей эти эпитопы. Эпитопы – части белковой молекулы (антигены), которые связываются со специфическими антителами и определяют состояние иммунореактивности [12, 13].
IgE-опосредованные аллергические реакции описаны в отношении более чем 170 пищевых аллергенов. Теоретически любой продукт может вызвать аллергическую реакцию. Однако чаще всего причиной аллергии становятся восемь продуктов: коровье молоко, яйцо, арахис, соя, пшеница, орехи, рыба и ракообразные [14].
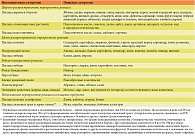
В зависимости от возраста роль пищевых аллергенов варьирует (табл. 1).
Помимо того что пищевые продукты сами по себе являются аллергенами, существует проблема скрытых аллергенов/триггеров в пищевых продуктах. Речь идет:
- о суррогатных заменителях продуктов;
- перекрестно реагирующих пищевых аллергенах;
- контактных аллергенах с перекрестной реакцией на пищевые компоненты;
- продуктах, содержащих не свойственные им загрязнители, например мучных продуктах, контаминированных аллергенами амбарных клещей при неправильном хранении, или рыбных и морепродуктах, контаминированных паразитами, такими как живые нематоды Anisakis simplex;
- пищевых добавках, в частности оранжево-красном красителе кармине из кошенили.
Принято выделять два класса пищевых аллергенов. Первый включает в себя продукты «большой восьмерки», относящиеся к водорастворимым гликопротеинам молекулярной массой от 10 дo 70 kDa, устойчивые к нагреванию, кислотам, протеазам, являющиеся первичными сенсибилизаторами и вызывающие сенсибилизацию через желудочно-кишечный тракт. Второй класс пищевых аллергенов отвечает за формирование перекрестной реактивности. Как правило, это белки растительного происхождения, имеющие высокую гомологию с пыльцевыми аллергенами, термолабильные, быстро разрушаемые, трудно изолируемые, связанные с пыльцевым и пищевым аллергическими синдромами. До последнего времени хорошие стандартизированные экстракты из них для проведения диагностических процедур отсутствовали [15, 16].
Типичные перекрестные реакции
У детей старшего возраста, подростков и взрослых значительную часть всех IgE-опосредованных пищевых аллергических реакций вызывают перекрестно реагирующие (кросс-реактивные) аллергены, присутствующие как в пищевых продуктах, так и в ингаляционных (пыльцевых) аллергенах. Для возникновения перекрестной реактивности обычно достаточно 40–70% идентичности аминокислотной последовательности в белках аллергена.
При формировании перекрестной реактивности уже после первого употребления пищи, содержащей кросс-реактивные аллергены, могут наблюдаться как местные легкие, так и тяжелые системные реакции анафилаксии.
Развитие молекулярной биологии и появление новых методов идентификации белковых молекул в последние десятилетия позволили получить информацию о структурных и функциональных свойствах растительных аллергенов, сходстве аминокислотной последовательности и пространственной конфигурации молекул.
Большинство пациентов с пыльцевой аллергией имеют поливалентную сенсибилизацию к пыльце разных видов растений, что обусловливает возможность множества перекрестных реакций.
Многие перекрестные реакции связаны с так называемыми патогенетическими белками (pathogenesis-related proteins – PR) [17].
Патогенетические белки синтезируются в растениях под воздействием стрессовых ситуаций, таких как инфекция, ультрафиолетовое облучение, неблагоприятные метеорологические условия, ряд химических веществ, механические повреждения. В некоторых тканях и органах растений, например в пыльце или плодах, кумуляция этих белков особенно высока. Патогенетические белки обеспечивают первую фазу защиты растений от инфекций и других раздражителей. Согласно классификации патогенетических белков, в основе которой лежит их аминокислотная последовательность или ферментная и биологическая активность, выделяют 14 групп (PR1 – PR14). Наиболее значимыми для развития пищевой аллергии белков с перекрестной реактивностью считаются протеины групп 2, 3, 5, 10. Так, РR2-белки – гидролитические ферменты бета-1,3-глюкозаназы (защищают растения от грибковой инфекции) демонстрируют перекрестную чувствительность с овощами и фруктами (фруктово-латексный синдром). Один из таких ферментов, обладающих выраженной сенсибилизирующей активностью, был выделен из натурального латекса, полученного из Hevea brasiliensis, и охарактеризован как один из аллергенов латекса (Hev b2). Гомологичные ему пептиды содержат многие фрукты и овощи, особенно авокадо, бананы, киви, инжир, каштаны, томаты и картофель.
РR3-белки – эндохитиназы отвечают за перекрестную аллергию с овощами/фруктами, латексом. К хитин-связывающим протеинам относятся аллергены латекса – прогевеин (Hev b6.01) и гевеин (Hev b6.02), а также главный аллерген авокадо (Pres al), аллергены банана (Mus a1) и каштана (Cas s5). Между ними имеются перекрестные реакции.
PR5-белки отвечают за сладкий вкус и называются тауматиноподобными белками, защищают растения от засухи, грибков. К PR5-белкам относят главные аллергены яблока Mal d2 и вишни Pru av 2.
PR10-белки – рибонуклеазы, гомологи Bet v1 – основного аллергена пыльцы березы. Гомологичные ему протеины представлены в большинстве цветущих растений: Cor a1 – главный аллерген пыльцы орешника, Ma1 d1 – главный аллерген яблока, аллергены вишни – Pru av1, абрикоса – Pru ar1, груши – Руг c1, сельдерея – Api g1, моркови – Dau c1. Гомологичные Bet v1 протеины также обнаружены в петрушке и картофеле. PR10-белки косточковых, пасленовых имеют структурную гомологию с пыльцой березы, ольхи, орешника, каштана, дуба, фундука, желудя [18–20].
Современным чувствительным методом исследования, позволяющим различать перекрестные реакции, происходящие после приема пищи у пациентов с пыльцевой аллергией, является компонент-специфическая аллергодиагностика. Использование молекулярной диагностики аллергии улучшает понимание роли клинически значимых кросс-реактивных компонентов в аллергии на пыльцу и продукты питания.
Перекрестное реагирование присуще также большой группе липид-переносящих белков (lipid transfer proteins – LTP), которые встречаются в пыльце растений и фруктах и обеспечивают перекрестные реакции между этими двумя источниками аллергенов. Пыльцевые LTP описаны как аллергены в различных растениях (амброзии, полыни, японском кедре, оливе, платане и постеннице) и могут вызывать не только респираторные симптомы, но и симптомы пищевой аллергии.
Аллергены плодов розоцветных растений (Рru р3 персика, Pru ar3 абрикоса и Mal d3 яблока) также представляют собой LTP. IgE-антитела к LTP обнаружены у больных, имеющих аллергические реакции на названные фрукты, но не сенсибилизированных к пыльцевым аллергенам [21, 22].
Результаты исследований показывают связь между сенсибилизацией к компоненту пыльцы полыни Art v3 и аллергическими реакциями на фрукты семейства «Розоцветные», например персик. Белок Art v3 служит важным диагностическим маркером пищевой аллергии, поскольку аминокислотная последовательность этого аллергокомпонента и липид-переносящего белка персика Pru p3 совпадает более чем на 40%. Гомологичность данных аллергенов лежит в основе кросс-реактивности «полынь – персик».
Аллергенные белки, вызывающие распространенные перекрестные реакции, часто называют паналлергенами. Из растительных аллергенов, являющихся паналлергенами, но не относящихся к PR-белкам, особое значение в формировании пищевой аллергии имеют профилины [23]. Это актин-связывающие протеины, способствующие организации цитоскелета из сети актиновых филаментов. Они являются низкомолекулярными белками, встречающимися во всех растительных клетках и играющими важную роль в развитии большого количества перекрестных реакций, в том числе так называемого березо-полынь-фруктово-овощного синдрома. Каждая эукариотическая клетка содержит структурно сходный профилин.
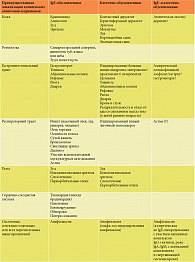
В таблице 2 представлены адаптированные данные [18, 19] о перекрестных реакциях между ингаляционными и пищевыми аллергенами.
В ряде эпидемиологических исследований, клинических наблюдений и обзорах показано, что степень риска развития перекрестных реакций зависит от особенностей иммунного ответа организма, основных характеристик аллергена (растворимость, устойчивость к перевариванию), его концентрации, путей сенсибилизации (респираторный или желудочно-кишечный тракт) и факторов, усиливающих аллергенные свойства белка (физическая нагрузка, этанол) [24–27]. Риск развития перекрестных реакций в силу перечисленных обстоятельств варьирует в широких пределах (табл. 3) [28].
Интерес к изучению перекрестной реактивности не угасает, выявляются новые варианты потенциального сочетанного действия на организм при пыльцевой аллергии гомологичных с пыльцой белков вируса. Перекрестная реактивность между аллергеном постенницы Par o1 и протеином VP4 ротавируса, вызывающего гастроэнтериты у детей, углубляет наше представление о косенсибилизации и эволюции механизмов защиты от инфекции и аллергии [19, 29].
С развитием молекулярной диагностики и описанием молекулярных особенностей пищевых аллергенов существенно расширились представления о перекрестной реактивности между разными источниками аллергенов. Понимание аллергических реакций, связанных с перекрестной активностью аллергенов, позволяет врачу-аллергологу обеспечить соответствующий подход к лечению и профилактике аллергии, оценить виды и тяжесть аллергических реакций. Пациенты с аллергией на определенные компоненты пыльцы и пищевых продуктов должны быть подробно проинформированы о возможных аллергических реакциях. Рекомендации по соблюдению диеты и отказа от продуктов питания, содержащих потенциально кросс-реактивные белки, должны предоставляться с учетом риска перекрестных реакций.
Клинические проявления, связанные с пищевой аллергией, предполагают наличие множества симптомов, обусловленных разными механизмами развития и вовлечением в патологический процесс различных органов и систем (табл. 4) [15, 30].
Среди клинических симптомов пищевой аллергии преобладают кожные (90%), респираторные (70%), реже отмечаются гастроинтестинальные (30–45%) и циркуляторные, вплоть до коллапса (10–45%). Среди тяжелых аллергических реакций у детей преобладают респираторные нарушения, а у взрослых – циркуляторные [3, 30–31].
Респираторные, кожные, системные проявления пищевой аллергии распознаются лучше, чем гастроинтестинальные. Изолированные IgE-опосредованные симптомы поражения желудочно-кишечного тракта редки. Характерно сочетание дерматологических и желудочно-кишечных симптомов, связанных с атопической гиперчувствительностью [32].
Тяжесть клинических проявлений имеет строгую градацию [13]:
- cтупень I. Конъюнктивит, ринит, синдром оральной аллергии (oral allergy syndrome – OAS), простая генерализованная крапивница, ангиоотек губ и/или лица без симптомов анафилаксии (затрудненного дыхания);
- ступень II. Астма (острый бронхоспазм): кашель, свистящие хрипы, падение показателей PEF (> 15%);
- ступень III. Отек гортани с симптомами асфиксии, анафилаксия (симптомы вовлечения различных органов, включая респираторные симптомы) и анафилактический шок (общий дискомфорт, возбуждение, потеря сознания, сердечно-сосудистый коллапс).
Пищевая анафилаксия
Пищевая аллергия является одной из наиболее распространенных причин анафилаксии. От анафилаксии на пищевые аллергены умирает в шесть-семь раз больше пациентов, чем от укусов насекомых.
Примерно в одной трети случаев у лиц, госпитализированных в стационар по поводу анафилаксии, причиной тяжелых реакций становятся пищевые продукты. При классической анафилаксии в дополнение к желудочно-кишечным симптомам нередко имеют место крапивница, ангиоотек, астма, ринит, конъюнктивит, гипотония, шок и нарушение ритма сердца, вызванные массовым высвобождением медиаторов из тучных клеток и базофилов [33].
Роль триггеров анафилаксии меняется с возрастом и местом регистрации события. Так, наиболее распространенными провокаторами для анафилаксии у пациентов, попадающих в отделение скорой помощи, являются лекарства и пищевые продукты, при этом имеют место некоторые возрастные различия. Наиболее частой причиной анафилаксии у детей становятся пищевые продукты, причем пыльцевая аллергия и астма у них рассматриваются как важные факторы риска [34, 35].
В группе пищевых системных аллергических реакций кроме классической анафилаксии выделяют анафилаксию, вызванную физической нагрузкой, и смертельно опасную пищевую анафилаксию.
Индуцированная физической нагрузкой пищевая анафилаксия (АнИФН) ранее рассматривалась как редкое событие, преимущественно у женщин (75%) и взрослых лиц (средний возраст больных – 37 лет). Однако в последние годы тренды распространенности меняются. При развитии анафилаксии от совместного влияния двух факторов (физической нагрузки и приема пищи до или после упражнений) принято говорить о зависимой от пищи анафилаксии, индуцированной физической нагрузкой. При этом каждый фактор в отдельности не вызывает анафилаксии. Симптомы анафилаксии, индуцированной физической нагрузкой, могут варьировать по степени тяжести. Летальные случаи редки. АнФИН встречается в любых возрастно-половых группах, но чаще у лиц с атопией. Интенсивность нагрузки не является решающим фактором. И у элитных спортсменов, и у лиц с низкой физической активностью возможно появление этого синдрома иногда даже после воздействия слабого физического триггера (например, работа по сгребанию садовых листьев). Механизмы развития АнИФН не совсем ясны. Из-за отсутствия наблюдения за достаточным пулом пациентов отдельными исследовательскими группами уровень доказательности снижается. Поэтому для всесторонней оценки патофизиологических механизмов, потенциального лечения и получения необходимой мощности научных и клинических наблюдений предлагается объединение усилий всех специалистов в единой глобальной сети.
Для АнФИН характерно появление симптомов аллергии при принятии пищи менее чем за два часа до физической нагрузки. Чаще наблюдаются зуд (92%), уртикарии (86%), ангионевротический отек (72%) и одышка (51%). При продолжении нагрузки нарастают симптомы генерализованной крапивницы, отека гортани, бронхоспазма, усугубляются гастроинтестинальные симптомы, развивается коллапс [36, 37].
В ряде случаев анафилаксия возникает при приеме перед нагрузкой любой пищи. Нередко анафилаксия ассоциирована с употреблением определенных продуктов, обычно сельдерея или ракообразных. В последнем случае употребление аллергенных продуктов в пищу, не сопряженное с физической нагрузкой, не вызывает аллергических реакций, несмотря на положительные результаты кожных тестов с соответствующими пищевыми аллергенами. Другими пищевыми аллергенами, ассоциированными с АнИФН, являются в большинстве случаев пшеница, реже томаты, виноград, куры, молочные продукты и грибы [38].
При АнИФН, а также анафилаксии, связанной с употреблением пшеницы, более чем у 80% пациентов обнаруживаются IgE-антитела к рекомбинантному аллергену омега-5 глиадин. Из других белков пшеницы определяются IgE-антитела к таким белкам, как альфа-бета-гамма-глиадин (особенно гамма-глиадин) и высокомолекулярный глютенин [39, 40].
Факторы риска для пищевой АнИФН включают астму и предыдущие аллергические реакции на пищу.
Из патогенетических механизмов АнИФН в настоящее время рассматриваются возможности развития синдрома вследствие:
- увеличения проницаемости желудочно-кишечного барьера под влиянием физических упражнений;
- повышения активности тканевой трансглютаминазы в слизистой оболочке кишечника;
- индуцированного физической нагрузкой перераспределения кровотока и гетерогенности тучных клеток;
- увеличения осмоляльности плазмы крови и активации вследствие этого высвобождения гистамина базофилами;
- индуцированного физической нагрузкой ацидоза и дегрануляции тучных клеток.
Принятие стандартизированного подхода к оценке пациентов с АнИФН с учетом определения роли и пищевой аллергии позволят добиться прогресса в понимании этого состояния [11, 15, 41].
Описан еще один фенотип пищевой анафилаксии, который относится к замедленным реакциям. С 2005 г. изучается роль аллергена альфа-гал (carbohydrate galactose-α-1,3-galactose) – олигосахарида из мяса млекопитающих животных, вызывающего развитие замедленной аллергии. Значимость этого аллергена в возникновении анафилаксии была впервые установлена у онкологических пациентов, получавших моноклональные противораковые антитела (цетуксимаб). Альфа-гал-индуцированная анафилаксия признана основной причиной тяжелых аллергических реакций на цетуксимаб и мясо (говядину, свинину, баранину). Следует отметить, что анафилаксия, связанная с альфа-гал-аллергеном, отличается от классической анафилаксии [42, 43]. Фатальные анафилактические реакции могут вызывать определенные пищевые продукты (арахис, лесные орехи, морепродукты). Сочетание пищевой аллергии с астмой усугубляет тяжесть анафилаксии. Несмотря на то что астма чувствительный маркер тяжести анафилаксии, фатальное течение анафилаксии может быть и у лиц (особенно детей) с пищевой аллергией без астмы [33, 44].
С увеличением распространенности пищевой аллергии и анафилаксии для врача и пациента возрастает потребность в точной диагностике.
Диагноз пищевой аллергии и анафилаксии
Тщательное изучение истории и определение специфических IgE у больного в большинстве случаев позволяют клиницисту поставить диагноз. Детальный сбор анамнеза помогает с высокой степенью достоверности выявить этиологически значимый пищевой продукт при заболеваниях, в основе которых лежат реакции немедленного типа. Объективное обследование больного предоставляет более весомую информацию преимущественно в период обострения [45, 46]. Диагноз пищевой аллергии не может основываться на анамнезе, не соответствующем пищевой гиперчувствительности. Никакой диагностический тест (кожный, специфические IgE в сыворотке и др.) не имеет значения и не должен интерпретироваться вне связи с анамнезом.
Золотым стандартом диагностики пищевой аллергии остаются провокационные тесты: открытый простой или двойной слепой плацебоконтролируемый провокационный тест с пищевыми продуктами (используется также сублингвальный тест). Двойной слепой плацебоконтролируемый провокационный тест (ДСПКПТ) предпочтителен при диагностике пищевой аллергии. Провокационные тесты должны выполняться в специализированных центрах с тщательным наблюдением за пациентом после провокации. Решение о целесообразности выполнения тестов принимает врач. Провокационные пробы в России не сертифицированы, предпочтение отдается диагностическим элиминационным диетам.
Диагноз анафилаксии базируется на данных анамнеза, времени от начала экспозиции причинного фактора до развития симптомов. Алгоритм подробно описан в клинических руководствах, а также в наших предыдущих публикациях [3–7, 10, 11, 3, 47–50].
Врач должен собрать подробную информацию обо всех событиях, происшедших в течение предшествующего появлению симптомов часа, и оценить все риски (в частности, физические упражнения, употребление лекарственных препаратов, выписанных врачом или самостоятельно принятых, употребление рекреационных наркотиков, этанола, наличие острой инфекции, воздействие холода, эмоциональный стресс, путешествие или другие нарушения привычного жизненного ритма, предменструальный статус у женщин, другие известные или потенциальные триггеры). Ключом к диагностике являются внезапное начало, мультисистемные характерные симптомы/признаки, их быстрое прогрессирование. Характерны различные высыпания на коже, респираторные, гастроинтестинальные симптомы и сердечно-сосудистые расстройства вплоть до коллапса и нарушений сердечного ритма. При анафилаксии, индуцированной пищей, уровень сывороточной бета-триптазы повышается редко.
В начале эпизода бывает трудно предсказать скорость прогрессирования или конечную степень тяжести реакции. Смертельный исход может наступить в течение нескольких минут. Клинический сценарий развития анафилаксии (время, начало, характер и количество симптомов/признаков) сугубо индивидуален. Даже у одного пациента повторяющиеся эпизоды анафилаксии могут отличаться.
В систематическом обзоре и метаанализе [51] приведены данные о чувствительности и характере обнаружения специфических IgE с помощью компонент-разрешающей диагностики в сравнении с кожными пробами (прик-тест и аппликационный) и эталонным стандартом (ДСПКПТ), а также об их клиническом значении.
Для классификации анафилаксии по степени клинической тяжести используются следующие критерии:
- анафилаксия первой степени – вовлечена одна система;
- анафилаксия второй степени – вовлечено более одной системы; не опасно для жизни;
- анафилаксия третьей степени – вовлечено более одной системы; опасно для жизни;
- анафилаксия четвертой степени – угрожающие жизни события с остановкой сердца.
Основные симптомы анафилаксии в соответствии с тяжестью их проявлений, необходимостью использования адреналина и возможностью применения антигистаминных препаратов представлены на рисунке [3] .
Медицинская помощь и лечение при пищевой анафилаксии
При оказании помощи в случае анафилаксии крайне важны:
- системный унифицированный подход к тактике ведения всех пациентов по протоколу лечения;
- доступность лекарственных средств и оборудования;
- фактор времени;
- умение любого врача оказать помощь независимо от триггеров;
- регулярный тренинг медперсонала, самого больного и окружения по оказанию неотложной терапии.
Трудно переоценить роль врача аллерголога-иммунолога в обучении пациента, его окружения, медицинских работников оказанию самопомощи и неотложной помощи, определении триггеров и факторов риска, разработке плана по элиминации аллергенов и назначению иммуномодуляции.
Для детей раннего возраста с аллергией к белкам коровьего молока предложены научно обоснованные методы рационального вскармливания, в том числе с использованием лечебных молочных смесей с высокой степенью гидролиза или аминокислотных смесей [47, 52, 53].
Во всех клинических рекомендациях (международных и национальных) по оказанию помощи при анафилаксии подчеркивается, что при лечении острых эпизодов скорость оказания помощи является критическим фактором (уровень доказательности A) [5, 3, 47, 48].
Препаратом выбора является адреналин, все остальное – вспомогательная терапия (уровень доказательности A) [11, 30, 52, 54].
Врач должен рекомендовать адреналин:
- лицам с анафилаксией, манифестирующей респираторными и сердечно-сосудистыми симптомами;
- лицам с астмой, постоянно получающим противоастматическую терапию, с эпизодами анафилаксии в анамнезе;
- индивидуально пациентам с анафилаксией, проявляющейся гастроинтестинальными симптомами;
- лицам с идиопатической анафилаксией;
- лицам с анафилаксией, вызванной физической нагрузкой.
Относительные показания для назначения адреналина:
- реакция на следовые количества какого-либо пищевого продукта;
- любая аллергическая реакция на арахис или орехи в анамнезе;
- наличие в анамнезе предположительно анафилаксии в случае проживания пациента в отдаленном от больницы районе;
- пищевая аллергия у подростков.
Элиминационные мероприятия при пищевой аллергии и анафилаксии. Маркировка продуктов
Одним из важнейших методов лечения пищевой аллергии/анафилаксии является исключение из рациона продуктов, вызывающих аллергию и перекрестные реакции. Если аллергию вызывают сразу несколько продуктов, больному предлагают полноценную элиминационную диету. В сложных ситуациях необходима консультация диетолога. Со временем пищевая аллергия может исчезнуть, что, возможно, обусловлено развитием иммунологической толерантности. Анализ естественного течения болезни показывает, что у детей часто восстанавливается нормальная переносимость продукта после его исключения из рациона на определенный период. Аллергия к молоку с возрастом уменьшается. Ребенок «перерастает» симптомы, и аллергия к молоку исчезает в возрасте одного года (50–60%), двух лет (70–75%), трех лет (85%). Аллергию к яйцу «перерастают» 55% детей с пищевой аллергией после шести лет. Аллергия к глютену (целиакия) сохраняется пожизненно. В этом случае пациентам рекомендуется безглютеновая диета постоянно. Аллергия к арахису, лесным орехам, рыбе и морепродуктам исчезает редко. Возможен возврат симптомов аллергии на продукты, к которым аллергия исчезала («перерастала»). Индуцированные пищевыми белками энтероколит и аллергический эозинофильный гастроэнтерит у детей старшего возраста и взрослых могут персистировать в течение длительного периода.
О случаях естественного течения пищевой аллергии у взрослых неизвестно. Аллергия к арахису, лесным орехам, рыбе и морепродуктам продолжается во взрослом периоде долговременно. Иногда улучшение наступает даже при ограничении употребления аллергенного продукта. Спустя некоторое время, как правило через два года, можно возобновить употребление продукта, исключенного из рациона. Повторно вводить продукт в рацион следует осторожно, постепенно увеличивая его количество. Необходимо помнить, что при этом у больного может развиться тяжелая системная аллергическая реакция. При системной аллергической реакции на какой-либо пищевой продукт в анамнезе повторно вводить его в рацион не рекомендуется. Сказанное касается развития пищевой аллергии в старшем детском или зрелом возрасте, поскольку в этих случаях иммунологическая толерантность развивается редко.
Таким образом, элиминация пищевых аллергенов является важнейшей составляющей стратегии ведения пациентов с пищевой аллергией и анафилаксией.
Для долговременного контроля и профилактики пищевой анафилаксии используется иммунотерапевтическая стратегия – аллергенспецифическая иммунотерапия (АСИТ), особенно при перекрестных реакциях на пыльцу. Показано, что OAS уменьшается при АСИТ пыльцевыми аллергенами. АСИТ при пищевой аллергии проводится, только когда в основе заболевания лежит реагиновый механизм, а пищевой продукт является жизненно необходимым (например, аллергия к молоку у детей). Эффективность АСИТ при пищевой аллергии низкая. Вопрос о ее внедрении в рутинную практику еще не решен и требует дальнейшего изучения. Наряду с классическими методами АСИТ разрабатываются новые стратегии иммуномодулирующей терапии:
- терапия гуманизированными моноклональными анти-IgE-антителами (омализумаб);
- иммунотерапия видоизмененными с помощью генной инженерии белками аллергенов;
- иммунотерапия с помощью антиген-стимулирующих последовательностей CpG-белков;
- пептидная иммунотерапия;
- иммунотерапия с использованием плазмидной ДНК;
- цитокин-модулирующая иммунотерапия;
- индукция пищевой толерантности и АСИТ пищевыми аллергенами или гомологами пыльцевых белков (например, Bet v1).
На мышиных моделях китайские фитопрепараты продемонстрировали эффективность при аллергии к арахису. Начаты клинические исследования у людей. На мышиных моделях изучается таргетная терапия, направленная на интерлейкин (ИЛ) 12, фактор некроза опухоли альфа и синтетический агонист TLR9 (toll-like receptor – толл-подобный рецептор).
В американском исследовательском центре National Jewish Health открыли новую мишень, воздействие на которую позволяет противостоять пищевым аллергическим реакциям на арахис. Как выяснили ученые, в тонком кишечнике мышей с аллергией на арахис повышен уровень определенного фермента – протоонкогена, кодирующего серин/треонинпротеинкиназу-1 (PIM1 – provirus integration site for Moloney murine leukemia virus 1 kinase). Ингибирование его активности заметно снижало аллергическую реакцию на земляной орех. Исследователи пришли к выводу, что PIM1 играет критически важную роль в аллергических реакциях на арахис, а также, возможно, на другие пищевые аллергены и поэтому является многообещающей мишенью для лечения подобных реакций. Ученые блокировали PIM1 у лабораторных животных с помощью коммерчески доступного органического соединения с малым молекулярным весом, в результате чего уровни гистамина в плазме крови мышей снижались почти до нормальных, а уровни тучных клеток, эозинофилов и Т-клеток CD4 и CD8 в ответ на прием арахиса повышались незначительно. После приема ингибитора PIM1 уменьшались и уровни цитокинных сигнальных молекул, ассоциируемых с аллергиями, – ИЛ 4, 6 и 13 [55].
В обеспечении тесного взаимодействия между врачом, пациентом и обществом важную роль играют программы обучения и поддержки на основе научно разработанных рекомендаций [49].
Больному (или его родителям), у которого в прошлом отмечались системные аллергические реакции на пищевые продукты, объясняют, что их употребление очень опасно и способно привести к смерти. Принимая пищу вне дома, пациент должен всегда выяснять, какие продукты входят в ее состав. Согласно рекомендациям Комитета здоровья школьников Американской академии педиатрии, в каждой школе должны быть лекарственные средства, необходимые для лечения тяжелых анафилактических реакций. Детей старше семи лет следует обучить самостоятельному введению инъекций адреналина [56, 57]. Учителя должны быть осведомлены о заболевании ребенка. Желательно не хранить дома аллергенные продукты. Если это не представляется возможным, на них нужно размещать предупреждающие наклейки. В США и других странах существуют многочисленные организации, которые проводят обучение и оказывают поддержку больным пищевой аллергией [47].
Пациенты должны уметь распознавать скрытые пищевые компоненты в переработанных и технологически обработанных пищевых продуктах [58]. Обработанные продукты могут содержать скрытые белки, например молока, яйца, сои, добавленных для увеличения содержания белка или улучшения вкуса. Арахис и продукты из орехов добавляют с целью увеличения объема продукта, в качестве загустителя и усилителя вкуса (соусы, кондитерские изделия). Кроме того, в технологически обработанных продуктах часто присутствуют другие скрытые белки (казеин и лактоза, полученные из молока, альбумин из яйца). Компоненты арахиса часто указываются в описании разных продуктов, как пищевых, так и косметических.
В некоторых странах крупные сети супермаркетов представляют списки безаллергенных продуктов, подходящих для людей с определенной пищевой аллергией. Иногда производители продуктов включают в маркировку информацию о возможности даже следовых концентраций аллергенов, попадающих в продукты при их изготовлении (орех или молочные белки). Лица с пищевой аллергией перед употреблением любых продуктов должны ознакомиться с информацией на их упаковке, поскольку возможны перекрестные аллергические реакции [59, 60].
Указанные лица должны предупреждать персонал ресторана или других предприятий общественного питания об имеющейся у них пищевой аллергии и уточнять, содержатся ли непереносимые ими ингредиенты в заказанном блюде. Контаминация аллергенами пищевых продуктов возможна при их приготовлении в общих помещениях или использовании оборудования.
Лицам, страдающим аллергией на яйцо, следует проводить вакцинацию против гриппа после предварительной консультации с лечащим врачом, хотя в целом аллергия к яйцу, как правило, не является противопоказанием к введению вакцины против гриппа, кори и комбинированной вакцины против кори, эпидемического паротита, краснухи.
Заключение
Пищевая аллергия и анафилаксия являются широко распространенными и потенциально жизнеугрожающими событиями, которые развиваются часто в любом месте, вне больницы и дома. Способность окружения распознать высокий риск их развития и оказать своевременную помощь играет ключевую роль в предотвращении тяжелых фатальных исходов.
Эксперты считают, что многие объекты розничной торговли и общественного питания не подготовлены к решению проблем пищевой анафилаксии, не имеют достаточных знаний и не готовы решать проблемы пищевой аллергии в случае возникновения острых реакций.
За предприятиями общественного питания (столовые, кафе, рестораны, сети быстрого питания с торговлей пищевыми продуктами на вынос) юридически не закреплена обязанность предупреждать потенциальных клиентов о содержании аллергенов в своих блюдах.
Необходима организация системы предупредительных мероприятий на всех уровнях. Индивидуальная, семейная профилактика заключается в строгом соблюдении рекомендованных врачом лечебно-профилактических мероприятий.
Задача врача-аллерголога – поставить правильный диагноз, оценить риски, предоставить больному информацию о заболевании, разработать план действий, научить правильно вводить инъекции адреналина.
Задача медперсонала образовательных учреждений (ясли, сад, школа) – выявление детей с аллергией, обеспечение доступности лекарств неотложной помощи, овладение навыками оказания неотложной помощи в соответствии с рекомендациями врача и индивидуальным планом, обеспечение условий для индивидуального питания ребенка при пищевой аллергии.
Задача продавцов, поставщиков продуктов питания – расширение компетентности в области пищевой аллергии, внедрение политики и процедур с целью сокращения перекрестного загрязнения пищевых продуктов аллергенными субстанциями, полное предоставление информации клиентам о содержании пищевых аллергенов или возможном перекрестном загрязнении.
Новые модели коммуникации на уровне врача, пациента, его окружения и общества позволят снизить бремя пищевой аллергии и риск анафилаксии.
N.G. Astafyeva, I.V. Gamova, D.Yu. Kobzev, Ye.N. Udovichenko, I.A. Perfilova, I.E. Mikhaylova
Saratov State Medical University named after V.I. Razumovsky
Leeds Trinity University, UK
Contact person: Natalya Grigoryevna Astafyeva, astang@mail.ru
Food allergy is a common allergic reaction in people of all ages, with a high incidence from early childhood to older age groups. The severity of the clinical manifestations can vary, but the most severe life-threatening event may be food anaphylaxis. By delayed recognition by patients and physicians food hypersensitivity and anaphylaxis inadequate treatment of food need exists for the development of unified approach to diagnosis and treatment of this diseases.
In order to improve the forecast of food anaphylaxis is necessary to inform the public about the probability of a fatal outcome, use of public prevention measures through accurate labeling of all potentially hazardous components of allergenic foods for their timely detection and prevention of the reception of persons with hypersensitivity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.