Эозинофильный эзофагит: современные представления о заболевании, собственные клинические наблюдения
- Аннотация
- Статья
- Ссылки
- English

Введение
Эозинофильный эзофагит (ЭоЭ) представляет собой хроническое прогрессирующее иммуноопосредованное заболевание пищевода, связанное с антигензависимым воспалением второго типа и симптомами дисфункции пищевода. Заболевание длительное время может протекать с минимальными неспецифическими клиническими проявлениями, чаще имитирующими гастроэзофагеальную рефлюксную болезнь (ГЭРБ), или даже бессимптомно и манифестировать приходящими симптомами вклинения фрагментов пищи в пищевод. Так, ЭоЭ выявляется примерно у 6% всех пациентов, которым по какой-либо причине проводили эзофагогастродуоденоскопию (ЭГДС), у 15%, которым выполняли эндоскопию по поводу дисфагии, и у более чем 50%, которым требовалась ургентная эндоскопия в связи с вклинением фрагментов пищи в пищевод [1].
Хотя этиология заболевания изучена не в полной мере, в основе запуска каскада иммунологических процессов лежит контактное воздействие антигенов из вдыхаемого воздуха или пищевых продуктов (наиболее изученный вариант), проникающих через барьер слизистой оболочки пищевода, приводящее к развитию воспаления с последующим фиброзом в стенке пищевода [2, 3].
Длительное время ЭоЭ относился к редким заболеваниям с частотой примерно 0,5–1 случай на 1000 человек, однако его распространенность в последнее время значительно выросла [4]. Так, метаанализ, объединивший исследования с 1976 по 2022 г., показал, что заболеваемость и распространенность ЭоЭ в мире составила соответственно 5,31 случая на 100 тыс. человеко-лет и 40,04 случая на 100 тыс. человеко-лет. Суммарная заболеваемость ЭоЭ выше среди мужчин и в странах с высоким уровнем дохода. Отмечена тенденция постепенного увеличения распространенности ЭоЭ с 1976 по 2022 г.: так, в период с 1976 по 2001 г. она составляла 8,18 (95%-ный доверительный интервал (95% ДИ) 3,67–12,69), а к 2017–2022 гг. достигла 74,4 (95% ДИ 39,66–109,19) случая на 100 тыс. человеко-лет [5]. Более того, по некоторым данным, экономические затраты на диагностику и лечение ЭоЭ уже в обозримом будущем могут превысить расходы на ведение пациентов с воспалительными заболеваниями кишечника и целиакией [6]. Существенный рост заболеваемости можно было бы объяснить возрастающим интересом к проблеме ЭоЭ и, соответственно, большей осведомленностью и улучшением диагностики, однако несколько популяционных исследований, проведенных в США [7, 8] и Европе [9], предоставили доказательства истинного увеличения заболеваемости [10, 11], поэтому изучение ЭоЭ, его этиологии, патогенеза, методов диагностики и лечения имеет большое медико-социальное значение.
Этиология и патогенез ЭоЭ
Этиология и патогенез ЭоЭ до конца не изучены, несмотря на многочисленные исследования, которые в значительной мере расширили современное понимание сущности заболевания. Установлено, что на механизмы, лежащие в основе развития и прогрессирования ЭоЭ, влияют различные факторы, такие как генетическая предрасположенность, возраст, сопутствующие иммуноопосредованные заболевания и экзогенные аллергены. Концептуально этиопатогенез ЭоЭ сводится к нарушению регуляции иммунного ответа, вызванного воздействием аллергенов, преимущественно содержащихся в пище, реже – во вдыхаемом воздухе [1, 12]. Патологический иммунный ответ приводит к воспалению и повреждению тканей пищевода с развитием характерных гистологических изменений и клинических симптомов. Ключевые элементы патогенеза заболевания включают сенсибилизацию к аллергенам, патологический иммунный ответ Th2, дисфункцию эпителиального барьера, инфильтрацию эозинофилами, фиброз и ремоделирование пищевода [1, 13].
ЭоЭ имеет сложный характер наследования, на который влияют эффекты множества локусов генетического риска и особенности окружающей среды. Генетические факторы, определяющие предрасположенность к ЭоЭ, до конца не изучены [14]. Большинство генов, участвующих в патогенезе ЭоЭ, влияют на опосредованные Th2-лимфоцитами ответы или целостность эпителиального барьера. Они способствуют выработке эпителиоцитами тимусного стромального лимфопоэтина – ключевого цитокина, активно участвующего в аллергическом воспалении (кодируется локусом 5q22-) [15], кальпацина-14 (CAPN14), кодируемого локусом 2p23 [16], и комплекса эпидермальной дифференцировки, кодируемого локусом 1q21 [17]. Примечательно, что у родственников первой линии родства пациентов с ЭоЭ риск развития этого заболевания в 10–64 раза выше, чем в общей популяции [18].
Исследования на близнецах показали, что частота ЭоЭ составляет 41% у монозиготных и 24% у дизиготных близнецов [19]. Наблюдаемые тенденции позволяют сделать предположение о том, что некие общие факторы окружающей среды раннего возраста существенно влияют на риск развития заболевания. Так, в исследовании E.T. Jensen и соавт. установлена связь пренатальных (лихорадки матери, преждевременных родов), интранатальных (кесарева сечения) особенностей и приема некоторых лекарственных препаратов в раннем возрасте (антибиотиков, средств, подавляющих желудочную секрецию) с повышенным риском развития ЭоЭ [20]. К схожим выводам пришли авторы других исследований: факторы окружающей среды, такие как диета, кесарево сечение, использование антибиотиков, искусственное вскармливание [21], применение ингибиторов протонной помпы в детстве, холодный климат, бытовые факторы [14], ассоциированы с повышенным риском ЭоЭ. В то же время наличие в детстве домашнего животного, покрытого шерстью, и инфекция Helicobacter pylori, а также некоторые антитела, вырабатываемые к указанному микроорганизму, связаны с более низким риском ЭоЭ [22, 23].
Роль микробиоты кишечника в иммунной регуляции получает все большее признание [24]. Изучение методов лечения, которые модулируют состав микробиоты для уменьшения воспаления и сенсибилизации к аллергенам, имеет потенциал для лечения ЭоЭ [25–27].
Установлена связь ЭоЭ с системными изменениями аутоиммунитета: у 6% пациентов с ЭоЭ выявляют сопутствующий псориаз, псориатический артрит, ревматоидный артрит или тиреоидит Хашимото [28].
Клеточные механизмы патогенеза ЭоЭ
Эозинофильная инфильтрация является отличительной чертой патогенеза ЭоЭ, ее значение изучалось как на мышиных, так и на человеческих моделях. Эозинофилы – плейотропные лейкоциты, участвующие в физиологической иммунной защите от патогенов [29]. Хроническое воздействие ирритантов и повреждение тканей приводят к высвобождению медиаторов, таких как GM-CSF и интерлейкин (ИЛ) 5, которые способствуют активации и местному привлечению эозинофилов [30]. Высвобождение эозинофильной пероксидазы, катионного белка эозинофилов и основного связывающего белка непосредственно приводит к повреждению тканей и дисфункции вагусных мускариновых рецепторов М2, что проявляется нарушениями моторики пищевода [31]. Наряду с биомеханическими последствиями ремоделирования эозинофильные продукты обладают также нейротоксической активностью, которая реализуется через изменения амплитуды сокращений мышц пищевода, а также через локальное высвобождение нейротрансмиттеров в межмышечных и подслизистых нервных сплетениях [32]. Кроме того, было показано, что при дегрануляции эозинофилов может наблюдаться некроз аксонов [33], что нарушает нормальное проведение импульсов по нейронам. О роли эозинофилов в развитии двигательных нарушений свидетельствуют обнаруженные плотные эозинофильные инфильтраты в мышечных слоях пищевода у пациентов с гиперконтрактивностью пищевода [34], а также ассоциация эозинофилии пищевода и ахалазии кардии [35]. Известно, что характерное для ахалазии нарушение продвижения пищи и ее длительный контакт со слизистой оболочкой могут способствовать эозинофилии пищевода, однако эозинофильная инфильтрация может сохраниться и даже усилиться в послеоперационном периоде [36, 37].
Воспалительная активность эозинофильных гранулоцитов опосредована высокоцитотоксическими белками, которые содержатся в окрашенных эозином специфических гранулах цитоплазмы [38]. В частности, 90% содержимого гранул эозинофилов представлено основными белками, включая катионный белок эозинофилов (ECP), нейротоксин эозинофильного происхождения (EDN), пероксидазу эозинофилов (EPO) и главный основной белок (MBP), которые представляют собой превосходные маркеры присутствия и активации эозинофилов и потенциально могут быть использованы в качестве биомаркеров при эозинофил-опосредованных заболеваниях, таких как экзема, аллергический ринит, астма и пищевая аллергия [39, 40]. Несмотря на ключевую роль эозинофилов в патогенезе заболевания, мышиные модели, генетически модифицированные с отсутствием эозинофилов, показали, что клинические признаки, в том числе нарушение моторики пищевода, не зависят от эозинофильной инфильтрации [41], а рандомизированные контролируемые исследования терапии анти-ИЛ-5 не доказали эффективность применения указанного агента в лечении ЭоЭ [42]. В целом накопленные данные свидетельствуют о том, что для ЭоЭ характерны не только большое количество эозинофилов в поле зрения, но и, возможно, более широкое воздействие на механизмы иммунного ответа второго типа, а также избыточное количество некоторых других клеток и цитокинов, включая тучные клетки, иммуноглобулин (Ig) G4, периостин и эотаксин-3, способствующих воспалительному процессу в пищеводе у пациентов с ЭоЭ [43].
В отличие от эозинофилов, тучные клетки в норме присутствуют в слизистой и подслизистой оболочках пищевода, однако в биоптатах пищевода пациентов с ЭоЭ обнаруживаются повышенная активация генов, специфичных для тучных клеток, и избыточное количество IgE-связанных тучных клеток [43]. Тучные клетки являются основными эффекторами при некоторых атопических заболеваниях, их концентрация и активация продемонстрированы в слизистой оболочке пищевода пациентов с ЭоЭ [44, 45]. Помимо своей роли в воспалительной реакции второго типа, тучные клетки высвобождают специфические медиаторы, такие как триптаза трансформирующего фактора роста β1, лейкотриены, простагландины и гистамин, которые способствуют гипертрофии гладких мышц пищевода и нарушению моторики органа [46]. Кроме того, тучные клетки способны продуцировать хемоаттрактант эозинофилов эотаксин-1, который влияет на накопление эозинофилов в тканях [47]. Локальное воспаление пищевода, индуцированное тучными клетками, приводит к изменению проницаемости слизистой оболочки, гипертрофии гладких мышц и изменению сокращения, что влечет нарушение моторики [48]. После активации тучные клетки способствуют ремоделированию тканей и фиброзу вследствие экспрессии некоторых профибротических медиаторов, в частности трансформирующий фактор роста β1 [32].
С целью реализации барьерной функции в физиологических условиях эпителий пищевода является относительно непроницаемым для молекул среднего и большого размера. При ЭоЭ активное воспаление приводит к повреждению эпителия, обусловленному снижением экспрессии структурных белков Е-кадгерина, десмоглеина-1, инволюкрина, филаггрина и синаптоподина [49], а также изменением соединительных белков, таких как клаудин и окклюдин [50]. При контакте с антигенами эпителиальные клетки пищевода могут экспрессировать молекулы MHC-II и, таким образом, действовать как непрофессиональные антигенпрезентирующие клетки [51].
Неконтролируемое трансмуральное воспаление при ЭоЭ приводит к прогрессивному ремоделированию стенки пищевода с фиброзом собственной пластинки, гиперплазией базальных клеток, субэпителиальным ангиогенезом и гипертрофией гладких мышц [52].
Клинические проявления
Симптомы ЭоЭ существенно различаются у детей и взрослых. Клиническая картина варьирует в зависимости от возраста: задержка развития у самых маленьких детей (медиана возраста – 2,0 года), рвота у детей старшего возраста (медиана возраста –
8,1 года), боль в животе у подростков (медиана возраста – 12,0 года), дисфагия (средний возраст –
13,4 года) и затруднение приема пищи (средний возраст – 16,8 года) у подростков старшего возраста [53]. Напротив, взрослые преимущественно предъявляют жалобы на дисфагию, особенно при приеме твердой пищи, за которой по частоте встречаемости следуют преходящие эпизоды вклинения пищи. В проспективном исследовании с участием 400 пациентов, перенесших эндоскопию по поводу дисфагии, у 7,3% обнаружены гистологические признаки ЭоЭ [54]. Проспективное исследование 100 взрослых пациентов с необструктивной дисфагией показало, что у 22% был выявлен ЭоЭ [55]. Вклинение пищевого комка является типичным и повторяющимся симптомом, который иногда требует экстренной эндоскопии для купирования ургентного состояния [56]. Ретроспективное исследование 202 пациентов, которым была проведена экстренная эндоскопия по поводу инородного тела, показало, что у 26% тех, кому выполнена биопсия пищевода, обнаружен ЭоЭ [57]. Вместе с тем ЭоЭ может имитировать ГЭРБ, проявляясь изжогой, регургитацией и некардиальной болью [58]. В ретроспективном исследовании с участием 161 пациента, перенесшего эндоскопию по поводу некардиальной боли, у 6% обследованных диагностирован ЭоЭ [59]. Кроме того, типичным проявлением заболевания являются выработанное адаптивное пищевое поведение и ограничительные стратегии, обусловленные необходимостью справляться с прогрессирующей дисфагией. Важно в каждом конкретном случае предполагаемой дисфагии прицельно рассмотреть изменение диеты и пищевого поведения, а именно необходимость медленного приема пищи с чрезмерным пережевыванием перед глотанием, измельчение или пюреризирование продуктов при приготовлении, прием жидкости с целью облегчения проглатывания и отказ от твердой пищи [60].
Пациенты с ЭоЭ, вне зависимости от возраста, имеют более высокую предрасположенность к заболеваниям аллергического и воспалительного характера, чем население в целом.
Инструментальная диагностика
Эндоскопическая оценка ЭоЭ (EREFS)
Эзофагоскопия является неотъемлемым, но не окончательным этапом диагностики ЭоЭ. Она необходима для выявления признаков заболевания, оценки ответа на терапию, устранения стриктур пищевода и с целью систематического пожизненного наблюдения за пациентами, находящимися в гистологической ремиссии. Все случаи вклинения фрагментов пищи в пищевод должны быть расценены как подозрение на ЭоЭ. Примечательно, что ЭоЭ образно называют «синдромом стейк-хауса», поскольку наиболее часто происходит вклинение фрагментов именно мясных продуктов [61]. В целом при выполнении экстренной эзофагоскопии в ситуации вклинения пищи после устранения фрагментов целесообразно выполнение биопсии для исключения ЭоЭ. Остатки пищи на слизистой пищевода, кровь в результате механической травматизации или заброс желудочного содержимого в пищевод могут препятствовать детальному осмотру даже после успешного удаления застрявшей пищи, поэтому велика вероятность недооценить визуальные признаки ЭоЭ. По некоторым данным, пищевой комок был успешно удален у большинства пациентов во время первичной экстренной эндоскопии, в то время как последующую биопсию пищевода не удавалось выполнить у 40% пациентов [62]. В других исследованиях показано, что эндоскопия в период от шести месяцев до двух лет после разрешения вклинения пищи выполнена только в 45–78% случаев а биопсия пищевода получена только в 28–76%, что способствовало существенному снижению выявляемости ЭоЭ [63, 64]. Таким образом, с целью верификации диагноза ЭоЭ крайне важно повторно выполнить эзофагоскопию у пациентов с вклинением фрагментов пищи после купирования ургентного состояния. Консенсусные заявления Американского общества желудочно-кишечной эндоскопии рекомендуют проводить биопсию при первоначальном эндоскопическом исследовании при вклинении пищи и вероятном ЭоЭ. При этом отмечается, что следует избегать участков слизистой непосредственного места вклинения, так как обнаруживаемые морфологические изменения могут быть обусловлены механическим повреждением и маскировать таким образом признаки ЭоЭ [65].
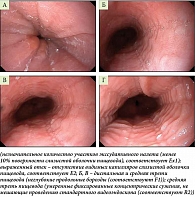
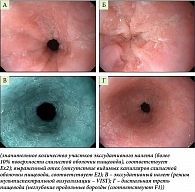
Для объективной оценки эндоскопических данных I. Hirano и соавт. в 2013 г. была предложена эндоскопическая эталонная шкала ЭоЭ (EREFS), включающая следующие признаки: E – экссудаты, R – концентрические сужения, E – отек, F – борозды, S – стриктуры [66]. Аббревиатура EREFS включает первые буквы пяти вышеупомянутых эндоскопических признаков. Поскольку E (отек) и E (экссудаты) могут быть перепутаны, термин ERExFS может считаться предпочтительным. Установлено, что по крайней мере один из указанных признаков обнаруживается более чем у 90% пациентов с ЭоЭ [67]. Экссудаты выглядят как белые бляшки или белые пятна, морфологическим субстратом которых являются эозинофильные микроабсцессы [68]. При оценке экссудата следует уделять внимание другим признакам ЭоЭ в связи с необходимостью проведения дифференциальной диагностики с кандидозом пищевода, поскольку оба состояния могут протекать с явлениями дисфагии и имеют схожие эндоскопические проявления. Концентрические сужения (КС) возникают в результате ремоделирования пищевода с субэпителиальным фиброзом, приводящим к формированию стриктур, снижением растяжимости пищевода, что коррелирует с риском возникновения эпизодов вклинения фрагментов пищи в пищевод [69]. Выраженность КС не коррелирует с количеством инфильтрирующих эозинофилов и имеет тенденцию сохраняться даже после гистологического улучшения [70]. Известно, что КС наблюдаются также при 10% случаев не-ЭоЭ, включая ГЭРБ, с необходимостью проведения дифференциальной диагностики. Отек, характеризующийся потерей или снижением васкуляризации слизистой, является весьма неспецифичным признаком, наблюдаемым при многих других заболеваниях пищевода, включая ГЭРБ, и по сравнению с другими признаками характеризуется наименьшей согласованностью между эндоскопистами. Линейные борозды представляют собой продольные «трещины», идущие вдоль пищевода, их легче распознать, уменьшив напряжение просвета пищевода с помощью частичной аспирации воздуха или с контрастирования (хромоэндоскопии с индигокармином). Линейные борозды можно обнаружить примерно у 90% пациентов с ЭоЭ, и они могут быть важным ключом к точному диагнозу [71]. Отличительной особенностью стриктур при ЭоЭ является возможность их образования не только в дистальной, но и в проксимальной части пищевода, что не наблюдается при осложненном течении ГЭРБ [72]. В ряде случаев стриктуры могут быть замаскированы в области желудочно-пищеводного перехода или верхней трети пищевода, где сложнее выполнить полную инсуффляцию.
Несмотря на широкую доступность и воспроизводимость EREFS, все еще существует ряд проблем на пути его повсеместного внедрения и оптимального использования в рутинной клинической практике. Для обнаружения невыраженных признаков ЭоЭ необходимы детальный осмотр, тщательная подготовка слизистой, применение различных приемов, улучшающих визуализацию. В исследовании E. Okimoto и соавт. коэффициент надежности каппа для группы из 40 эндоскопистов для диагностики ЭоЭ составил 0,34 (95% ДИ 0,33–0,35), что указывает на низкий уровень согласия между наблюдателями. Кроме того, значительно более низкое значение каппа отмечали эндоскописты без сертификации Японского общества гастроэнтерологической эндоскопии по сравнению с теми, кто был сертифицирован советом, что позволяет предположить, что эндоскопическая диагностика ЭоЭ может быть затруднена вследствие неопытности эндоскопистов [73].
Оптимальное пороговое значение показателя ERERS для диагностики ЭоЭ не определено. В некоторых отчетах показано, что EREFS ≥ 2 может предсказать ЭоЭ с относительно высокой чувствительностью и специфичностью [70], по другим данным, этого недостаточно ввиду низкой специфичности обнаруживаемых признаков [74]. Следует учитывать тот факт, что выраженность и количество эндоскопических признаков заболевания по шкале EREFS плохо коррелируют с клиническими симптомами и гистологической активностью. Кроме объективных трудностей обнаружения визуальных проявлений ЭоЭ, смазанность или полное отсутствие эндоскопических признаков ЭоЭ может быть обусловлено воздействием ингибиторов протонной помпы (ИПП), самостоятельно применяемых пациентом или назначенных врачом с целью купирования симптомов до момента постановки диагноза. Результаты метаанализа 33 исследований воздействия ИПП на течение ЭоЭ показали совокупную частоту достижения гистологической ремиссии в 51% случаев [75]. Временной интервал после отмены ИПП, необходимый для появления характерных гистологических признаков ЭоЭ, в настоящее время не определен. По некоторым данным, он составляет не менее трех недель.
Помимо эндоскопических критериев ЭоЭ, вошедших в основу системы ERERS, определенный интерес представет признак ankylosaurus back («спина анкилозавра» – СА), впервые описанный N. Ishimura и соавт. Признак СА определялся как продольно расположенные с равным интервалом белесоватые узелки в пищеводе, четко выявляемые при осмотре в белом свете. Причина образования белесых узелков остается неясной. Предполагается, что, поскольку слизистая и подслизистая оболочки пищевода образуют продольные складки и, соответственно, поперечное сечение просвета пищевода имеет звездчатую форму, воздействие повреждающего фактора по отношению к продольным складкам пищевода (гребень или впадина) может иметь важное значение в патогенезе СА. Преимущественное присутствие СА на гребнях складок указывает на возможную роль рефлюкса содержимого желудка в его образовании. Признак СА удалось идентифицировать при существенном согласии между наблюдателями среди экспертов-эндоскопистов после инструкций относительно эндоскопических характеристик СА. В биопсиях образцов эпителия пищевода с указанным признаком не обнаружено каких-либо специфических гистологических изменений. Предполагается, что патоморфологическим субстратом СА является субэпителиальный фиброз. Интерес к признаку СА обусловлен еще и тем фактом, что он описан только для фенотипа ЭоЭ, отвечающего на лечение ИПП, который, соответственно, может быть полезным в аспекте выбора терапевтического подхода [76].
Получение биопсийного материала
Верификация ЭоЭ возможна только при морфологическом исследовании, поэтому количество и качество получаемого материала слизистой пищевода имеют ключевое значение. Необходимо помнить о том, что патоморфологические изменения при ЭоЭ носят неоднородный, мозаичный характер, а при недостаточном количестве получаемых биоптатов диагностическая точность заключений существенно снижается. В настоящее время нет единого консенсуса относительно минимального или максимального количества требуемых биоптатов, а также конкретных участков слизистой пищевода, где гистологические признаки наиболее выражены. Предполагается, что прицельная биопсия, в частности из участков с экссудатом и бороздами, а также увеличение количества образцов – оптимальные стратегии диагностики ЭоЭ. Согласно текущим рекомендациям, желательно выполнить как минимум шесть биопсий из как минимум двух разных частей пищевода. Согласно другому распространенному подходу, необходимо получить четыре фрагмента из дистальной части и четыре фрагмента из проксимальной части пищевода с включением биоптатов, полученных прицельно из областей, где обнаружены визуальные признаки заболевания [77].
Морфологическая диагностика ЭоЭ
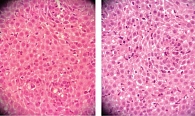
Основным морфологическим дифференциально-диагностическим критерием ЭоЭ является выраженность эозинофильной инфильтрации. При ГЭРБ количество эозинофилов обычно составляет < 5, в то время как гистологический порог в 15 эозинофилов традиционно считается подтверждением диагноза ЭоЭ с чувствительностью 100% и специфичностью 96% [77].
При ЭоЭ могут наблюдаться заметные различия в плотности эозинофилов как между пациентами при первичной постановке диагноза, так и у отдельных пациентов в разные периоды течения заболевания. Также может наблюдаться совпадение количества эозинофилов с другими состояниями, такими как ГЭРБ. Следовательно, важно, чтобы, помимо простой плотности эозинофилов для подтверждения диагноза ЭоЭ учитывались и другие гистологические признаки. К ним относится наличие базальноклеточной гиперплазии, отека (спонгиоза), эозинофильных микроабсцессов, наслоения эозинофилов, дегрануляции эозинофилов и субэпителиального склероза [78]. Необходимо отметить, что субэпителиальный слой оценивается менее чем у половины пациентов при биопсии, взятой с использованием стандартных биопсийных щипцов. С целью повышения диагностической точности и объективизации данных все чаще при оценке биоптатов включаются дополнительные гистопатологические изменения слизистой оболочки пищевода, связанные с активным заболеванием, в том числе изменения морфологии эпителиальных клеток, гиперплазия базальной зоны, расширение межклеточных пространств и фиброз собственной пластинки.
Неинвазивные методы диагностики ЭоЭ
Для диагностического алгоритма ЭоЭ требуются проведение многократных эндоскопических исследований и выполнение как минимум дважды мультифокальной биопсии пищевода: первичной – при наличии клинических и/или эндоскопических признаков ЭоЭ, последующей – для оценки ответа на терапию. На практике количество исследований может быть существенно выше ввиду сложностей диагностики и необходимости смены лечения при неэффективности стартовой терапии. Такой подход нельзя назвать оптимальным из-за высоких экономических затрат, а также из-за возможности осложнений при проведении инвазивных процедур. Соответственно, научные изыскания направлены на поиски неинвазивных и при этом надежных маркеров, позволяющих как минимум сформировать группы риска по ЭоЭ или проводить мониторинг ответа на терапевтические воздействия. В настоящее время обнаружен ряд маркеров, которые потенциально могли бы стать решением указанной проблемы.
В нескольких исследованиях изучалась потенциальная роль эозинофильного катионного белка (ECP) в диагностике и наблюдении за течением ЭоЭ с помощью определения его концентрации в сыворотке крови, смывах из просвета пищевода и в образцах стула. W. Doménech и соавт. показали, что ECP в сыворотке крови после лечения значительно коррелирует с клиническим ответом на элиминационную диету у пациентов с ЭоЭ [79]. C. Cengiz и соавт. исследовали точность сывороточного ECP при диагностике ЭоЭ. Авторы включили 15 пациентов с диагнозом ЭоЭ и 14 здоровых добровольцев и обнаружили, что пороговое значение сывороточного ECP 13,9 мкг/мл имело специфичность 92,8% и чувствительность 80% для диагностики ЭоЭ. Кроме того, результаты исследования также показали, что сывороточная ECP значительно коррелировала с тяжестью эндоскопической эталонной оценки ЭоЭ и историей нарушений пищевого поведения [80]. В проспективном обсервационном исследовании, проведенном на 15 пациентах, C. Schlag и соавт. исследовали возможность определения сывороточного уровня ECP в качестве суррогатного маркера ответа на лечение топическими глюкокортикостероидами (ГКС) взрослых пациентов с ЭоЭ. Авторы обнаружили значительное снижение средних значений ECP в сыворотке при местном применении флутиказона, как и одновременное снижение сывороточного ECP и количества эозинофилов у 87% пациентов [81]. В рандомизированном двойном слепом плацебо-контролируемом исследовании исходный уровень ECP и его уровень после лечения оценивались у пациентов, проходящих двухнедельное лечение будесонидом в сравнении с плацебо. Гистологическая ремиссия достигнута у 98 и 0% пациентов. В рандомизированном контролируемом исследовании уровень ECP, определенный с помощью иммунофлуоресценции в биоптатах пищевода, имел превосходную корреляцию с количеством эозинофилов в тканях, что демонстрирует многообещающую роль ECP пищевода в мониторинге ЭоЭ [82]. Изучалась также возможность оценки фекального ECP при ЭоЭ. M. Ghisa и соавт. показали, что в группе из 29 пациентов с ЭоЭ в сравнении с 71 больным контрольной группы без ЭоЭ фекальный ECP достигал 100% отрицательной прогностической ценности для диагностики ЭоЭ, позволяя отличать все случаи активного ЭоЭ от контроля без ЭоЭ, и 86% для гистологической ремиссии у пациентов с диагнозом ЭоЭ. Авторы показали значительную корреляцию между фекальным ECP и гистологической активностью ЭоЭ, коэффициент корреляции составил 0,48; p = 0,008 [83].
Эозинофильный нейротоксин (EDN) также изучается в качестве неинвазивного маркера для диагностики и наблюдения за течением ЭоЭ. M.R. Konikoff и соавт. обнаружили, что значения EDN в плазме коррелировали с уровнями эозинофилов в тканях и были увеличены у 47 детей с активным ЭоЭ по сравнению с пациентами контрольной группы [84]. Аналогичным образом в другом исследовании с участием 60 детей с ЭоЭ и 20 пациентов из контрольной группы G. Subbarao и соавт. обнаружили, что уровень EDN в сыворотке был значительно выше у пациентов с ЭоЭ по сравнению с контрольной группой, что позволяет предположить возможную роль сывороточного EDN в диагностике ЭоЭ. Кроме того, авторы также обнаружили значительное снижение уровня EDN в сыворотке крови после лечения, что указывает на потенциальную роль EDN в наблюдении за течением заболевания у детей с ЭоЭ [85]. При этом в проспективном исследовании, выполненном в когорте взрослых пациентов, были получены противоположные результаты. Не обнаружено различий в значениях сывороточной EDN между пациентами с ЭоЭ и контрольной группой. Кроме того, уровень EDN не изменился в ответ на лечение [86]. EDN изучался также в качестве дополнительного морфологического критерия ЭоЭ. Установлено, что в слизистой пищевода пациентов с ЭоЭ присутствуют выраженные тканевые отложения внеклеточного EDN [87]. G.T. Furuta и соавт. показали, что количественное определение EDN, измеренного в секретах просвета пищевода с помощью Esophageal String Test (EST), значительно различалось между детьми с активной фазой течения заболевания, ремиссией, ГЭРБ и группой контроля (здоровые добровольцы) [88]. S.J. Ackerman и соавт. подтвердили, что EDN может быть полезен для мониторинга активности заболевания, и показали, что EDN, полученный с помощью EST, имеет плошадь под кривой 0,86 с чувствительностью 87% и специфичностью 71% для разделения активного и неактивного заболевания [89].
Еще один биомаркер – основной базовый белок (MBP), представляющий собой основной белок массой 13,8 кДа, который продуцируется в виде гораздо более крупного неактивного белка, называемого proMBP, для защиты клеточных структур от цитотоксической активности MBP. При хранении в гранулах эозинофилов кислая часть proМВР отщепляется и активная форма MBP сохраняется внутри гранул эозинофилов. Хотя точные механизмы токсичности, связанной с MBP, еще предстоит выяснить, известно, что MBP вызывает прямое повреждение тканей. Кроме того, показано, что MBP вызывает непрямую цитотоксичность вследствие активации других воспалительных путей, таких как базофил-опосредованное высвобождение гистамина, неспецифическая активация комплемента, а также активация и дегрануляция нейтрофилов [90]. J.B. Wechsler и соавт. обнаружили, что сывороточный MBP предсказывает количество эозинофилов в пищеводе в 183 образцах от 56 детей с ЭоЭ и 15 детей без ЭоЭ. Кроме того, при анализе образцов пациентов до и после лечения авторы обнаружили, что значения MBP значительно снизились у пациентов, достигших гистологической ремиссии после лечения, по сравнению с активным ЭоЭ [91]. По результатам нескольких исследований показано, что MBP может накапливаться в пищеводе пациентов с ЭоЭ. E.S. Dellon и соавт. сравнили плотность MBP при иммуногистохимическом исследовании в образцах биопсии пищевода у пациентов из контрольной группы с активным ЭоЭ и без ЭоЭ. Плотность MBP была значительно выше при ЭоЭ и коррелировала с количеством эозинофилов в пищеводе [92].
Оценка уровней биомаркеров является чрезвычайно перспективной стратегией в диагностике и мониторинге ЭоЭ. Однако следует отметить, что большинство доступных исследований по изучению биомаркеров выполнены на малых по объему выборках и результаты во многом являются противоречивыми. Таким образом, необходимы дальнейшие исследования для внедрения неинвазивных методов в реальную клиническую практику.
Лечение
Связь между диетой и ЭоЭ впервые установлена в 1995 г., когда у 10 детей с эозинофилией пищевода и гастроэзофагеальным рефлюксом наблюдалось гистологическое и клиническое улучшение при приеме пищи на основе аминокислот (элементной диеты), а после возвращения на обычное питание возник рецидив заболевания [93].
Позднее предложена диета с исключением шести наиболее распространенных пищевых аллергенов (SFED): коровьего молока, пшеницы, яиц, сои, арахиса/древесных орехов, рыбы и морепродуктов. В первом опубликованном исследовании ЭоЭ на педиатрической выборке с использованием SFED описана клиническая и гистологическая ремиссия
у 74% обследованных [94].
По результатам метаанализа показано, что применение диеты SFED приводит к позитивному гистологическому ответу у 72,1% пациентов, причем результаты одинаковы как для взрослых, так и для детей. Элементные диеты имели показатель ответа 90,8%, а диеты, разработанные по результатам тестирования на пищевую аллергию, – 45,5%. Однако качество исследований, включенных в метаанализ, не оценивалось, и многие из них были обсервационными, без рандомизированных контролируемых исследований. Дальнейшая метарегрессия SFED показала гистологическую ремиссию у 69% и улучшение симптомов у 87,3%. SFED трудно внедрить в повседневную клиническую практику из-за высокого уровня приверженности, требуемого от пациентов, а также вследствие того факта, что при повторном введении большинство ответивших на диету SFED фактически реагируют на один или два продукта, вызывающих симптомы [95]. В связи с этим разработаны более простые диетические стратегии, такие как диета, исключающая четыре продукта, и диета, исключающая два продукта (FFED и TFED соответственно), которые доказали свою эффективность у 40–50% пациентов. Большинство пациентов реагировали на исключение коровьего молока и пшеницы. В ретроспективном исследовании 337 детей из Европы наиболее распространенными аллергенами стали молоко (42%), яйца (21,5%), пшеница (10,9%), арахис (9,9%) и соя (8,4%) [96].
Подбор диеты, основанный на тестировании аллергена, не продемонстрировал значительного эффекта. Метаанализ опубликованных исследований показывает, что подобные диеты имеют самые низкие показатели гистологической ремиссии [97]. В отличие от других элиминационных диет, включенных в анализ, между исследованиями наблюдалась значительная гетерогенность, что связано с различными методами тестирования на аллергию, а также их интерпретацией. Кроме того, ЭоЭ считается преимущественно не-IgE-опосредованным состоянием, и поэтому тестирование пищевых триггеров с использованием методов, основанных на IgE, вряд ли можно считать точным. Эксперты British Society of Gastroenterology (BSG) не рекомендуют проводить тестирование на пищевые антитела (IgE или IgG-4) у пациентов с ЭоЭ [77].
Фармакотерапией первой линии ЭоЭ являются препараты из группы ингибиторов протонной помпы. Систематический обзор и метаанализ 33 исследований с участием 431 взрослого и 188 детей показали частоту частичного клинического и гистологического ответа 60,8 и 50,5% соответственно [75]. В более позднем систематическом обзоре и метаанализе 11 гетерогенных рандомизированных контролируемых исследований с объединенной выборкой пациентов из 456 взрослых и детей с ЭоЭ оценили лечение ИПП как более эффективное, чем плацебо, лечение системными ГКС и биологическими препаратами (антитела к ИЛ-5), но менее эффективное в сравнении с препаратами на основе будесонида для местного применения [98]. Большинство опубликованных исследований включают восьминедельное лечение ИПП с последующей оценкой ответа посредством повторной эндоскопии и биопсии пищевода. Препараты и дозировки широко варьировали, хотя схемы обычно включали минимальную дозу омепразола (40 мг в день) или эквивалентную дозу для другого ИПП. В настоящее время не достигнут консенсус по продолжительности поддерживающей терапии ИПП у пациентов с позитивным ответом на лечение. По данным ретроспективного когортного исследования 75 пациентов с ЭоЭ, реагирующих на ИПП, устойчивая гистологическая ремиссия достигнута у 73%, а клиническая ремиссия – у 100% при поддерживающей терапии ИПП в течение как минимум 12 месяцев, 16 пациентов прекратили лечение по крайней мере через 12 месяцев, из них у 14 (87,5%) наблюдался рецидив симптомов, и у всех наблюдался гистологический рецидив [99]. Последующее исследование 40 пациентов с ЭоЭ, реагирующих на ИПП, показало аналогичные результаты: у 81% наблюдалась длительная клинико-морфологическая ремиссия [100].
Обоснованность применения топических ГКС в лечении ЭоЭ имеет обширную доказательную базу. По данным 11 рандомизированных контролируемых исследований, установлена высокая эффективность терапии топическими глюкокортикостероидами (ГКС), большой метаанализ показал достижение гистологической ремиссии на фоне терапии с отношением шансов (ОШ) 13,66 (95% ДИ 2,65–70,34) [101]. В качестве наиболее распространенных топических ГКС используются будесонид и флутиказон. После первоначального ответа на терапию в случае отмены местного лечения с высокой частотой наблюдается клинический и гистологический рецидив заболевания, что обусловлено необходимостью длительного поддерживающего лечения. В лечении ЭоЭ не рекомендуется применение системных ГКС и азатиоприна [77].
Перспективной стратегией лечения ЭоЭ является применение биологических препаратов, воздействующих на различные этапы воспалительного процесса. В настоящее время проводятся исследования нескольких препаратов (дупилумаба, цендакимаба, бенразизумаба). Дупилумаб, представляющий собой моноклональные антитела против рецепторов ИЛ-4, продемонстрировал эффективность в рандомизированном исследовании второй фазы с участием взрослых пациентов с активным ЭоЭ. Эффекты дупилумаба исследовали у 23 пациентов и сравнивали с 24 контрольными группами плацебо. В группе, получавшей еженедельные инъекции дупилумаба (300 мг в течение 12 недель), наблюдалось значительное уменьшение симптомов дисфагии на 10-й неделе, эндоскопических и морфологических проявлений заболевания. Отмечена хорошая переносимость пациентами препарата с незначительными побочными эффектам (35% имели эритему в месте инъекции, а 17% – назофарингит по сравнению с плацебо 8 и 4% соответственно) [102].
Цендакимаб – моноклональные антитела против ИЛ-13 – также изучался в исследованиях второй фазы. У 99 взрослых в ходе 16-недельного исследования наблюдалось значительное снижение среднего количества эозинофилов и показателей дисфагии, эффект был достигнут также в группе пациентов, рефрактерных к лечению топическими ГКС [103].
Бенрализумаб – моноклональные антитела против рецептора ИЛ-5 – также продемонстрировал свою эффективность в виде купирования симптомов дисфагии и достижения гистологической ремиссии [104].
Клинические наблюдения
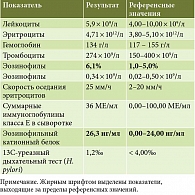
Клиническое наблюдение 1. Пациентка 37 лет обратилась к гастроэнтерологу с жалобами на практически ежедневную изжогу, тошноту, горечь в течение дня, отрыжку воздухом. Из анамнеза: указанные жалобы с прогрессивным нарастанием в течение последних двух лет, за медицинской помощью не обращалась, обследование не проходила, самостоятельно принимала антациды с незначительным положительным эффектом. Аллергологический анамнез: гиперчувствительность к некоторым сортам рыбы, белку яиц. Наследственность не отягощена. В общесоматическом статусе – без особенностей. Результаты лабораторного исследования представлены в табл. 1.
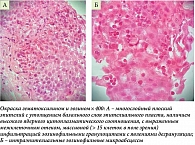
По данным ЭГДС: эндоскопические признаки ЭоЭ Eх1R2E2F1S0 (рис. 1). Выполнена мультифокальная биопсия (шесть фрагментов). Морфологическое заключение (рис. 2): фрагменты многослойного плоского неороговевающего эпителия с подлежащей стромой, инфильтрированные эозинофилами (в полях зрения при большом увеличении 15–20).
Установлен диагноз: «эозинофильный эзофагит Eх1R2E2F1S0». Пациентке рекомендована диета SFED (исключающая диета из шести продуктов: молоко/молочные продукты, пшеница/глютен, яйца, соя, орехи и морепродукты), медикаментозная терапия – ИПП в стандартной дозировке на шесть месяцев с последующим контролем (ЭГДС и морфологическое исследование биоптатов пищевода) для оценки ответа на стартовую терапию.
Клиническое наблюдение 2. Пациентка 24 лет обратилась к гастроэнтерологу с жалобами на преходящие эпизоды дисфагии (затруднение прохождения плотной пищи по пищеводу), одинофагии, изжогу 2–3 раза в месяц. Из анамнеза: редкие эпизоды изжоги в течение шести лет, явления дисфагии и одинофагии последние четыре месяца, ранее осмотрена гастроэнтерологом, около года назад выполнена ЭГДС: недостаточность кардии; рефлюкс-эзофагит; эритематозная гастропатия; дуоденогастральный рефлюкс. В соответствии с установленным диагнозом (K21.0 Гастроэзофагеальный рефлюкс с эзофагитом) получала лечение: ИПП, прокинетики, антациды. На фоне проводимого лечения отмечала купирование симптомов. Аллергологический анамнез, наследственность не отягощены. В общесоматическом статусе – без особенностей. По данным ЭГДС: эндоскопические признаки ЭоЭ Ех2R0E2F1S0 (рис. 3). Выполнена мультифокальная биопсия. Морфологическое заключение (рис. 4): фрагменты слизистой оболочки пищевода, представленной пластом многослойного плоского эпителия с явлениями паракератоза и акантоза. В субэпителиальной строме и в толще слизистой оболочки – очагово-диффузный воспалительный инфильтрат, представленный лимфоцитами, плазмоцитами с примесью большого числа эозинофильных лейкоцитов (45–50 в поле зрения при увеличении × 400) с формированием эозинофильных микроабсцессов. Отмечаются диффузная гиперплазия базального слоя эпителиального пласта, наличие межклеточного отека. Результаты лабораторного исследования представлены в табл. 2.
Установлен диагноз: «эозинофильный эзофагит Ех2R0E2F1S0». Пациентке рекомендована диета SFED (исключающая диета из шести продуктов: молоко/молочные продукты, пшеница/глютен, яйца, соя, орехи и морепродукты), медикаментозная терапия – ИПП в стандартной дозировке на один месяц с последующим контрольным осмотром гастроэнтеролога для оценки клинического ответа на проводимую терапию.
Представленные клинические примеры представляют интерес, так как демонстрируют «неклассические» варианты ЭоЭ. Обращают на себя внимание несколько особенностей: в обоих случаях пациенты – молодые женщины, хотя заболевание чаще встречается среди мужчин. Показательно, что клиническая картина заболевания не коррелировала с эндоскопическими и морфологическими признаками. В первом случае при ЭГДС обнаруживались характерные проявления, при этом жалобы в полной мере соответствовали таковым при ГЭРБ, а гистологические данные характеризовались минимальными проявлениями заболевания. Во втором случае, напротив, манифестное течение ЭоЭ с дисфагией и одинофагией, отсутствие указаний в анамнезе на иммуноопосредованные заболевания и едва различимые эндоскопические признаки не соответствовали выраженным гистологическим изменениям в биоптатах пищевода – большое количество эозинофильных лейкоцитов (45–50 в поле зрения при увеличении × 400) с формированием эозинофильных микроабсцессов, диффузная гиперплазия базального слоя эпителиального пласта, межклеточный отек. Выраженность клинических проявлений, обнаруженных морфологических изменений, вероятно, может быть предиктором более тяжелого, чем в первом случае, течения ЭоЭ с возможной неэффективностью терапии ИПП и необходимостью применения топических ГКС.
Заключение
Заболеваемость и распространенность ЭоЭ значительно увеличиваются во всем мире. Точные патогенетические механизмы заболевания остаются неясными, но известно, что определенные факторы окружающей среды могут вызывать воспаление слизистой оболочки пищевода у генетически предрасположенных людей. Клинические проявления ЭоЭ существенно варьируют не только в зависимости от возраста, но и у разных пациентов – от «классического» вклинения фрагментов пищи в пищевод до малоспецифичных симптомов, скрывающихся под маской ГЭРБ. В диагностике заболевания, помимо тщательного анализа жалоб, анамнеза, сопутствующих иммуноопосредованных заболеваний, ключевое значение имеет эндоскопическое исследование с оценкой визуальных признаков по EREFS с последующим морфологическим исследованием биоптатов. Перспективным следует считать внедрение в клиническую практику неинвазивных маркеров диагностики ЭоЭ для первичного выявления и мониторинга заболевания. Применяемые в настоящее время принципы лечения включают диету с исключением определенных продуктов, ИПП, ГКС для местного и перорального применения, а также биологические препараты.
Shchelochenkov S.V., PhD, Bordin D.S., PhD, Prof., Livzan M.A., PhD, Prof., Corresponding member of the RAS, Guskova O.N., PhD, Shchelochenkova T.D., PhD
Immanuel Kant Baltic Federal University, Kaliningrad
Omsk State Medical University
A.S. Loginov Moscow Clinical Scientific Center
Russian University of Medicine, Moscow
Tver State Medical University
Contact person: Sergey V. Shchelochenkov, workmedbox@gmail.com
Eosinophilic esophagitis (EoE) is a chronic immune-mediated disease of the esophagus that requires lifelong therapy and monitoring. The diagnosis is established on the basis of an endoscopic examination of the esophagus with a multifocal biopsy of the mucous membrane and the detection of at least 15 eosinophils in the field of view (≈ 60 eosinophils/mm2) at high magnification. The incidence and prevalence of EoE have increased significantly in recent decades, with an average delay in diagnosis of EoE of 4–6 years in both children and adults. Early detection of EoE depends on recognition of the initial clinical manifestations, which vary significantly between children and adults, as well as among patients of the same age. Approaches to the treatment of EoE have not been fully developed and include dietary recommendations, medications, and endoscopic methods at the stage of formation of esophageal strictures. This article reviews the epidemiological, clinical, endoscopic and morphological features of the disease, as well as therapeutic options for EoE, and presents clinical observations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.