Плечелопаточный периартроз в практике невролога
- Аннотация
- Статья
- Ссылки
- English



Введение
Боли в области плечевого сустава могут сопутствовать целому ряду не только неврологических, но и соматических заболеваний, а также ортопедической и травматологической патологии. Их распространенность в популяции варьируется от 7 до 26%, причем в некоторых странах боль в плече служит причиной выдачи 18% оплачиваемых больничных листов [1, 2].
Как известно, синдром артралгии полиэтиологичен [3]. Он может быть вызван вирусными и бактериальными инфекциями, кристалл-индуцированными синовитами, включая подагру, ревматическими заболеваниями, спондилоартропатиями, злокачественными опухолями и рядом других патологических состояний (саркоидозом, остеопорозом, остеомиелитом, туберкулезом, травмами суставов, наследственными скелетными дисплазиями, фибромиалгиями, радикулопатиями и др.). У пожилых пациентов около 65% случаев болей в плече обусловлено патологией вращательной манжеты плеча, 11% – болезненностью перикапсулярной мускулатуры, 10% – патологией акромиально-ключичного сустава, 3% – артритом плечевого сустава, а в 5% случаев боли носят характер иррадиирущих из шейного отдела позвоночника [4, 5].
Обычно артралгия в области плечевого сустава связана с плечелопаточным периартрозом/периартритом (ПЛП) (этот термин был введен в 1872 г. французским хирургом S. Duplay) [6]. ПЛП имеет много терминов-синонимов (например, импинджмент-синдром, плечевая периартропатия, адгезивный капсулит, синдром «замороженного плеча») и до сих пор является предметом обсуждения врачей смежных специальностей: неврологов, ортопедов, ревматологов и др. ПЛП составляет 80% от числа всех ревматических заболеваний плеча [7]. Его доля в структуре причин боли в плече на специализированном приеме достигает 43% [8]. Такая высокая частота возникновения данной патологии в значительной степени обусловлена особенностями анатомии и биомеханики плечевого сустава, а также физиологией сухожильной ткани: большой подвижностью и недостаточной стабильностью головки плеча в суставной впадине лопатки, уязвимостью структур периферической нервной системы области плечевого пояса и плеча, высокими нагрузками на мышцы плечевого сустава [9–11].
Заболеваемость ПЛП достигает максимума в возрасте 41–50 лет (61,11%), что можно объяснить характерными для этого периода дегенеративными изменениями в нервно-мышечно-скелетном аппарате плечевого сустава [12].
Частота встречаемости ПЛП у мужчин выше (55,56%), чем у женщин (44,44%) [12], хотя в этом вопросе нет однозначности [7]. Однако и у мужчин (79%), и у женщин (73%) поражена, как правило, одна сторона [13].
Анатомия и физиология плечевого сустава
По форме плечевой сустав является типичным шаровидным суставом и образован суставной впадиной лопатки и головкой плечевой кости, которая ввиду больших размеров лишь частично контактирует с суставной впадиной, благодаря чему плечевой сустав по сравнению с остальными суставами более подвижен и имеет более сложное строение. Анатомический комплекс плечевого сустава состоит из плечелопаточного, грудино-ключичного и акромиально-ключичного суставов, а также двух ложных суставов – подплечевого и лопаточно-грудинного [14, 15].
Плечевой сустав позволяет совершать различные движения: приведение и отведение, сгибание и разгибание, наружную и внутреннюю ротацию, циркумдукцию (круговые движения попеременно вокруг всех осей, когда вся конечность описывает форму конуса). Мышцы, осуществляющие весь объем движений в плечевом суставе, перечислены в табл. 1 [7]. Значительная амплитуда движений в этом суставе обусловлена структурными факторами: серьезными диспропорциями суставных поверхностей, просторной и слабо натянутой суставной капсулой, недостаточной развитостью связочного аппарата, большим количеством периартикулярных мышц [16, 17].
Конгруэнтность суставных поверхностей обеспечивается за счет суставной губы (аналога мениска), фиксирующейся по периферии суставной впадины и образующей замкнутое кольцо. Она углубляет суставную впадину, в 1,5 раза увеличивая ее площадь и в четыре раза – ее объем. Кроме того, она ослабляет толчки и сотрясения при движениях в плечевом суставе и выступает дополнительной опорой для головки плечевой кости, предотвращая ее дислокацию [18]. Она также отвечает за свободу движений. Снижение ее эластичности или чрезмерное натяжение приводит к сокращению объема движений.
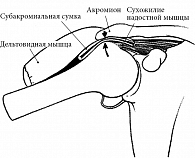
В мобильности плечевого сустава существенную роль играют синовиальные сумки, составляющие вспомогательный аппарат. Самые крупные среди них – подакромиальная, поддельтовидная, подклювовидная и подсухожильная сумка подлопаточной мышцы. Подакромиальная сумка уменьшает трение дельтовидной мышцы об акромион, способствует скольжению надостной мышцы под клювовидно-акромиальной дугой. Подсухожильная сумка подлопаточной мышцы и подклювовидная сумка сообщаются с полостью сустава [14, 19].
Статическую стабильность плечевому суставу придают суставная капсула, верхняя, средняя и нижняя плечелопаточные связки, клювовидно-акромиальная связка [20]. Капсула плечевого сустава имеет два отверстия. Через одно отверстие проходит сухожилие подлопаточной мышцы, через другое – сухожилие длинной головки двуглавой мышцы плеча [15, 19]. Последнее располагается в межбугорковой борозде и укрепляет сустав спереди, препятствуя подвывиху головки вперед [21]. Существенный вклад в стабильность плечевого сустава вносят окружающие его мышцы, особенно мышцы, образующие так называемую вращательную манжету (малая круглая, над- и подостная, подлопаточная) [15]. Эти мышцы начинаются на лопатке и прикрепляются к бугоркам плечевой кости. Надостная мышца удерживает в центре суставной впадины головку плечевой кости и вместе с пучками дельтовидной мышцы способствует отведению плеча. Подостная и малая круглая мышцы вращают кнаружи плечо и предупреждают смещение головки плечевой кости вверх, что имеет особое значение при интенсивных нагрузках. В центрировании головки плечевой кости также принимает участие подлопаточная мышца, которая ротирует плечо кнутри [17].
В целом факторы, определяющие стабильность плечевого сустава в соотношении 30:70, можно условно разделить на две группы: пассивные (статические) и активные (динамические). Среди первых следует выделить костные структуры, суставные губы, связки, суставную капсулу, а также отрицательное давление в полости плечевого сустава (вогнутая и выпуклая поверхности с эластичной губой по периферии впадины и минимальным количеством жидкости между ними функционируют как присоска). Ко вторым относятся мышцы – элементы вращательной манжеты и другие мышцы, окружающие плечевой сустав [22, 23].
Структуры верхней части плечевого сустава и его капсулы (задняя ее сторона), а также большую часть вращательной манжеты иннервирует надлопаточный нерв, переднюю сторону сустава и капсулы – подмышечный нерв [24]. В целом иннервация мышц плеча обеспечивается плечевым сплетением [7].
Патогенез
Причины, вызывающие ПЛП, многочисленны. Рассмотрим наиболее известные этиологические факторы ПЛП.
Патогенетически ПЛП может рассматриваться как миофасциальный болевой синдром. Воспалительно-дегенеративные изменения в мышцах манжеты ротаторов плеча (ее составляют надостная, подостная, малая круглая и подлопаточная мышцы) вызывают гипертонус и локальную болезненность межбугорковой борозды с проходящим в ней сухожилием длинной головки бицепса в области сухожилия надостной мышцы, подостной и малой круглой мышц, а также сухожилия подлопаточной мышцы (чаще в местах прикрепления) [25]. В результате острого перенапряжения мышцы или хронических нагрузок происходит перегрузка сократительных элементов в каком-либо локусе с повреждением тканей и выходом ионов Са2+ из саркоплазматического ретикулума, что инициирует и поддерживает устойчивую контрактуру вовлеченных в патологический процесс мышечных волокон [25]. Формируется область с усиленным метаболизмом, сниженным кровотоком и сильно сокращенными мышечными волокнами, которая при пальпации ощущается в виде плотного тяжа. При этом уплотнения особенно часто определяются в местах перехода мышц в сухожилия и фасции. Таким образом, складывается устойчивая патологическая система – порочный круг, генератором которого являются триггерные точки [26]. В ряде случаев может развиваться анталгическая миогенная контрактура плечевого сустава [27].
Выделяют также неврологические причины ПЛП, которые могут стать следствием нарушений как в периферической, так и в центральной нервной системе. К подобным периферическим расстройствам относятся поражение корешков в шейном отделе позвоночника, нервных стволов в области капсулы плечевого сустава, сегментов спинного мозга, плечевого сплетения и его коротких ветвей (паралич Дюшена – Эрба), а также рефлекторная цервикобрахиалгия [27, 28].
По мнению Я.Ю. Попелянского, в случае поражения корешков в позвоночнике и нервных стволов в области капсулы плечевого сустава формируются очаги нейроостеофиброза по рефлекторным механизмам [28]. Периартикулярные ткани плечевого сустава – лишь один из адресатов патологических нервных импульсов из позвоночника или других очагов. В качестве доказательства возможной неврогенной природы ПЛП можно рассматривать:
- развитие заболевания на фоне шейного остеохондроза или спондилоартроза с компрессией корешков;
- развитие у пациентов с шейным остеохондрозом заболеваний, близких по патогенезу к ПЛП (эпикондилита, стилоидита);
- ликвидацию симптомов ПЛП дерецепцией пораженного диска.
Вертеброгенная радикулопатия корешков С4–С6 проявляется болью в области шеи, плеча и лопатки, иррадиирущей вниз по наружному краю плеча. При длительном течении возникают слабость и гипотрофия дельтовидной мышцы и бицепса. Снижается или отсутствует рефлекс с бицепса. Отмечаются гипалгезия кожи в области лопатки, наружной поверхности плеча и парестезии в области первого пальца кисти, могут возникать вегетативно-трофические расстройства в форме ПЛП [23, 24].
E. Schlesinger и H. Liss считают, что в формировании ПЛП существенную роль играет неврит подкрыльцового нерва [29]. По мнению А.И. Арутюнова и М.К. Бротмана, помимо ПЛП, обусловленного местной травматизацией и инфекционно-воспалительными заболеваниями, имеют место идиопатические формы ПЛП, и таких большинство. Они не являются заболеванием sui generis, а только выражают трофические расстройства, вызванные ирритативным процессом в симпатическом образовании шейного отдела, преимущественно в звездчатом узле [30].
Поражение центральной нервной системы, в частности пирамидного пути, и экстрапирамидные нарушения способны привести к ПЛП. Это подтверждает тот факт, что ПЛП может развиться у пациентов с очаговыми заболеваниями центральной нервной системы, а также то, что процесс способен затронуть и вторую сторону [28, 31].
Отдельной разновидностью ПЛП можно считать некоторые формы постинсультного болевого синдрома в области плеча [32], распространенность которого варьируется от 16 до 80% среди лиц, перенесших инсульт [9, 11]. Условно причины такого болевого синдрома можно разделить на две группы: связанные с невральной дисфункцией/повреждением и вызванные локальным повреждением околосуставных тканей. К неврологическим причинам постинсультного болевого синдрома в области плеча относятся комплексный регионарный болевой синдром, центральная постинсультная боль, повреждение плечевого сплетения, изменение мышечного тонуса в паретичных конечностях [9, 32], к локальным повреждениям – адгезивный капсулит, ротационные надрывы манжеты плеча, артрит плечевого сустава и акромиально-ключичного сочленения, тендовагинит двуглавой мышцы, поддельтовидный тендовагинит, синдром ротаторов плеча [9, 32, 33].
Острые травмы анатомических составляющих плечевого сустава, травмы ключицы, вывих плечевого сустава и т.п. могут вызвать слабость и затруднение при поднятии руки вверх, что говорит о разрыве сухожилий вращательной манжеты. При этом обычно повреждаются сухожилия всех трех мышц одновременно, но возможны и изолированные разрывы сухожилий надостной мышцы или только подостной и малой круглой мышц. На ранних этапах диагностика ПЛП затруднена симптомами вывиха плеча и других травм и дальнейшей гипсовой иммобилизацией [31, 34]. Но впоследствии в процессе реабилитации часто выставляется диагноз ПЛП. В его патогенез входят сами структурные повреждения тканей сустава, длительная иммобилизация, нарушение двигательного стереотипа и др.
Как правило, основной структурой, вовлеченной в синдром ПЛП, является вращательная манжета плеча. Главный механизм повреждения – микротравматизация дистальных отделов вращательной манжеты (тендиниты) и разрывы сухожилий (и/или мышц) вследствие стереотипных, силовых движений у людей, занимающихся физическим трудом или спортом (работа с поднятыми руками), привычного статического удержания плеча у офисных работников и т.д. Чаще страдают мужчины старше 40 лет, обычно поражается доминантная рука [14, 35].
В 1972 г. C. Neer предложил термин «импинджмент-синдром», или «синдром столкновения», поскольку в его основе лежит столкновение вращательной манжеты с передненижней частью акромиона. При этом чаще страдает сухожилие надостной мышцы, которое находится между плечевой костью и акромионом, как между молотом и наковальней, и, будучи наиболее уязвимым, сдавливается (рис. 1) [36]. К факторам риска компрессии сухожилия надостной мышцы относятся особенности анатомического строения канала надостной мышцы, образованного снизу верхним краем головки плечевой кости, а сверху – клювовидно-акромиальной дугой и акромиально-ключичным суставом.
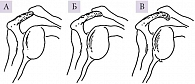
Повреждаться может не только сухожилие надостной мышцы, но и вся вращательная манжета, что обусловлено тесным контактом анатомических структур (клювовидно-акромиальной дуги, бугорков плечевой кости, сухожилий вращательной манжеты и субакромиальной сумки) в области под акромиальным отростком. Вращательная манжета имеет толщину 5–6 мм, а пространство, необходимое для ее движения под клювовидно-акромиальной дугой, составляет 6–7 мм [37, 38]. В результате такого ограничения сухожилия вращательной манжеты при подъеме плеча вверх могут ущемляться между головкой плечевой кости и акромионом. Большое значение имеет форма акромиона, которая, по данным L. Bigliani и соавт., в 43% случаев бывает изогнутой, в 40% – крючковидной и в 17% случаев – плоской (рис. 2) [39]. Разрывы вращательной манжеты происходят чаще у пациентов с крючковидной формой акромиона [40, 41]. При сгибании плеча и его ротации внутрь большой бугорок плечевой кости прижимается к нижней поверхности акромиона и клювовидно-акромиальной дуге. Смещение головки плечевой кости вверх приводит к постоянному столкновению и повреждению нижней поверхности акромиона, что в свою очередь вызывает дегенерацию суставного хряща и нарушение секреции синовиальной жидкости в плечевом суставе [42]. Причинами ущемления в канале надостной мышцы также может быть уменьшение пространства, в котором движется вращательная манжета, в результате фиброза подакромиальной сумки, утолщения клювовидно-плечевой связки, костных разрастаний (остеофитов) на нижней поверхности акромиально-ключичного сустава, увеличения большого бугорка головки плечевой кости [24, 43].
Повреждение вращательной манжеты повышает нагрузку на статические стабилизаторы сустава, что способствует растяжению и истончению суставной капсулы, улучшению подвижности плеча. Несостоятельность статических механизмов стабилизации ведет к патологическому смещению головки плечевой кости и дальнейшему ущемлению вращательной манжеты. Из-за боли пациент ограничивает движения в суставе и щадит мышцы вращательной манжеты, тем самым выключая динамические механизмы стабилизации и усиливая нагрузку на статические. Дегенеративное изменение манжеты ротатора усугубляется механизмом трения. Трение с нижней поверхностью акромиона приводит к ее полному разрыву. В результате формируется порочный круг развития импинджмент-синдрома [10, 44].
В динамике патологического процесса импинджмент-синдрома C. Neer выделил три стадии, которые можно учитывать при выборе терапии и прогнозировании течения заболевания [36]:
- стадия I – острое воспаление, отек (и возможное кровоизлияние) сухожилий мышц вращательной манжеты плеча. Возникает у пациентов до 25 лет и регрессирует при адекватной консервативной терапии;
- стадия II – утолщение сухожилий, которое создает повышенные условия для трения и развития необратимых явлений тендинита и фиброза. Отмечается в возрасте 25–45 лет;
- стадия III – фактически механическое разрушение сухожилий вращательной манжеты плеча.
Артриты плечевого сустава, асептический некроз головки плечевой кости, артроз плечевого и/или акромиально-ключичного сустава часто сопровождаются ПЛП. Однако четкие критерии постановки диагноза и подразделения форм ПЛП на подтипы отсутствуют. Только для синдрома «замороженного плеча», или адгезивного капсулита, как клинической формы ПЛП описаны первичный и вторичный подтипы. При этом вторичный адгезивный капсулит может быть внутренним, внешним и связанным с системным заболеванием, что важно для дифференцированного лечения [34, 45]. Многие врачи, к сожалению, вообще не выделяют в данном случае диагноз ПЛП. Хотя ПЛП следует рассматривать как «шлейф» любой артропатии, поскольку боль всегда порождает мышечный спазм, изменение двигательного стереотипа, ограничение двигательной активности в суставе и т.п. [46]. При выборе адекватной терапии необходимо учитывать все компоненты артралгии, не забывая о периартропатии.
По нашему мнению, целесообразно подразделять ПЛП на первичный и вторичный. Первичный ПЛП развивается на фоне нарушения двигательного стереотипа, длительного напряжения определенных групп мышц и т.п. Вторичный ПЛП в свою очередь возникает на фоне различных заболеваний: патологии опорно-двигательного аппарата (ортопедических аномалий развития, артрозов, артритов, спондилоартритов, синдрома дисплазии соединительной ткани, гипермобильности суставов), эндокринно-обменных нарушений (сахарного диабета, нарушений жирового, кальциевого обмена, гипотиреоза, гиповитаминоза), ревматологической патологии, нейротрофических нарушений, сосудистых расстройств, онкопатологии и т.п. [46, 47].
Как известно, в Международной классификации болезней 10-го пересмотра диагноз «периартрит плечевого сустава» отсутствует. Все периартикулярные поражения области плечевого сустава представлены в виде отдельных нозологических форм, в основном соответствующих классификации T. Thornhill [48]:
- тендинит мышц вращательной манжеты (с указанием конкретной мышцы);
- тендинит двуглавой мышцы плеча;
- кальцифицирующий тендинит;
- разрыв (частичный или полный) сухожилий мышц области плечевого сустава;
- адгезивный капсулит (хроническое фиброзное воспаление капсулы плечевого сустава, характеризующееся значительным ограничением активных и пассивных движений).
В рутинной клинической практике периартикулярные поражения целесообразно разделять на патологию вращательной манжеты (первые четыре пункта классификации) и поражение собственно капсулы (пункт 5) [49].
В целом ПЛП – нозология гетерогенного характера, и в большинстве случаев (90–95%) причиной боли в области плечевого сустава является поражение периартикулярных структур [10]. Однако во избежание расхождений всем смежным специалистам было бы полезно иметь четкую классификацию, позволяющую выделять подтипы ПЛП с учетом всех возможных вариантов и определять для каждого алгоритм лечения.
При ведении пациента с болью в плече нельзя забывать и о «красных флажках» – признаках серьезной патологии (первичных опухолей, метастазов, инфекционных артритов и др.). Опасен синдром Панкоста, когда боли в плечевом суставе и клинические проявления ПЛП возникают на фоне опухолевого поражения верхних долей легких и купола диафрагмы. ПЛП при этом рассматривается как «симптом на отдалении» основного заболевания и требует от врача особой настороженности и тщательного исследования внутренних органов [50].
Под нашим наблюдением находилась пациентка 64 лет с симптомами ПЛП на фоне остеоартроза плечевого сустава, сопровождавшегося высокой скоростью оседания эритроцитов (47 мм/ч), у которой в дальнейшем при тщательном обследовании была выявлена гомолатеральная саркома лопатки.
Клиническая картина
Как известно, независимо от причин ПЛП проявляется одинаково – болевым синдромом и ограничением подвижности в плечевом суставе [2]. Пациенты с ПЛП при сборе анамнеза редко могут сказать, что именно вызвало заболевание и когда оно дебютировало. К ПЛП могут привести прямая или непрямая травма, длительное перенапряжение регионарных мышц, резкое «неправильное» движение в суставе, длительная микротравматизация структур плечевого сустава. Нужно помнить и о внутренних факторах, которые также могут стать причиной ПЛП: врожденные аномалии структур сустава, гиподинамия (иммобилизация), нарушение кровоснабжения отдельных зон сухожилий, возрастная инволюция опорно-двигательного аппарата [38].
Боль развивается постепенно, локализуясь по переднебоковой поверхности плечевого сустава и реже по его задней поверхности. Сначала боль вызывают отведение, подъем вперед или заведение руки за спину. В этот период пациенты в основном занимаются самолечением и стараются избегать болевых движений в плечевом суставе. В результате объем движений в плечевом суставе ограничивается, боль приобретает постоянный, а временами нетерпимый, стреляющий характер. Больные начинают испытывать сложности в быту: им трудно расчесываться, одеваться, держаться за верхний поручень в транспорте, делать домашнюю уборку. Из-за боли часто нарушается сон, пациентам приходится чаще спать на спине или здоровом боку. Развернутая клиническая картина ПЛП формируется в течение двух-трех месяцев от дебюта процесса, и только тогда больные впервые обращаются за медицинской помощью [31, 34, 49].
В неврологическом статусе отсутствуют анизорефлексия и нарушения чувствительности. Сила в конечностях не снижена, однако исследовать силу в некоторых мышцах проблематично, поскольку многие движения в плечевом суставе вызывают сильную боль. Невролог должен оценить симметричность положения лопаток, ключиц, верхних конечностей, пропальпировать паравертебральные и межостистые точки шейного отдела позвоночника, точки Эрба, периартикулярные ткани плечевого сустава, выявить зоны гипертонуса, болезненные триггерные пункты. Внешний вид плечевой области и пальпация мышц иногда позволяют определить асимметричную гипотрофию (неспецифический признак, свидетельствующий о длительности присутствия патологии), деформацию мышц в результате полного разрыва сухожилий (надостной и длинной головки бицепса плеча), провести пробы Аллена, Адсона для исключения скаленус-синдрома. Дополнительно могут быть выявлены следующие клинические характеристики ПЛП [10, 27, 51]:
- большая интенсивность болевого синдрома и степени ограничения объема движений при адгезивном капсулите;
- отчетливая тенденция к хронизации болевого синдрома у пациентов с мышечно-тоническим синдромом плечевого пояса;
- большая частота дисфункции в шейном отделе позвоночника;
- патологии структур вращательной манжеты плеча у больных этой группы.
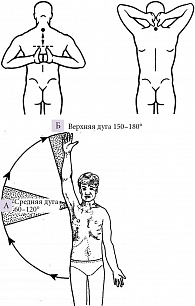
Чтобы оценить объем движений в плечевом суставе, невролог должен зафиксировать ладонью надплечье сверху вниз, захватив лопатку и ключицу. Измерение объема движений в суставе выполняется с помощью гониометра (угломера), который состоит из двух браншей (подвижной и неподвижной), соединенных с измерительной шкалой от 0 до 180 либо 360°. Методику измерения объема движений в суставах конечностей предложил R. Braddom [52]. Объем движений в плечевом суставе в норме показан на рис. 3.
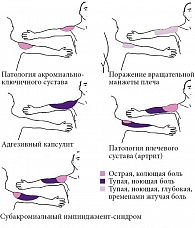
Для патологии вращательной манжеты плеча характерна разлитая тупая, ноющая, глубокая, временами жгучая боль в верхненаружном отделе плеча с иррадиацией до уровня локтя по передней, задней и боковой части плеча. Боль усиливается при подъеме руки вверх и заведении ее за спину. Любые резкие движения в плечевом суставе могут усиливать боль, и, замечая это, больные начинают сознательно ограничивать объем движений [53]. Патология акромиально-ключичного сустава проявляется острой болью в месте его проекции, а также глубоко в надостной ямке и области верхней порции трапециевидной мышцы. Адгезивный капсулит и импинджмент-синдром вызывают тупые, ноющие боли в верхненаружном отделе плеча по наружной поверхности плеча до локтя, но последний может давать острую/стреляющую боль в передней, задней и боковой части плеча и тупую ноющую боль в переднелатеральной и заднелатеральной части руки. Боль при артрите плечевого сустава острая, стреляющая через плечо, в переднелатеральный и заднелатеральный отделы руки, а также тупая ноющая, достигающая середины предплечья. Наиболее сильная боль у пациентов с артритом плечевого сустава – 8,46 балла по визуальной аналоговой шкале (ВАШ). Чуть менее выражена боль при патологии вращательной манжеты плеча (8,41 балла по ВАШ), импинджмент-синдроме (7,72 балла по ВАШ), адгезивном капсулите (6,95 балла по ВАШ). Наиболее терпимую боль вызывает патология акромиально-ключичного сустава (6,42 балла по ВАШ) [54].
Артрит плечевого сустава можно отличить от патологии вращательной манжеты плеча по большей области распределения боли [55]. Локализация и характер боли в зависимости от пораженных структур приведены на рис. 4 [54].
Болевой синдром при периартропатиях обычно интенсивный, длительный и часто сопровождается психологическими нарушениями. Для описания больных с таким синдромом был даже предложен термин «периартритная личность» [13, 56, 57]. Хотя не все были согласны с тем, что определенные психологические черты – результат болезни, а не ее причина [57]. Наиболее часто у пациентов с ПЛП выявлялись бессонница и тревожность [58].
Прогноз
В 2014 г. вышло Руководство по диагностике и лечению субакромиального болевого синдрома (синдрома вращательной манжеты), подготовленное Нидерландской ортопедической ассоциацией [59]. В основу руководства положен мультидисциплинарный подход. Отмечается, что длительность симптомов свыше трех месяцев ассоциируется с плохим прогнозом. Прогноз ухудшается также при высокоинтенсивной боли в дебюте заболевания, возрасте пациента 45–55 лет, изогнутой и крючковидной формах акромиона по L. Bigliani [39]. Негативные психосоциальные факторы способствуют хронизации процесса. Для предупреждения возникновения поражений вращательной манжеты плеча или их обострения рекомендуется избегать повторяющихся нагрузок на мышцы плечевого пояса, избыточного напряжения мышц рук, вибрации, соблюдать принципы эргономики при работе. Раннее возвращение к труду улучшает прогноз заболевания. В проспективном исследовании показано, что в течение десяти лет только у 39% пациентов наблюдалось полное восстановление, у 54% имелись клинические признаки без функциональных ограничений, а 7% остались инвалидами [60].
Диагностика
Рациональный подход к диагностике предполагает возможность определения пораженной структуры на этапе клинического осмотра с дальнейшим уточнением (при необходимости) характера патологического процесса с помощью инструментальных методов. В основе выявления поражений мягких тканей области плечевого сустава лежит клинический метод: тщательный анализ жалоб, истории развития заболевания, данные осмотра, включая оценку функциональных тестов [10]. Рассмотрим наиболее распространенные тесты для диагностики ПЛП [8, 61, 62].
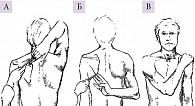
Тесты «почесывания» Apley. Позволяют исключить поражение суставов и периартикулярных тканей плечевого пояса. Тест «почесывания» Apley (отведение и наружная ротация): пациенту предлагают заложить руку за голову и дотронуться до верхнего медиального края лопатки противоположной стороны (рис. 5А). Тест «почесывания» Apley 1 (приведение и внутренняя ротация): пациенту предлагают заложить руку за спину и попытаться дотронуться до нижнего угла лопатки (рис. 5Б). Тест «почесывания» Apley 2 (приведение и внутренняя ротация): пациенту предлагают положить руку на противоположное плечо (рис. 5В). В норме пациент выполняет все движения в полном объеме и не чувствует боли. Появление или усиление боли и/или затруднения при выполнении этих тестов свидетельствуют о патологии в структурах плечевого пояса.
Тест «Расстояние большой палец кисти – СVII» 1. При выполнении теста можно одновременно оценить отведение, наружную ротацию, сгибание в плечевом суставе, а также функцию надостной, подостной, малой круглой мышц. Пациенту предлагают заложить руки за голову и положить кисти на затылок или заложить руку за голову и дотронуться большим пальцем кисти до CVII. В норме пациент полностью касается позвонка пальцем (рис. 6А).
Тест «Расстояние большой палец кисти – СVII» 2. При выполнении теста можно одновременно оценить приведение, разгибание и внутреннюю ротацию в плечевом суставе, а также функцию подлопаточной мышцы. Пациенту предлагают заложить руки за спину. Врач определяет расстояние от большого пальца кисти до CVII. В норме это расстояние не превышает 20 см (рис. 6Б).
Тест надостной мышцы. Тест подразумевает отведение руки в положении внутренней ротации (первый палец смотрит вниз) или наружной ротации (первый палец смотрит вверх). Дополнительно врач может оказывать давление на руку, а пациент должен сохранять исходное положение. Появление боли или снижение мышечной силы указывает на поражение сухожилия надостной мышцы или подлопаточного нерва.
Тест подостной мышцы. Позволяет диагностировать целостность подостной мышцы и/или ее сухожилия. Пациент сидит или стоит, руки согнуты в локтях, предплечье в среднем положении между пронацией и супинацией (первый палец смотрит вверх). Врач фиксирует свои ладони на тыльной поверхности кистей пациента. Пациент пытается развести руки в стороны, преодолевая сопротивление врача. Положительным тест считается при возникновении боли и слабости.
Тест болезненной дуги (проба Dowborn). Тест заключается в активном отведении и подъеме руки пациента, которая в норме описывает дугу в 180° (рис. 7). Появление боли при отведении руки в промежутке между 60–120° (средняя дуга) свидетельствует о поражении сухожилия надостной мышцы и/или субакромиальной сумки, а при последних 20–30° отведения (верхняя дуга) – о поражении ключично-акромиального сустава.
Тест Neer. Фиксируя лопатку пациента одной рукой, другой рукой врач поднимает вытянутую руку пациента под углом, средним между передним сгибанием и отведением (рис. 8). При этом происходит пассивное сдавление структур под передней частью акромиона. Боль при выполнении этого движения свидетельствует о субакромиальном синдроме.
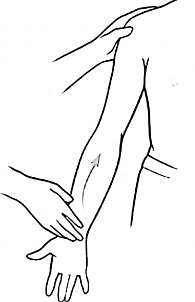
Тест Speed. Позволяет диагностировать поражение двуглавой мышцы плеча. Пациент сидит или стоит, плечевой сустав согнут под углом 60–90°, локоть разогнут, предплечье супинировано так, что ладонь пациента направлена вверх (рис. 9). Пациенту предлагают выполнить дальнейшее сгибание в плечевом суставе, преодолевая сопротивление руки врача, расположенной на дистальной части предплечья пациента. Появление боли, локализованной в области межбугорковой борозды плечевой кости, считается положительным результатом теста и характерно для тендинита длинной головки двуглавой мышцы плеча.
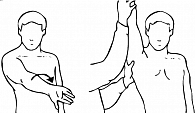
Тест Yocum. Тест проводят для диагностики импинджмент-синдрома сухожилий вращательной манжеты плечевого сустава. Исследуемая рука пациента располагается на противоположном плече. Испытуемому предлагается поднять локоть, не допуская подъема плеча (рис. 10). Появление боли при подъеме локтя считается положительным результатом теста.
Тест Hawkins – Kennedy. Проводится для выявления импинджмент-синдрома. Плечевой и локтевой суставы пациента согнуты под углом 90°. Одна рука врача располагается в области локтевого сустава пациента, другая – в области исследуемого плечевого сустава. Затем врач выполняет форсированную внутреннюю ротацию плечевого сустава до завершения полного объема движения (рис. 11). Появление выраженной боли считается положительным результатом теста.
Для топической диагностики поражения мышц манжеты ротаторов плеча наиболее показательны резистивные активные движения, то есть движения через сопротивление. При данном обследовании рука больного опущена вдоль туловища и согнута в локтевом суставе вперед под углом 90°. В этот момент врач фиксирует руку пациента, не давая ей совершать движения. Болезненность, появляющаяся в плече при попытке больного привести кисть медиально к животу, свидетельствует о поражении подлопаточной мышцы. Боль при попытке отведения руки в латеральную сторону указывает на поражение подостной и малой круглой мышц. Возникновение болевого синдрома при стремлении отвести руку через сторону вверх заставляет предположить патологию надостной мышцы. Боль в плече при попытке супинировать предплечье указывает на поражение сухожилия длинной головки бицепса (симптом Эргазона, или симптом «поворота ключа в дверном замке») [10, 63].
Специфические изменения на рентгенограмме при ПЛП обычно отсутствуют (могут быть обнаружены остеопороз головки плечевой кости, кистовидная перестройка костной ткани большого бугорка и т.п.). Однако рентгенологическое исследование имеет значение для исключения других серьезных причин боли в плече, сопровождающихся резким ограничением подвижности (кальцифицирующего тендинита, артрита, травм, асептического некроза головки плечевой кости, остеофитов, неровности нижней поверхности акромиона и др.) [34, 50].
Магнитно-резонансная томография и ультразвуковое исследование также носят вспомогательный характер для диагностики ПЛП, но позволяют визуализировать патологию мягких периартикулярных тканей. Эти высокочувствительные методы с большой точностью могут определять локализацию и размеры патологических очагов (зоны дегенерации, надрывы, отек сухожилий, утолщение коракобрахиальной связки и суставной капсулы, облитерацию аксиллярного кармана, жидкость в субакромиальной сумке и т.д.), но эти изменения могут быть найдены и у тех, кто не испытывает боль в области исследуемого плечевого сустава. Поэтому результаты таких исследований всегда должны соотноситься с клиническими данными.
Инвазивные методы диагностики, такие как артрография и артроскопия, целесообразны лишь в ситуациях, когда решается вопрос о хирургическом лечении (например, при частичном и полном разрыве сухожилий вращательной манжеты) или в сложных диагностических случаях [10, 64, 65].
Проводя дифференциальную диагностику болевого синдрома в области плечевого сустава, необходимо оценить ревматологический анамнез, выполнить анализ крови на ревмопробы и другие лабораторные анализы (общий анализ крови, коагулограмма, анализ на гликированный гемоглобин и др.), провести магнитно-резонансную томографию шейного отдела позвоночника, в сложных случаях электромиографию, электронейромиографию, исследование соматосенсорных вызванных потенциалов, ультразвуковую допплерографию сосудов шеи, верхних конечностей. Основные дифференциально-диагностические различия ПЛП со сходными заболеваниями приведены в табл. 2 [27, 51].
Лечение
Несмотря на понимание причин и механизмов развития ПЛП, лечение этой патологии далеко не всегда можно назвать успешным и эффективным. По официальной статистике, выздоровления удается добиться в 56–80% случаев, значительного улучшения – в 25–44%, незначительного восстановления – в 3–11% случаев [9, 10]. У 5–20% пациентов эффект от лечения отсутствует [7].
Программа лечения и реабилитации должна быть индивидуальной и включать в себя как прием лекарственных препаратов, так и немедикаментозные методы воздействия. Безусловно, предпочтителен мультидисциплинарный подход [34]. В Руководстве по диагностике и лечению субакромиального болевого синдрома (синдрома вращательной манжеты) (2014) предпочтение отдается не хирургическому, а консервативному лечению: приему нестероидных противовоспалительных препаратов (НПВП) в первые две недели заболевания, низкоинтенсивным (в границах болевого диапазона) и частым домашним занятиям физкультурой. Эффективность физиотерапевтических методик (ультразвукового воздействия, электростимуляции, иглоукалывания) не доказана [59]. Кинезиотерапия в дополнение к классическому медицинскому лечению существенно улучшает прогноз [12].
НПВП традиционно используют при ПЛП, начиная с ранних стадий, их эффективность показана в систематических обзорах [66, 67]. Однако из-за множества побочных реакций рекомендуется назначать НПВП селективного действия короткими курсами на фоне гастропротекторов и начинать терапию с внутримышечных инъекций [68]. Применение миорелаксантов (тизанидина, толперизона) позволяет снизить дозу НПВП и тем самым уменьшить риск появления нежелательных эффектов [66]. В связи с частой хронизацией ПЛП необходимо учитывать, что терапия может продолжаться достаточно долго. Поэтому в целях безопасности рекомендуется проводить парентеральные недлительные курсы НПВП и миорелаксантами, например такими препаратами, как Элокс-СОЛОфарм (мелоксикам 1,5 мл, 10 мг/мл) и Лидамитол (толперизон 1,0 мл 100 мг/мл и лидокаин 2,5 мг/мл). Препараты изготавливаются на высокотехнологичном российском фармацевтическом предприятии Solopharm с использованием новейших методов очистки субстанции и контроля ее качества.
Рекомендованы ограничение нагрузки на сустав, проведение блокад с глюкокортикостероидами (ГКС) и местными анестетиками, различные виды физиотерапии, постизометрическая релаксация, растягивание мышц, массаж и мануальная терапия [69]. Локальные инъекции – лечебно-медикаментозные блокады (с ГКС и анестетиками) и лечебно-медикаментозные инъекции (с хондропротекторами и антигомотоксическими препаратами) широко применяются при периартропатиях [34, 70–74]. Они зарекомендовали себя как высокоэффективный и быстродействующий инструмент лечения ПЛП и иных периартропатий, который может сочетаться с другими медикаментозными и немедикаментозными терапевтическими методами.
Метаанализ, включавший семь исследований, в которых сравнивались эффективность и безопасность субакромиальных инъекций растворов ГКС и плацебо, и три исследования, в которых сопоставлялись эффективность и безопасность субакромиального введения растворов ГКС с применением НПВП при синдроме вращательной манжеты плеча, определил эффективность введения ГКС при данной патологии, а наблюдение в течение девяти месяцев показало их большую результативность по сравнению с НПВП и высокими дозами ГКС [75]. Был проанализирован десятилетний опыт использования пери- и интраартикулярных блокад бетаметазона (Дипроспан) в ортопедической практике у 793 пациентов, в том числе с болью в плече. Отмечены высокая эффективность (в 92% случаев) и хорошая переносимость препарата [76].
В схему лечения пациентов с некоторыми видами хронических периартропатий целесообразно включать препарат ботулинического токсина типа А (Ботокс). Так, при ПЛП с адгезивным капсулитом и мышечно-тоническим синдромом плечевого пояса ботулинотерапия показана при отсутствии:
- ярко выраженной патологии структур вращательной манжеты плеча;
- сформированных депрессивных расстройств, признаков соматоформного болевого расстройства;
- признаков компрессионной радикулопатии шейных корешков;
- клинически значимого синдрома верхней апертуры грудной клетки (синдрома передней лестничной мышцы) [27, 77, 78].
В комплексном лечении ПЛП используют витамины группы В: для метаболических и нейротрофических эффектов – витамин В1, а поддержания процессов миелинизации нервных волокон – витамин В6, который участвует в синтезе медиаторов не только периферической, но и центральной нервной системы, и В12. Витамины группы B, будучи адъювантными средствами, при назначении вместе с НПВП усиливают их анальгетический эффект, что позволяет уменьшить дозу НПВП и сроки лечения, а следовательно, снизить риск побочных эффектов. Кроме того, витамины группы B ослабляют болевой синдром и как кофакторы метаболических процессов оказывают благоприятное влияние на нервную систему [31, 79, 80]. Препарат Ларигама компании Solopharm представляет собой комплекс витаминов группы B (пиридоксина гидрохлорид 100 мг, тиамина гидрохлорид 100 мг, цианокобаламин 1 мг, лидокаина гидрохлорид 20 мг) с анальгезирующим, улучшающим кровоснабжение тканей, стимулирующим регенерацию нервной ткани действием и может широко использоваться при хроническом течении ПЛП.
У больных с тенденцией к хронизации процесса приветствуется широкое применение антидепрессантов, антиконвульсантов, анксиолитиков [51].
Одним из важнейших факторов, предопределяющих вероятность хронического течения боли при периартропатиях, считаются прогрессирующие дегенеративные процессы в хрящевой ткани суставов. Хрящ не имеет нервных окончаний и сосудов. Его питание осуществляется пассивно из синовиальной жидкости и сосудов подлежащей кости [64]. По мере старения организма в хрящевой ткани уменьшаются концентрация протеогликанов и связанная с ними гидрофильность ткани, ослабляются процессы размножения хондробластов и молодых хондроцитов. Именно дегенеративные изменения этих структур вызывают стойкие биомеханические нарушения, приводящие к затяжному рецидивирующему течению болевого синдрома [81]. Поэтому целесообразно применение фармакологических средств, стимулирующих продукцию нормальной хрящевой ткани и замедляющих ее разрушение, – так называемых симптом-модифицирующих препаратов замедленного действия, или хондропротекторов. Длительная и систематическая терапия хондропротекторами при периартропатиях, которые зачастую сопровождают остеоартрозы, может замедлить текущий дегенеративный процесс и преодолеть тенденцию к хронизации боли. Достаточно большой опыт использования хондропротекторов при дегенеративных заболеваниях периферических суставов (остеоартрозе) показал, что они способствуют более быстрому купированию болевого синдрома и восстановлению подвижности пораженных суставов. К препаратам этой группы относятся предшественники хрящевого матрикса (глюкозамин, хондроитина сульфат и гиалуроновая кислота) и модуляторы цитокинов (диацереин и ингибиторы металлопротеиназ) [46, 82–85]. Хондроитина сульфат – ключевой компонент внеклеточного матрикса хрящевой ткани, ответственный за сохранение ее эластичности и сопротивление нагрузкам. Антивоспалительные свойства хондроитина сульфата хорошо изучены [86], но о его воздействии на ангиогенез известно немного. Хондроитина сульфат влияет на выработку синовиальными фибробластами про- и антиангиогенных факторов в пораженной остеоартрозом синовиальной мембране и способен восстанавливать баланс между ними. С учетом того что в развитии остеоартроза одним из ключевых процессов является ангиогенез, положительный эффект хондроитина сульфата может объясняться именно антиангиогенными свойствами [87]. Препарат Артогистан (хондроитина сульфат 1 и 2 мл в ампулах 100 мг/мл) компании Solopharm – инъекционный хондропротектор, который применяется при ПЛП с признаками дегенеративно-дистрофических изменений суставной ткани плечевого сустава.
Хирургическое лечение показано при неэффективности консервативной терапии и определяется размерами разрыва мышц и сухожилий [34]. К артроскопическим операциям следует прибегать в случае полного разрыва манжеты ротаторов плеча или неэффективности консервативной терапии в течение шести месяцев. Однако у молодых пациентов, особенно после травмы, вмешательство возможно и в более ранние сроки [35].
Авторы заявляют об отсутствии конфликта интересов.
I.E. Gordeeva, PhD, A.M. Tkachev, A.V. Epifanov, K.Sh. Ansarov
Volgograd State Medical University
Medical Institute named after Berezin Sergey
Tkachev Clinic
Tkachev – Epifanov Clinic
Contact person: Irina E. Gordeeva, ira110370@yandex.ru
Periarthropathy or periarthrosis, which includes the shoulder-scapular periarthrosis (PLP), is still the subject of discussion by doctors of related specialties: neurologists, orthopedists, rheumatologists, etc. Pain in this case may be due to the primary degenerative process in the muscles and tendons, pathological processes associated with chronic microtrauma, ischemia or reactive inflammation of periarticular tissues. Periarthropathy can be considered as a ‘plume’ of any arthropathy, since pain always causes muscle spasm, a change in the motor stereotype, a limitation of motor activity in the joint, etc. However, the shoulder joint is one of the most complex joints of the human body, in fact it is a whole complex anatomical complex. The defeat of his periarticular tissues is the most common pathology of their all types of arthalgia of this joint. There is still no unambiguous understanding of this nosological problem, including pathogenesis, diagnostic algorithms and therapy. Basically, in the treatment of PLP, general recommendations are used: limiting the load on the damaged joint, massage (according to indications), exercise therapy, manual therapy, physiotherapy. Drug therapy includes various types of blockade using glucocorticosteroids, the use of non-steroidal anti-inflammatory drugs, muscle relaxants, but, as you know, these drugs have certain side effects and contraindications. Therefore, the value of their parenteral use together with adequate gastroprotection is high, for example, such as Elox-SOLOfarm (meloxicam) and Lidamitol (tolperisone and lidocaine) from Solopharm, a high-tech domestic manufacturer of modern medicines. Treatment of PLP with chondroprotectors, for example, such as Artogystan, is becoming very relevant, since, along with glucocorticosteroids and non-steroidal anti-inflammatory drugs, they help reduce pain and increase the functionality of the joints, but, unlike the latter, their safety profile is much higher.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.