Сравнительная эффективность курсовой инъекционной терапии Инъектраном или в комбинации с Ферматроном у пациентов с остеоартритом голеностопных суставов на фоне базового приема Генитрона
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено наблюдение в реальной клинической практике за пациентами с остеоартритом голеностопных суставов первой и второй степени по классификации Келлгрена – Лоуренса. С 2017 по 2018 г. под наблюдением находилось 100 больных. В качестве базового нестероидного противовоспалительного препарата использовали мелоксикам (Генитрон). Больные были разделены на три группы. Первая группа (n = 35) помимо базового лечения получала инъекционный хондроитина сульфат (Инъектран), вторая (n = 35) – хондроитина сульфат (Инъектран) и гиалуронат натрия (Ферматрон), третья группа (n = 30) – только мелоксикам (Генитрон). Длительность лечения составила шесть месяцев.
Результаты. Через шесть месяцев у большинства пациентов амплитуда движений статистически значимо увеличилась, выраженность болевого синдрома – уменьшилась. Наиболее значимые результаты отмечены во второй группе. В отношении выраженности синовита и лабораторных показателей также наблюдалась положительная динамика. Однако различия между группами были в пределах статистической погрешности. Ни один пациент не был исключен из исследования.
Переносимость курсовой терапии характеризовалась как удовлетворительная, нежелательных явлений не возникало.
Материал и методы. Проведено наблюдение в реальной клинической практике за пациентами с остеоартритом голеностопных суставов первой и второй степени по классификации Келлгрена – Лоуренса. С 2017 по 2018 г. под наблюдением находилось 100 больных. В качестве базового нестероидного противовоспалительного препарата использовали мелоксикам (Генитрон). Больные были разделены на три группы. Первая группа (n = 35) помимо базового лечения получала инъекционный хондроитина сульфат (Инъектран), вторая (n = 35) – хондроитина сульфат (Инъектран) и гиалуронат натрия (Ферматрон), третья группа (n = 30) – только мелоксикам (Генитрон). Длительность лечения составила шесть месяцев.
Результаты. Через шесть месяцев у большинства пациентов амплитуда движений статистически значимо увеличилась, выраженность болевого синдрома – уменьшилась. Наиболее значимые результаты отмечены во второй группе. В отношении выраженности синовита и лабораторных показателей также наблюдалась положительная динамика. Однако различия между группами были в пределах статистической погрешности. Ни один пациент не был исключен из исследования.
Переносимость курсовой терапии характеризовалась как удовлетворительная, нежелательных явлений не возникало.






Введение
Остеоартрит (ОА) – заболевание, развивающееся в результате различных механических и биологических факторов, нарушающих существующее равновесие между процессами деградации и синтеза во всех компонентах матрикса, прежде всего в суставном хряще.
Распространенность ОА в популяции коррелирует с возрастом, достигая максимальных значений у лиц старше 65 лет [1]. При этом женщины болеют ОА почти в два раза чаще мужчин. Как правило, поражаются коленные и тазобедренные суставы, что нередко приводит к инвалидизации [2].
Остеоартрит – мультифакториальное заболевание. Помимо возраста и пола в качестве факторов риска его развития рассматривают наследственную предрасположенность, избыточную массу тела и т.д. [3].
Несмотря на высокую медико-социальную значимость заболевания, стандартов оказания помощи при поражении голеностопного сустава не существует. Действующий стандарт по оказанию помощи больным артрозами 2005 г. предписывает использовать нестероидные противовоспалительные препараты (НПВП) и глюкокортикостероиды (ГКС). Этиопатогенетическая терапия не предлагается [4]. Федеральные клинические рекомендации по диагностике и лечению остеоартроза 2016 г. не нашли широкого применения в клинической практике. Кроме того, на современном этапе развития отечественного здравоохранения рекомендательные согласительные документы необязательны для исполнения. Поэтому в клинической практике часто руководствуются зарубежными клиническими рекомендациями и протоколами лечения больных ОА. Наиболее востребованы рекомендации экспертов Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартроза 2016 г. – используются при лечении кокс- и гонартрозов. Рекомендации экспертов Национального института здоровья и качества медицинской помощи по ведению страдающих остеоартритом применимы топографически ко всем суставам, в том числе голеностопным [5]. Согласно данному документу, в качестве начальной фармакотерапии целесообразны топические НПВП, несмотря на то что максимальная их концентрация составляет всего 15% от концентрации системных НПВП, назначаемых в аналогичной дозе. Возможно также применение парацетамола, при неэффективности которого предлагается использовать пероральные НПВП, в том числе ингибиторы циклооксигеназы (ЦОГ) 2 (мелоксикам, диклофенак, ибупрофен, кетопрофен, ацеклофенак и др.), или опиоидные анальгетики (трамадол) в течение короткого периода времени в дополнение к парацетамолу или вместо него.
В отношении хондропротекторов (глюкозамина сульфата, хондроитина сульфата), а также солей гиалуроновой кислоты для внутрисуставного введения экспертная группа рекомендует продолжить исследования. При интенсивном болевом синдроме может быть целесообразно внутрисуставное введение ГКС (метилпреднизолона или триамцинолона). В случае неэффективности терапевтических мер показано хирургическое лечение – эндопротезирование.
Целью данного исследования стала оценка влияния инъекционной терапии хондроитина сульфатом, а также комплексной инъекционной терапии хондроитина сульфатом и гиалуронатом натрия на фоне базового приема мелоксикама на функциональный и объективный статус пораженного голеностопного сустава.
Материал и методы
С 2017 по 2018 г. проведено наблюдение за 100 пациентами с начальными стадиями посттравматического и идиопатического ОА голеностопного сустава (первая или вторая степень по классификации Келлгрена – Лоуренса).
При разработке критериев включения/исключения учитывался зарубежный опыт проведения аналогичных исследований [6–9].
В наблюдение были включены пациенты, соответствующие следующим критериям:
- амбулаторные пациенты обоего пола в возрасте от 45 лет;
- посттравматический или идиопатический ОА голеностопного сустава первой или второй степени, подтвержденный как минимум одной рентгенографией в течение трех месяцев до включения в исследование и протекающий с периодами выраженного обострения, чаще сезонного, признаками стойкого синовита, умеренными изменениями в гемограмме воспалительного характера;
- ОА, установленный на основании критериев Американской коллегии ревматологов 1987 г.;
- боль при ходьбе ≥ 30 мм по визуальной аналоговой шкале (ВАШ);
- обязательное соблюдение указаний врача.
Критерии исключения:
- возраст менее 45 лет;
- боль при ходьбе < 30 мм по ВАШ;
- рентгенологическое поражение сустава третьей или четвертой степени по классификации Келлгрена – Лоуренса;
- хирургическое лечение ОА в анам-незе;
- болезни крови;
- прием антикоагулянтов;
- вторичный ОА на фоне иммуновоспалительных заболеваний суставов;
- прием ГКС в течение месяца до проведения исследования;
- тяжелые заболевания печени, почек, сердечно-сосудистой системы;
- фенилкетонурия;
- язва желудка или двенадцатиперстной кишки в течение последних 12 месяцев;
- непереносимость НПВП, в том числе аспириновая бронхиальная астма;
- сахарный диабет 1-го типа;
- онкологические заболевания;
- беременность, период лактации;
- отсутствие письменного согласия на осмотр и лечение.
Исследование предполагало три обязательных визита: первый – перед лечением, второй – через три месяца терапии (промежуточные результаты), третий – через шесть месяцев (окончательные результаты). Консервативное лечение пациентов первой группы (n = 35) заключалось в применении инъекционного препарата из группы хондропротекторов хондроитина сульфата (Инъектрана) 200 мг № 30 через день внутримышечно и НПВП мелоксикама (Генитрон) 15 мг внутримышечно первые три дня с переходом в дальнейшем на его пероральные формы – до 14 дней. Во второй группе (n = 35) использовали комбинацию хондроитина сульфата (Инъектрана) в той же дозе с препаратом гиалуроновой кислоты (Ферматроном) 1% в преднаполненном шприце 2 мл № 2 с интервалом семь дней в полость голеностопного сустава и мелоксикам (Генитрон) в той же дозе. Пациенты третьей группы (n = 30) получали только мелоксикам (Генитрон) в аналогичной дозе в течение 14 дней. Учитывая относительно длительное применение НПВП, для гастропротекции всем больным был назначен Омепразол перорально. Режим применения – по 20 мг два раза в сутки в течение 14 дней.
Выбор препаратов был обусловлен наличием обширной доказательной базы по применению хондроитина сульфата и гиалуроната натрия при ОА, а также их хорошей переносимостью. Кроме того, данные лекарственные средства рекомендованы для лечения ОА ведущими международными экспертными организациями [10–12].
В препарате Инъектран хондроитина сульфат представлен в виде гомогенизированной субстанции MV 7-13 kDa. Его оптимальная абсорбция и биодоступность обеспечиваются низким молекулярным весом, терапевтический эффект – близким к составу хряща человека соотношением сульфатных групп. Так, соотношение хондроитина-4 и -6 сульфата составляет 2:1, что является маркером молодости хряща. Результаты последних исследований убедительно доказали, что с возрастом в хрящевой ткани уменьшается содержание хондроитина-4 сульфата и увеличивается содержание хондроитина-6 сульфата. Хондроитина-4 сульфат лучше аккумулирует влагу и обладает лучшими амортизационными свойствами [13]. Хондроитина сульфат – структурный модулятор, который, интегрируясь в структуры хрящевой ткани, стимулирует ее синтез и подавляет деструкцию. Его своевременное и регулярное применение обеспечивает торможение, стабилизацию и профилактику развития деструктивных процессов в суставе.
Ферматрон 1%-ный относится к четвертому поколению препаратов гиалуроновой кислоты, имеет оптимальный молекулярный вес 1,1–2,2 млн Да, в большей степени соответствующий молекулярному весу нормальной синовиальной жидкости человека. Он изготовлен путем бактериальной ферментации. Стерилизация препарата проводится с помощью микромембранной фильтрации с сохранением его максимальной нативности. Стабилизация рН осуществляется фосфатным буферным раствором, идентичным человеческому. Гиалуроновая кислота влияет на синовиальный гомеостаз путем восстановления вязкоэластичных свойств синовиальной жидкости, стабилизации коллагеновых волокон капсулы и лигаментарного аппарата, восстановления скорости транспорта метаболитов от клеток через синовиальную среду в лимфатические сосуды и поддержания нормального уровня транссиновиального обмена за счет барьерной и механической функции. На микроуровне происходит восстановление вязкоэластичного окружения клеточных структур синовиальной оболочки, ноцицепторов, угнетение миграции, фагоцитоза и высвобождения простагландинов, а также стимуляция выработки эндогенной гиалуроновой кислоты синовиоцитами [14]. Учитывая наличие разных доз дериватов гиалуроновой кислоты, Ферматрон 1%-ный был выбран из фармакоэкономических соображений и вследствие лучшей переносимости при введении в голеностопный сустав.
Мелоксикам (Генитрон) обладает противовоспалительным, жаропонижающим и анальгетическим действием. Данный препарат относится к классу оксикамов, производных эноловой кислоты. Мелоксикам ингибирует синтез простагландинов в результате избирательного подавления ферментативной активности ЦОГ-2. При этом синтез простагландинов в области воспаления подавляется в большей степени, чем в слизистой оболочке желудка или почках.
Оценка эффективности терапии проводилась по клиническим, параклиническим и лабораторным показателям. Изменение объема движений больного сустава (амплитуда в градусах) констатировали клинически, выраженности синовита – по результатам ультразвукового исследования. Динамику болевого синдрома определяли по ВАШ. Оценка неспецифического воспалительного процесса проводилась по результатам лабораторных исследований. В частности, определяли скорость оседания эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ).
При анализе результатов использовали t-критерий Стьюдента.
Результаты
В таблице 1 представлена характеристика больных, включенных в исследование. Среди них преобладали женщины в возрасте 56–65 лет с длительностью ОА от пяти до десяти лет, второй степени дегенеративного процесса в период обострения.
Исходные клинические, параклинические и лабораторные показатели представлены в табл. 2 и 3.
Статистически значимых различий в отношении исследуемых критериев в группах не обнаружено (p ≥ 0,1).
Все больные успешно прошли курс назначенной терапии.
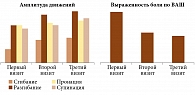
Изменение показателей эффективности лечения у пациентов первой группы представлено на рис. 1. У большинства получавших Инъектран амплитуда сгибания и разгибания во время второго визита статистически значимо увеличилась (p < 0,05), однако к третьему визиту она снизилась. Изменение пронации/супинации стопы оказалось статистически незначимым (p ≥ 0,1). Степень боли уменьшилась на 25 мм к моменту второго визита (p < 0,01) и незначительно увеличилась к концу наблюдения. Выраженность синовита также снижалась, но не всегда это носило достоверный характер. Аналогичная тенденция прослеживалась в отношении лабораторных показателей (табл. 4).
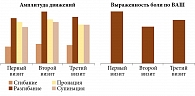
Более выраженной оказалась динамика исследуемых показателей во второй группе (рис. 2).
В группе Инъектрана и Ферматрона наблюдались аналогичные изменения. Однако они были более значительными. Так, интенсивность болевого синдрома к третьему визиту снизилась на 35 мм (p < 0,01), при этом положительная динамика отмечалась в течение всего периода наблюдения. Амплитуда сгибания и разгибания значимо возрастала на фоне лечения, однако изменение пронации/супинации стопы оказалось недостоверным (p ≥ 0,1). В отличие от первой группы динамика морфологических изменений была статистически значимой (p < 0,01). Лабораторные показатели также имели позитивную динамику, а в случае СРБ – даже достоверную (табл. 5).
Сравнение результатов лечения в первой и второй группах показало, что применение исследуемых препаратов было эффективным. Однако совместное использование Инъектрана и Ферматрона на фоне базового приема Генитрона обеспечивало синергизм лечебного воздействия, о чем свидетельствует динамика клинических и параклинических показателей.
В третьей группе также наблюдалась положительная динамика оцениваемых показателей. Однако в отношении большинства из них не отмечено статистической достоверности результатов, за исключением выраженности боли и синовита во время второго визита. Как и в первой группе, указанные показатели ухудшились к третьему визиту (рис. 3, табл. 6).
Обсуждение результатов
Анализ полученных результатов свидетельствует, что терапии в первую очередь различались по выраженности клинических и параклинических эффектов. Так, у большинства получавших Инъектран и Ферматрон в дополнение к Генитрону к концу наблюдения клинические, параклинические и сонографические показатели статистически значимо улучшились, среди лабораторных – достоверно изменился только уровень СРБ. Кроме того, только во второй группе положительная динамика сохранялась как во время второго, так и во время третьего визита. Ни в первой, ни в третьей группах такой закономерности не выявлено. Объяснением данного факта могут служить особенности фармакодинамики используемых препаратов – хондроитина сульфата, гиалуроновой кислоты, мелоксикама. Возможно, при взаимодействии хондроитина сульфата с гиалуроновой кислотой первая субстанция протектирует последнюю от разрушающего воздействия факторов агрессии, в частности гиалуронидазы и аггрекиназы, путем угнетения их активности и потенцирования противовоспалительного действия, а также регуляторного эффекта на метаболизм околосуставного хряща.
Заключение
На амбулаторном этапе среди пациентов с начальными стадиями ОА голеностопного сустава следует выделять когорту с преобладанием в клинической картине фазы обострения по типу артритической. Таковая характеризуется стойким синовитом и изменением лабораторных показателей, ассоциированных с воспалением.
Использование в качестве комплексного консервативного лечения ОА голеностопного сустава препаратов Инъектран, Ферматрон и Генитрон достоверно позволяет добиться раннего клинического ответа. Причиной достижения значимых показателей может быть взаимодействие хондроитина сульфата и гиалуроновой кислоты. В частности, хондроитина сульфат защищает гиалуроновую кислоту от воздействия гиалуронидазы и аггрекиназы путем угнетения их активности и потенцирования противовоспалительного действия, а также регуляторного эффекта на метаболизм хряща.
При определении выраженности эффекта предложенной схемы амбулаторного лечения ОА голеностопного сустава первой и второй степени оценка синовита и лабораторных показателей воспаления была значимой, но не всегда статистически доказательной.
Полученные результаты позволяют рекомендовать предложенную схему терапии (хондроитина сульфат плюс гиалуроновая кислота плюс мелоксикам) для включения в регламентирующие документы по лечению больных ОА голеностопных суставов при условии получения достаточной доказательной базы.
O.A. Kaplunov, MD, PhD, Prof., K.O. Kaplunov, PhD
Volgograd State Medical University
Department of Orthopedics and Traumatology Volgograd Medical Clinical Center
Contact person: Oleg A. Kaplunov, volortho@mail.ru
The Рurpose. To compare the efficacy of injectable Iniectran and its combination with Fermathron on the background of basic therapy with Genytron in terms of functional and objective status of the affected ankle joint.
Material and Methods. Patients with osteoarthritis of the ankle joints of the first and second degree according to Kellgren – Lawrence classification were observed in routine daily clinical practice. From 2017 to 2018, 100 patients were under observation taking meloxicam as a basic non-steroidal anti-inflammatory drug. The patients were divided into three groups. The first group (n = 35) in addition to the basic treatment received injectable chondroitin sulfate (Iniectrаn), second (n = 35) – chondroitin sulfate (Iniectran) and sodium hyaluronate (Fermathron), the third group (n = 30) – meloxicam (Genytron). The duration of treatment was six months.
Results. After six months in most patients the amplitude of movements significantly increased, the severity of pain syndrome decreased. The most significant results were observed in the second group. Positive dynamics was also observed concerning synovitis and laboratory parameters. However, the differences between the groups were within the statistical error. No patients were excluded from the study. Course therapy tolerability was characterized as satisfactory, no adverse events occurred.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.