Подходы к коррекции кишечных нарушений при неалкогольном стеатогепатите
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено открытое проспективное сравнительное исследование эффективности комплексной терапии кишечной дисфункции у пациентов с неалкогольным стеатогепатитом. В исследование были включены две группы из 36 пациентов с НАСГ с симптомами кишечной дисфункции, установленным кишечным дисбиозом, структурными изменениями слизистой оболочки толстой кишки.
Результаты и обсуждение. Установлено, что комплексная терапия кишечной дисфункции с включением препарата Saccharomyces boulardii на фоне НАСГ уменьшает частоту абдоминальной боли, связанной с кишечником, нормализует стул, уменьшает степень дисбиоза, способствует эпителизации микроэрозий, снижает частоту нейтрофильной инфильтрации слизистой оболочки толстой кишки.
Заключение. Результаты проведенного исследования свидетельствуют об эффективности комплексной терапии с добавлением препарата Saccharomyces boulardii у пациентов с НАСГ и кишечной дисфункцией.
Материал и методы. Проведено открытое проспективное сравнительное исследование эффективности комплексной терапии кишечной дисфункции у пациентов с неалкогольным стеатогепатитом. В исследование были включены две группы из 36 пациентов с НАСГ с симптомами кишечной дисфункции, установленным кишечным дисбиозом, структурными изменениями слизистой оболочки толстой кишки.
Результаты и обсуждение. Установлено, что комплексная терапия кишечной дисфункции с включением препарата Saccharomyces boulardii на фоне НАСГ уменьшает частоту абдоминальной боли, связанной с кишечником, нормализует стул, уменьшает степень дисбиоза, способствует эпителизации микроэрозий, снижает частоту нейтрофильной инфильтрации слизистой оболочки толстой кишки.
Заключение. Результаты проведенного исследования свидетельствуют об эффективности комплексной терапии с добавлением препарата Saccharomyces boulardii у пациентов с НАСГ и кишечной дисфункцией.





Введение
В структуре гастроэнтерологической патологии в мире распространенность неалкогольной жировой болезни печени (НАЖБП) стремительно растет и достигает 27% в российской популяции [1, 2]. Представления о механизмах развития и прогрессии НАЖБП постепенно меняются [3, 4]. В патологический процесс при НАЖБП вовлекаются разные органы и системы, в том числе кишечник [5]. Внимание клиницистов-исследователей в основном уделено роли изменений кишечной микробиоты при НАЖБП [6, 7]. В качестве значимого механизма развития и ее прогрессии указывают на нарушения проницаемости кишечного барьера, транслокацию в печень бактерий, вирусов с дальнейшим развитием в ее паренхиме и строме низкоактивного воспаления [8]. Из всех клинических форм НАЖБП именно неалкогольный стеатогепатит (НАСГ) чаще сопровождается кишечной дисфункцией, снижающей качество жизни пациентов и требующей соответствующей терапии [9, 10]. В этой связи одним из направлений в терапии НАЖБП стала коррекция изменений микробиоты [11].
Установлено, что назначение препарата Saccharomyces boulardii способствовало снижению уровня глюкозы, нормализации липидного спектра, нарушенных функций печени, уменьшению стеатоза [12, 13]. При этом объектом анализа были не только биохимические показатели функций печени, но и маркеры синдрома избыточного бактериального роста, ассоциированного с тонкой кишкой [14, 15]. Исследования эффективности Saccharomyces boulardii в отношении микробиологического и морфологического состояния толстой кишки при НАСГ проводились в эксперименте [15].
В реальной клинической практике представляется очевидной необходимость анализа эффективности комплексной терапии с включением Saccharomyces boulardii и изучением эволюции кишечных симптомов, абдоминальной боли, связанной с кишечником, структурных изменений слизистой оболочки толстой кишки (СОТК) на фоне НАСГ.
Цель – оценка эффективности комплексной терапии с включением препарата Saccharomyces boulardii при НАСГ с кишечной дисфункцией на основе анализа эволюции кишечных симптомов, показателей дисбиоза и структуры СОТК.
Материал и методы
Проведено проспективное сравнительное исследование, в которое были включены 36 пациентов (13 мужчин и 23 женщины) с НАСГ и кишечной дисфункцией. Возраст пациентов составлял 56 ± 11,65 года. В ходе целенаправленного опроса и комплексного обследования пациентов были выявлены симптомы кишечной дисфункции и абдоминальной боли, связанной с кишечником. Критерии, по которым пациенты не были включены в исследование: болезни печени вирусной, аутоиммунной, алкогольной, лекарственной этиологии, болезни накопления, воспалительные заболевания кишечника (язвенный колит, болезнь Крона, микроскопический колит), опухоли любой локализации, хронические соматические заболевания в фазе декомпенсации, патология эндокринной системы (кроме сахарного диабета второго типа), беременность, период лактации, отказ пациента от обследования.
Обследование и лечение пациентов с НАЖБП проводили в гастроэнтерологических отделениях стационара и поликлинике Саратовской городской клинической больницы № 5, дневного стационара Городской поликлиники г. Пензы в период 2016–2018 гг. Протокол исследования утвержден комитетом по этике Саратовского государственного медицинского университета им. В.И. Разумовского (протокол № 6 от 2016 г.). Все пациенты дали письменное информированное согласие на участие в исследовании.
НАСГ верифицировали по критериям Российской гастроэнтерологической ассоциации (с учетом повышения уровня трансаминаз, изменений липидного спектра сыворотки крови, маркеров фиброза при эластометрии), Европейской ассоциации по изучению печени [16, 17]. Определяли маркеры цитолиза – аланиновую и аспарагиновую аминотрансферазы (АЛТ, АСТ), холестаза (щелочную фосфатазу (ЩФ) и гамма-глютамил-транспептидазу (ГГТП)), а также содержание билирубина, показатели липидного спектра (общий холестерин, холестерин липопротеидов высокой (ХС-ЛПВП), низкой плотности (ХС-ЛПНП), триглицериды), содержание глюкозы натощак. Ультразвуковое исследование (УЗИ) брюшной полости с оценкой ультразвуковой степени стеатоза по L. Needdleman [18] выполняли на аппаратах Hittachi (Япония). Наличие и стадию фиброза печени у пациентов с НАСГ определяли методом транзиентной эластометрии на аппарате Fibroscan (EchoSens, Франция). По результатам эластометрии у включенных в исследование пациентов с НАСГ определены следующие стадии фиброза: F0 – у 47%, F1 – у 29%, F2 – у 22%, F3 – у 2%, что служило дополнительным критерием верификации НАСГ.
В связи с наличием кишечной дисфункции и абдоминальной боли, связанной с кишечником, в алгоритм обследования были включены эндоскопические, морфологические, бактериологические исследования. Эндоскопия выполнена с помощью эндоскопа Olympus (Япония), морфологическое исследование колонобиоптатов проводилось с применением окрашивания колонобиоптатов по Романовскому – Гимзе. Исследование биоптатов проведено с помощью светового микроскопа с увеличением 400. Диагностика кишечного дисбактериоза выполнена бактериологическим методом при посеве кала согласно «Протоколу ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003, утвержденный приказом МЗ РФ № 231 от 09.06.2003) [19]. Оценка степени кишечного дисбиоза основывалась на рекомендациях И.Б. Куваевой и соавт. [20], М.Д. Ардатской и соавт. [21].
Пациенты с НАСГ, кишечной дисфункцией и верифицированным дисбиозом были разделены на две группы. Первую группу составили 20 пациентов с НАСГ и кишечной дисфункцией, которые получали урсодезоксихолевую кислоту (УДХК) в дозе 10 мг/кг/сут и тримебутин в дозе 400 мг/сут для купирования симптомов кишечной дисфункции с назначением в режиме «по требованию» [22]. Во вторую группу вошли 16 пациентов с НАСГ и кишечной дисфункцией, которые в комплексе с перечисленными выше препаратами получали препарат Saccharomyces boulardii по 250 мг два раза в сутки в течение 10 дней. По окончании лечения препаратом Saccharomyces boulardii пациенты продолжали прием УДХК в прежней дозировке, тримебутин – в режиме «по требованию».
Клинико-эндоскопические, морфологические, биохимические и микробиологические показатели изучали в динамике: на старте исследования и через 12 недель.
У 25 (69,4%) пациентов в динамике изучали эндоскопические и структурные изменения СОТК при повторной колоноскопии.
Результаты исследования обработаны статистически с помощью Microsoft Office Excel 2016 и R-Studio Version 1.1.383. Определяли нормальность распределения данных с помощью критериев Колмогорова – Смирнова, Шапиро – Уилка. Описательная статистика нормально распределенных данных представлена в виде среднего значения (M) и среднеквадратического отклонения (sd). Данные, имевшие распределение, отличное от нормального, представлены как медиана (m), минимальное (min) и максимальное (max) значения.
Группы независимых непрерывных данных сравнивали по характеру распределения с помощью параметрических (t-критерий Стьюдента) и непараметрических (Уилкоксона) критериев.
Результаты и обсуждение
Динамика симптомов кишечной дисфункции при НАСГ на фоне разных вариантов терапии представлена в табл. 1.
В результате лечения у пациентов обеих групп отмечены регрессия абдоминальной боли, связанной с кишечником, уменьшение метеоризма и диареи. В группе пациентов, получавших лечение, дополненное препаратом Saccharomyces boulardii, снижение частоты указанных симптомов было статистически значимым по сравнению с соответствующими показателями в первой группе.
У двух пациентов на старте на фоне терапии с УДХК и тримебутином возникли метеоризм и диарея, описанные как нежелательные явления на фоне приема УДХК, которые купировались самостоятельно и не потребовали коррекции терапии [23].
Динамика маркеров цитолиза, холестаза, липидного спектра и гликемии натощак при НАСГ с кишечной дисфункцией на фоне разных вариантов терапии представлена в табл. 2.
Тенденция к нормализации исследуемых лабораторных маркеров состояния печени, липидного спектра, глюкозы крови натощак наблюдалась в обеих исследуемых группах. В то же время у пациентов, получавших терапию, дополненную препаратом Saccharomyces boulardii, снижение ряда анализируемых показателей было статистически значимым по сравнению с аналогичными показателями первой группы.
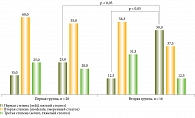
Динамика степеней стеатоза, по данным трансабдоминального УЗИ, при НАСГ с кишечной дисфункцией представлена на рисунке.
У пациентов первой группы УЗ-динамики стеатоза не выявлено. У пациентов второй группы отмечено снижение степеней стеатоза. Полученные нами результаты во многом согласуются с описанными в литературе [12, 13]. При НАСГ снижение АСТ, ЛПНП, степени стеатоза на фоне комплексной терапии с назначением препарата Saccharomyces boulardii может быть ассоциировано с его опосредованным через микробиоту модулирующим влиянием на гиперхолестеринемию [25].
Эволюция степени кишечного дисбиоза представлена в табл. 3.
В группе пациентов, которым была назначена УДХК в сочетании с нормокинетиком, степень дисбиоза не изменилась. У 72,2% пациентов, получавших комплексную терапию с препаратом Saccharomyces boulardii, показатели биоценоза нормализовались, степень выраженности дисбиоза снизилась. Описанные изменения при НАСГ ассоциированы с модулирующим эффектом препарата Saccharomyces boulardii на состав кишечной микробиоты [12].
Через 12 недель от начала лечения повторная колоноскопия с морфологическим исследованием колонобиоптатов выполнена 25 пациентам: 12 пациентам первой группы и 13 пациентам второй группы. Результаты динамического эндоскопического и морфологического исследований представлены в табл. 4 и 5.
В динамике наблюдения у 6 (50%) пациентов первой группы и 10 (76,9%) пациентов второй группы уменьшились неспецифические воспаления СОТК. У 50% пациентов первой группы эрозии СОТК, выявленные на старте исследования, эпителизировались. После комплексного лечения с добавлением препарата Saccharomyces boulardii эрозии СОТК не были обнаружены ни в одном случае, при этом значимо увеличилось число пациентов с эндоскопически неизмененной СОТК.
При динамическом морфологическом исследовании у пациентов, получавших лечение с добавлением препарата Saccharomyces boulardii, значимо уменьшилась частота нейтрофильной и лимфоплазмоцитарной инфильтрации. Частота атрофических изменений СОТК при различных вариантах терапии не менялась.
Результаты проведенного исследования свидетельствуют об эффективности комплексной терапии с добавлением препарата Saccharomyces boulardii у пациентов с НАСГ и кишечной дисфункцией. В эксперименте получены данные о том, что препарат, изменяя микробный пейзаж толстой кишки, может улучшать трофику слизистой оболочки, возможно, за счет снижения проницаемости кишечного барьера и подавления гиперпродукции провоспалительных цитокинов [25–27].
Заключение
Таким образом, у пациентов с НАСГ и кишечной дисфункцией добавление к терапии препарата Saccharomyces boulardii способствует уменьшению симптомов, связанных с кишечником, снижению степени дисбиоза, уменьшению признаков хронического низкоактивного воспаления СОТК.
I.V. Kozlova, PhD, Prof., E.A. Lapteva, PhD, A.P. Bykova, PhD, A.L. Pakhomova, PhD
Saratov State Medical University named after V.I. Razumovsky
Penza State University
Contact person: Elena A. Lapteva, e.al.lapteva@mail.ru
The aim is to evaluate the effectiveness of complex therapy with the inclusion of the drug Saccharomyces boulardii in patients with non-alcoholic steatohepatitis (NASH) and intestinal dysfunction.
Material and methods. An open prospective comparative study of the effectiveness of complex therapy of intestinal dysfunction in patients with non-alcoholic steatohepatitis was carried out. The study included two groups of 36 patients with NASH with symptoms of intestinal dysfunction, established intestinal dysbiosis, structural changes in the mucous membrane of the colon.
Results and discussion. It was found that the complex therapy of intestinal dysfunction with the inclusion of the drug Saccharomyces boulardii against the background of NASH reduces the frequency of abdominal pain associated with the intestines, normalizes stool, reduces the degree of dysbiosis, promotes epithelialization of microerosions, and reduces the frequency of neutrophilic infiltration of the colon mucosa.
Conclusion. The results of the study indicate the effectiveness of complex therapy with the addition of Saccharomyces boulardii in patients with NASH and intestinal dysfunction.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.