Поколение Х и сахарный диабет 2 типа. VII Всероссийский диабетологический конгресс «Сахарный диабет в XXI веке – время объединения усилий»
- Аннотация
- Статья
- Ссылки






Открывая симпозиум, его председатель, член-корреспондент Российской академии медицинских наук, директор Института диабета ФГБУ «Эндокринологический научный центр», д.м.н., профессор Марина Владимировна ШЕСТАКОВА отметила, что понимание тенденций развития такого заболевания, как сахарный диабет (СД) 2 типа, требует выделения отдельной группы пациентов, относящихся к поколению Х. Его основными характеристиками являются относительно молодой возраст (35–55 лет), достаточно долгая ожидаемая продолжительность жизни, избыточная масса тела или ожирение в дебюте.
Данные, свидетельствующие о дефиците инкретинов при СД 2 типа, позволяют предположить, что препараты, усиливающие инкретиновый эффект, могут стать важным терапевтическим средством в управлении диабетом.
Результаты рандомизированных контролируемых исследований продемонстрировали преимущества раннего назначения ингибиторов дипептидилпептидазы 4 и интенсификации терапии, в частности препаратов Галвус и Галвус Мет. Данная терапия характеризуется высокой эффективностью, безопасностью и связана с минимальным риском развития гипогликемии. В реальной клинической практике врачи наблюдали высокую эффективность лечения вилдаглиптином, сопоставимую с эффективностью, полученной в ходе рандомизированных контролируемых исследований, чего не удалось достичь средствами традиционной терапии.
«Ингибиторы дипептидилпептидазы 4 появились в отечественной практике в 2005 г. Каждое новое исследование убеждает нас, что мы на правильном пути, что, возможно, появился инкретиннаправленный класс препаратов. Мы надеемся, что благодаря этим лекарственным средствам удастся избежать эффекта ускользания, что они будут отвечать нуждам не только поколения Х, но и других поколений. На мой взгляд, имеются все основания говорить о перспективности нового класса препаратов», – констатировала профессор М.В. Шестакова.
Роль инкретинов в развитии предиабетических состояний
Современная тенденция такова, что СД 2 типа молодеет. «Если раньше дебют заболевания приходился на 40 лет, а пик заболеваемости – на 60–70 лет, то, согласно результатам мониторинга распределения СД 2 типа по возрастам в России (2014), наибольшее количество больных имеют возраст 30–50 лет, а в возрастной категории 60–70 лет распространенность заболевания снижается», – отметила сотрудник Эндокринологического научного центра (ЭНЦ), к.м.н. Екатерина Алексеевна ШЕСТАКОВА.
Похожая тенденция прослеживается и у пациентов с предиабетом, к которому относятся такие состояния, как нарушенная гликемия натощак (НГН) и нарушенная толерантность к глюкозе (НТГ). Согласно данным исследования, которое в 2010 г. провела Международная диабетическая федерация (International Diabetes Federation – IDF), максимальное количество пациентов с НТГ приходится на возрастную категорию 40–60 лет. Следовательно, предиабет и СД 2 типа все чаще поражают людей трудоспособного возраста. Именно такие пациенты (30–50 лет) и относятся к поколению X – поколению, которое хочет сохранять максимум активности, быть работоспособным, не тратить много времени на визиты к врачам и получать максимально быстрый и безопасный эффект от лечения, которое не будет ограничивать их активность.
Согласно международным данным о вероятности различных исходов предиабета, которые сопоставимы с данными ЭНЦ, у 25% пациентов с предиабетом существует риск развития СД в течение трех – пяти лет, у 15% – в течение года1, 2.
В связи с этим встает вопрос: нужно ли лечить предиабет? Безусловно, поскольку исследования показывают, что у пациентов с НГН и НТГ смертность от любых причин выше, чем у лиц без каких-либо нарушений углеводного обмена. Следовательно, независимо от того, манифестирует в последующем СД 2 типа или нет, такие пациенты находятся в группе риска3.
Для того чтобы определить оптимальную тактику лечения пациентов с предиабетом, необходимо понимать его патогенез. В этом отношении, по мнению докладчика, показательны результаты ретроспективного наблюдательного исследования, охватившего 1991–2009 гг.4 Авторы анализировали показатель, на основании которого ставился диагноз СД.
Так, у пациентов с высоким уровнем гликемии натощак и постпрандиальной гипергликемией на отрезке минус 10 лет от начала заболевания инсулинорезистентность (ИР) резко возрастала и одновременно наблюдалось увеличение функции бета-клеток, то есть поджелудочная железа в ответ на возросшую ИР начинала работать в очень интенсивном режиме, вследствие чего к моменту постановки диагноза происходило истощение секреторной активности бета-клеток. У пациентов с изолированной постпрандиальной гипергликемией показатель ИР увеличивался плавно, а индекс функции бета-клеток повышался, но незначительно. В связи с этим можно предположить, что пациентам с НГН и пациентам с НТГ требуется разный подход к терапии. Таким образом, предиабетические состояния, а следовательно, и СД 2 типа – это группа гетерогенных заболеваний, в основе развития которых, возможно, лежат различные механизмы.
Участвуют ли в развитии предиабетических состояний инкретины? Одни исследования это опровергают, поскольку у лиц с факторами риска развития СД 2 типа и предиабета (родственники первой линии, пациентки с гестационным СД) обычно не наблюдаются нарушение секреции инкретинов и снижение инкретинового эффекта5. Другие исследования, в том числе проведенное на базе ЭНЦ, показывают, что на стадии НТГ и НГН прирост глюкагоноподобного пептида 1 (ГПП-1) в ответ на углеводную нагрузку будет снижен (по сравнению со здоровыми лицами). Еще более низкий уровень ГПП-1 наблюдается у пациентов с СД 2 типа. Следовательно, снижение уровня инкретинов может быть звеном патогенеза в развитии как предиабетических состояний, так и СД 2 типа.
В норме повышенный уровень глюкозы вызывает стимуляцию секреции инсулина и подавление секреции глюкагона. Известно, что при СД механизм отрицательной обратной связи нарушается и, несмотря на высокие значения инсулина, уровень глюкагона не снижается. Исследование ЭНЦ подтвердило эту закономерность. При этом уже у лиц с предиабетом зафиксирована тенденция к повышению уровня глюкагона6. А к моменту манифестации СД 2 типа секреция глюкагона остается выше нормы на ~60%7. Учитывая способность инкретиннаправленной терапии снижать секрецию глюкагона в условиях гипергликемии, применение ингибитора дипептидилпептидазы 4 (иДПП-4) является патогенетически оправданным уже на самых ранних стадиях СД 2 типа.
Почему диабет молодеет?
В настоящее время не вызывает сомнений генетическая основа СД 2 типа, при этом необходимо учитывать и факторы, способствующие запуску патологических процессов, такие как ожирение, снижение физической активности, старение организма.
Наиболее изученными патогенетическими механизмами развития СД 2 типа считаются длительная, выраженная ИР тканей и меняющаяся секреторная активность островкового аппарата поджелудочной железы. Как отметил заведующий кафедрой эндокринологии и диабетологии с курсом эндокринной хирургии Российской медицинской академии последипломного образования, заслуженный деятель науки РФ, д.м.н., профессор Александр Сергеевич АМЕТОВ, островок Лангерганса – это самостоятельный мини-орган, созданный и предназначенный для производства и секреции целого ряда гормонов в необходимых количествах и необходимое время, который участвует в регулировании гомеостаза глюкозы.
Непрерывно идут процессы биосинтеза инсулина бета-клетками, благодаря чему пополняются запасы и формируются функциональные внутриостровковые инсулиновые пулы. Это принципиально важно, поскольку нарушенный биосинтез молекулы инсулина с извращенной последовательностью аминокислот, дефект конверсии проинсулина в инсулин лежат в основе развития СД 2 типа.
Сегодня наука далеко продвинулась в изучении функционирования бета-клетки поджелудочной железы. Установлено, что существует триггерный механизм, который дает разрешение на поступление глюкозы в клетки, в результате происходит метаболизм глюкозы с образованием аденозинтрифосфатазы (АТФ), закрытие камер АТФ-зависимых каналов, деполяризация клеточной мембраны, открытие кальциевых каналов, повышение концентрации внутриклеточного кальция и экзоцитоз гранул инсулина. Помимо триггерного есть метаболический механизм, который работает только при наличии триггерного.
При этом существует запасной вариант – нейрогуморальный механизм индукции секреции инсулина, который предусматривает гуморальное влияние на бета-клетку с помощью инкретинов и нейронального влияния, что в итоге способствует секреции инсулина в необходимых количествах и нужное время. Данные, указывающие на дефицит инкретинов при СД 2 типа, являются основанием считать препараты, усиливающие инкретиновый эффект, важным терапевтическим средством в управлении диабетом.
На сегодняшний день главным стимулятором секреции инсулина считается глюкоза, которая обладает разрешительным эффектом для других модуляторов секреции. Основной функцией бета-клетки поджелудочной железы в качестве энергетического сенсора является способность отвечать на изменение уровня основных энергетических субстратов циркуляции крови.
А.С. Аметов еще раз подчеркнул, что при постановке диагноза СД 2 типа отмечается снижение секреции инсулина и повышенный апоптоз бета-клеток, не компенсирующийся адекватной регенерацией8. Причем уже на стадии НТГ наблюдается не только уменьшение массы бета-клеток, но и дисфункция альфа-клеток.
Показано, что гиперглюкагонемия приводит к повышенной продукции и избыточному выбросу глюкозы печенью, вследствие чего отмечается гипергликемия натощак. Однако первоначально происходит гибель бета-клеток «из-за множества мелких ударов» – таких, как липотоксичность, глюкозотоксичность, оксидативный стресс, стресс эндоплазматического ретикулума, нарушение ремоделирования островков, регуляции инкретинов, откладывание амилоида (islet amyloid polypeptide – IAPP).
Уменьшение массы бета-клеток, снижение их функции приводят к гипергликемии, повышению уровня свободных жирных кислот. Гипергликемия обратимо снижает секреторную функцию бета-клеток и значительно уменьшает способность оставшихся бета-клеток отвечать на стимуляцию секреции инсулина.
Следовательно, дисфункция бета-клеток из-за воздействия высокого уровня гликемии может рассматриваться как осложнение СД 2 типа, такое же, как микро- и макрососудистые осложнения. Когда говорят, что надо добиваться хорошего гликемического контроля, это означает, что таким образом существенно улучшается состояние и бета- и альфа-клеток поджелудочной железы, пояснил докладчик.
«Насколько все-таки сложна система регулирования одного миллиона островковых клеток, которые в самом начале выступления я назвал мини-органом. И функция этого органа направлена на достижение гликемического контроля и обеспечение органов и тканей важнейшим энергетическим субстратом, каковым является глюкоза, в первую очередь в ответ на системный запрос энергии в тканях головного мозга», – констатировал профессор А.С. Аметов.
Новые тенденции в лечении пациентов с СД 2 типа
По мнению заведующего отделением терапевтических и хирургических методов лечения диабетической стопы Института диабета ЭНЦ, д.м.н., профессора Гагика Радиковича ГАЛСТЯНА, быстрый рост числа пациентов с СД 2 типа, с одной стороны, и недостаточное следование многими из них рекомендациям врачей по изменению образа жизни и применению лекарственных препаратов, с другой, делают особенно актуальной задачу разработки новых подходов к терапии заболевания на самом раннем этапе.
Согласно данным контрольно-эпидемиологических исследований, сейчас в странах Европейского союза распространенность СД 2 типа составляет 8,1% (53 млн чел.), а к 2030 г. она достигнет 9,5% (64 млн)9.
Важно и то, что пик смертности, ассоциированной с СД, приходится на активный возраст – установлено, что 50-летние больные СД умирают в среднем на шесть лет раньше и в 40% случаев ранняя летальность связана не с сосудистыми и не с онкологическими заболеваниями10.
Следующий тревожный аспект связан с поздним выявлением СД 2 типа. Так, в исследовании UKPDS средний возраст больных с впервые выявленным СД 2 типа составил 50 лет. Было также показано, что снижение гликированного гемоглобина (HbA1c) всего лишь на 1% дает преимущество в отношении снижения всех исходов, связанных с диабетом, в том числе общей смертности.
Это исследование позволило сформулировать концепцию «метаболической памяти», раннего вмешательства и своевременной интенсификации лечения СД 2 типа. По мнению профессора Г.Р. Галстяна, помимо возможности увеличения продолжительности и качества жизни больных интенсивное лечение выгодно и с экономической точки зрения, в том числе с учетом предупреждения сосудистых осложнений.
Однако, как показывает клиническая практика, 2/3 больных СД 2 типа не следуют рекомендациям врачей. В связи с этим Американской диабетической ассоциацией (American Diabetes Association – ADA) и Европейской ассоциацией по изучению сахарного диабета (European Association for the Study of Diabetes – EASD) в 2015 г. был опубликован алгоритм лечения СД 2 типа, в основе которого лежит пациент-центрированный подход11. Следует отметить, что индивидуальный подход к лечению пациентов был в свое время взят за основу и в консенсусе Российской ассоциации эндокринологов (2011).
Пациент-центрированный подход предусматривает: лечение следует проводить с ответственным и уважительным отношением к индивидуальным потребностям и нуждам пациента, оценивая предпочтительный уровень его вовлечения в лечение заболевания, расширять терапевтические возможности и предлагать пути решения проблем, но не навязывая свое мнение, а разделяя принятие решения с пациентом с учетом имеющихся доказанных данных и индивидуальных потребностей последнего.
Еще в 1991 г. психологи Н. Хоув и В. Штраус сформулировали теорию поколений. Поколения сменяются каждые 20 лет и имеют характерные для их формирования исторические моменты, социальные и бытовые аспекты. Согласно этой теории выделяют молчаливое поколение (1923–1943 гг.), поколение беби-бумеров (1943–1963 гг.) и поколение Х (1963–1983 гг.). Если молчаливое поколение искренне верит в докторов, а беби-бумеры расценивают посещение врачей как необходимость, готовы лечиться и регулярно проходить медосмотры, то для поколения Х важно постоянно оставаться работоспособными, они пойдут к врачу только в случае крайней необходимости, готовы потратить деньги, но не время. Принципиально важно, чтобы терапия никак не влияла на их активный образ жизни.
Согласно последним российским алгоритмам лечения больных СД 2 типа препаратами первого выбора для старта терапии признаны метформин, ингибиторы ДПП-4, агонисты ГПП-1. Для интенсификации терапии наиболее рациональными считаются комбинации «метформин + ингибиторы ДПП-4», «метформин + агонисты ГПП-1» как препараты с низким риском гипогликемий, в альтернативе – «метформин + производные сульфонилмочевины», «метформин + тиазолидиндионы», «метформин + ингибиторы натрий-глюкозного котранспортера 2» и т.д.
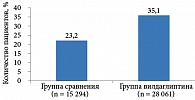
В широкомасштабном наблюдательном исследовании EDGE с участием порядка 46 тыс. больных СД 2 типа из 27 стран мира с недостаточным контролем гликемии на монотерапии метформином оценивались эффективность и безопасность интенсификации терапии вилдаглиптином по сравнению с эффективностью и безопасностью интенсификации другими пероральными сахароснижающими препаратами (ПССП) в условиях реальной клинической практики12, 13. Исследование показало высокую эффективность вилдаглиптина в комбинации с метформином (препарат Галвус Мет) в отношении снижения уровня HbA1c. При этом количество пациентов, ответивших на терапию вилдаглиптином без эпизодов гипогликемии и увеличения массы тела, было выше, нежели в группах сравнения (рис. 1). В результате приверженность пациентов лечению существенно повысилась.
Дальнейший анализ, проведенный по результатам EDGE, подтвердил в условиях реальной клинической практики эффективность терапии вилдаглиптином, идентичную данным рандомизированных контролируемых исследований (РКИ) (снижение значений HbA1c больше чем на 1%). При этом эффективность терапии препаратами сульфонилмочевины в реальной практике оказалась ниже, чем в РКИ. Это может быть обусловлено страхом развития гипогликемии и связанным с ней набором массы тела14.
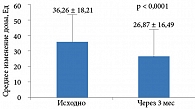
Показательны также данные исследования PROVIL, в котором оценивалась эффективность вилдаглиптина как в свободной (Галвус + Метформин), так и в фиксированной комбинации (ФК) с метформином (препарат Галвус Мет) по сравнению с другими ПССП в комбинации с метформином15. Исследование продемонстрировало преимущество вилдаглиптина в комбинации с метформином в снижении как HbA1c, так и глюкозы плазмы натощак (ГПН) перед другими ПССП в комбинации с метформином в реальной клинической практике (рис. 2).
Вилдаглиптин обладает обширной доказательной базой на всех этапах терапии СД 2 типа, в том числе и при интенсификации терапии инсулином. Данная комбинация является патофизиологически обусловленной, учитывая влияние вилдаглиптина на функцию альфа-клеток поджелудочной железы и нормализацию секреции глюкагона. В исследовании 2007 г. применение вилдаглиптина (препарат Галвус) в сочетании с базальным инсулином позволило достичь снижения уровня HbA1c на 0,3% больше по сравнению с применением инсулина в сочетании с плацебо16. Кроме того, добавление Галвуса к инсулинотерапии сопровождалось достоверным снижением общего числа случаев гипогликемии, а также тяжелых гипогликемий (рис. 3).
Еще одно двойное слепое исследование было проведено в азиатской популяции пациентов, которая характеризуется большим риском развития гипогликемии вследствие меньшей массы тела и более высокой чувствительности к инсулину17. В него были включены больные СД 2 типа с неудовлетворительным контролем гликемии на фоне терапии базальным инсулином или комбинацией «инсулин + метформин». Добавление к терапии Галвуса в дозе 50 мг два раза в день способствовало достоверно более значимому снижению уровня HbA1c по сравнению с группой контроля (-1,1 и -0,4% соответственно), при этом риск развития гипогликемии был существенно ниже (2,4 и 5,4% соответственно).
Результаты исследования V. Paresh и соавт. продемонстрировали снижение дозы инсулина у пациентов на фоне добавления к терапии препаратов Галвус или Галвус Мет (на 9,4 ± 1,7 Ед) (рис. 4)18.
Кроме того, полученные данные позволили сделать вывод: добавление Галвус и Галвус Мет к инсулинотерапии способствует улучшению гликемического контроля – снижению показателей ГПН, постпрандиальной гликемии и HbA1c. Эти данные еще раз подтверждают, что терапия вилдаглиптином является оптимальной на всех этапах управления заболеванием.
Возвращаясь к теме своевременной интенсификации терапии СД 2 типа, необходимо отметить, что в 2014 г. стартовало уникальное многонациональное мультицентровое пятилетнее исследование VERIFY, в котором принимают участие 260 центров из более 30 стран Европы, Азии, Северной и Южной Америки19. Это первое исследование по оценке клинических преимуществ ранней комбинированной терапии метформином с вилдаглиптином, которое позволит получить ответ на вопрос, может ли раннее назначение комбинации ингибиторов ДПП-4 с метформином уменьшить скорость прогрессирования СД. Исследование VERIFY предоставит ценные данные по влиянию вилдаглиптина на функцию бета-клеток, ИР, по безопасности и переносимости данной терапии. Результаты исследования помогут понять, когда у больных СД 2 типа начинаются патологические изменения сердечно-сосудистой системы, как влияет терапия на конечные точки и сердечно-сосудистые исходы.
Завершая выступление, Г.Р. Галстян еще раз акцентировал внимание аудитории на том, что на современном этапе СД 2 типа молодеет, что именно поколение Х подвержено наибольшему риску. «Учет индивидуальных особенностей пациента должен включать не только биомедицинские параметры, но и биопсихосоциальные аспекты. А ранний многонаправленный старт сахароснижающей терапии является ключевым в улучшении долгосрочных прогнозов и предотвращении как прогрессирования заболевания, так и сердечно-сосудистых катастроф», – подчеркнул профессор.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.