Применение вилдаглиптина у пациентов с метаболическим синдромом и нарушением толерантности к глюкозе
- Аннотация
- Статья
- Ссылки

По мнению эндокринологов, МС является предстадией сахарного диабета (СД) типа 2. С точки зрения кардиологов, МС является предиктором развития и прогрессирования сердечно-сосудистых заболеваний [2, 3]. Основным признаком МС является висцеральное ожирение. Впервые Vague в 1956 году описал концепцию ведущей роли висцерального ожирения в развитии нарушения толерантности к глюкозе, СД 2 типа и атеросклероза. В дальнейшем ряд эпидемиологических исследований продемонстрировал связь висцерального ожирения с инсулинорезистентностью (ИР) и гиперинсулинемией (ГИ) [4].
Таким образом, в основе выделения МС лежит принцип первичной профилактики СД типа 2, атеросклероза и его последствий. В связи с этим важным вопросом изучения проблем метаболического синдрома является поиск эффективных и безопасных средств, способных воздействовать на несколько патогенетических механизмов (ИР, висцеральное ожирение, АД).
Следует отметить, что одной из самых важных составляющих МС является нарушение толерантности к глюкозе (НТГ). НТГ является состоянием, связанным с наличием инсулинорезистентности, и способно прогрессировать в СД типа 2. Согласно рекомендациям ВОЗ по МС, нарушение гликемии натощак диагностируется при уровне глюкозы в венозной плазме > 6,1 ммоль/л, но < 7,0 ммоль/л, а нарушение толерантности к глюкозе – при уровне глюкозы в плазме через 2 ч после перорального глюкозотолерантного теста 7,8–11,1 ммоль/л. Сегодня в мире более 300 млн человек имеют предиабет, а через 20 лет их число может увеличиться до 500 млн.
НТГ является состоянием, ассоциированным с повышенным риском сердечно-сосудистых осложнений (ССО). Эпидемиологические исследования показали, что в дебюте СД типа 2 около 50% больных уже имеют макро- и микрососудистые осложнения. Возможно, это результат того, что метаболические нарушения, возникающие до первых клинических проявлений СД, способны приводить к поражению органов-мишеней и повышать риск ССО. В ряде исследований доказано, что НТГ не только повышает риск развития СД, но и значительно увеличивает риск ССО, причем даже в большей степени, чем артериальная гипертензия (АГ) и дислипидемия.
Кроме того, НТГ ассоциировано с повышенным риском сердечно-сосудистой смертности. Мета-анализ результатов 20 исследований, суммарно включавших более 95 тыс. человек без СД, показал, что постпрандиальная гликемия на уровне 7,8 ммоль/л уже характеризовалась увеличением риска развития сердечно-сосудистых заболеваний в 1,58 раза. В исследовании DECODE (Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe Study, 1999) показано, что у пациентов с НТГ риск сердечно-сосудистой смертности повышается в 1,32 раза по сравнению с лицами с нормогликемией, а у пациентов с гликемией натощак – только в 1,14 раза [5].
В настоящее время в распоряжении врачей для лечения НТГ имеется лишь один препарат – акарбоза, применение которого зачастую ограничено в связи с его побочными эффектами: метеоризм, боли в животе, диарея; в отдельных случаях (особенно при приеме в высоких дозах) повышение активности печеночных трансаминаз.
Появление в начале ХХI столетия тиазолидиндионов (глитазонов) – препаратов нового класса, устраняющих ключевую причину развития СД типа 2 (инсулинорезистентность) – первоначально вселило большие надежды на возможность преодоления эпидемии СД. Однако надежды эти не оправдались. Долгосрочное проспективное исследование ADOPT (the Adult Diabetes Outcome Progression Trial), в котором сравнивали три режима терапии СД типа 2 (метформин, препараты сульфонилмочевины (СМ) и росиглитазон), показало, что, действительно, глитазон способен дольше других препаратов удерживать гликемический контроль в пределах нормальных значений [6]. Тем не менее, ухудшение компенсации все же происходит через 2,5–3 года лечения, и, кроме того, нарастают побочные эффекты терапии (увеличение массы периферического жира, задержка жидкости с появлением отеков, риск прогрессирования сердечной недостаточности).
Таким образом, современная сахароснижающая терапия (метформин, СМ, глитазоны) не способна остановить потерю инсулинсекретирующей функции β-клеток и имеет ряд ограничений в связи с риском развития побочных эффектов терапии (увеличение массы тела, гипогликемии, сердечной недостаточности).
В связи с этим представляет интерес новый класс препаратов – высоко селективных ингибиторов дипептидилпептидазы 4 (ДПП-4), одним из представителей которого является вилдаглиптин.
Вилдаглиптин (Галвус) отличается по химической структуре и фармакологическому действию от аналогов глюкагоноподобного пептида-1 (ГПП-1), инсулина, производных сульфонилмочевины, бигуанидов, агонистов γ-рецепторов, активируемых пролифератором пероксисом (PPAR-γ), ингибиторов β-гликозидазы, аналогов амилина. Ингибируя ДПП-4, вилдаглиптин повышает концентрацию 2 известных гормонов семейства инкретинов: ГПП-1 и глюкозо-зависимого инсулинотропного пептида (ГИП). Гормоны семейства инкретинов секретируются в кишечнике в течение суток, их уровень повышается в ответ на прием пищи.
Инкретины являются частью внутренней физиологической системы регуляции гомеостаза глюкозы. При нормальном или повышенном уровне глюкозы крови гормоны семейства инкретинов способствуют увеличению синтеза инсулина, а также его секреции β-клетками поджелудочной железы за счет сигнальных внутриклеточных механизмов, ассоциированных с циклическим АМФ. ГПП-1 также способствует подавлению повышенной секреции глюкагона α-клетками поджелудочной железы. Снижение концентрации глюкагона на фоне повышения уровня инсулина способствует уменьшению продукции глюкозы печенью, что в итоге приводит к уменьшению гликемии.
При низкой концентрации глюкозы крови, перечисленные эффекты инкретинов на выброс инсулина и уменьшение секреции глюкагона не наблюдаются. ГПП-1 и ГИП не влияют на выброс глюкагона в ответ на гипогликемию. В физиологических условиях активность инкретинов ограничивается ферментом ДПП-4, который быстро гидролизует инкретины с образованием неактивных продуктов. Вилдаглиптин предотвращает гидролиз инкретинов ферментом ДПП-4, тем самым увеличивая плазменные концентрации активных форм ГПП-1 и ГИП. Повышая уровень инкретинов, вилдаглиптин увеличивает глюкозозависимый выброс инсулина и способствует уменьшению секреции глюкагона.
У пациентов с СД типа 2 с гипергликемией эти изменения секреции инсулина и глюкагона приводят к снижению уровня гликированного гемоглобина НbА1С и уменьшению плазменной концентрации глюкозы, определяемой натощак и после нагрузочной пробы.
И хотя данный препарат зарегистрирован для лечения СД 2 типа, для многих ученых представляет большой интерес изучение данной группы препаратов для лечения НТГ. В исследовании «Effect of the DPP-4 inhibitor vildagliptin on incretin hormones, islet function, and postprandial glycemia in subjects with impaired glucose tolerance» [7] вилдаглиптин использовали для лечения больных с НТГ. Это было 12-недельное, двойное слепое рандомизированное плацебо-контролируемое исследование с параллельными группами, которое проводилось с целью оценки эффекта вилдаглиптина на прандиальный гликемический контроль, уровень инкретиновых гормонов и функцию островковых клеток у пациентов с нарушенной толерантностью к глюкозе (НТГ).
Пациенты (средний ИМТ 23–45 кг/м2) были рандомизированы на терапию вилдаглиптином 50 мг/сут. или плацебо. Первичная эффективность оценивалась по динамике от исходных значений уровня глюкозы в плазме крови (по показателю площади под кривой – ППК0-2h) и скорости секреции инсулина (ССИ) по отношению к глюкозе как показателю функции β-клеток. Все показатели измерялись через 2 ч после приема пищи. Терапия вилдаглиптином у пациентов с СД типа 2 продемонстрировала, что:
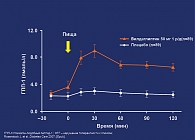
- вилдаглиптин повышает уровень ГПП-1 в плазме через 2 ч после приема пищи более чем в 5 раз с достоверным приростом ППК для ГПП-1 через 2 ч после приема пищи (рис. 1);
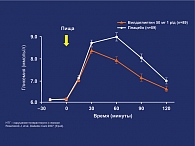
- вилдаглиптин снижает постпрандиальный уровень глюкозы в плазме крови с достоверным снижением постпрандиальных пиков на -0,6 ммоль/л (p < 0,001 vs placebo);
- вилдаглиптин достоверно снижает ППК для глюкозы через 2 ч после еды в сравнении с плацебо (-0,9 ммоль/л x h vs + 0,1 ммоль/л x h;p < 0,001) (рис. 2);
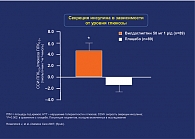
- скорость секреции инсулина по отношению к плацебо – показатель функциональной активности β-клеток достоверно повысился на фоне терапии вилдаглиптином и снизился на фоне плацебо (p = 0,002 vs placebo) (рис. 3);
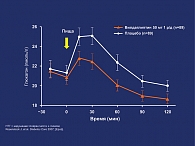
- в сравнении с плацебо терапия вилдаглиптином достоверно подавляла уровень глюкагона в плазме крови через 2 ч после приема пищи (рис. 4).
Все эти данные доказывают, что те же благоприятные эффекты вилдаглиптина на ГПП-1, уровни гликемии, функцию β-клеток и глюкагона, показанные у пациентов с СД типа 2, сохраняются и у пациентов с НТГ.
В отделе системных гипертензий РКНПК было проведено исследование, целью которого явилась оценка влияния высоко селективного ингибитора ДПП 4 на висцеральное ожирение, показатели углеводного, липидного обмена и суточный профиль АД у пациентов с МС, артериальной гипертензией I степени и НТГ.
Материалы и методы
В исследование были включены 20 пациентов с МС, АГ I степени и НТГ. После предварительного скрининга пациентам, включенным в исследование, был назначен вилдаглиптин 50 мг/сут в виде монотерапии. Следует отметить, что назначенная ранее антигипертензивная терапия не менялась. Соотношение мужчин и женщин в группе составило 8 и 12 соответственно. Средний возраст пациентов, принимавших вилдаглиптин, был 46,4 ± 12,62 лет.
У всех пациентов, принимавших участие в исследовании, имело место ожирение по абдоминальному типу разной степени выраженности. Средняя масса тела составляла 98,12 ± 18,5 кг, ИМТ 33,1 ± 4,25 кг/м² и ОТ 110,9 ± 12,17 см. Клиническое САД у пациентов зафиксировано на уровне 136,0 ± 9,27 мм рт. ст., ДАД – 85,6 ± 7,58 мм рт. ст. У всех пациентов было выявлено нарушение толерантности к углеводам. У абсолютного большинства больных также отмечалась разной степени выраженности дислипидемия.
До начала исследования и через 24 недели терапии у пациентов собирали полный анамнез, проводили физикальный осмотр и антропометрическое обследование: измерение роста, массы тела, окружности талии (ОТ). Индекс массы тела (ИМТ) рассчитывался по формуле Кетле. Проводили биохимическое исследование венозной крови (общий холестерин (ХС), ХС липопротеидов низкой плотности (ЛПНП), ХС липопротеидов высокой плотности (ЛПВП), триглицеридов (ТГ), глюкоза, мочевая кислота). Забор крови для лабораторных анализов производился из локтевой вены в период между 9 и 10 ч утра после 12-часового голодания. Содержание общего ХС и ТГ (в сыворотке крови) и ХС ЛПВП определяли ферментативным колориметрическим методом с помощью наборов фирмы DIASYS (Германия) на биохимическом автоанализаторе EXPRESS PLUS (CHIRON Diagnostics, Великобритания). Результаты выражали в ммоль/л. Содержание ХС ЛПНП вычисляли по формуле Фридвальда и соавт.: ХС ЛПНП = общий ХС - (ТГ/2,2 + ХС ЛПВП), где ТГ/2,2 = ХС ЛПОНП (193).
Контроль качества при выполнении исследований осуществляли с использованием контрольной сыворотки Precinorm L (Германия). Для определения уровня мочевой кислоты использовали наборы и стандартные образцы фирмы DIASYS на биохимическом автоанализаторе EXPREES PLUS (CHIRON Diagnostics, Великобритания).
Для оценки безопасности и побочных эффектов препаратов определяли активность АСТ, АЛТ, уровни общего билирубина, общего белка, креатинина на автоанализаторе EXPREES PLUS при использовании реактивов и контрольных сывороток фирмы DIASYS (Германия). Методика проведения перорального теста толерантности к глюкозе: пробы крови брали после 12-часового голодания из локтевой вены в период с 8.00 до 9.00 ч утра. После забора крови натощак больному давали выпить в течение 2–3 мин. 75 г сухой глюкозы, растворенной в 250 мл воды, после чего осуществлялось повторное взятие венозной крови через 2 ч после приема глюкозы. В период проведения теста исключалось курение, прием пищи и воды, физические нагрузки.
В исследование не включались пациенты с тяжелой АГ, инфарктом миокарда в анамнезе, хронической сердечной недостаточностью, хронической почечной и печеночной недостаточностью, онкологическими заболеваниями, СД типа 1 и 2, в период беременности и лактации.
Статистическую обработку полученных данных проводили с использованием программы MedCalk, Statistika v.6. Результаты представлены как М ± m. Достоверность различий определяли с помощью непараметрического теста Манна–Уитни. Сравнение частоты распространения признаков по группам проводили при помощи точного двустороннего критерия Фишера. Анализ корреляционных взаимосвязей клинических и биохимических показателей осуществляли с помощью метода Спирмена. Уровень значимости р < 0,05 рассматривали как достоверный.
Результаты
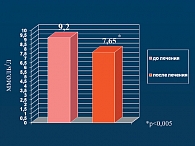
На фоне 24 недельного лечения вилдаглиптином у пациентов было достигнуто значимое снижение массы тела с 98,12 ± 18,5 до 93,9 ± 18,74 кг (р < 0,001) (рис. 5). Окружность талии существенно уменьшилась с 110,9 ± 12 до 104,8 ± 12,39 см (р < 0,001). В результате проведенной терапии вилдаглиптином у пациентов наблюдалось достоверное снижение уровня постпрандиальной глюкозы с 9,19 ± 0,99 до 7,65 ± 1,03 ммоль/л (р < 0,005) (рис. 6) и уровня глюкозы натощак с 6,1 ± 0,28 до 5,88 ± 0,26 ммоль/л (р < 0,005).
Также на фоне проводимой терапии существенно улучшились показатели липидного обмена. Так, уровень общего холестерина уменьшился с 5,96 ± 0,75 до 5,21 ± 1,03 ммоль/л (р < 0,005) за счет достоверного снижения уровня липопротеидов низкой плотности с 3,8 ± 0,69 до 3,14 ± 0,97 ммоль/л (р < 0,005). Показатели уровня липопротеидов высокой плотности и триглицеридов существенно не изменились.
По данным суточного мониторирования АД (СМАД) было зарегистрировано достоверно значимое снижение показателей систолического артериального давления и диастолического артериального давления в дневные часы: САД с 136,0 ± 9,27 до 121,4 ± 7,29 мм рт. ст. (р < 0,0001), ДАД с 85,6 ± 7,58 до 76,6 ± 5,62 мм рт. ст. (р < 0,001). В ночные часы САД снизилось со 128,2 ± 8,31 до 117,2 ± 6,11 мм рт. ст. (р < 0,001), ДАД с 72,3 ± 5,31 до 68,4 ± 5,13 мм рт. ст. (р < 0,0001).
В течение 24-недельной терапии вилдаглиптином по данным биохимических показателей и клинической картины эпизодов гипогликемии не наблюдалось.
Выводы
- На фоне приема вилдаглиптина у пациентов с метаболическим синдромом и нарушением толерантности к глюкозе отмечается значимое снижение массы тела и окружности талии.
- Терапия вилдаглиптином у пациентов с метаболическим синдромом и нарушением толерантности к глюкозе приводит к достоверному снижению как постпрандиального уровня глюкозы, так и глюкозы натощак.
- Терапия вилдаглиптином у пациентов с метаболическим синдромом и нарушением толерантности к глюкозе сопровождалась хорошим антигипертензивным эффектом с достоверным снижением систолического и диастолического АД как в дневные, так и в ночные часы.
- В результате проводимой терапии у пациентов с метаболическим синдромом и нарушением толерантности к глюкозе достоверно снизились показатели липидного обмена: общего холестерина, липопротеидов низкой плотности. При этом уровень ТГ и липопротеидов высокой плотности значимо не менялся.
- На фоне лечения вилдаглиптином у пациентов с метаболическим синдромом и нарушением толерантности к глюкозе эпизодов гипогликемии не зарегистрировано, при этом терапия вилдаглиптином сопровождалась хорошим профилем переносимости и безопасности.
- Tаким образом, применение вилдаглиптина у больных с МС и НТГ продемонстрировало высокую эффективность, хорошую переносимость и отсутствие гипогликемических состояний на фоне терапии. Лечение вилдаглиптином приводило к достоверному улучшению показателей углеводного обмена, снижению как постпрандиального уровня глюкозы, так и гликемии натощак, при этом достоверно снижались уровни общего холестерина и холестерина липопротеидов низкой плотности. Кроме того, терапия вилдаглиптином у пациентов с МС и НТГ сопровождалась достоверным снижением как систолического так и диастолического АД уже в первые 6 месяцев терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.