Послеоперационный и посттравматический эндофтальмит
- Аннотация
- Статья
- Ссылки
- English
В статье изложены современные представления о послеоперационном эндофтальмите (ПЭ), включая частоту развития, этиологические причины и методы лечения. Описаны стандарты оперативного лечения ПЭ, в том числе способы и модификации хирургического вмешательства. Кроме того, рассмотрены возможности интравитреального применения антибактериальных препаратов при введении их в полость стекловидного тела, а также при использовании силиконового масла и перфторорганических соединений для тампонады витреальной полости.
Проанализировано 114 наиболее цитируемых статей, относящихся к послеоперационному и посттравматическому эндофтальмиту. Глобальный поиск литературы осуществлялся в базах данных PubMed и eLibrary. Отобраны рецензируемые статьи по направлению «офтальмология» по ключевому слову «послеоперационный эндофтальмит».
В наиболее цитируемых статьях, посвященных ПЭ, представлены классификация, частота возникновения, этиология заболевания, патогенез, особенности клиники и диагностики, вопросы дифференциальной диагностики и лечения, факторы риска, методы профилактики, особенности ПЭ после хирургического лечения катаракты, глаукомы, витрэктомии, кератопластики, интравитреальных введений лекарственных средств.
В статье изложены современные представления о послеоперационном эндофтальмите (ПЭ), включая частоту развития, этиологические причины и методы лечения. Описаны стандарты оперативного лечения ПЭ, в том числе способы и модификации хирургического вмешательства. Кроме того, рассмотрены возможности интравитреального применения антибактериальных препаратов при введении их в полость стекловидного тела, а также при использовании силиконового масла и перфторорганических соединений для тампонады витреальной полости.
Проанализировано 114 наиболее цитируемых статей, относящихся к послеоперационному и посттравматическому эндофтальмиту. Глобальный поиск литературы осуществлялся в базах данных PubMed и eLibrary. Отобраны рецензируемые статьи по направлению «офтальмология» по ключевому слову «послеоперационный эндофтальмит».
В наиболее цитируемых статьях, посвященных ПЭ, представлены классификация, частота возникновения, этиология заболевания, патогенез, особенности клиники и диагностики, вопросы дифференциальной диагностики и лечения, факторы риска, методы профилактики, особенности ПЭ после хирургического лечения катаракты, глаукомы, витрэктомии, кератопластики, интравитреальных введений лекарственных средств.
Введение
Эндофтальмит (греч. endo – внутри, ophthalmos – глаз) – воспалительный процесс внутренних оболочек глаза, приводящий к образованию гнойного выпота в стекловидном теле (СТ) [1]. Эндофтальмит представляет собой серьезное осложнение, требующее немедленного вмешательства со стороны офтальмологов. Послеоперационный эндофтальмит (ПЭ) является наиболее распространенным и диагностируется более чем в 90% случаев [2]. Посттравматический эндофтальмит, вызванный открытой травмой глаза, особенно проникающей раной, составляет около 25–30% всех случаев данного заболевания.
Классификация
Эндофтальмит подразделяется на острый и хронический ПЭ, посттравматический и эндогенный эндофтальмит [1, 3, 4]. ПЭ относится к группе экзогенных эндофтальмитов.
Классификация эндофтальмитов, предложенная А.М. Южаковым в 1983 г. [4], считается наиболее полной и распространяется на посттравматический эндофтальмит. Классификация применяется также в клинической практике в отношении послеоперационных и эндогенных эндофтальмитов. Согласно классификации, выделяют:
- очаговый эндофтальмит (абсцесс СТ), стадии I–II;
- диффузный эндофтальмит, стадии I–IV;
- смешанную форму, стадии I–IV;
- панофтальмит.
Об остром ПЭ говорят, когда симптомы заболевания появляются в течение двух недель после хирургического вмешательства [1, 5–7], в исключительных случаях – до шести недель [8]. Патогенез острого ПЭ предполагает миграцию патогенов в заднюю камеру глаза и накопление воспалительных медиаторов в этой области, что занимает не менее двух суток [1, 8]. Хронический ПЭ развивается спустя более чем шесть недель после предшествующей внутриглазной операции [9]. В таких случаях в процесс обычно вовлекаются менее вирулентные микроорганизмы, которые находятся в капсульном мешке и в значительной степени изолированы от иммунной системы. Среди наиболее распространенных возбудителей хронического эндофтальмита – Propionibacterium acnes и грибы [10]. Это отличает хронический эндофтальмит от острого ПЭ, при котором, как правило, присутствуют более агрессивные микроорганизмы, включая стрептококки, стафилококки и кишечную палочку.
Статистический анализ
При анализе статистической информации акцент был сделан на эндофтальмите после операций по удалению катаракты, что обусловлено широким распространением данной процедуры. В ранних исследованиях показано, что частота развития эндофтальмита – один случай на 300 операций. Однако хирургия с использованием малых разрезов и улучшенного оборудования способствовала существенному снижению заболеваемости. Как показал более поздний большой метаанализ, с 2000 г. частота эндофтальмита варьировалась в пределах 0,012–1,3%. Последние исследования указывают на снижение показателей после факоэмульсификации с 0,145 до 0,053% за десятилетний период.
В исследовании ESCRS частота ПЭ после экстракции катаракты без интракамерального введения цефуроксима составила 0,35%, в то время как с использованием интракамерального цефуроксима – 0,05% [8, 11]. В США эти показатели составляют 0,31 и 0,014% соответственно [12]. В Китае частота ПЭ без применения интракамерального цефуроксима достигает 0,06% [13].
В Швеции после микроинвазивной витрэктомии 23G и 25G ПЭ регистрируется в 0,14% случаев [14], в Индии – в 0,052% [15]. В Саудовской Аравии после антиглаукомных операций частота эндофтальмита достигает 0,00074–0,00197% [16], в США – 1,1% [17], во Франции – 0,06–0,2% [18]. Проведенный анализ примерно 16 000 инъекций анти-VEGF-препаратов показал 0,2%-ную вероятность развития ПЭ [19]. После имплантации бостонского протеза (США) ПЭ может отмечаться у 13% пациентов [20].
Данных о распространенности хронического ПЭ пока недостаточно [21]. Исследование, проведенное в одном медицинском центре, показало частоту 0,017% [22].
В Российской Федерации в настоящее время не применяются антибактериальные препараты для интракамерального введения в связи с отсутствием их регистрации. Частота возникновения ПЭ в России после катарактальной хирургии остается высокой – 0,1–0,3% [1].
Этиология
К наиболее частым этиологическим агентам, способствующим развитию острого ПЭ, относят различные виды бактерий, в том числе коагулазонегативные стафилококки, особенно Staphylococcus epidermidis (33–77%); S. aureus (10–21%); бета-гемолитические стрептококки, Streptococcus pneumoniae, дельта-гемолитические стрептококки (9–19%); а также различные грамотрицательные бактерии (6–22%), грибы рода Candida, Aspergillus, Fusarium (до 8%) [1, 23].
Propionibacterium acnes, Corynebacterium spp., S. epidermidis и грибы являются доминирующими возбудителями хронического ПЭ [8].
Благодаря масштабным исследованиям EVS (США, 1996), ESCRS (девять стран Европы, 2007) [8, 24, 25], Swedish National Study (Швеция, 2013) [26] появились данные о схожести микробных возбудителей ПЭ в мире.
Различия в этиологии ПЭ наблюдаются только в странах Азии [8, 18, 27, 28], где большая доля возбудителей, вызываемых ПЭ, приходится на грамотрицательные бактерии и грибы, что несравнимо выше, чем в Европе и Америке. В Китае вероятность выявить грамотрицательные бактерии при ПЭ составляет 26,2%, грибы – 16,7% [23]. В Индии эти показатели составляют 13,4 и 12,7% соответственно [28].
С учетом широкого использования антибиотикотерапии для профилактики ПЭ увеличивается вероятность развития ПЭ в результате контаминации метициллинрезистентными штаммами S. epidermidis и S. aureus (как показано в исследовании Ocular TRUST, 2006) [29].
Патогенез
Воспалительный процесс в передней и задней камерах глаза на третий-четвертый день после операции захватывает СТ [1, 8]. Из-за ограниченной естественной возможности дренажа СТ экссудат с бактериями стремительно накапливается в СТ. В результате формируется гнойный экссудат. Развитию передней и задней витреоретинопатии способствует образующийся в СТ сгусток фибрина [8]. Важной составляющей патогенеза ПЭ является вовлечение сетчатки в воспалительный процесс, приводящий к разрушению нейрорецепторного комплекса [1, 4, 8]. Под воздействием медиаторов воспаления, таких как гистамин, серотонин, перекись водорода, гидрорадикалы, брадикинины, простагландины, а также из-за накопления продуктов жизнедеятельности бактерий, в частности экзотоксинов и протеаз, происходит деструкция внутренних оболочек глаза [8, 30]. Чем больше слоев сетчатки вовлечено в воспалительный процесс, тем ниже шансы на восстановление зрительных функций в послеоперационном периоде [8, 31].
Клиническая картина и диагностика
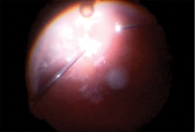
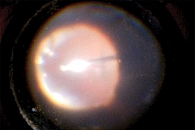
Острый ПЭ характеризуется быстрым развитием внутриглазного воспаления [1, 3, 4, 8, 31]. В течение 3–7 дней после операции возникают симптомы, такие как затуманивание зрения, боль и смешанная инъекция глаза. Эти признаки со временем могут усиливаться. При офтальмоскопии обнаруживаются гипопион, фибрин или отложения на интраокулярной линзе либо передней капсуле хрусталика (рис. 1). Отложения также могут быть видны на эндотелии. Из-за витреита и образования экссудата в полости СТ рефлекс с глазного дна при офтальмоскопии становится серым (рис. 2) [1, 4, 8, 10].
Ретроспективная оценка, основанная на результатах ультразвукового исследования 81 глаза, выявила, что уплотненная организация помутнений СТ с или без образования мембраны и утолщение задней стенки глазного яблока служат важными диагностическими признаками [32].
К дополнительным методам обследования относятся автоматическая компьютерная периметрия и электрофизиологические исследования, позволяющие оценить функцию проводящей системы глаза. Изменения в исследованиях указывают на токсическое повреждение внутренних оболочек глаза и рассматриваются как основание для хирургического лечения [1, 8, 31].
Лазерная тиндалеметрия считается перспективным методом диагностики и контроля эффективности лечения послеоперационного воспаления, но не все клиники обладают необходимым оборудованием [33].
Своевременный посев водянистой влаги из передней камеры и биопсия СТ для бактериологического анализа проводятся в обязательном порядке перед началом лечения. Взятые пробы окрашивают методом Грама (экспресс-метод) с последующей идентификацией микроорганизмов и определением их чувствительности к антибиотикам [1, 8].
Дифференциальная диагностика
На основании клинической картины, дополнительных инструментальных и лабораторных методов обследования устанавливают предварительный диагноз острого инфекционного ПЭ. Диагноз инфекционного ПЭ верен, если его инфекционная природа подтверждена результатами бактериологического исследования.
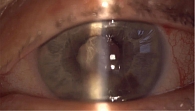
Интраокулярное воспаление, возникающее на первый-второй день после операции, корректнее классифицировать как экссудативно-воспалительную реакцию (ЭВР) глаза [34, 35]. ЭВР глаза от эндофтальмита отличает асептический характер воспаления [21, 34]. До 1990 г. для обозначения этого типа послеоперационного воспаления использовали термины «псевдофакоанафилактический» эндофтальмит, с 1992 г. – «токсический синдром переднего сегмента глаза» [35]. В настоящее время в России чаще применяют термин «ЭВР глаза», а за рубежом – «токсический синдром переднего сегмента» (TASS-синдром, Toxic Anterior Segment Syndrome) [21, 34]. В 1992 г. С.Н. Федоровым и Э.В. Егоровой была предложена классификация ЭВР глаза (рис. 3).
Дифференциальную диагностику предполагаемого диагноза «эндофтальмит» проводят с ЭВР глаза. Одним из важных дифференциальных признаков в пользу ЭВР глаза является раннее начало проявлений – 12–24 часа после операции, отек, отсутствие витреита и ультразвуковой картины, улучшение клинической симптоматики на фоне применения противовоспалительных препаратов.
Послеоперационный псевдогипопион, который может возникать, например, после инъекции триамцинолона или обширной фотокоагуляции сетчатки во время витрэктомии, иногда ошибочно принимают за гипопион при ПЭ [8, 11].
При хронических формах заболевания возможны значительные вариации симптомов и начала заболевания, что затрудняет точную дифференциацию с увеитом заднего отрезка глаза.
Бактериальная нагрузка
Ятрогенный доступ к глазу может привести к бактериальной инокуляции, а следовательно, повышению риска развития внутриглазного заражения. В ряде исследований до 18% игл после интравитреальных инъекций были бактериально контаминированы, ПЭ не развивался [35, 36].
Установлено, что использование больших портов входа в стекловидную полость, например при операциях на открытом небе или травмах, ассоциируется с увеличением риска развития ПЭ [2, 37]. Следовательно, количество бактерий также является важным фактором развития ПЭ.
Лечение
В России пациенты с эндофтальмитом (код по Международной классификации болезней 10-го пересмотра Н40.0, Н40.1) получают лечение в соответствии с требованиями стандартов специализированной медицинской помощи, установленными приказом Минздрава России от 24 декабря 2012 г. № 1451н. Согласно приказу, медицинские препараты, зарегистрированные на территории РФ, назначаются в соответствии с инструкцией к применению и фармакотерапевтической группой, рекомендованной Всемирной организацией здравоохранения. Учитываются также способы введения и применения лекарственных препаратов.
После предварительного диагноза назначается местное и системное антибактериальное и противовоспалительное лечение с использованием гормонов. Однако особенности сосудистой оболочки глаза и наличие гематоофтальмического барьера снижают вероятность достижения необходимой терапевтической концентрации лекарственных средств в очаге воспаления (СТ) при использовании традиционных методов введения [4, 8]. Из-за этого единственно адекватным методом антибактериальной терапии ПЭ остается введение антибиотиков интравитреальным путем [1, 4, 8, 10, 23].
Наиболее эффективным методом лечения ПЭ признана витрэктомия с интравитреальным введением антибиотических препаратов [1, 8]. При выборе антибиотиков необходимо учитывать, чтобы их спектр действия соответствовал возбудителю инфекции, а доза была достаточной для подавления роста микроорганизмов и обеспечения безопасности пациента.
Оптимальными считаются комбинации ванкомицина (0,1 мл или 1 мг) и цефтазидима (0,1 мл или 2–2,25 мг), а также ванкомицина (0,1 мл или 1 мг) и амикацина (0,1 мл или 0,4 мг). Ванкомицин характеризуется бактерицидным эффектом, воздействуя в основном на грамположительные бактерии. Цефтазидим или амикацин активны в отношении грамотрицательных бактерий.
Кроме того, для интравитреального введения используются другие антибиотики: ампициллин (2 мг), амфотерицин В (0,005–0,01 мг), цефазолин (2 мг), цефуроксим (2 мг), клиндамицин (1 мг), эритромицин (0,5 мг), гентамицин (0,2 мг), метициллин (2 мг), миконазол (0,005–0,01 мг), моксифлоксацин (0,05–0,16 мг), оксациллин (0,5 мг), вориконазол (0,1 мг) [1, 8, 38–40].
Несмотря на разнообразие антибактериальных препаратов и их комбинаций, универсального сочетания, перекрывающего весь спектр потенциальных возбудителей заболевания, нет [1, 8].
Рекомендуемые дозы антибиотиков стандартные и не учитывают особенности глазного яблока или предыдущих вмешательств [38, 39]. Однако данные литературы указывают, что доза антибиотиков в разных случаях варьируется. Например, эксперименты на кроликах показали, что при интравитреальных инъекциях цефазолина в глаза без хрусталика или СТ скорость его выведения в два раза быстрее, чем при инъекциях в глаза с сохраненными хрусталиком и СТ [41].
Концентрация ванкомицина 1 мг в 0,1 мл 0,9%-ного раствора натрия хлорида может быть недостаточной при лечении эндофтальмита у пациентов с выраженной осевой миопией, поскольку концентрация антибиотика способна снижаться из-за разбавления его в большем объеме жидкости [38, 39]. Несмотря на это, в инструкциях по применению ванкомицина и цефтазидима, широко применяемых при эндофтальмите, нет указаний по их интраокулярному введению (в переднюю камеру или интравитреально).
В соответствии со стандартом оказания специализированной помощи, при ПЭ может быть предусмотрено интравитреальное введение лекарственных препаратов (код медицинской услуги – А16.26.086). Однако следует отметить, что в России отсутствует антибактериальное средство, в инструкции к применению которого предусмотрено интравитреальное введение при ПЭ. Таким образом, интравитреальное введение антибиотиков при остром ПЭ выполняется off-label.
Применение тампонирующего вещества, такого как силиконовое масло или перфторорганическое соединение, для заполнения витреальной полости после витрэктомии уменьшает риск рецидива воспаления в авитреальном глазе при ПЭ. Однако следует отметить, что такой подход не обеспечивает бактерицидного эффекта в очаге воспаления – ключевого принципа лечения инфекционного послеоперационного воспаления.
Факторы риска и профилактика
ПЭ после факоэмульсификации катаракты связан с использованием техники туннельного бесшовного разреза роговицы, что не исключает проникновения слезы в переднюю камеру глаза в раннем послеоперационном периоде. Исследование ESCRS показало, что у пациентов с роговичным доступом вероятность развития ПЭ в 5,88 раза ниже, чем у пациентов с корнеосклеральным доступом [8, 24].
Использование роговичного шва на разрезе значительно снижает риск развития ПЭ [8]. Национальный реестр Швеции также подтверждает, что тщательно выполненный ступенчатый разрез роговицы ассоциируется с меньшей вероятностью развития ПЭ [42].
В исследовании Европейского общества катарактальных и рефракционных хирургов имплантация силиконовых интраокулярных линз (ИОЛ) повышала риск развития ПЭ в 3,13 раза по сравнению с имплантацией линз из акрила или других материалов [8, 24, 42]. На поверхности силиконовых ИОЛ может образовываться бактериальная прослойка, способствующая прикреплению возбудителей ПЭ. Однако некоторые исследователи приводят противоположные результаты сравнения акриловых и силиконовых ИОЛ [8]. Значение также имеет материал, используемый для гаптических элементов линзы. В случае применения линз с полипропиленовым гаптическим элементом частота ПЭ повышается из-за склонности стафилококков к адгезии на полипропиленах.
Имеются данные о том, что имплантация ИОЛ с помощью пинцета – фактор, повышающий риск развития ПЭ. Однако в настоящее время эти данные статистически не подтверждены [8]. Сказанное относится к таким факторам, как наличие или отсутствие у пациентов сопутствующей патологии, иммуносупрессии и сахарного диабета, использование одноразового оборудования, амбулаторная хирургия катаракты [8, 24].
Интраоперационные осложнения, например разрывы задней капсулы хрусталика, существенно увеличивают риск развития ПЭ. Ранее считалось, что в подобных случаях воспалительные осложнения возникают в 14–17 раз чаще. Тем не менее, согласно результатам исследования ESCRS, риск увеличивается всего в 4,95 раза [8, 11]. В шведском исследовании этот показатель составил 3,65 [8, 42].
Интракамеральное введение антибиотиков снижает риск развития ПЭ в 4,92 раза [8, 43]. Введение 1 мг антибиотика в переднюю камеру создает концентрацию 3300 мкг/мл, что превышает концентрацию при субконъюнктивальном введении в 100 раз [8]. Вместе с тем не все хирурги применяют данную профилактическую процедуру: в Европе этим методом пользуются 74% опрошенных хирургов, в Великобритании – 55%, в США – 22% [8, 24]. Основной причиной отказа от интракамерального введения антибиотиков является отсутствие подходящего лекарственного препарата в продаже. Как показали данные опроса, 80,3% хирургов для профилактического интракамерального введения используют цефуроксим, 12,9% – ванкомицин, 6,8% – моксифлоксацин [8]. Вопрос предоперационной антибактериальной профилактики остается дискутабельным. Современные литературные источники указывают на отсутствие достоверных данных о снижении вероятности ПЭ при использовании антибиотиков в каплях до операции [8, 24, 43].
Следует учитывать, что в ряде случаев на фоне применения антибактериальных капель не только не снижается вероятность послеоперационных воспалительных осложнений, но и индуцируется развитие бактериальной резистентности [8].
Профилактические мероприятия в ходе операции включают обеспечение асептики и антисептики, использование одноразовых инструментов, а также антибактериальных препаратов в форме инстилляций, субконъюнктивальных инъекций или интракамерального введения в конце операции [1, 8, 24, 29].
Показано, что наиболее важным профилактическим мероприятием является предоперационная обработка глаз 5%-ным раствором повидон-йода. Это позволяет подавлять до 90% микрофлоры на поверхности глаза и существенно снижать риск развития ПЭ [1, 8]. Поскольку собственная микрофлора глазной поверхности является основной причиной развития ПЭ [44], важна предоперационная обработка [1, 8].
Для предотвращения развития ПЭ применяется постоперационная профилактика, которая включает использование антибиотиков в конце операции и в послеоперационном периоде в форме инстилляций или субконъюнктивальных инъекций. Для сравнения: использование капель с цефуроксимом в терапевтической дозе (50 мг/мл) создает концентрацию препарата во внутриглазной жидкости 0,18–2,16 мкг/мл, а субконъюнктивальное введение 125 мг антибиотика создает пиковую концентрацию 20–33 мкг/мл [8].
Эндофтальмит после интравитреального введения
Частота использования интравитреальных инъекций стремительно растет. Если до начала нового тысячелетия в США ежегодно выполнялось менее 3000 таких инъекций, то в 2016 г. – свыше 3 млн. Ожидается дальнейший рост этого показателя [45, 46]. Однако интравитреальные инъекции не рассматриваются всеми зарубежными авторами и специалистами в области витреоретинальной хирургии как операции. Поэтому в англоязычных странах для обозначения эндофтальмита, развившегося после интравитреальных инъекций, используется термин «постинъекционный эндофтальмит».
В России в отличие от ряда зарубежных стран интравитреальные инъекции считаются хирургическими процедурами, требующими операционной подготовки и условий. Заболеваемость после интравитреальных инъекций варьируется в широких пределах. Согласно данным исследований, ПЭ составляет от 0,095% [47, 48] (приблизительно один случай на 1000 инъекций) до 0,0053% [49, 50] (приблизительно один случай на 20 тыс. инъекций). Такие различия в частоте, вероятно, зависят от хирургического протокола, в том числе методов предоперационной дезинфекции, а также возможных ошибок включения ложноотрицательных бактериальных культур или неконтагиозных воспалительных реакций.
В большинстве крупных исследований сообщается о частоте инфицирования – один случай на 2000 интравитреальных инъекций [18]. Факторы риска, которые способствуют развитию инфекции, в основном связаны с хирургическим протоколом. Использование хирургических масок и стерильных одноразовых перчаток во время процедуры стало стандартной практикой во всем мире. Кроме того, периоперационная гигиена как для пациента, так и для хирурга рассматривается как фактор риска [51].
В исследовании, в котором было изучено 47 случаев ПЭ у пациентов с возрастной макулярной дегенерацией (ВМД), блефарит повышал риск инфицирования практически в 20 раз. Сдавливание или смещение век во время инъекции также ассоциировалось с увеличением риска развития ПЭ [52].
Ретроспективный анализ свидетельствует о том, что использование повидон-йода после наложения векорасширителя снижает частоту развития ПЭ примерно в семь раз [53]. Для предотвращения контакта века с местом инъекции целесообразно использовать повидон-йод после снятия векорасширителя, что может значительно повысить безопасность интравитреальных инъекций.
Частота ПЭ также зависит от показаний для операции [54]. В исследовании у пациентов, которые получали лечение по поводу макулярного отека после окклюзии ретинальной вены, риск ПЭ был ниже по сравнению с пациентами, которые страдали диабетическим макулярным отеком или неоваскулярной формой ВМД. Возможно, это объясняется сниженным иммунитетом у пациентов с диабетом и ослабленным иммунитетом у пациентов с неоваскулярной формой ВМД, особенно пожилого возраста. Однако результаты исследований зависимости частоты ПЭ от используемого препарата противоречивы. В исследованиях, в которых сравнивали различные ингибиторы сосудистого эндотелиального фактора роста, не обнаружено разницы в показателях ПЭ [55]. В то же время в ряде исследований использование шприцев (например, ранибизумаб) ассоциировалось со снижением риска ПЭ [50]. Однако можно предположить, что использование шприцев с бевацизумабом, заполненных в стерильных условиях сертифицированных аптек, не повышает риск развития ПЭ [56].
Пациентам, нуждающимся в лечении ингибиторами VEGF обоих глаз, необходимы двусторонние инъекции. Показано, что двусторонние инъекции в один и тот же день, увеличивающие нагрузку на систему здравоохранения и позволяющие сэкономить время пациентам, не являются независимым фактором риска развития ПЭ и считаются относительно безопасными.
Факторы риска развития ПЭ остаются предметом изучения [57–59]. Однако важно рассматривать оба глаза как независимые единицы, когда речь идет о дезинфекции и подготовке к операции. Применение антимикробных глазных капель перед операцией неактуально, поскольку не снижает частоту инфицирования, а иногда способствует развитию антибиотикорезистентности [46, 60].
В исследовании сравнивали сроки возникновения эндофтальмита после операции по удалению катаракты и после интравитреального введения (ИВВ) лекарственных препаратов [61]. Исследователи пришли к выводу, что ПЭ после ИВВ возникает раньше, чем после операции по удалению катаракты, и характеризуется различным спектром возбудителей и менее благоприятным исходом лечения. Правда, эти результаты не были подтверждены в других исследованиях. Протокол исследования вызвал критику, особенно в отношении отсутствия рассмотрения профилактических мер [62].
Эндофтальмит после хирургии катаракты
Операция по удалению катаракты является наиболее распространенной внутриглазной процедурой в мире. С внедрением техник факоэмульсификации и микроразрезов частота возникновения ПЭ снизилась. В крупных исследованиях, проведенных в разных странах с 2000 г., частота ПЭ после операции по удалению катаракты варьировалась в диапазоне 0,012–1,3%, что частично объяснялось разным дизайном исследований [63]. Анализ результатов более ранних исследований показал снижение частоты ПЭ с 0,327% в 1970-х гг. до 0,158% в 1980-х гг. и 0,087% в 1990-х гг. [64]. Это снижение может быть обусловлено техническим усовершенствованием операционной техники, в частности более мелкими разрезами. Введение интракамеральной антибиотикопрофилактики в конце операции, вероятно, положительно влияет на частоту возникновения ПЭ.
В моноцентрическом анализе показано снижение частоты ПЭ с 0,18 до 0,07% [65]. В многоцентровом исследовании, проведенном в Индии и включавшем свыше 600 000 операций, использование интракамеральной антибиотикопрофилактики снизило заболеваемость в 3,5 раза [66].
Ретроспективный обзор, проведенный в США и включавший около 315 000 операций, подтвердил, что интракамеральная антибиотикотерапия эффективнее местной терапии [67].
Авторы статьи, опубликованной в журнале Ophthalmology в 2016 г., рекомендовали использовать интракамеральную антибиотикотерапию. Однако в США до сих пор нет препарата, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для интракамерального применения. Важным аспектом остается резистентность к антибиотикам, особенно к ванкомицину, который не рекомендуется применять профилактически. В целом тема резистентности остается дискуссионной. Предполагают, что устойчивые к цефуроксиму патогены легче размножаются после стандартной терапии цефуроксимом, что приводит к более агрессивному развитию инфекции [68, 69].
Некоторые исследователи выявили повышенный риск заднего капсульного разрыва, особенно при потере СТ в результате передней витрэктомии [70].
Как показал анализ данных шведского регистра катаракт, возраст старше 85 лет – дополнительный фактор риска развития послеоперационного ПЭ помимо интраоперационных осложнений и отсутствия интракамеральной антибиотикопрофилактики [68].
Исследователи выделили разрыв задней капсулы, наличие сопутствующих глазных заболеваний и факоэмульсификацию через склеральный подход с имплантацией складчатой линзы в качестве независимых факторов риска [68].
Не исключено, что тип разреза играет значительную роль в риске развития ПЭ, но единого мнения на этот счет нет. Например, показано, что частота ПЭ после экстракции катаракты с разрезом на роговице составляет 0,189%, в то время как после склерального разреза – 0,074%, лимбального – 0,062%. В исследовании свыше 30 000 операций по удалению катаракты не подтвердилось наличия таких факторов риска, как доступ через роговицу или наличие системных заболеваний, в частности сахарного диабета.
Эндофтальмит после витрэктомии
На протяжении многих лет в ряде исследований описывались случаи ПЭ после витрэктомии. Частота ПЭ при использовании 20G-системы относительно низкая – от 0,03 до 0,14% [71–79]. Однако некоторые авторы сообщают о более высокой частоте – до 1,55% [80–82]. Данные о влиянии типа и способа склеротомии на возникновение ПЭ также противоречивы [79, 83–88]. Послеоперационная гипотония может способствовать проникновению микроорганизмов через склеротомию в витреальную полость [89–91]. В исследовании 2010 г. продемонстрированы преимущества шовной и бесшовной склеротомии с точки зрения заживления раны [92]. При аутопсийном исследовании витрэктомированных глаз обнаружена инкаркация (вставление в склеру) СТ в местах, где расположены порты [93, 94]. В контексте витрэктомии инкаркация СТ означает, что его небольшие фрагменты могут оставаться внутри глаза после операции, особенно склеротомии.
В случае бесшовной склеротомии микроорганизмы, прикрепленные к нити СТ, могут проходить через негерметичную склеротомную рану и попадать внутрь глазной полости [80, 86, 95].
Существует гипотеза, что газовая тампонада в силу поверхностного натяжения обеспечивает лучшую целостность раны в местах склеротомии по сравнению со сбалансированным раствором солей [80, 86]. Более высокое поверхностное натяжение воздуха, газа и силиконового масла способно предотвратить утечку жидкости через склеротомию [96]. Считается, что эндотампонады не способствуют такому же росту бактерий, как сбалансированный раствор солей.
Обсуждается значение системных факторов. Исследователи, описывающие ПЭ после витрэктомии, отмечают, что значительная часть пациентов имеет в анамнезе сахарный диабет 2-го типа [71, 73, 80, 83, 97].
Теоретически между сахарным диабетом и повышенным риском развития ПЭ после витрэктомии может быть связь в силу относительного иммунологического компромисса. Кроме того, наличие пролиферативной диабетической ретинопатии и осложнений, таких как тракционная отслойка сетчатки, увеличивает продолжительность хирургического вмешательства. Указанные процедуры могут включать многократное введение и извлечение инструментов и часто сочетаются с операцией по удалению катаракты, что увеличивает риск развития ПЭ.
Эндофтальмит после хирургии глаукомы
Глаукомные операции, такие как трабекулэктомия или имплантация дренажных систем, связаны с повышенным риском развития ПЭ. U. Ticho и A. Ophir в исследовании 1993 г. отмечали развитие ПЭ в 3,8% случаев [98]. В более позднем (2013) крупном исследовании (CIGTS) [17] пятилетний риск развития ПЭ после трабекулэктомии составил 1,1%. J.A. Olayanju и соавт. отмечали 5%-ный долгосрочный риск в течение 20-летнего наблюдения [99].
Повторное применение антифибротических препаратов, таких как митомицин-С или 5-фторурацил, теоретически способно увеличить частоту инфекций, поскольку при повышении их дозы уменьшается толщина стенки склеры [100], что может привести к учащению феномена Зейделя. Это в свою очередь повышает риск развития ПЭ, что сопровождается плохим прогнозом.
Кроме того, глаукомные операции с использованием аваскулярных фильтрующих подушек связаны с повышенным риском инфицирования [25].
Еще один фактор, увеличивающий риск инфильтрации, – местонахождение фильтрационной подушки. Фильтрующие подушки, расположенные ближе к нижнему отделу, имеют более высокий риск инфицирования, возможно из-за контакта с потенциально бактерицидной слезной пленкой [101, 102]. Не случайно в настоящее время большинство операций по трабекулэктомии проводятся сверху. Блефарит также считается фактором риска, особенно после трабекулэктомии, поскольку способствует инфицированию слезной пленки [103]. После имплантации глаукомной дренажной системы ПЭ встречается реже, чем после трабекулэктомии, и его развитие скорее всего связано с эрозией трубки [104]. По данным одних авторов, частота встречаемости ПЭ после глаукомной хирургии составляет 1,73% [105], по данным других – 0,7% [106]. Дополнительным фактором риска служат ревизионные процедуры [104].
Эндофтальмит после кератопластики
Принимая во внимание риск развития ПЭ после кератопластики, целесообразно учитывать различия в зависимости от типа выполненной процедуры. Частота возникновения ПЭ после сквозной кератопластики (CK) отличается от частоты после послойных методик. Согласно данным литературы, частота ПЭ после CK колеблется в диапазоне 0,08–1,05% [107–111]. Однако систематический обзор показал изменение частоты острой формы ПЭ за последние десятилетия – с 0,142% в 1970-х гг., 0,376% в 1980-х гг., 0,453% в 1990-х гг. до 0,2% в 2000-х гг. [112]. Это можно объяснить тем, что послойные методики стали предпочтительными вмешательствами, в то время как CK выполняется только в более сложных случаях, когда риск развития ПЭ выше. По данным D.S. Borkar и соавт., передняя витрэктомия при CK связана с восьмикратным увеличением риска развития ПЭ [113].
В последние годы стали популярны ламеллярные операции, включая DMEK (эндотелиальная кератопластика десцеметовой мембраной), имеющие значительные преимущества в лечении эндотелий-ассоциированных заболеваний. В сравнительном исследовании с участием 3069 пациентов продемонстрировано, что риск развития ПЭ после послойных процедур ниже, чем после проникающей кератопластики (0,2 против 0,7%; p = 0,01) [111]. Однако необходимо учитывать исходный диагноз, на основании которого было принято решение о виде кератопластики. Например, после герпетического кератита с рубцами в строме эндотелиальные операции могут быть связаны с сопутствующими глазными заболеваниями, такими как лимбальная недостаточность стволовых клеток или нейротрофическая кератопатия. Нейротрофическая кератопатия ассоциируется с повышенным риском инфицирования [111, 113].
Посттравматический инфекционный эндофтальмит
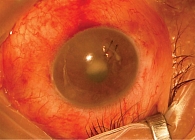
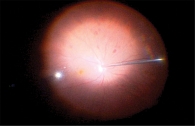
Посттравматический инфекционный эндофтальмит (ПИЭ) – редкое, но серьезное осложнение глазной травмы. Патогены, вызывающие ПИЭ, отличаются от возбудителей других типов эндофтальмита, в связи с чем данное состояние требует отдельного изучения. ПИЭ может быть обусловлен различными факторами, в том числе типом травмы и микроорганизмами, вовлеченными в процесс, а также наличием/отсутствием внутриглазного инородного тела. Изучение этих факторов имеет значение для понимания прогноза и выбора оптимальных стратегий лечения ПИЭ. ПИЭ, вызванный открытой травмой глаза, особенно проникающей раной, составляет около 25–30% всех случаев этого заболевания. Основными возбудителями ПИЭ являются грамотрицательные бактерии, что негативно отражается на лечении (рис. 4). ПИЭ встречается в десять раз чаще, чем послеоперационный эндофтальмит. Кроме того, дополнительные повреждения структур глазного яблока, обусловленные ПИЭ, негативно влияют на результаты лечения [114].
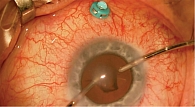
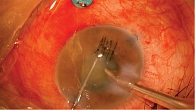
В ходе хирургического лечения, если герметичности склеры и роговицы недостаточно, накладывают дополнительные швы. Далее проводят факоэмульсификацию катаракты без имплантации (рис. 5). Затем устанавливают три порта 25G в 3,5 мм от лимба и проводят витрэктомию (рис. 6). После витрэктомии центральных и периферических отделов выполняют дренирование с переходом на воздушную смесь (рис. 7).
Выводы
Послеоперационный эндофтальмит – серьезное осложнение, возникающее на 3–7-е сутки после офтальмохирургического вмешательства или в раннем послеоперационном периоде в результате контаминации бактериями. На фоне сильного воспалительного ответа и активной иммунной реакции выделяется экссудат в передней части глаза, в полость СТ проникают лимфоциты и макрофаги. Наиболее распространенными возбудителями острого ПЭ являются коагулазоотрицательные стафилококки, особенно S. epidermidis (33–77%), а также грамотрицательные бактерии (6–22%).
Ситуации в офтальмохирургии, связанные с развитием ПЭ, требуют немедленного оперативного вмешательства. Решение о хирургическом лечении должно приниматься в течение нескольких часов после установления диагноза, поскольку раннее оперативное вмешательство позволяет достигать лучших результатов остроты зрения в послеоперационном периоде.
Согласно рекомендациям ESCRS (2013) и EVRS (2017) по лечению эндофтальмита, золотым стандартом признано проведение витрэктомии (в течение 24–48 часов) с интравитреальным введением антибиотиков. Введение антибиотиков без витрэктомии рассматривается как альтернатива и используется, когда выполнение витрэктомии невозможно.
Главными возбудителями посттравматического эндофтальмита являются грамотрицательные бактерии. Посттравматический эндофтальмит встречается в десять раз чаще, чем послеоперационный. Своевременное хирургическое лечение обеспечивает функциональный результат.
Заключение
Несмотря на предпринимаемые профилактические меры, ПЭ невозможно полностью исключить. Перед любым хирургическим вмешательством, в том числе интравитреальными инъекциями, важно информировать пациентов о признаках ПЭ и неотложности обращения к офтальмологу. Быстрая диагностика и оперативное лечение эндофтальмита независимо от его этиологии – залог успеха.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Авторы не получали финансирования при проведении исследования и написании статьи.
S.A. Abakarov, Ye.N. Kuznetsov, I.A. Loskutov, PhD
M.F. Vladimirsky Moscow Regional Research Clinical Institute
Contact person: Sapiyulla A. Abakarov, Boss@limesmedia.ru
Endophthalmitis is a serious complication requiring immediate intervention by ophthalmologists. Despite the availability of a wide range of antibacterial drugs and improved methods of preventing infectious complications before, during, and after surgery and after ocular trauma, endophthalmitis remains a pressing problem in ophthalmic surgery.
The article presents modern ideas about postoperative endophthalmitis (PE), including the frequency of development, etiological causes and treatment methods. The standards of surgical treatment of PE are described, including methods and modifications of surgical intervention. In addition, the possibilities of intravitreal use of antibacterial drugs when injected into the vitreous cavity, as well as when using silicone oil and organofluorine compounds for tamponade of the vitreous cavity are considered.
Were analyzed the 114 most cited articles related to postoperative and posttraumatic. A global literature search was carried out in the PubMed and eLibrary databases. Peer-reviewed articles in the field of ophthalmology were selected based on the keyword ‘postoperative endophthalmitis’.
The most cited articles on PE present the classification, frequency of occurrence, etiology of the disease, pathogenesis, features of the clinic and diagnosis, issues of differential diagnosis and treatment, risk factors, prevention methods, features of PE after surgical treatment of cataracts, glaucoma, vitrectomy, keratoplasty, intravitreal drug administration.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.