Применение Актовегина у больных с гнойно-некротическими осложнениями синдрома диабетической стопы
- Аннотация
- Статья
- Ссылки
В статье представлены результаты оценки эффективности препарата Актовегин в составе комплексной терапии у пациентов с синдромом диабетической стопы (СДС), подвергнутых хирургическому лечению. Изучено влияние Актовегина на микроциркуляторный кровоток у этой категории больных в послеоперационном периоде.
Основную группу больных, лечение которых дополнялось внутривенным введением Актовегина, составили 255 пациентов; контрольная группа включила 170 пациентов, получавших стандартную терапию. Показано, что хирургическое лечение пациентов с гнойно-некротическими поражениями нижних конечностей на фоне сахарного диабета 2 типа в сочетании с применением препарата Актовегин позволяет стабилизировать течение раневого процесса и нормализовать сроки всех его фаз.
Применение препарата Актовегин в комплексном лечении больных с различными формами СДС позволяет достоверно улучшить уровень микроциркуляции по данным определения транскутанного напряжения кислорода.
В статье представлены результаты оценки эффективности препарата Актовегин в составе комплексной терапии у пациентов с синдромом диабетической стопы (СДС), подвергнутых хирургическому лечению. Изучено влияние Актовегина на микроциркуляторный кровоток у этой категории больных в послеоперационном периоде.
Основную группу больных, лечение которых дополнялось внутривенным введением Актовегина, составили 255 пациентов; контрольная группа включила 170 пациентов, получавших стандартную терапию. Показано, что хирургическое лечение пациентов с гнойно-некротическими поражениями нижних конечностей на фоне сахарного диабета 2 типа в сочетании с применением препарата Актовегин позволяет стабилизировать течение раневого процесса и нормализовать сроки всех его фаз.
Применение препарата Актовегин в комплексном лечении больных с различными формами СДС позволяет достоверно улучшить уровень микроциркуляции по данным определения транскутанного напряжения кислорода.

Введение
По данным Всемирной организации здравоохранения (ВОЗ), в 2011 г. число больных сахарным диабетом (СД) в мире составило 360 млн человек. Повсеместно наблюдается тенденция роста количества больных с синдромом диабетической стопы (СДС), доля которых составляет 4–10% в России и 3–8% в США от числа всех больных СД. Развитие СДС приводит к ранней инвалидизации и летальности. Несмотря на успехи развития современной медицины, по-прежнему 50–70% всех ампутаций нижних конечностей выполняется у больных СД, лишь 10–15% пациентов после высоких ампутаций сохраняют подвижность и активность в пределах собственного дома. Летальность от гнойных осложнений при СДС составляет от 6 до 22% [1, 2, 3].
Гнойные осложнения СДС включают в себя: гнойно-некротические раны, флегмоны подошвенных пространств, гнойные остеоартриты, сухие и влажные гангрены пальцев, дистальных и проксимальных отделов стопы. Общепринятым лечением является оперативное вмешательство в области поражения, в частности вскрытие флегмон, вскрытие и ревизия подошвенных пространств стопы, ампутации пальцев, малые ампутации стопы. Патогенез СДС включает типичные для диабета микро- и макроангиопатию, остео- и нейропатию, на фоне которых при присоединении инфекции развив аются гнойно-некротические поражения нижних конечностей, требующие оперативного вмешательства.
В большинстве случаев центральную роль в развитии СДС играют нейропатия (70–80%), ишемия (5–12%), деформация стопы (63%). Трофические изменения являются следствием процесса адаптационной перестройки эндокринно-метаболического статуса в сторону дезадаптации, прежде всего – повышения симпатоадреналовой и глюкокортикоидной активности углеводного и липидного обменов, угнетения естественной резистентности организма и различных дефектов иммунного ответа [4, 5].
По данным современной литературы, нейропатия является пусковым механизмом в формировании симптомокомплекса диабетической стопы. В основе развития диабетической нейропатии лежит метаболический механизм, который заключается в активации так называемого полиолового шунта, вследствие чего повышается синтез сорбитола из глюкозы под действием фермента альдозоредуктазы в леммоцитах. Из сорбитола под влиянием сорбитолдегидрогеназы образуется фруктоза. Активность альдозоредуктазы не зависит от инсулина и не насыщается при гипергликемии. В норме до 1–2% внутриклеточной глюкозы превращается в сорбитол, в то время как в условиях гипергликемии конвертация возрастает в 7–10 раз. Гипергликемия ведет к снижению активности протеинкиназы С (ПК-С), участвующей в синтезе эндотелийрелаксирующего фактора, и ингибирует образование эндогенного оксида азота.
Таким образом, страдает интраневральный кровоток, возникает состояние хронической ишемии нерва и снижение скорости проведения афферентных и эфферентных импульсов по нервным волокнам [6, 7]. Данным механизмом определяются первые функциональные расстройства периферической нервной системы в ответ на гипергликемию – хроническая симметричная прогрессирующая периферическая нейропатия, проявляющаяся сенсорными, моторными и автономными нарушениями. Сенсорная нейропатия приводит к снижению болевой, тактильной, термической, вибрационной и проприорецептивной чувствительности [4, 5, 7]. Дегенеративные изменения в двигательных нервах приводят к атрофии мышц и дисбалансу между сгибательными и разгибательными мышцами стопы, результатом чего является опускание свода стопы, «клювовидная» деформация пальцев и выступание головок метатарзальных костей [8, 9].
Периферическая и автономная нервная система, в свою очередь, определяют состояние микроциркуляции и осуществляют ее регуляцию. Факторами, способствующими развитию диабетической микроангиопатии, являются генетическая предрасположенность, длительность СД, гипергликемия, гипертриглицеридемия, гиперхолестеринемия и гипертония [8, 9, 10]. Патофизиологической основой поражения сосудов при СД являются повреждения эндотелия и субэндотелия. Важным патогенетическим звеном в развитии диабетической микро- и макроангиопатии являются гликозилирование и полиоловый путь окисления глюкозы [11, 12]. В результате этих процессов в просвете сосудов происходит перекрестное связывание белков плазмы с матричными белками (в том числе с коллагеновыми) стенки сосудов посредством конечных продуктов выраженного гликозилирования.
Избыточное накопление продуктов сдвигает равновесие гемостаза в сторону гиперкоагуляции и усиливает пролиферацию клеток сосудистой интимы и адвентиции. Поражение микрососудистого русла при диабете сочетается с изменением гемореологических свойств крови: изменением вязкости крови, гиперфибриногенемией, гиперагрегацией тромбоцитов и эритроцитов [6, 13]. Нарушение микроциркуляции обусловливает возникновение гипоксии тканей, что в сочетании с хронической гипергликемией способствует утолщению базальной мембраны капилляров, изменению ее проницаемости и, следовательно, ведет к развитию микроангиопатии [7, 10, 13, 14]. Структурные и функциональные изменения микрососудов, нарушение их проницаемости, изменение числа функционирующих капилляров, а также изменение агрегатного состояния крови, развивающиеся при диабетической микроангиопатии, ведут к изменению перфузии микроциркуляторного русла кровью. Одними из ранних признаков нарушения микроциркуляции являются локальный спазм артериолярных и расширение венулярных сосудов, замедление скорости капиллярного кровотока и появление пристеночной адгезии лейкоцитов.
Совокупность расстройств всех компонентов системы микроциркуляции, включая ишемическое поражение тканей и нарушение метаболизма клеток, ведет к полной декомпенсации микроциркуляции, развитию стаза и выключению локусов микроциркуляторного русла, развитию глубоких трофических нарушений в тканях и появлению трофических язв [15]. При развитии нарушений микроциркуляции особенно важна сохранность механизма селективного распределения потоков крови между сетью нутритивных микрососудов и путями шунтирующего кровотока [16]. Снижение интенсивности капиллярного кровотока приводит к нарастающей гипоксии тканей, следовательно, в первую очередь страдает нутритивная часть системы микроциркуляции, которая непосредственно обслуживает специфический обмен веществ в клеточном (паренхиматозном) компартменте. При возникновении у больных СД локального очага нарушения микроциркуляции обычно возникает порочный круг, усугубляющий развитие патологического процесса [17].
Трофические изменения в тканях при СД обусловлены нарушением морфологического состояния и нейрорегуляции микрососудистого русла, то есть возникновением микроангиопатии, последствия которой реализуются через два основных патогенетических механизма. При первом градиент гидростатического давления капиллярной сети определяется балансом между пре- и посткапиллярами, прекапилляры находятся под нейрогенным контролем, потеря которого ведет к сужению прекапилляров и нарушению гидростатического давления. Это, в свою очередь, ведет к нарушению фильтрации жидкости и питательных веществ. При втором механизме автономная нейропатия ведет к паралитическому расширению шунтов между артериолами и венулами и значительному повышению кровотока в них.
Артериоло-венозные шунты особенно хорошо развиты на нижних конечностях. Они проходят параллельно микроциркуляторной сети, но никак не влияют на тканевое жизнеобеспечение. При повышении кровотока в них происходит сброс артериализированной крови, богатой кислородом, в венозную систему, минуя капиллярную сеть. Таким образом, уменьшается объем циркулирующей крови в микроциркуляторном русле, и поэтому у больных периферической нейропатией обнаруживается сравнительно высокое парциальное давление кислорода в венозной крови.
В лечении больных с гнойно-некротическими поражениями нижних конечностей первостепенное значение должно придаваться коррекции гипергликемии [17, 18]. С учетом распространенности поражений магистральных сосудов нижних конечностей у больных СД 2 типа на первый план выходит проблема фармакологической коррекции ишемии и тканевой гипоксии, а именно: применение препаратов, активизирующих метаболизм в тканях, улучшающих их трофику и стимулирующих процессы регенерации. К числу таких лекарственных средств относится Актовегин – высокоочищенный гемодиализат крови телят, получаемый методом ультрафильтрации.
Препарат содержит физиологические компоненты, обладающие высокой биологической активностью: аминокислоты, олигопептиды, нуклеозиды, электролиты. Механизм действия Актовегина заключается в улучшении аэробного обмена за счет повышения поступления в ткани кислорода и глюкозы и их утилизации. Это ведет к стимуляции образования аденозинтрифосфата, нормализации энергетического метаболизма в условиях его недостаточности, улучшению обмена веществ и функционирования клеток [17, 19]. Активные компоненты препарата оказывают также инсулиноподобное действие. Накопленный опыт применения Актовегина у лиц, страдающих СД, свидетельствует, что на фоне его использования существенно замедляется прогрессирование диабетической ангио- и полинейропатии. В связи с вышеизложенным нами было проведено исследование Актовегина с целью определения эффективности препарата у пациентов с СДС, подвергнутых хирургическому вмешательству.
Материал и методы
Проведен ретроспективный анализ результатов комплексного лечения 425 пациентов с гнойно-некротическими осложнениями СДС, находившихся на лечении в отделении гнойной хирургии МБУЗ «Видновская районная клиническая больница» в период с 2007 по 2012 г.; оценивалось влияние препарата Актовегин на микроциркуляторный кровоток у этой категории больных в послеоперационном периоде. Препарат вводился внутривенно капельно в дозе 2 г в сутки в виде 10- или 20%-ного раствора в течение 10–20 дней, затем переходили на пероральный прием Актовегина в дозе 1–2 таблетки (200–400 мг) 3 раза в сутки в течение 1–1,5 месяцев. Основную группу составили 255 пациентов, лечение которых дополнялось внутривенным введением Актовегина. В контрольную группу были включены 170 пациентов со сходным течением СД, находившихся в том же отделении, в тот же период времени, получавших стандартную терапию без использования Актовегина.
В обеих исследуемых группах длительность заболевания СД составила более 10 лет, средний возраст больных основной и контрольной групп составил 56,5 ± 9,2 и 58,3 ± 7,7 года соответственно. При поступлении в стационар у 73,1% пациентов основной и у 58,5% больных контрольной групп отмечена декомпенсация СД, течение заболевания расценивалось как тяжелое. Пациенты обеих групп имели сочетание поздних осложнений СД и сопутствующих заболеваний, в основном преобладали ишемическая болезнь сердца (67,3% в основной и 62,4% в контрольной группах), постинфарктный кардиосклероз (36,8 и 37,2% соответственно), артериальная гипертония 3-й степени (59,9 и 61,3% соответственно). Пациенты обеих групп имели различные формы гнойно-некротических поражений стопы, а именно: гангрены, гнойно-некротические раны, флегмоны и их сочетания, при этом поражения захватывали несколько анатомических образований стопы. Всем больным было проведено хирургическое лечение в объеме малых операций на стопе (некрэктомия, вскрытие флегмон подошвенных пространств, передняя резекция стопы с фасциотомией и тендэктомией, ампутации пальцев).
При выборе тактики лечения и объема хирургического вмешательства важную роль играла форма СДС. При обследовании выявлено, что в обеих группах преобладали больные с нейропатической формой СДС: 40,4% – в основной и 43,5% – в контрольной группах. Хирургическое лечение пациентов с гнойно-некротическими поражениями стопы было направлено на купирование гнойно-воспалительного процесса и сохранение опорной функции конечности. Стандартное консервативное лечение включало проведение интенсивной инсулинотерапии, антибактериальной терапии, введение низкомолекулярных гепаринов, разгрузку пораженной конечности; местно применялись перевязочные средства. Больные были обследованы до начала курса лечения и после его завершения. Показателем, свидетельствующим о нарушении трофики тканей у больных СДС с гнойно-некротическими поражениями стопы, является уровень транскутанного напряжения кислорода (ТсрО2). Для проведения транскутанной полярографии использовался монитор ТСМ-400 фирмы Radiometer (Дания).
Результаты и их обсуждение
Большинство больных с гнойно-некротическими осложнениями СДС были оперированы в первые 3 суток с момента поступления в стационар (58,3 и 59,8% в основной и контрольной группах соответственно). Наиболее часто больным проводили следующие оперативные вмешательства: ампутации пальцев (27,6% в основной и 29,7% в контрольной группах), трансметатарзальные резекции стопы (26,2% в основной и 28,9% в контрольной группах) и некрэктомии (19,3% в основной и 24,1% в контрольной группах) в сочетании с фасциотомией и тендэктомией (34,3% в основной и 37,4% в контрольной группах).
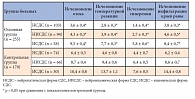
Клиническую эффективность проводимого послеоперационного лечения ран у больных с СДС оценивали по следующим параметрам: уменьшение отека в области послеоперационной раны, температурная реакция, гиперемия окружающих тканей, инфильтрация краев раны (табл. 1). Данные таблицы 1 демонстрируют, что применение в послеоперационном периоде Актовегина способствует вне зависимости от формы СДС более быстрому исчезновению отека стопы (3–9-е сутки в основной группе, 6–10-е – в контрольной), уменьшению локальной гиперемии стопы (1–5-е сутки в основной группе, 4–7-е – в контрольной), исчезновению инфильтрации краев раны (4–8-е сутки в основной группе, 6–14-е – в контрольной).
Скорость заживления послеоперационных ран оценивали по срокам появления грануляций и начала эпителизации (табл. 2). Данные таблицы 2 отражают ускорение процессов репарации ран у больных основной группы. Так, появление грануляционной ткани в ране происходило у них в зависимости от формы СДС на 3–12-е сутки с момента оперативного вмешательства, а у пациентов контрольной группы – на 9–19-е сутки; эпителизация начиналась в основной группе на 8–19-е сутки, а в контрольной – на 11–23-е. В среднем на 3–4-е сутки от начала введения препарата Актовегин 91% пациентов основной группы отмечали снижение выраженности болевого синдрома в нижних конечностях, объективное уменьшение отека, локальное потепление конечности, особенно у пациентов с нейроишемической и ишемической формами СДС.
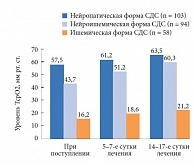
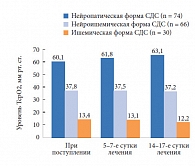
Изменения уровня ТсрО2 у больных с различными формами СДС в основной (при применении Актовегина) и контрольной группах представлены на рисунках 1 и 2. При поступлении у пациентов с нейропатической формой СДС выявлено незначительное уменьшение уровня кислородного насыщения тканей стопы, который составил 57,5 ± 5,1 мм рт. ст. в основной и 60,1 ± 3,7 мм рт. ст. в контрольной группах. У пациентов с ишемической формой СДС отмечено резкое снижение уровня насыщения тканей кислородом: 16,2 ± 0,7 и 13,4 ± 1,3 мм рт. ст. в основной и контрольной группах соответственно. У больных с нейроишемической формой СДС исходные показатели кислородного насыщения тканей составили в указанных группах 43,7 ± 2,8 и 37,8 ± 3,4 мм рт. ст. соответственно. Очевидно, что нарушение микроциркуляции более выражено при ишемической форме СДС.
При применении Актовегина в послеоперационном периоде у пациентов с нейропатической формой СДС уже на 5–7-е сутки лечения отмечено значительное повышение уровня ТсрО2, составившего 61,2 ± 6,7 мм рт. ст. У больных с нейроишемической формой СДС наблюдался более медленный прирост ТсрО2 (достигал нормальных значений только к 14-м суткам с момента начала лечения). У пациентов с ишемической формой СДС, несмотря на проводимое лечение, уровень ТсрО2 оставался низким, находясь на субкритических значениях (21,2 ± 3,1 мм рт. ст.), что требует добавления к проводимой комплексной терапии препаратов из группы простагландинов. При исследовании динамики уровня кислородного насыщения тканей у больных, получавших стандартную терапию, показатель ТсрО2 у больных с нейропатической и нейроишемической формами СДС в ходе лечения практически не отличался от исходного уровня, зарегистрированного при поступлении в стационар (63,1 ± 4,1 и 37,2 ± 5,2 мм рт. ст. соответственно), а при ишемической форме СДС уровень ТсрО2 не только не увеличивался, но даже имел тенденцию к снижению. Следует также отметить, что применение препарата Актовегин не сопровождалось развитием побочных явлений.
Заключение
Применение препарата Актовегин в комплексном лечении больных с различными формами СДС позволяет достоверно улучшать уровень микроциркуляции по данным определения транскутанного напряжения кислорода. Хирургическое лечение пациентов с гнойно-некротическими поражениями нижних конечностей на фоне СД 2 типа в сочетании с применением препарата Актовегин позволяет стабилизировать течение раневого процесса и нормализовать сроки всех его фаз.
Основную группу больных, лечение которых дополнялось внутривенным введением Актовегина, составили 255 пациентов; контрольная группа включила 170 пациентов, получавших стандартную терапию. Показано, что хирургическое лечение пациентов с гнойно-некротическими поражениями нижних конечностей на фоне сахарного диабета 2 типа в сочетании с применением препарата Актовегин позволяет стабилизировать течение раневого процесса и нормализовать сроки всех его фаз.
Применение препарата Актовегин в комплексном лечении больных с различными формами СДС позволяет достоверно улучшить уровень микроциркуляции по данным определения транскутанного напряжения кислорода.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.