Возможности иммунотерапии при синдроме диабетической стопы
- Аннотация
- Статья
- Ссылки
- English
Исследование эффективности комплексной терапии с добавлением препарата Ронколейкин проведено у пациентов с СДС. Основную группу составили 50 больных, группу сравнения – 26. Через семь – десять дней применения препарата Ронколейкин достоверно увеличилось количество Т-лимфоцитов (CD3), Т-хелперов (CD4), Т-супрессоров (CD8), В-лимфоцитов (CD19) (р < 0,05). В группе сравнения в указанный период достоверно возросло лишь количество Т-лимфоцитов. На 14–21-е сутки лечения в основной группе все показатели иммунограммы приблизились к норме, в группе сравнения – достоверно изменились CD3, CD4, фагоцитарная активность нейтрофилов. В отношении остальных показателей тенденции к нормализации не наблюдалось.
Исследование эффективности комплексной терапии с добавлением препарата Ронколейкин проведено у пациентов с СДС. Основную группу составили 50 больных, группу сравнения – 26. Через семь – десять дней применения препарата Ронколейкин достоверно увеличилось количество Т-лимфоцитов (CD3), Т-хелперов (CD4), Т-супрессоров (CD8), В-лимфоцитов (CD19) (р < 0,05). В группе сравнения в указанный период достоверно возросло лишь количество Т-лимфоцитов. На 14–21-е сутки лечения в основной группе все показатели иммунограммы приблизились к норме, в группе сравнения – достоверно изменились CD3, CD4, фагоцитарная активность нейтрофилов. В отношении остальных показателей тенденции к нормализации не наблюдалось.
Cиндром диабетической стопы (СДС) считается одним из частых осложнений сахарного диабета (СД). Его распространенность варьируется от 4 до 10%. С данной патологией связана примерно треть всех госпитализаций больных сахарным диабетом. Кроме того, она нередко становится причиной ампутации нижних конечностей у пациентов с СДС. Так, в структуре ампутаций нетравматического характера указанные случаи составляют 50–75% [1]. Более чем у 50% прооперированных пациентов в течение четырех лет проводится контралатеральная ампутация. Летальность при септических осложнениях достигает 40–60%. Длительные госпитализации, инвалидизация, необходимость реабилитации ассоциируются с дополнительными расходами не только пациентов, но и системы здравоохранения [1–5].
В настоящее время установлено, что одним из звеньев патогенеза СДС является иммунодефицит. Наличие и выраженность иммунодефицита напрямую зависят от длительности сахарного диабета, а также тяжести СДС.
При тяжелом течении СДС вторичный иммунодефицит развивается практически у всех пациентов. Ранним его проявлением служит абсолютная лимфопения (менее 1200 клеток в 1 мм). В частности, снижаются лимфоидные субпопуляции CD3, CD4 и CD8, то есть уровень Т-хелперов 1 и цитотоксических лимфоцитов. Необходимо отметить, что сокращение популяций CD3 и CD4 коррелирует со степенью тяжести синдрома диабетической стопы [6].
При гангренах и гнойных осложнениях могут развиться гнойно-септические заболевания.
В случае системного воспалительного ответа запускаются механизмы компенсаторного противовоспалительного ответа. Для ранней стадии компенсаторного противовоспалительного ответа характерно преобладание интерлейкинов (IL) 4 и 10, уменьшение выработки иммуноглобулинов (Ig), массовый апоптоз иммунных клеток и катастрофическое снижение уровня IL-2 [4].
Для развития сепсиса необходимы не только провоспалительные цитокины, но и провоспалительные медиаторы. Баланс между этими оппозиционными группами определяет характер течения и исход гнойно-септического заболевания. Соответственно восстановление цитокинового баланса можно рассматривать в качестве перспективного метода лечения гнойно-септических заболеваний.
Рекомбинантные цитокины – генно-инженерные аналоги эндогенных цитокинов. Они обладают как замещающими, так и индуктивными (регуляторными) свойствами [2, 7].
Эндогенные цитокины, в частности IL-2, признаны основными регуляторами межклеточных взаимодействий разных физиологических систем организма. IL-2 обладает свойствами одного из главных ростовых и мобилизационных факторов адаптивного иммунного ответа. Он способен регулировать эффекты и усиливать цитотоксический потенциал иммунокомпетентных клеток. IL-2 активирует клональную пролиферацию и дифференциацию Т- и В-лимфоцитов, усиливает эффект цитотоксических T-лимфоцитов (CTL-клеток) и естественных киллеров (NK-клеток), а также активность мононуклеарных фагоцитов и антигенпрезентирующих клеток, в том числе дендритных, стимулирует синтез плазматическими клетками специфических иммуноглобулинов большинства изотопов, наряду с этим уменьшает апоптоз мононуклеаров и нейтрофилов [6].
Эффективными иммунокорректорами при гнойно-септической и инфекционной патологии оказались цитокиновые препараты, такие как рекомбинантные интерфероны, ростовые и колониестимулирующие факторы, отдельные интерлейкины [6].
К одним из таких препаратов относится рекомбинантный IL-2 человека (rIL-2) Ронколейкин.
Ронколейкин с 1995 г. разрешен к применению у взрослых, с 2008 г. – у детей с первого дня жизни. Препарат включен в Федеральное руководство по использованию лекарственных средств № ЛС 001810 от 27.07.2011.
Клинические эффекты Ронколейкина связаны с его способностью стимулировать противоинфекционный и противоопухолевый иммунитет. Воздействуя на разные клеточные мишени, препарат в конечном итоге повышает эффективность работы врожденного и приобретенного иммунитета.
Активация механизмов врожденного и приобретенного иммунитета приводит к более быстрой элиминации этиопатогенных микроорганизмов, что способно значительно повысить эффективность лечения.
Необходимо отметить, что иммунореставрационный эффект в отношении иммунных клеток и иммунной системы достигается при курсовом применении Ронколейкина.
Целью исследования стала оценка роли Ронколейкина в повышении эффективности комплексной терапии синдрома диабетической стопы.
Материал и методы
В Первую республиканскую клиническую больницу Министерства здравоохранения Удмуртской республики (г. Ижевск) в 2014 г. госпитализировано 34 больных СД 2 типа с СДС, в 2015 г. – 25, в 2016 г. – 25, в 2017 г. – 34 пациента. Среди них 40% мужчин и 60% женщин. Средний возраст мужчин – 45–62 года, женщин – 51–77 лет. Средний возраст всех пациентов составил 56,4 года.
С 2014 по 2017 г. консервативное лечение проведено 57% больных, ампутация разного уровня – 43%. Ампутация на уровне пальцев стоп выполнена в 71,5% случаев, на уровне бедра – в 28,5%. Вскрытие флегмон потребовалось каждому пятому пациенту – 21% случаев. От ампутации отказались 4% больных.
В исследование было включено 76 пациентов с СД 2 типа, осложненным СДС. Их разделили на две группы: основную (n = 50) и сравнения (n = 26). Сепсис выявлен у 17% пациентов: в основной группе у шести (21%) больных, в группе сравнения – у четырех (15%).
Пациенты основной группы получали цитокинотерапию (34 человека), группы сравнения – традиционное лечение (25 человек).
Препарат Ронколейкин вводили по следующей схеме: внутривенно по 0,5 мг № 3 с интервалом три дня. До операции – 0,5 мг за два – четыре дня.
Обработка данных проводилась с использованием методов вариационной статистики. Определяли среднее значение (M), вероятность расхождений (m), достоверность изменений (t-критерий Стьюдента). Различия считали достоверными при р < 0,05.
Результаты
Длительность лечения больных СДС в основной группе составила 24,6 ± 4,3 койко-дня, в группе сравнения – 30,2 ± 6,8 койко-дня, больных с сепсисом в основной группе – 44,6 ± 14,5 койко-дня, в группе сравнения – 54,8 ± 12,9 койко-дня (р = 0,02).
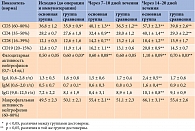
На фоне комплексного лечения с применением Ронколейкина у пациентов с СДС основной группы через семь – десять дней отмечено достоверное увеличение Т-лимфоцитов (CD3), Т-хелперов (СД4), Т-супрессоров (CD8), В-лимфоцитов (CD19) (р < 0,05). При этом у пациентов группы сравнения достоверно повысилось лишь количество Т-лимфоцитов. В основной группе также наблюдалось увеличение фагоцитарной и макрофагальной активности нейтрофилов (р < 0,05), уровня Ig (недостоверно).
Через 14–20 дней в основной группе все показатели иммунограммы достоверно повысились и достигли нормы. В группе сравнения достоверно увеличилось количество CD3, CD4, макрофагальная и фагоцитарная активность нейтрофилов. Однако изменения других показателей были незначительными (таблица).
Оценка динамики показателей иммунограммы подтвердила наличие у пациентов с СДС Т- и В-клеточного иммунодефицита.
Установлено, что включение в комплексное лечение Ронколейкина (rIL-2) приводило к нормализации соотношения субпопуляций иммунных клеток за счет стимуляции клональной пролиферации Т- и В-лимфоцитов. Ронколейкин повышал функциональную активность иммунокомпетентных клеток: усиливал эффекторный потенциал цитотоксических Т-лимфоцитов, естественных киллеров, фагоцитирующих мононуклеаров, а также синтез иммуноглобулинов.
Кроме того, иммунотерапия способствовала уменьшению болевого синдрома и более быстрому отграничению участков гнойно-некротического поражения с формированием демаркационной зоны. Как следствие, повысилась частота проведения органосберегающих операций и уменьшилось количество повторных ампутаций из-за снижения частоты послеоперационных осложнений. Не было зафиксировано ни одного случая диабетической комы и летального исхода.
У больных, перенесших операцию, не отмечалось несостоятельности культи, таких частых осложнений раневого процесса, как рожистое воспаление, тромбофлебит, формирование обширных зон некроза кожи. Количество ампутаций снизилось на 12% в группе сравнения и на 31% в основной группе.
Вывод
При адекватном оперативном пособии включение в комплексное лечение пациентов с СДС препарата Ронколейкин приводит к нормализации показателей клеточного и гуморального иммунитета, улучшению клинического состояния. Это позволяет снизить продолжительность стационарного лечения и уменьшить количество случаев гнойно-септических осложнений и летальных исходов.
S.N. Styazhkina, DM, PhD, Prof., E.D. Bayramkulov, N.A. Kiryanov, DM, PhD, Prof., T.Ye. Chernyshova, DM, PhD, Prof., A.A. Naumova, A.Ye. Matusevich
Izhevsk State Medical Academy
Contact person: Svetlana Nikolayevna Styazhkina, asu@rkb1.udm.ru
One of the links in the pathogenesis of diabetic foot syndrome is immunodeficiency. A study of the effectiveness of the drug Roncoleukin in 76 patients with diabetic foot syndrome. The main group consisted of 50 patients, the control group – 26 patients. When the dynamic observation after 7–10 days there was a significant increase in T-lymphocytes (CD3), T-helper cells (CD4), T-suppressors (CD8), B-lymphocytes (CD19) (p <0.05), compared to the control group, where there is only a small number of T-lymphocytes. In the control group, all confidence indicators changed: CD3, CD4, macrophage activity and phagocytic activity of neutrophils, the rest do not tend to normalize it.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.