количество статей
7261
Пожалуйста, авторизуйтесь:
Исследования
Применение меглумина акридонацетата в лечении инфекционно-воспалительных заболеваний нижних мочевых путей у женщин
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №3
- Аннотация
- Статья
- Ссылки
Все большее значение в развитии воспалительных поражений нижних мочевых путей у женщин наряду с условно-патогенной микрофлорой приобретает специфическая урогенитальная инфекция (уреаплазма, микоплазма, хламидии и др.), что обусловливает необходимость комплексного подхода к обследованию и лечению этой категории больных.
В комплексном лечении может с успехом применяться индуктор синтеза интерферона – меглумина акридонацетат. Приведены результаты нескольких исследований эффективности этого препарата у пациенток с хроническим уретритом, бактериальным вагинозом, кандидозным вульвовагинитом и неспецифическим бактериальным вагинитом.
Неосложненная инфекция нижних мочевых путей у женщин и рост числа воспалительных заболеваний уретры и мочевого пузыря являются актуальной проблемой современной урогинекологии.
Неосложненные инфекции мочевых путей (НИМП) относятся к числу наиболее распространенных заболеваний как в амбулаторной, так и в госпитальной практике у женщин репродуктивного возраста [1, 2, 3]. Наиболее часто НИМП поражает нижние мочевые пути. Последнее международное эпидемиологическое исследование при неосложненном цистите у женщин (ARESC) было проведено в 9 странах Европы (включая Россию) и Бразилии [4]. В ходе этого исследования определялась чувствительность уропатогенов к девяти антибиотикам (назначаемым per os) на основании требований Института клинических и лабораторных стандартов (CLSI). Согласно полученным данным, основным уропатогеном являлась Escherichia coli (74,6%), далее Enterococcus faecalis (4,0%), Staphylococcus saprophyticus (3,6%), Klebsiella pneumoniae (3,5%) и Proteus mirabilis (3,5%).
Все большее значение в развитии воспалительных поражений нижних мочевых путей у женщин наряду с условно-патогенной микрофлорой приобретает специфическая урогенитальная инфекция (уреаплазма, микоплазма, хламидии и др.), что обусловливает необходимость комплексного подхода к обследованию и лечению этой категории больных.
В комплексном лечении может с успехом применяться индуктор синтеза интерферона – меглумина акридонацетат. Приведены результаты нескольких исследований эффективности этого препарата у пациенток с хроническим уретритом, бактериальным вагинозом, кандидозным вульвовагинитом и неспецифическим бактериальным вагинитом.
Вместе с тем во многих странах (Франция, Италия, Венгрия, Польша и Россия) при обследовании пациенток с симптомами нижних мочевых путей и подозрением на НИМП в 36,4–49,3% случаев урокультура оказалась негативной, т.е. лабораторное подтверждение ИМП отсутствовало. Причины расстройств мочеиспускания у женщин многообразны и могут быть обусловлены помимо обычной НИМП хроническим уретритом на фоне инфекции, передаваемой половым путем, нарушением влагалищного микробиоценоза и местного иммунитета, гормональными нарушениями, функциональными и неврологическими расстройствами.
Исследования показали, что у женщин с рецидивирующей ИМП грамнегативная микрофлора присутствует во влагалищной среде в 56% случаев, тогда как у женщин, не имеющих в анамнезе клинических проявлений ИМП, она была обнаружена только у 24% обследованных. При рецидивирующей ИМП влагалище пациенток значительно чаще бывает колонизировано E. coli, Enterococcus faecalis, Proteus mirabilis и Klebsiella. В отечественной и зарубежной литературе имеются указания на этиологическую роль в развитии воспалительных поражений нижних мочевых путей не только условно-патогенной микрофлоры, но и специфической урогенитальной инфекции (уреаплазма, микоплазма, хламидии и др.), что требует комплексного обследования и лечения этой категории больных [5, 6, 7]. Комплексное клиникоинструментальное обследование 120 пациентов с НИМП выявило наличие возбудителей урогенитальных инфекций у 80% больных пиелонефритом и у 72% с циститом.
Дисбиоз микрофлоры влагалища у женщин нередко приводит к развитию бактериального вагиноза (БВ) и кандидозного вагинита (КВ). На долю БВ приходится не менее 1/3 всех инфекций влагалища, а по некоторым данным, его распространенность составляет 40–50%. При этом происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища строгими анаэробами и гарднереллой. Кандидозный вагинит – один из наиболее распространенных микозов у женщин. Среди возбудителей кандидоза – дрожжеподобные грибы рода Candida, которых в настоящее время насчитывают более 150 видов. Заболевание в 80–90% случаев вызывается C. аlbicans, в 1–5% – C. tropicalis, в 10% – C. grabrata. У 10–15% женщин бактериальный вагиноз сочетается с кандидозным вагинитом, в этом случае необходимо параллельное назначение антимикотиков. У женщин с БВ или КВ, а также их половых партнеров нередко наблюдается поражение мочеиспускательного канала, обусловленное Gardnerella vaginalis или Candida.
В постменопаузе вследствие снижения уровня эстрогенов у женщин развивается урогенитальная атрофия, эпителий во влагалище и уретре становится тонким, возникает дефицит гликогена, снижается продукция молочной кислоты и повышаются значения влагалищного рН. Эти изменения влагалищной среды способствуют чрезмерному росту некисломолочных колиформных видов бактерий и исчезновению лактобактерий, создаются благоприятные условия для колонизации влагалища условнопатогенной и патогенной микрофлорой. Частота восходящей инфекции нижних мочевыводящих путей (включая поражения уретры) в период постменопаузы возрастает. В ходе исследования, начатого в клинике урологии МГМСУ совместно с многопрофильной диагностической лабораторией ГНЦ «Институт иммунологии ФМБА России» (директор, д.м.н. М.Н. Болдырева), были обследованы 19 пациенток в возрасте от 19 до 30 лет с длительно существующими рецидивирующими СНМП.
Рецидивирующее течение уретритов нередко обусловлено недостаточной диагностикой этиологии заболевания, неадекватной антимикробной терапией, нарушением больными режима, реинфекцией в случае, если половые партнеры не получали соответствующего лечения. При терапии рецидивирующих уретритов необходимо помимо адекватной этиотропной фармакотерапии применять методы стимуляции неспецифической реактивности, иммуномодуляторы, лазеромагнитную терапию и некоторые другие дополнительные методы. В клинике урологии МГМСУ в течение последних 5 лет в комплексном лечении женщин с рецидивирующими воспалительными заболеваниями нижних мочевых путей применяются различные иммуномодуляторы, в том числе индукторы синтеза интерферона.
Среди многочисленных цитокинов, обладающих регуляторными функциями, особое место отводится интерферонам (ИФН). Индукция их синтеза, прежде всего натуральными киллерами, клетками моноцитарного ряда, а также дендритными клетками, предшествует формированию специфических иммунных реакций. В этой связи представляется весьма перспективным применение индукторов синтеза интерферона в лечении ряда заболеваний, при которых ИФН оказывают протективное действие. Индукторы синтеза интерферона (ИСИ) – группа веществ природного или синтетического происхождения, способных индуцировать в организме человека продукцию эндогенного интерферона. В отличие от препаратов рекомбинантного ИФН индукторы его синтеза обладают рядом преимуществ:
Л.Д. Кунцевич и соавт. (2010) изучили эффективность очаговой иммунофизиотерапии в комплексном лечении пациентов с манифестными проявлениями папилломавирусной инфекции. Группа 1 (72 пациента) в комплексном лечении получала меглумина акридонацетат внутримышечно по 2 мл 12,5%-ного раствора через день в течение 10 дней, группа 2 (35 пациентов) – с помощью электрофореза на область наружных половых органов (по 2 мл 12,5%-ного раствора через 1–2 дня, всего 5 процедур). Изучены уровни локальных цитокинов (интерферона α и γ, а также лактоферина) в уретральном секрете и половых гормонов в сыворотке крови до и после лечения. Результаты лечения показали, что иммунофизиотерапия с меглумина акридонацетатом по сравнению с его внутримышечным введением более чем в 2 раза уменьшает риск возникновения рецидивов ВПЧ-инфекции и не оказывает негативного влияния на уровень половых гормонов в сыворотке крови. При этом курсовая доза препарата и продолжительность иммунотерапии в 2 раза меньше, чем при внутримышечном введении [10].
В комплексном лечении инфекционно-воспалительных заболеваний в урологии, гинекологии и дерматовенерологии 10 лет назад стал активно применяться жидкий линимент меглумина акридонацетата. Установлено выраженное антибактериальное, противовоспалительное, антипролиферативное и антихламидийное (за счет активации системы иммунитета) действие препарата. Изучение эффективности препарата проводилось по нескольким направлениям:
Изучение переносимости и эффективности местного применения меглумина акридонацетата в комплексной терапии вагинальных инфекций – БВ, КВ, неспецифического бактериального вагинита – проводилось в течение 6 месяцев у 62 пациенток репродуктивного возраста. Препарат использовался как составная часть общепринятой антимикробной терапии. Контрольная группа была сформирована из 50 больных. В группе 1 препарат меглумина акридонацетата назначался интравагинально в виде аппликаций один раз в сутки в течение 10 дней, в группе 2 – 1 раз в 3 дня до 10 аппликаций. В 3-й группе введение первых 3 доз осуществлялось 1 раз в 3 дня с помощью ультразвукового аппарата для орошения тканей, а в дальнейшем – ежедневно в виде влагалищных аппликаций. Клиническая эффективность оценивалась на основании клинических и микробиологических параметров. Субъективное улучшение отметили 62 из 64 (96,9%) пациенток в 1-й и 2-й группах, а также все пациентки в 3-й группе.
Исследования показали, что у женщин с рецидивирующей ИМП грамнегативная микрофлора присутствует во влагалищной среде в 56% случаев, тогда как у женщин, не имеющих в анамнезе клинических проявлений ИМП, она была обнаружена только у 24% обследованных. При рецидивирующей ИМП влагалище пациенток значительно чаще бывает колонизировано E. coli, Enterococcus faecalis, Proteus mirabilis и Klebsiella. В отечественной и зарубежной литературе имеются указания на этиологическую роль в развитии воспалительных поражений нижних мочевых путей не только условно-патогенной микрофлоры, но и специфической урогенитальной инфекции (уреаплазма, микоплазма, хламидии и др.), что требует комплексного обследования и лечения этой категории больных [5, 6, 7]. Комплексное клиникоинструментальное обследование 120 пациентов с НИМП выявило наличие возбудителей урогенитальных инфекций у 80% больных пиелонефритом и у 72% с циститом.
У пациенток с рецидивирующими НИМП на фоне урогенитальных инфекций наблюдались очаговые изменения в проксимальной части уретры, шейке мочевого пузыря, мочепузырном треугольнике с морфологической картиной лейкоплакии [5]. Авторы указывают на необходимость изменения схем лечения таких пациентов в клинической практике. Burkhard F.C. с соавт. (2004) обследовали 103 женщины (средний возраст 46 лет), страдавшие от длительной дизурии (продолжительность симптомов от 3 до 480 месяцев). У всех пациенток при цистоскопии выявлены гиперемия слизистой уретры, псевдополипоз в шейке мочевого пузыря и лейкоплакия в зоне мочепузырного треугольника. Эти изменения расценивались как признаки хронического воспаления. Вместе с тем лейкоцитурия наблюдалась только в 30% случаев, а бактериологические исследования подтвердили наличие патогенных микроорганизмов в нижних мочевых и половых путях лишь у 15% пациенток. При этом в 5% случаев выявлены бактерии (E. Coli; E. coli + Klebsiella; Enterococcus), а в 10% – грибы и вирусы.
Исследование материала из уретры, влагалища и цервикального канала, а также серологические анализы на хламидии, микоплазмы и уреаплазмы не определили у пациенток этих микроорганизмов. В то же время авторы считают, что трудности в идентификации данных внутриклеточных микроорганизмов и несовершенство применяемых методик увеличивают количество ложно-негативных результатов в клинической практике. В связи с этим всем пациенткам было проведено эмпирическое лечение доксициклином, в результате которого в 71% случаев наблюдался полный или существенный регресс симптомов нижних мочевых путей, а также положительная динамика цистоскопической картины. На основании полученных результатов авторы сделали вывод, что у больных этой категории имеет место скрытая хроническая инфекция, и данное лечение показано до постановки диагноза «интерстициальный цистит» или направления пациенток на дополнительную консультацию [8].
Дисбиоз микрофлоры влагалища у женщин нередко приводит к развитию бактериального вагиноза (БВ) и кандидозного вагинита (КВ). На долю БВ приходится не менее 1/3 всех инфекций влагалища, а по некоторым данным, его распространенность составляет 40–50%. При этом происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища строгими анаэробами и гарднереллой. Кандидозный вагинит – один из наиболее распространенных микозов у женщин. Среди возбудителей кандидоза – дрожжеподобные грибы рода Candida, которых в настоящее время насчитывают более 150 видов. Заболевание в 80–90% случаев вызывается C. аlbicans, в 1–5% – C. tropicalis, в 10% – C. grabrata. У 10–15% женщин бактериальный вагиноз сочетается с кандидозным вагинитом, в этом случае необходимо параллельное назначение антимикотиков. У женщин с БВ или КВ, а также их половых партнеров нередко наблюдается поражение мочеиспускательного канала, обусловленное Gardnerella vaginalis или Candida.
В постменопаузе вследствие снижения уровня эстрогенов у женщин развивается урогенитальная атрофия, эпителий во влагалище и уретре становится тонким, возникает дефицит гликогена, снижается продукция молочной кислоты и повышаются значения влагалищного рН. Эти изменения влагалищной среды способствуют чрезмерному росту некисломолочных колиформных видов бактерий и исчезновению лактобактерий, создаются благоприятные условия для колонизации влагалища условнопатогенной и патогенной микрофлорой. Частота восходящей инфекции нижних мочевыводящих путей (включая поражения уретры) в период постменопаузы возрастает. В ходе исследования, начатого в клинике урологии МГМСУ совместно с многопрофильной диагностической лабораторией ГНЦ «Институт иммунологии ФМБА России» (директор, д.м.н. М.Н. Болдырева), были обследованы 19 пациенток в возрасте от 19 до 30 лет с длительно существующими рецидивирующими СНМП.
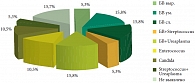
На протяжении последних 6–12 месяцев пациентки неоднократно получали антимикробное лечение по поводу хронического цистита без видимого эффекта. При обследовании в клинике урокультура во всех случаях не выявила роста микроорганизмов, уретроцистоскопия свидетельствовала о наличии умеренных признаков гиперемии слизистой уретры и изменений в мочепузырном треугольнике, которые расценивались как признаки хронического воспаления. КУДИ не выявило существенных отклонений от нормальных показателей. Всем пациенткам проведено исследование урогенитального биоценоза с помощью тест-системы «Фемофлор-16». Применялся метод ПЦР с детекцией результатов в режиме реального времени. Результаты исследования свидетельствовали о наличии бактериального вагиноза у 58% пациенток: в 36,9% случаев имел место БВ разной степени выраженности; в 5,3% случаев отмечено наличие БВ в сочетании с повышенным титром Streptococcus spp. и в 15,8% – в сочетании с Ureaplasma urealyticum. Комбинация Streptococcus spp. и Ureaplasma urealyticum в исследованном материале из уретры и влагалища наблюдалась у 5,3% пациенток, в 10,5% случаев обнаружен Enterococcus и в 10,5% случаев имел место кандидозный вагинит (рис. 1).
Рецидивирующее течение уретритов нередко обусловлено недостаточной диагностикой этиологии заболевания, неадекватной антимикробной терапией, нарушением больными режима, реинфекцией в случае, если половые партнеры не получали соответствующего лечения. При терапии рецидивирующих уретритов необходимо помимо адекватной этиотропной фармакотерапии применять методы стимуляции неспецифической реактивности, иммуномодуляторы, лазеромагнитную терапию и некоторые другие дополнительные методы. В клинике урологии МГМСУ в течение последних 5 лет в комплексном лечении женщин с рецидивирующими воспалительными заболеваниями нижних мочевых путей применяются различные иммуномодуляторы, в том числе индукторы синтеза интерферона.
Среди многочисленных цитокинов, обладающих регуляторными функциями, особое место отводится интерферонам (ИФН). Индукция их синтеза, прежде всего натуральными киллерами, клетками моноцитарного ряда, а также дендритными клетками, предшествует формированию специфических иммунных реакций. В этой связи представляется весьма перспективным применение индукторов синтеза интерферона в лечении ряда заболеваний, при которых ИФН оказывают протективное действие. Индукторы синтеза интерферона (ИСИ) – группа веществ природного или синтетического происхождения, способных индуцировать в организме человека продукцию эндогенного интерферона. В отличие от препаратов рекомбинантного ИФН индукторы его синтеза обладают рядом преимуществ:
- при введении ИСИ образуется эндогенный ИФН, не обладающий антигенностью;
- они лишены побочных эффектов рекомбинантных ИФН;
- однократное введение ИСИ обеспечивает относительно длительную циркуляцию эндогенного ИФН.
Л.Д. Кунцевич и соавт. (2010) изучили эффективность очаговой иммунофизиотерапии в комплексном лечении пациентов с манифестными проявлениями папилломавирусной инфекции. Группа 1 (72 пациента) в комплексном лечении получала меглумина акридонацетат внутримышечно по 2 мл 12,5%-ного раствора через день в течение 10 дней, группа 2 (35 пациентов) – с помощью электрофореза на область наружных половых органов (по 2 мл 12,5%-ного раствора через 1–2 дня, всего 5 процедур). Изучены уровни локальных цитокинов (интерферона α и γ, а также лактоферина) в уретральном секрете и половых гормонов в сыворотке крови до и после лечения. Результаты лечения показали, что иммунофизиотерапия с меглумина акридонацетатом по сравнению с его внутримышечным введением более чем в 2 раза уменьшает риск возникновения рецидивов ВПЧ-инфекции и не оказывает негативного влияния на уровень половых гормонов в сыворотке крови. При этом курсовая доза препарата и продолжительность иммунотерапии в 2 раза меньше, чем при внутримышечном введении [10].
В комплексном лечении инфекционно-воспалительных заболеваний в урологии, гинекологии и дерматовенерологии 10 лет назад стал активно применяться жидкий линимент меглумина акридонацетата. Установлено выраженное антибактериальное, противовоспалительное, антипролиферативное и антихламидийное (за счет активации системы иммунитета) действие препарата. Изучение эффективности препарата проводилось по нескольким направлениям:
- монотерапия вагинальных инфекций (бактериальный вагиноз, кандидозный вульвовагинит, неспецифический бактериальный вагинит);
- в комплексной терапии вагинальных инфекций;
- при лечении инфекций, передающихся половым путем.
Изучение переносимости и эффективности местного применения меглумина акридонацетата в комплексной терапии вагинальных инфекций – БВ, КВ, неспецифического бактериального вагинита – проводилось в течение 6 месяцев у 62 пациенток репродуктивного возраста. Препарат использовался как составная часть общепринятой антимикробной терапии. Контрольная группа была сформирована из 50 больных. В группе 1 препарат меглумина акридонацетата назначался интравагинально в виде аппликаций один раз в сутки в течение 10 дней, в группе 2 – 1 раз в 3 дня до 10 аппликаций. В 3-й группе введение первых 3 доз осуществлялось 1 раз в 3 дня с помощью ультразвукового аппарата для орошения тканей, а в дальнейшем – ежедневно в виде влагалищных аппликаций. Клиническая эффективность оценивалась на основании клинических и микробиологических параметров. Субъективное улучшение отметили 62 из 64 (96,9%) пациенток в 1-й и 2-й группах, а также все пациентки в 3-й группе.
Эффективность лечения в контрольной группе больных составила 64% [11]. И.М. Нестеров с соавт. (2002) отметили эффективность монотерапии меглумина акридонацетатом в виде интравагинальных инстилляций в группе больных с КВ на уровне 78% [12]. При сочетанном поражении слизистой влагалища и уретры выполнялось также интрауретральное введение линимента меглумина акридонацетата; эффективность лечения в этой группе больных составила 73,3%. Накопленный в клинике урологии МГМСУ опыт лечения пациенток с инфекционно-воспалительными заболеваниями нижних мочевых путей, а также результаты исследований, опубликованные в отечественной литературе за последние 10 лет, позволяют считать, что применение меглумина акридонацетата способствует оптимизации традиционной антимикробной и противовоспалительной терапии у этой категории больных за счет влияния на факторы местного иммунитета. Линимент 5%-ный меглумина акридонацетата обладает высокой степенью эффективности, хорошей переносимостью, его применение возможно как в виде монотерапии, так и в составе комбинированного лечения.
1. Лоран О.Б., Зайцев А.В., Годунов Б.Н., Каприн А.Д. Давидьянц А.А. Современные аспекты диагностики и лечения хронического цистита у женщин // Урология и нефрология. 1997. № 6. С. 7–14.
2. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic cost. Disease-a-month. 2003. Vol. 49 (2). P. 53–70.
3. Пушкарь Д.Ю., Зайцев А.В. Современный взгляд на применение цефиксима в лечении инфекции мочевыводящих путей // РМЖ. 2010. № 18 (29). С. 1809 –1812.
4. Naber K.G et al. Surveillance study in Europe and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology in Females with Cystitis (ARESC): implications for empiric therapy // Eur. Urol. 2008. Vol. 54(5). P. 1164–1175.
5. Лоран О.Б., Синякова Л.А., Косова И.В. Роль урогенитальных инфекций в этиологии циститов, необструктивных пиелонефритов у женщин // Урология. 2005. № 3. С. 60–63.
6. Кисина В.И., Забиров К.И. Урогенитальные инфекции у женщин. М.: МИА, 2005. С. 627–641.
7. Baka S., Kouskouni E., Antonopoulou S. et al. Prevalence of Ureaplasma urealyticum and Mycoplasma hominis in women with chronic urinary symptoms // Urology. 2009. Vol. 74. P. 62–66.
8. Burkhard F.C., Blick N., Hochreiter W.W., Studer U.E. Urinary urgency and frequency, and chronic urethral and/or pelvic pain in females. Can doxycycline help? // Urol. 2004. Vol. 172 (1). P. 232–235.
9. Донсков В.В., Старцев В.Ю., Мовчан К.Н., Полюшкин С.В. Вопросы патогенеза и лечения больных после политравмы // Урология. 2011. № 1. С. 11–13.
10. Кунцевич Л.Д., Комов Н.Н., Шибаева Е.В. и др. Очаговая иммунофизиотерапия в комплексном лечении мужчин с манифестными проявлениями папилломавирусной инфекции // Урология. 2010. № 6. С. 58–62.
11. Циклоферон в клинической практике: методические рекомендации для врачей / под ред. проф. В.А. Исакова. СПб. 2002. 48 с.
12. Нестеров И.М., Тополян А.А. Монотерапия вагинальных инфекций линиментом 5% циклоферона // Циклоферон – от эксперимента в клинику. Применение лекарственных форм циклоферона. СПб. 2002. С. 194–206.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.