Применение препарата Гиалган Фидия при остеоартрозе коленных суставов
- Аннотация
- Статья
- Ссылки
у пациентов с остеоартрозом коленных суставов.
у пациентов с остеоартрозом коленных суставов.

Заболевания костно-мышечной системы широко распространены в самых различных популяциях. Остеоартроз (ОА) занимает лидирующие позиции среди данной группы болезней как наиболее частая причина временной нетрудоспособности и инвалидизации больных.
Частота ОА среди взрослого населения составляет до 14%, при этом самой распространенной локализацией патологии является ОА коленных суставов [1]. По данным K.M. Jordan с соавт., частота артропластических операций среди пациентов старше 65 лет, страдающих гонартрозом, составляет в среднем 0,5–0,7 на 1000 человек в год [2]. К сожалению, статистика последних десятилетий свидетельствует о постоянном увеличении числа больных ОА, что объясняется, наряду с совершенствованием диагностики болезни, увеличением продолжительности жизни населения и накоплением факторов риска заболевания, особенно ожирения.
В настоящее время ОА рассматривается как органная патология, поскольку в патологический процесс вовлекаются все ткани сустава: хрящ, субхондральная кость, синовиальная мембрана, капсула, связки и периартикулярные мышцы. Одним из механизмов развития ОА является нарушение равновесия между процессами деградации матрикса и его образования: происходит нарушение синтеза хондроцитами основных компонентов матрикса – протеогликанов и коллагена II типа – и/или их усиленный катаболизм. Не последнюю роль в патогенезе ОА играет повышенная продукция хондроцитами провоспалительных цитокинов – интерлейкинов (ИЛ-1, ИЛ-6), фактора некроза опухоли альфа (ФНО-α), оксида азота, циклооксигеназы-2, которые принимают участие в деградации хряща [3].
Продукты деградации хряща попадают в синовиальную жидкость и, обладая антигенными свойствами, провоцируют воспаление синовиальной оболочки. Это приводит к нарушению обменных процессов в синовиоцитах, в результате чего страдает образование синовиальной жидкости и гиалуроновой кислоты (ГК). Помимо этого, синовиальные клетки продуцируют медиаторы воспаления, которые способствуют повышению проницаемости сосудов и усилению трансфузии плазмы в синовиальную жидкость. Все эти процессы ведут к уменьшению концентрации ГК и снижению вязкоэластических и любрикантных свойств синовиальной жидкости [4, 5].
Роль гиалуроновой кислоты в трофике хряща и регуляции среды в полости сустава
ГК является органическим соединением, которое присутствует в межклеточном матриксе практически любой ткани организма человека и является одним из основных компонентов соединительной ткани. По химической структуре ГК представляет собой гетерополисахарид (глюкозаминогликан), мономером которого является дисахарид, состоящий из D-глюкуронила и D-N-ацетилглюкозамина, соединенных между собой гликозидными мостиками. Молекула ГК может содержать до 25 000 дисахаридных звеньев. Эта длинная неразветвленная цепочка дисахаридов образует ось гигантской молекулы протеогликана, который наряду с коллагеном является основным биополимером соединительной ткани, в том числе и суставного хряща.
ГК в линейной форме секретируется синовиоцитами в полость сустава, где ее макромолекулы обеспечивают уникальные вязко-эластичные свойства нормальной синовиальной жидкости, которая без ГК представляет собой простой диализат плазмы.
ГК играет ключевую роль в трофике хряща и регуляции среды в полости сустава. На уровне макрогомеостаза ГК, постоянно присутствующая на поверхности суставного хряща и синовиальной оболочки, предотвращает трение соприкасающихся поверхностей. Благодаря своим вязко-эластичным свойствам ГК способна уменьшать механические нагрузки на суставные поверхности. На уровне минигомеостаза ГК обеспечивает диффузию питательных веществ и продуктов обмена между синовиальной жидкостью и суставным хрящом, хондроцитами и хрящевым матриксом, протеогликанами и коллагеном хряща, регулирует лимфообращение. Кроме того, молекулы ГК способствуют нейтрализации и выведению свободных радикалов, и, соответственно, стабилизации клеточных мембран, защищают хондроциты и синовиоциты от воздействия катаболических энзимов, десенсибилизируют чувствительные рецепторы (в том числе и болевые), создают оптимальную среду для синтетических процессов [6].
Поддержание гомеостаза синовиальной жидкости и гиалинового хряща в значительной степени зависит от присутствия в синовиальной жидкости необходимой концентрации ГК (в норме она составляет от 2,5 до 3,5 мг/мл) с оптимальным молекулярным весом (от 500 до 3000 кДa). При ОА в синовиальной жидкости отмечается снижение концентрации ГК в 2–3 раза по сравнению с нормальным уровнем, что приводит к уменьшению вязко-эластичных и амортизирующих свойств синовиальной жидкости. Было установлено, что при острых и хронических воспалительных процессах в суставе размер молекул ГК уменьшается. Так, согласно данным C. Belcher и соавт. (1997), в синовиальной жидкости у пациентов с гонартрозом концентрация ГК, гликозаминогликанов и кератан сульфата ниже, чем у здоровых людей. Кроме того, в экспериментах на животных продемонстрировано, что провоспалительные цитокины, в частности ИЛ-1 и ФНО-α, стимулируют экспрессию гиалуронан-синтетазы, вызывающей фрагментацию ГК и прогрессирование деструкции хряща. Эти изменения ведут к увеличению статической и динамической нагрузки на суставные поверхности. Сустав становится более уязвимым к травматическим воздействиям, что, в свою очередь, способствует ускорению дегенеративных изменений и клинически проявляется болями и ограничением движений в суставе. Эти данные послужили основанием для создания препаратов экзогенной ГК, обладающих структурно-модифицирующими свойствами, которые вводятся в пораженный ОА сустав.
Механизм действия экзогенной ГК в суставе недостаточно ясен. Несомненным является улучшение вязко-эластических свойств синовиальной жидкости, однако не исключается и наличие других механизмов. Так, время существования введенного препарата в суставной полости составляет от нескольких часов до нескольких дней, а клинический эффект сохраняется в течение нескольких месяцев. Предполагается, что механизмы «восполнения эластичности» связаны с противовоспалительными и антиноцицептивными эффектами, а также стимуляцией синтеза эндогенной ГК введенными извне препаратами [7].
Большое число исследований, проведенных in vitro и in vivo, показали, что ГК способна индуцировать агрегацию и синтез протеогликанов, модулировать воспалительный ответ, уменьшать хемотаксис и действие супероксиданион-радикалов [8–13]. Наличие хондропротективного эффекта ГК было доказано в исследовании in vitro K. Fukuda и соавт. (1997), которое показало, что меченная флуоресцином ГК способна проникать в хрящевую ткань и стимулировать синтез эндогенных протеогликанов.
Опыт применения препаратов гиалуроновой кислоты в медицинской практике
Первым препаратом гиалуроновой кислоты, используемым в медицинской экспериментальной практике, был гиалуронан (Hyaluronan), появившийся в 1960-е гг. Следующим поколением препаратов данной группы стали гиланы, разработанные в 1980-х гг., позднее появились другие препараты с различным молекулярным весом.
В 80–90-е гг. XX в. было опубликовано значительное число работ, в которых авторы представляли свой опыт применения того или иного препарата. Критические сравнения между ними затруднительны в связи с тем, что в исследованиях использовались препараты с различным молекулярным весом, разные режимы их введения, участвовало небольшое числа испытуемых, отсутствовал плацебо-контроль, кроме того, возможно наличие и других факторов, способных существенно повлиять на результаты исследований.
Если не принимать во внимание некоторые сложности, возникающие при изучении эффективности внутрисуставного введения препаратов ГК, результаты большого числа исследований свидетельствуют об уменьшении боли и восстановлении функций суставов на фоне терапии препаратами ГК.
Эффективность препаратов ГК показана во многих плацебоконтролируемых исследованиях. E. George в 1998 г. опубликовал результаты метаанализа 43 исследований ГК (6000 пациентов) [20], согласно которому препарат показал статистически значимую эффективность в сравнении с плацебо (р < 0,001) как в конце курса лечения (3–5 недель), так и через 6 месяцев наблюдения при сопоставимой частоте побочных реакций. К таким же выводам спустя 2 года после публикации обзора пришли E.C. Huskisson и S. Donnelly: статистически значимое снижение боли по ВАШ по сравнению с плацебо отмечено на 5-й неделе от начала исследования (р = 0,0087), эффект сохранялся до 26-й недели наблюдения (р = 0,0049). Общая оценка эффективности лечения пациентами, получавшими ГК, к концу исследования тоже превышала таковую среди тех, кто получал плацебо (р = 0,012) [21].
В Кохрановском систематическом обзоре 2006 г., который включал 76 клинических исследований, установлено достоверно значимое улучшение при введении ГК по сравнению с плацебо по основным показателям: боль в покое и при нагрузке (ВАШ), индексы WOMAC и Лекена [14]. Было показано, что ГК оказывает более длительное действие по сравнению с кортикостероидами при внутрисуставном введении. Так, длительность эффекта у большинства пациентов после окончания курса введения препаратов ГК составляла от 4 месяцев до 1 года, в то время как эффект от внутрисуставного введения кортикостероидов – не более 4 недель.
Сравнительная эффективность ГК и внутрисуставного введения кортикостероидов изучалась в нескольких работах. G. Leardini и соавт. одними из первых провели такое исследование (по три инъекции препарата Гиалган через 1 неделю), результаты которого через неделю после окончания лечения показали, что обезболивающее действие ГК было аналогичным действию 40 мг метилпреднизолона; в конце периода наблюдения (45 дней после окончания лечения) наблюдалось выраженное снижение всех болевых параметров у пациентов, которым вводили ГК. Оба варианта лечения переносились хорошо, поскольку никаких локальных или системных побочных действий не наблюдалось [17].
Схожие результаты были получены V. Pietrogrande и соавт. [18]. Позднее A.C. Jones и соавт. (1995) и L. Frizziero и соавт. (2001) двойным слепым методом сравнили эффект от вводимых внутрисуставно ГК и триамцинолон гексацетонида при ОА коленного сустава. На этапе лечения в течение 5 недель существенных различий по показателям боли, функциональной подвижности сустава, потребности в приеме НПВП в группах не наблюдалось, однако при последующем 6-месячном наблюдении выраженность болевого синдрома была ниже у пациентов, получавших ГК. Подобная тенденция наблюдалась и в отношении остальных критериев, что позволило исследователям заключить, что введение ГК может являться терапевтической альтернативой кортикостероидам при гонартрозе [19].
Обобщив данные экспериментальных и клинических исследований применения различных препаратов ГК, V.M. Goldberg и J.A. Buckwalter в своем обзоре в 2005 г. заключили, что препараты обладают структурно-модифицирующим действием и способны влиять на течение заболевания, однако механизмы действия до сих пор окончательно не выяснены [22]. В 2000 г. Американский колледж ревматологов включил препараты ГК в рекомендации по лечению гонартроза.
Далее, в обзоре D. Brzusek и D. Petron, анализирующем целый ряд рандомизированных плацебоконтролируемых исследований, подтверждены эффективность и безопасность терапии препаратами ГК, в том числе и при сопоставлении с различными НПВП. Авторы заключили, что ГК может рассматриваться в качестве достойной альтернативы НПВП, было подчеркнуто, что по сравнению с НПВП у препаратов ГК отсутствует риск развития кардиоваскулярных, гастроинтестинальных и почечных осложнений [15].
Клиническая эффективность ГК была показана в метаанализе C.T. Wang и соавт., включавшем 20 рандомизированных клинических исследований (РКИ) у пациентов с ОА коленных суставов [23]. Данные этих РКИ продемонстрировали, что введение высоко- и низкомолекулярной ГК значимо уменьшает боль и улучшает функцию коленных суставов, однако высокомолекулярная ГК оказывает лучший терапевтический эффект по сравнению с низкомолекулярной.
Дальнейшее изучение физиологических, фармакологических и клинических свойств ГК привело к предположению, что первоначальная концепция «вязкоэластичности» [24, 25] как механизма действия ГК недостаточна для объяснения долгосрочных клинических эффектов подобной терапии. Гипотеза о том, что молекулярная масса ГК является главным фактором ее клинической эффективности, была поставлена под сомнение [26]. A.D. Aviad и J.B. Houpt предположили, что большее значение имеет концентрация ГК, чем ее молекулярная масса. Систематический обзор пяти метаанализов, проведенный J.G. Divine и соавт., показал, что введение низко- и высокомолекулярных препаратов ГК демонстрирует одинаковые результаты. Все препараты эффективно уменьшают симптомы при ОА коленных суставов в отношении влияния на боль, припухлость и скованность. Не отмечено преимуществ одного препарата над другим, хотя было подчеркнуто, что анализируемые работы трудно сравнивать [27]. Однако в доклинических исследованиях по оценке структурных изменений тканей суставов было показано, что именно низкомолекулярные ГК обладают более выраженным эффектом в отношении модификации заболевания.
Многие авторы сообщают о хорошем эффекте терапии у большинства больных при повторных введениях препарата в среднем через 4–8 месяцев [28–34].
В настоящее время используется целый ряд препаратов ГК с различной молекулярной массой, которые получают разными методами: методом бактериальной ферментации (ГК не животного происхождения – Oртовиск, Ферматрон, Oстенил), методом NASHA™(Non-Animal Stabilized Hyaluronic Acid – Дьюролан) и методом экстракции из биологического материала (петушиные гребешки), который используется для производства препарата Гиалган («Фидия Фармацеутици С.п.А», Италия).
Препарат Гиалган Фидия – концентрированный (2 мг/2 мл) вязкий раствор ГК с высокой степенью очистки (молекулярная масса 500–730 кДа). Натриевая соль ГК является единственным активным ингредиентом Гиалгана Фидия. Препарат хорошо абсорбируется и удерживается в слое синовиальных клеток и хряще, распределяется в ретикулоэндотелиальной системе, метаболизируется в печени и выделяется с мочой и путем потоотделения. Не существует данных о биологической аккумуляции препарата в организме. Гиалган Фидия применяется в клинической практике с 1987 г. и зарегистрирован в 80 странах. В нашей стране он используется с 2009 г. В России это единственный препарат ГК, зарегистрированный в качестве лекарственного средства.
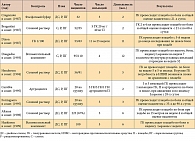
Изучение эффективности и безопасности препарата Гиалган проводилось в рандомизированных плацебоконтролируемых исследованиях (табл. 1) при ОА коленных и других суставов. Два исследования были слепыми, семь – двойными слепыми. Инъекции ГК выполнялись с интервалом в 1 неделю. В исследовании «доза – эффект», проводимом A. Вragantini и соавт., вводили 2 мл и 4 мл ГК или плацебо [35]. Различий между двумя режимами дозирования получено не было. Показатели боли в обеих группах ГК достоверно уменьшались по сравнению с группой плацебо в течение всего периода наблюдения.
В одном из исследований E.B. Henderson и соавт. не выявили различий между Гиалганом и плацебо [36]. После периода «отмывки» от НПВП в течение двух недель больные получали пять еженедельных инъекций ГК или плацебо. В исследование был включен 91 пациент, они оценивались в конце периода терапии (через 5 недель) и через 5 месяцев. Критерием эффективности была оценка боли (ВАШ). Достоверных различий между группами при оценках через 5 недель и 5 месяцев не отмечалось. Однако у пациентов группы ГК по сравнению с группой плацебо потребность в НПВП после проведенной терапии появилась значительно позже. Полученные результаты объясняются некорректным дизайном данного исследования: первая оценка была выполнена в конце курса терапии, что, очевидно, рано для развития эффекта ГК; количество пациентов было недостаточным для выявления межгрупповых различий по шкале боли (ВАШ); при оценке боли через 5 месяцев 38% пациентов были недоступны для наблюдения, вследствие чего сравниваемые группы оказались несопоставимы.
M. Carrabba и соавт. [40] исследовали оптимальную схему применения Гиалгана. В двойном слепом исследовании Гиалгана одна, три и пять еженедельных инъекций препарата сравнивались с плацебо и артроцентезом, поскольку было показано, что любое внутрисуставное вмешательство может приводить к клиническим улучшениям при ОА. Три и пять инъекций Гиалгана достоверно превосходили по эффективности одну инъекцию препарата, плацебо и артроцентез. И хотя статистически значимых различий между тремя и пятью инъекциями найдено не было, наблюдалась тенденция, свидетельствующая о более высокой эффективности пяти инъекций. Данные результаты позволили авторам предположить, что оптимальное количество инъекций Гиалгана составляет от трех до пяти.
Другие плацебоконтролируемые исследования показали статистически значимое уменьшение боли, улучшение индекса Лекена, снижение потребности в НПВП и внутрисуставных инъекциях кортикостероидов у больных, получавших ГК, по сравнению с плацебо [21, 37–42].
Сравнительное изучение трех инъекций Гиалгана и метилпреднизолона 40 мг у 36 пациентов через 2 месяца и 12 месяцев, проведенное G. Lenardini и соавт., показало их равную эффективность в снижении интенсивности боли, боли при нагрузке и улучшении функционального состояния суставов [43]. D.D. Guidolin и соавт. сравнили пять еженедельных инъекций препарата Гиалган с тремя еженедельными инъекциями метилпреднизолона 40 мг/мл у 59 пациентов по клиническим и морфологическим изменениям. Оценки включали клинические показатели (боль по ВАШ, функция сустава и наличие выпота в нем) и анатомические повреждения, определяемые при артроскопии и гистологическом анализе материала, взятого при биопсии. Анатомические оценки выполнялись в слепых условиях. Авторы пришли к выводу, что через 6 месяцев оба препарата снижали повреждение хрящевой ткани и воспалительные процессы в синовиальной оболочке, а улучшение клинических параметров терапии было практически одинаковым в обеих группах [44].
В другом двойном слепом исследовании A.C. Jones и соавт. сравнили пять инъекций ГК с одной инъекцией кортикостероида наиболее длительного действия – триамцинолоном гексацетонидом (ТГ) – и четырьмя инъекциями плацебо у 63 пациентов с воспалительным выпотом в коленном суставе [45]. Оценки включали показатели боли по ВАШ, длительность скованности, функциональное состояние сустава и наличие суставного выпота. Через неделю ТГ оказывал более выраженный эффект в отношении боли, функционального состояния сустава и снижал потребность в НПВП по сравнению с ГК. Начиная с 5-й недели и до конца периода наблюдения (6 месяцев) ГК оказалась более эффективной по всем клиническим параметрам. Однако в связи с тем, что значительное количество пациентов отказались от наблюдения после 4 месяцев, межгрупповые различия уменьшились к концу исследования.
В проводимых открытых исследованиях [46–48], где период наблюдения после терапии был коротким (4 недели), наблюдалась та же тенденция, что и в слепых исследованиях: короткое, но более выраженное противовоспалительное действие кортикостероидов с последующим значимым и более длительным превосходством Гиалгана начиная с 21-го и 28-го дня. Учитывая данные предварительного исследования, проведенного G. Grecomoto и соавт., добавление дексаметазона к первой из пяти инъекций ГК приводило к лучшим клиническим результатам.
В двойном слепом 6-месячном исследовании R.D. Altman и соавт. сравнили Гиалган с плацебо и напроксеном в дозе 1000 мг/сут [42]. Пациентам из группы напроксена проводилась местная подкожная инъекция лидокаина. Аспирация синовиальной жидкости выполнялась только в случае четких признаков наличия выпота в суставе. Анализ эффективности терапии у пациентов, завершивших исследование, показал, что напроксен был эффективнее ГК на 2-й неделе. Однако начиная с 4-й по 26-ю недели ГК обладала равной эффективностью с напроксеном в снижении боли.
С 1987 по 2010 г. было проведено 84 клинических исследования препарата Гиалган Фидия для различных суставов (46 плацебоконтролируемых, 34 неконтролируемых, 4 постмаркетинговых), в которых участвовали 13 000 пациентов. Как показывает большинство клинических исследований, развитие эффекта начинается через 2–4 недели после введения Гиалгана и продолжается в течение 6–12 месяцев.
Является ли Гиалган структурно-модифицирующим препаратом при ОА? Исследования in vitro при ОА позволяют предположить, что ГК с молекулярной массой 500–730 кДa может быть потенциальным структурно-модифицирующим препаратом. Было проведено четыре исследования, в которых изучалось структурно-модифицирующее действие препарата Гиалган при ОА коленных суставов [44, 49–52].
Двойное слепое контролируемое рандомизированное исследование длительностью 1 год было проведено V. Listrat и соавт. [49] у 39 пациентов с ОА коленных суставов. После лаважа полости сустава (2 мл физиологического раствора) при артроскопии пациенты распределялись на две группы, одна из которых получала 3 инъекции ГК с интервалом в неделю. Каждый курс инъекций ГК повторялся 1 раз в 3 месяца (всего 9 инъекций). Пациенты оценивались по критериям: боль по ВАШ, индекс Лекена и французская версия шкалы измерения влияния артрита (0AIMS2). Структурно-модифицирующий эффект оценивался по степени сужения суставной щели при передне-задней рентгенографии коленного сустава во время нагрузки и при артроскопическом исследовании. Исходные и конечные оценки записывались на различные видеопленки, которые анализировались врачом, не имевшим сведений о пациенте и хронологии записи пленок. Результаты показали наличие достоверно меньшего количества патологических изменений структурных параметров в группе ГК по сравнению с контрольной группой.
В 1998 г. L. Frizziero и соавт. оценили клинические и морфологические изменения состояния коленных суставов после пяти еженедельных инъекций препарата Гиалган у 40 пациентов в открытом исследовании. Оценки проводились с помощью микроартроскопического и морфологического анализов биопсийного материала, полученного исходно и через 6 месяцев наблюдения. Все гистологические образцы анализировались в слепых условиях. Согласно полученным данным у большинства пациентов (60%) не выявлено никаких микроскопических изменений в хрящевой ткани, у 32,5% отмечалось уменьшение степени поражения хряща: по сравнению с исходными значениями состояние поверхностного аморфного слоя хряща восстановилось (р = 0,0039), возросла плотность хондроцитов (р = 0,0023) и их жизнеспособность (р = 0,05). Эти изменения сопровождались достоверным уменьшением воспалительных явлений в синовиальной оболочке (р = 0,001). Данные результаты были подтверждены морфологической оценкой. Клинически больные отмечали снижение боли в покое и при нагрузке, улучшение функционального состояния суставов и уменьшение количества выпота начиная с 35 суток до окончания наблюдения. Ухудшение было отмечено только у 7,5% больных [16].
Для подтверждения структурно-модифицирующего эффекта препарата Гиалган было проведено двойное слепое плацебоконтролируемое исследование, в которое были включены 408 больных с ОА коленных суставов [52]. Инъекции Гиалгана или плацебо проводились 3 раза с недельным интервалом. Оценка структурного эффекта проводилась рентгенологически до начала терапии и через 1 год. Завершили исследование 319 человек, рентгенография в динамике была сделана 273 больным. Данные исследования показали, что среднее уменьшение ширины суставной щели было достоверно меньше в группе ГК, чем в группе плацебо: -0,13 + 1,1 мм по сравнению с -0,5 + 1,0 мм соответственно (р = 0,02) у пациентов с исходным размером суставной щели, превышающим медиану. Как ранее было отмечено в исследовании V. Listrat и соавт., данные результаты подтверждают, что внутрисуставное введение ГК с молекулярной массой 500–730 кДa при ОА коленных суставов может оказывать структурно-модифицирующее действие [49].
Переносимость Гиалгана в целом очень хорошая. Относительно редко отмечаются местные реакции. Так, A.S. Dixson и соавт. [38] отметили реакции в виде покраснения и умеренной болезненности коленного сустава, которые спонтанно проходили в течение 1–3 суток, только у 1–2% пациентов. Описан один случай гемартроза, сопровождавшийся признаками воспаления, после одной из инъекций. М. Dougados и соавт. [39] сообщили о равной частоте (33%) местных реакций в группе ГК и плацебо, E.B. Henderson с соавт. [36] наблюдали более частые местные реакции в группе ГК по сравнению с плацебо (47% и 22% соответственно). R.D. Аltman и соавт. [42] сообщили, что 23% пациентов, получавших ГК, предъявляли жалобы на боли в месте инъекции в сравнении с 13% пациентов, получавших плацебо, и 9% пациентов из группы напроксена (имитация инъекции). В другом открытом исследовании длительностью 30 месяцев (курс 5 инъекций ГК) побочные реакции в виде локального припухания и легких болей в коленном суставе были отмечены только у пяти пациентов из 75 (6%) [53].
Препарат Гиалган применяется для внутрисуставного введения с 1987 г. По оценкам на май 2010 г., препарат получили более 6 500 000 больных с первичным и вторичным ОА коленных суставов и при ортопедических оперативных вмешательствах. За этот период было получено 997 сообщений, подтвержденных профессиональными сотрудниками здравоохранения, о нежелательных явлениях (НЯ) у 344 пациентов (0,01%) при коммерческом применении препарата («Фидия Фармацеутици С.п.А», неопубликованные данные). Наиболее частые НЯ были местными и незначительными. При этом у 5,9% больных наблюдалось локальное припухание и у 6,3% – боль в месте инъекции. У 9,4% пациентов НЯ были связаны с внутрисуставным выпотом. Признаки и симптомы аллергии, такие как зуд, сыпь, эритема и уртикарная сыпь, отмечались крайне редко. Сообщения о развитии воспалительных реакций после применения Гиалгана отсутствуют.
Результаты открытого исследования эффективности и безопасности препарата Гиалган Фидия
Мы провели многоцентровое открытое 12-месячное исследование эффективности и безопасности препарата Гиалган Фидия у больных с первичным ОА коленных суставов. В исследовании участвовали 47 пациентов обоего пола (34 женщины и 13 мужчин) в возрасте 45–70 лет (средний возраст 58,8 ± 11,6) с гонартрозом I, II, III стадий по Kellgren – Lawrence. Все пациенты удовлетворяли диагностическим критериям ОА Американской коллегии ревматологов. Интенсивность боли при ходьбе соответствовала 40 мм и более (ВАШ); больные регулярно принимали НПВП в течение 30 дней за последние 3 месяца до исследования. Все пациенты подписали информированное согласие на участие в исследовании. Критериями исключения были наличие синовитов, остеонекроз суставных поверхностей, внутрисуставное введение любых препаратов в течение предшествующих 6 недель, варусная/вальгусная установка сустава (более 15 градусов), терапия медленнодействующими препаратами для ОА (4 месяца до начала терапии), операции на целевом суставе в анамнезе. Гиалган вводился 4-кратно (1 раз в неделю). Длительность наблюдения составила 12 месяцев, больные осматривались спустя 4, 12, 24 и 48 недель после введения препарата (табл. 2).
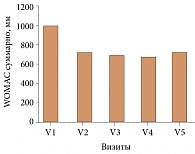
Оценка эффективности лечения проводилась по общепринятым на сегодняшний день критериям оценки препаратов для лечения ОА: индекс WOMAC, оценка эффекта от проводимой терапии врачом и пациентом (улучшение, значительное улучшение, отсутствие эффекта, ухудшение), суточная потребность в НПВП. Эти параметры анализировались до начала лечения (Визит 1) и на каждом последующем визите. НЯ, оценка эффективности от проводимого лечения и суточная потребность в НПВП регистрировались на каждом повторном визите. 35 больных имели различные сопутствующие заболевания, наиболее часто встречающимися из них были: артериальная гипертония – у 30 (63,8%) пациентов, ишемическая болезнь сердца – у 7 (14,8%), сахарный диабет 2 типа – у 6 (12,6%), варикозная болезнь нижних конечностей – у 4 (8,4%), язвенная болезнь 12-перстной кишки – у 1 (2,1%). Все 47 больных завершили исследование. Анализ результатов показал наличие достоверного обезболивающего эффекта уже через 1 месяц после введения препарата, который сохранялся до конца наблюдения. Статистически значимое снижение скованности отмечалось в конце курса введения Гиалгана и на последнем визите. Достоверное улучшение функционального состояния суставов и снижение суммарного индекса WOMAC наблюдалось уже через 1 месяц терапии (Визит 2) и сохранялось на протяжении 12 месяцев (см. рис.).
Переносимость препарата в целом была хорошей. НЯ были зарегистрированы у 3 пациентов. У 1 больной отмечались боли в коленном суставе после введения препарата, у 1 пациента на 4-й день развился синовит, и у 1 больного отмечалось покраснение кожи в месте введения препарата. 94% пациентов отметили переносимость препарата как «хорошую» и только 6% больных как «удовлетворительную».
Оценки эффективности лечения, проводимые пациентом и врачом, практически не отличались друг от друга. Улучшение состояния в конце периода наблюдения через 12 месяцев отмечалось у 96% (45 пациентов), а отсутствие эффекта – у 4% (2 пациента).
Уменьшение выраженности боли позволило постепенно снизить потребность в НПВП у 28 больных (58,8%), отменить НПВП – у 15 человек (32%), и только у 4 больных доза НПВП осталась прежней.
Таким образом, Гиалган Фидия является эффективным, безопасным и длительно действующим препаратом при ОА суставов различной локализации. Эффективность Гиалгана подтверждена многочисленными клиническими исследованиями. Развитие эффекта начинается через 2–4 недели после введения Гиалгана и продолжается в течение 6–12 месяцев. Оптимальное количество инъекций Гиалгана составляет от трех до пяти.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.