Боль при остеоартрозе: взаимосвязь между структурными изменениями и центральными механизмами боли
- Аннотация
- Статья
- Ссылки
- English
Остеоартроз (ОА) представляет собой одно из наиболее распространенных заболеваний костно-мышечной системы, которое встречается примерно у 11–13% населения Земли. В России, по данным официальной статистики, частота ОА за последние годы возросла на 48%, ежегодная первичная заболеваемость – более чем на 20%. Количество зарегистрированных в стране больных ОА достигло почти 4 млн человек, каждый год впервые выявляется более 600 тыс. случаев заболевания. Однако эти данные не отражают истинную распространенность патологии, поскольку не все больные обращаются за помощью в лечебно-профилактические учреждения. Увеличение частоты ОА обусловлено прежде всего быстрым постарением популяции и пандемией ожирения.
Механизмы формирования боли при остеоартрозе
Основной клинический симптом ОА – боль различной интенсивности. По данным C.Y. Wenham и соавт., 81% больных ОА испытывает постоянные боли в суставах [1]. Именно боль является основной причиной обращения больных за медицинской помощью и главным фактором снижения качества жизни.
Причины боли при ОА до конца не изучены [2]. Источником боли при ОА могут быть синовиальная оболочка, капсула, связочный аппарат, периартикулярные мышцы, субхондральная кость (остеит и периостит) и проч. [3]. В последние годы активно обсуждается роль центральной и периферической нервной системы в формировании и интенсивности болевого синдрома. Кроме того, боль – субъективное ощущение, которое во многом формируется под влиянием психологических, социальных, демографических, генетических и других факторов.
Считается, что наиболее чувствительные болевые структуры располагаются в жировой клетчатке под надколенником, синовии и связках. Суставной хрящ не имеет иннервации и поэтому не может быть непосредственным источником боли. Однако инвазия сосудов в пораженные участки суставного хряща может приводить к появлению чувствительных нервных волокон в аневральном в норме хряще [4]. Кроме того, изменения субхондральной кости при ОА: развитие остеосклероза, образование остеофитов, микропереломов, очагов отека костного мозга и повышение интрамедуллярного давления – могут вызывать боль. На сегодняшний день доказано, что изменения архитектоники в субхондральных участках кости, обнаруживаемые при проведении магнитно-резонансной томографии (МРТ), ассоциируются не только с болью, но и с длительностью интенсивного болевого синдрома в коленных, тазобедренных и мелких суставах кистей [5].
K. Moisio и соавт. (n = 182) выявили ассоциацию между умеренной и сильной болью в коленных суставах и частотой обнаружения на МРТ «обнаженных» участков субхондральной кости, лишенной суставного хряща. Отношение шансов (OШ) для медиального отдела тибио-феморального сустава составило 3,9 (95% доверительный интервал (ДИ) 1,33–11,47), феморо-пателлярного сустава – 3,11 (95% ДИ 1,24–7,81) [6]. Кроме того, обнаруживаемые при МРТ «обнаженные» участки субхондральной кости коррелировали с четырехкратным повышением риска развития хронического болевого синдрома в коленных суставах (OШ = 4,19, 95% ДИ 1,56–11,22).
Еще одной причиной боли могут стать очаги отека костного мозга. Это подтверждено в работе M.F. Sowers и соавт., которые наблюдали 120 женщин в возрасте 35–55 лет [7]. Женщин разделили на четыре группы: первая группа – с манифестным гонартрозом, вторая – с безболевым ОА коленных суставов, третья – с болью в коленных суставах без рентгенологических признаков ОА и четвертая – без боли и рентгенологических изменений. Результаты показали, что очаги отека костного мозга размером > 1 см в пять раз чаще встречались у женщин с клиническими и рентгенологическими признаками гонартроза, чем у пациенток других групп (OШ = 5,0, 95% ДИ 1,4–10,5).
D.T. Felson и соавт. статистически значимо чаще обнаруживали изменения костного мозга на МРТ у пациентов с манифестным ОА, чем у больных без боли в коленных суставах (77,5 и 30% соответственно, р < 0,05). При этом повреждения костного мозга были независимым фактором возникновения боли в коленных суставах (ОШ = 3,31, 95% ДИ 1,54–7,41) после поправки на возраст, пол, рентгенологическую стадию [8].
Большинство исследователей, используя различные инструментальные методы, доказали наличие корреляции между синовитом и болью в суставах при ОА [9–14]. Так, по данным K. Baker и соавт., у пациентов с синовитом (при МРТ) более чем в девять раз повышался риск развития болевого синдрома (ОШ = 9,2, 95% ДИ 3,2–26,3) [15]. Авторы пришли к выводу, что синовит – один из основных предикторов возникновения боли при ОА.
В ряде работ подтверждена взаимосвязь рентгенологической стадии ОА и интенсивности боли [16]. Именно наличие остеофитов как в тибио-феморальной, так и в феморо-пателлярной областях ассоциируется с болью в коленных суставах [17–19]. P.R. Kornaat и соавт. показали, что наличие остеофитов в феморо-пателлярной области более чем в два раза увеличивает риск манифестного ОА (OШ = 2,25, 99% ДИ 1,06–4,77) [20].
На инициацию боли и ее выраженность при ОА могут влиять также возраст, пол, этническая принадлежность, семейное положение, социально-экономический статус, психологические особенности человека, состояние ментального здоровья и т.д.
В масштабном французском исследовании с участием 5324 пациентов с ОА коленных и тазобедренных суставов было продемонстрировано, что интенсивная боль превалировала у пациентов старше 75 лет, женского пола, с индексом массы тела выше 40 кг/м2 [21]. Авторы отметили, что оценка выраженности боли зависела и от социального статуса: на сильную боль в суставах чаще жаловались социально неустроенные (одинокие, пенсионеры или безработные) участники исследования. T. Rosemann и соавт. также подтвердили, что высокая интенсивность боли в суставах статистически значимо ассоциируется с депрессивными состояниями, низким уровнем социальной активности и образования [22].
На интенсивность боли могут влиять повреждение менисков и поражение связочного аппарата [14].
Боль при ОА может быть вызвана и повышенным напряжением скелетных мышц – синдромом болезненного мышечного спазма, который характеризуется локальной болью в пределах спазмированной мышцы. Болезненный мышечный спазм при ОА развивается в результате воздействия множества биомеханических (плоскостопие, варусная/вальгусная деформация оси нижней конечности, асимметрия длины ног, нарушение осанки позвоночника, синдром гипермобильности суставов и пр.) и воспалительных факторов. Болезненный мышечный спазм может быть обусловлен и психологическими причинами, такими как тревога и стресс. Развитие болезненного мышечного спазма во многом связано с сенситизацией мышечных ноцицепторов. Сенситизированные ноцицепторы становятся источником усиленной афферентной ноцицептивной импульсации, вследствие чего повышается возбудимость ноцицептивных нейронов в структурах спинного и головного мозга [23]. Повышение возбудимости ноцицептивных нейронов в структурах центральной нервной системы вызывает рефлекторную активацию мотонейронов в соответствующих сегментах спинного мозга и сокращение мышц [24]. В дальнейшем этот фактор становится причиной хронического болевого синдрома, так как мышечный спазм приводит к стимуляции болевых рецепторов самой мышцы. Предполагают, что в мышце формируются триггерные точки, содержащие множественные локусы сенситизации, состоящие из одного или нескольких сенситизированных нервных окончаний. Возникает так называемый порочный круг: боль – мышечный спазм – усиленная боль – болезненный мышечный спазм.
Нестероидные противовоспалительные препараты при остеоартрозе
Исследования последних лет подтверждают, что в основе боли при ОА лежат два механизма: ноцицепция и центральная сенситизация. В большинстве случаев (от 60 до 80%) ноцицептивный генез болей играет первостепенную роль. В связи с этим применение нестероидных противовоспалительных препаратов (НПВП) при ОА патогенетически обосновано. Например, ацеклофенак (Аэртал) – дериват фенилуксусной кислоты обладает высоким терапевтическим потенциалом и хорошей переносимостью при лечении ОА. Эффективность Аэртала доказана в многочисленных клинических исследованиях.
В 2010–2011 гг. Л.И. Алексеева и соавт. провели многоцентровое открытое рандомизированное сравнительное трехмесячное исследование эффективности и безопасности ацеклофенака и диклофенака у больных гонартрозом [25]. Одна группа (n = 100) принимала ацеклофенак (Аэртал) 200 мг/сут, вторая (n = 100) – диклофенак 100 мг/сут. Согласно полученным результатам, оба препарата обладали равной эффективностью по влиянию на боль и функциональное состояние суставов. Однако на фоне приема ацеклофенака отмечалось более быстрое статистически значимое уменьшение скованности. Кроме того, препарат характеризовался лучшим профилем безопасности по сравнению с диклофенаком.
В исследовании Е.П. Шараповой и соавт. были продемонстрированы эффективность и безопасность препарата Аэртал (порошок для приготовления раствора) у пациентов с ОА коленных и тазобедренных суставов. На фоне двухнедельного лечения отмечалось статистически значимое снижение интенсивности боли, скованности в суставах (на 25 и 34% соответственно ), наблюдались улучшение функции суставов (на 17%) и уменьшение суммарного индекса WOMAC (на 18%) [26].
Таким образом, данные литературы свидетельствуют о выраженном анальгетическом и противовоспалительном эффектах ацеклофенака при ОА.
Место миорелаксантов в лечении остеоартроза
С учетом того что один из механизмов болевого синдрома – это мышечный спазм, в схемы лечения ОА, кроме НПВП, анальгетиков, симптоматических препаратов замедленного действия, включаются миорелаксанты.
Толперизона гидрохлорид (Мидокалм®) – миорелаксант центрального действия, который успешно применяется для лечения мышечного спазма при заболеваниях опорно-двигательного аппарата более чем в 30 странах мира.
Препарат оказывает мембраностабилизирующее действие [27]. Мидокалм® отличается способностью блокировать натриевые каналы. Известно, что именно усиление потока натрия при фосфорилировании ионных каналов является одним из важных механизмов сенситизации ноцицепторов. Блокада натриевых каналов тормозит активность клеточных мембран нейронов, в результате уменьшаются амплитуда и частота патологически усиленных потенциалов, снижается проведение болевой импульсации. D. Hinck и соавт. на модели изолированного нерва установили, что добавление толперизона гидрохлорида в инкубируемую среду в дозе 100 ммоль/л уменьшает проницаемость ионов натрия на 50% [28].
Толперизона гидрохлорид способен подавлять моно- и полисинаптические рефлексы на уровне спинного мозга, облегчая движение. Кроме того, препарат угнетает усиленную импульсацию в каудальной части ретикулярной формации, нормализуя регуляцию мышечного тонуса.
Мидокалм® дозозависимо ингибирует рефлекторные ответы в передних и задних корешках спинного мозга [29]. Он блокирует потенциалзависимые кальциевые каналы. Это позволяет предположить, что помимо стабилизации мембран антиспастическое действие препарата может быть дополнительно связано с торможением выброса возбуждающих нейромедиаторов из центральных терминалей афферентных волокон путем комбинированного влияния на потенциалзависимые натриевые и кальциевые каналы [30].
Приведенные данные свидетельствуют о том, что Мидокалм® действует практически на все патогенетические механизмы формирования болевого синдрома и мышечно-тонических нарушений, разрывая цепь патологических событий: повреждение – боль – мышечный спазм – боль. Эффективность препарата была доказана в комплексной терапии при многих хронических заболеваниях опорно-двигательного аппарата, сопровождающихся болезненными мышечными спазмами (спондилезе, остеоартрозе, артритах, анкилозирующем спондилите, дорсопатиях с мышечно-тоническим синдромом, ревматоидном артрите и др.) [31].
При пероральном приеме Мидокалм® полностью всасывается в желудочно-кишечном тракте, метаболизируется в печени и почках, выводится почками в виде метаболитов (более 99%). Максимальная концентрация в плазме крови достигается примерно через полтора часа после приема препарата. В наибольших концентрациях препарат накапливается в спинном мозге, стволе мозга и периферической нервной системе.
Мидокалм® характеризуется хорошей переносимостью и высокой степенью безопасности. Нежелательные реакции встречаются менее чем у 1% больных и проявляются незначительной мышечной слабостью, головной болью, головокружением, артериальной гипотензией, диспепсическими нарушениями, крайне редко аллергическими реакциями. При отмене препарата или уменьшении ежедневной дозы нежелательные явления быстро проходят и не требуют фармакологической коррекции. Среди важных преимуществ Мидокалма – отсутствие седативного эффекта, выраженной мышечной слабости, влияния на артериальное давление.
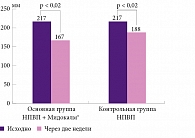
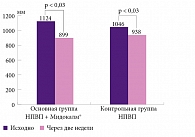
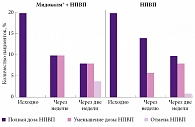
Оценка эффективности и переносимости препарата Мидокалм® была проведена в Научно-исследовательском институте ревматологии им. В.А. Насоновой [32]. 40 пациенток с достоверным ОА коленных суставов были рандомизированы на две группы по 20 человек – основную и контрольную. Все больные получали НПВП, на фоне которых в основной группе был дополнительно назначен Мидокалм® в суточной дозе 450 мг. Длительность лечения составила 14 дней. В основной группе к концу исследования отмечалось статистически значимое снижение боли (рис. 1) и суммарного индекса WOMAC. Так, суммарный индекс WOMAC снизился на 25% в группе пациенток, получавших Мидокалм®, и только на 14% в контрольной (рис. 2). Авторы также оценивали функциональное состояние позвоночника в динамике по специальному опроснику Освестри, с помощью которого определяются интенсивность боли в спине, способность к самообслуживанию, подъему тяжестей, нарушения сна, трудности при сидении и стоянии. К 14-му дню терапии статистически значимое снижение индекса Освестри было выявлено только в группе пациенток, принимавших Мидокалм® (3,15 ± 0,62 и 2,6 ± 0,72 балла, р < 0,01), в контрольной группе различия оказались недостоверными (2,78 ± 0,55 и 2,6 ± 0,6 балла, р > 0,05). Уже через неделю лечения 50% больных основной группы и 30% контрольной снизили дозы НПВП вдвое. К концу исследования 20% больных основной группы полностью отказались от приема НПВП и 40% сократили дозу наполовину, в контрольной группе аналогичные показатели составили 5 и 40% соответственно (рис. 3). Переносимость терапии в целом была хорошая. Нежелательные реакции наблюдались у одной пациентки контрольной группы в виде повышения артериального давления до 210/110 мм рт. ст., что потребовало отмены НПВП через неделю от начала приема.
Е.Л. Никонов и соавт. с помощью анкеты SF36 изучали динамику показателей качества жизни у 86 пациентов с ОА в течение четырех недель лечения толперизоном и диклофенаком [33]. Монотерапия препаратом Мидокалм® в дозе 300 мг/сут оказалась сравнимой с таковой диклофенаком 100 мг/сут при оценке качества жизни. Полученные результаты позволяют констатировать, что Мидокалм® обладает не только миорелаксирующим, но и определенным анальгезирующим эффектом: на фоне его применения снижаются выраженность боли, суммарный индекс WOMAC и Освестри, суточная потребность в НПВП.
Таким образом, достаточно выраженная клиническая эффективность и отсутствие серьезных нежелательных реакций дают основание рекомендовать Мидокалм® к использованию в комплексном лечении ОА. Результаты исследований свидетельствуют о том, что прием Мидокалма позволяет уменьшить дозу НПВП, тем самым способствуя снижению риска развития желудочно-кишечных и сердечно-сосудистых осложнений, характерных для этой группы препаратов.
E.A. Taskina, L.I. Alekseyeva
Research Institute of Rheumatology named after V.A. Nasonova, Moscow
Contact person: Elena Aleksandrovna Taskina, braell@mail.ru
Pathogenetic mechanisms underlying development of pain syndrome during osteoarthrosis are analyzed in the paper. A role for non-steroid anti-inflammatory drugs and muscle relaxants in a combination therapy of osteoarthrosis are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.