количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Применение препарата Полиоксидоний в лечении урологических заболеваний
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4 (37)
- Аннотация
- Статья
- Ссылки
- English
В статье обосновывается целесообразность комплексного лечения воспалительных урологических заболеваний. Показаны преимущества назначения иммуномодулирующей и антибактериальной терапии по сравнению с монотерапией антибиотиками. На примере препарата Полиоксидоний продемонстрирована эффективность включения иммуномодуляторов в терапию цистита, пиелонефрита, простатита.
В статье обосновывается целесообразность комплексного лечения воспалительных урологических заболеваний. Показаны преимущества назначения иммуномодулирующей и антибактериальной терапии по сравнению с монотерапией антибиотиками. На примере препарата Полиоксидоний продемонстрирована эффективность включения иммуномодуляторов в терапию цистита, пиелонефрита, простатита.
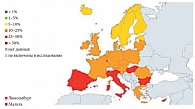
Рис. 1. Резистентность Escherichia coli к фторхинолонам в странах Европы
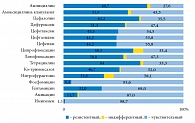
Рис. 2. Pезистентность возбудителей инфекций мочевых путей к антимикробным препаратам
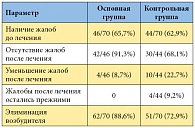
Таблица. Динамика субъективной симптоматики и результаты микробиологического обследования у больных хроническим простатитом
Опыт применения препарата Полиоксидоний при хронических инфекциях мочевых путей
Инфекции мочевых путей (ИМП) – одни из самых распространенных инфекционных заболеваний, которые встречаются в амбулаторной и внутрибольничной урологической практике. Причиной до 90% случаев всех ИМП являются бактерии семейства Enterobacteriaceae, а также Pseudomonas aeruginosa, Enterococcus faecalis, Staphylococcus saprophyticus. В свою очередь Staphylococcus aureus, Staphylococcus epidermidis, Gardnerella vaginalis, Streptococcus spp., дифтероиды, лактобациллы, анаэробы практически не вызывают ИМП, хотя также колонизуют кожу, слизистую оболочку прямой кишки и влагалища. Необходимо отметить, что в настоящее время редко регистрируется моноинфекция ИМП. Возникают также трудности с идентификацией организмов, которые во многом обусловлены распространением протопластов и L-форм микроорганизмов, более устойчивых к антибактериальной терапии и не растущих на обычных питательных средах [1–4].
Одной из ключевых причин хронизации ИМП в настоящее время считается нарушение иммунитета. Слизистые оболочки являются естественной первой линией противомикробной защиты. Доказано, что для больных с рецидивирующими ИМП характерны изменения иммунного ответа в виде нарушения отдельных функций нейтрофилов (хемотаксис, фагоцитоз, бактерицидность) [5–9], снижения активности интерлейкина (ИЛ) 2 [10] и уровня ИЛ-8 в моче, способствующего миграции нейтрофилов в просвет мочевого пузыря [7, 8], а также секреторного IgA [11, 12], который блокирует прикрепление бактерий к эпителиальным клеткам.
Под воздействием токсических факторов инфекционных агентов происходят не только деструктивные изменения, но и подавляется фагоцитарная активность лейкоцитов, в крови уменьшается количество NK-клеток (CD16+) [6, 13, 14], снижается абсолютное количество лимфоцитов и уменьшается общая популяция Т-лимфоцитов (CD3+) и Т-хелперов (CD4+). Одновременно увеличивается количество Т-супрессоров (CD8+) [15–17]. Наблюдается снижение уровня всех фракций иммуноглобулинов (IgA, IgM и IgG) и некоторых цитокинов (ИЛ-2) [18, 19].
Благодаря исследованиям последних лет было доказано, что каждая из инфекций органов мочеполовой системы может подавлять Т- и В-клеточные звенья иммунной системы, вызывая нарушения микробиоценоза, которые обусловлены постоянным поступлением в кровь продуктов воспаления, тканевого и клеточного детрита, снижением защитных свойств слизистых оболочек и секрета желез. Все это приводит к развитию аутоиммунного воспаления [20–25].
Иммунодефицит при хронических заболеваниях может быть обусловлен длительно персистирующими микроорганизмами, оказывающими токсическое действие на костный мозг, вилочковую железу, а также Т- и В-лимфоциты [20].
Учитывая доказанную роль иммунных нарушений в развитии хронических ИМП, перспективным представляется применение в комплексной терапии иммуномодуляторов широкого спектра действия, характеризующихся низкой частотой развития побочных эффектов (таких как Полиоксидоний).
Полиоксидоний – отечественный препарат, обладающий не только иммунотропной, но также и выраженной детоксикационной активностью, которая не определяется активацией иммунных механизмов. Положительное действие Полиоксидония на организм человека проявляется в 4 основных его эффектах – иммуномодулирующем, детоксицирующем, антиоксидантном, мембраностабилизирующем [26].
Иммуномодулирующий эффект Полиоксидония связан с его способностью воздействовать на факторы естественной резистентности: моноциты/макрофаги, нейтрофилы и естественные киллеры, а также на факторы приобретенного иммунитета – гуморального и клеточного. Полиоксидоний взаимодействует с внешней мембраной клеток иммунной системы, на поверхности которых формируется сигнал в виде входящих токов ионов кальция, активирующий клетки [27]. Взаимодействие Полиоксидония с нейтрофилами и моноцитами ведет к изменению их функциональной активности, что проявляется усилением синтеза цитокинов и фагоцитоза. При взаимодействии Полиоксидония с нейтрофилами активируется их миграция в очаг воспаления. Взаимодействуя с мононуклеарами периферической крови человека, Полиоксидоний усиливает цитотоксичность NK-клеток, но только в том случае, если эта цитотоксичность была исходно понижена. При нормальном или повышенном уровне цитотоксичности он не оказывает влияния. Таким образом, клетками-мишенями для Полиоксидония являются прежде всего факторы естественной резистентности: моноциты/макрофаги, нейтрофилы и NK-клетки, то есть факторы ранней защиты организма от инфекции. Следует подчеркнуть, что иммуномодулирующее действие Полиоксидония зависит от исходного состояния функциональной активности факторов иммунной системы.
Антиоксидантный эффект Полиоксидония проявляется в способности нейтрализации кислородных радикалов, при этом уменьшается риск повреждения тканей и снижается острота воспалительного процесса [26].
В урологии Полиоксидоний применяют в комплексной терапии хронических ИМП – цистита, пиелонефрита, для лечения простатитов, урогенитальных инфекций. Полиоксидоний назначают парентерально (в/м, внутривенно) или ректально.
С 2010 по 2013 г. в Российско-израильском медицинском центре «РАМБАМ» препаратом Полиоксидоний было пролечено 86 пациенток с хроническим циститом и 18 больных хроническим пиелонефритом. Рассмотрим более подробно несколько клинических случаев.
Клинический пример 1
Больная Д., 26 лет, обратилась с жалобами на учащенное мочеиспускание (15–20 раз в сутки) малыми порциями, сильную резь в промежности, возникающую в конце акта мочеиспускания. Указанные жалобы периодически возобновлялись в течение полутора лет. Больной неоднократно проводилась терапия антибактериальными препаратами – фторхинолонами и макролидами – курсами по 7–10 дней с временным эффектом.
При ультразвуковом исследовании (УЗИ) и экскреторной урографии патологических изменений органов мочевой системы выявлено не было. Исследование, проведенное с помощью методов прямой иммунофлюоресценции (ПИФ) и полимеразной цепной реакции (ПЦР), позволило исключить наличие специфических возбудителей. При двухстаканной пробе количество лейкоцитов в 1-й порции составило 20 в поле зрения, во 2-й порции – 15 в поле зрения. При бактериологическом исследовании мочи была выделена Escherichia coli в титре 5 × 10⁶, с высокой степенью чувствительности к фосфомицину. При цистоскопии были обнаружены гиперемия и отечность слизистой оболочки в области шейки мочевого пузыря с инъекцией сосудов и мелкими петехиальными кровоизлияниями.
Исследование иммунного статуса показало нарушения показателей фагоцитарного звена иммунной системы – был снижен фагоцитарный индекс (3,2). Кроме того, были снижены цитолитическая активность NK-клеток (63% от нормы) и количество NK-клеток, содержащих перфорин (132 кл/мкл).
Больной было проведено лечение фосфомицином по 3 г через 24 часа (всего 2 приема), диклофенаком в/м по 75 мг 1 р/сут, всего 5 инъекций, Вобэнзимом по 2 таблетки перорально 3 р/сут и препаратом Полиоксидоний по 6 мг внутримышечно через день – 5 инъекций, затем 2 раза в неделю – еще 5 инъекций.
Состояние больной стало улучшаться на 2-й день лечения. Контрольное обследование, проведенное через 2 недели после окончания лечения, показало отсутствие клинических проявлений заболевания, микроскопические и бактериологические анализы мочи были в норме. Согласно данным контрольного исследования иммунного статуса, цитолитическая активность NK-клеток нормализовалась. При контрольном обследовании, проведенном через 2 месяца после окончания лечения, анализы мочи были в норме, жалобы у больной отсутствовали.
Клинический пример 2
Больная К., 32 года, обратилась с жалобами на болезненное мочеиспускание. Указанные жалобы периодически возобновлялись в течение 1 года. Больная получала терапию антибактериальными и уросептическими препаратами курсами по 7–14 дней с временным эффектом.
УЗИ не показало патологических изменений органов мочевой системы. ПИФ и ПЦР позволили исключить наличие специфических возбудителей. При двухстаканной пробе мочи количество лейкоцитов в 1-й порции составило 30 в поле зрения, во 2-й порции – 20 в поле зрения. При бактериологическом исследовании мочи был выделен Enterococcus faecalis в титре 1 × 10⁵, с чувствительностью к фторхинолонам, нитрофурантоину.
Больной было проведено лечение Флексидом по 250 мг 1 р/сут в течение 5 дней и препаратом Полиоксидоний по 12 мг ректально через день – 10 суппозиториев на курс.
Состояние пациентки начало улучшаться на 3-й день лечения. При контрольном обследовании, проведенном через 2 недели после окончания лечения, симптомы цистита были выражены незначительно, результаты микроскопического и бактериологического анализов мочи нормализовались. При контрольном обследовании, проведенном через 4 месяца после окончания лечения, анализы мочи были в норме, больная жалоб не предъявляла.
Клинический пример 3
Больная С., 38 лет, обратилась с жалобами на частые рецидивы хронического необструктивного правостороннего пиелонефрита (3 случая за последний год). Больной проводилась терапия антибактериальными препаратами курсами по 10–15 дней с временным эффектом.
При УЗИ патологических изменений органов мочевой системы выявлено не было. По результатам микционной цистографии был исключен пузырно-мочеточниковый рефлюкс.
По результатам общего анализа мочи в момент обострения лейкоциты покрывали все поля зрения. При бактериологическом исследовании мочи был выделен Enterococcus faecalis в титре 5 × 10⁴ с чувствительностью к фторхинолонам (ципрофлоксацин) и устойчивостью к другим группам препаратов.
Больной было проведено лечение ципрофлоксацином по 500 мг 2 р/сут в течение 10 дней, противовоспалительными средствами, препаратами, улучшающими кровоток, и препаратом Полиоксидоний по 6 мг внутримышечно через день – 10 инъекций.
Состояние больной нормализовалось на 5-й день лечения. Общий анализ мочи, проведенный после окончания приема ципрофлоксацина, был в норме. Через 2 месяца на фоне хорошего самочувствия и нормальных анализов мочи пациентке был проведен повторный курс лечения препаратом Полиоксидоний по 12 мг ректально через день – на курс 10 суппозиториев. Через 8 месяцев после окончания последнего курса антибиотиков жалобы у пациентки отсутствовали, анализы были в норме.
Рассмотренные клинические случаи демонстрируют, что применение иммуномодуляторов при хронических ИМП позволяет не только добиться более раннего клинического и лабораторного излечения, но и обеспечить более стойкую ремиссию заболевания.
Опыт применения препарата Полиоксидоний у больных хроническим простатитом
Распространенность хронического простатита в общей популяции составляет 5–8% [28]. По данным отечественных и зарубежных авторов, хроническим простатитом страдают от 20 до 35% мужчин в возрасте от 20 до 40 лет. Кроме того, хронический простатит является первым по частоте урологическим заболеванием у мужчин до 50 лет и третьим – у мужчин старше 50 лет [28–30].
На сегодняшний день для лечения простатита применяется огромное количество лекарственных средств, включая биологически активные добавки. Во многом этот факт обусловлен низкой эффективностью стандартных схем терапии. Среди причин неэффективности традиционных методов ведения больных хроническим простатитом можно выделить следующие:
Наиболее распространенными возбудителями хронического простатита были и остаются грамотрицательные бактерии, которые попадают в предстательную железу из желудочно-кишечного тракта:
Многочисленные исследования, посвященные оценке иммунного статуса при инфекционно-воспалительных заболеваниях урогенитального тракта, свидетельствуют об изменении иммунологических показателей [33–35]. Однако следует отметить, что значимые количественные нарушения иммунитета могут отсутствовать, а выявляемые функциональные отклонения не всегда являются патологией. В то же время многие авторы отмечают положительное влияние ряда иммунотропных препаратов на общую эффективность лечения данной группы заболеваний. В этой связи необходимо систематизировать иммунотерапевтические подходы, выработать показания к назначению иммуномодуляторов, а также оценить эффективность иммуномодулирующей терапии.
В клинике урологии Первого МГМУ им. И.М. Сеченова на протяжении более 10 лет проводятся исследования показателей иммунного статуса при различных заболеваниях. Методика исследования иммунного статуса включает определение более 80 параметров. При исследовании иммунного статуса у больных хроническим простатитом в 67 и 70% случаев отмечается изменение свойств фагоцитирующих клеток, выражающееся в увеличении относительного и абсолютного числа моноцитов, что указывает на активацию данного звена иммунитета [36]. Однако у 52% больных индекс фагоцитоза (среднее число бактериальных клеток, поглощенное 1 фагоцитом) остается сниженным, а его среднее значение приближается к нижней границе нормы. Это говорит о дисфункции иммунной системы, когда рост фагоцитарной реакции обратно пропорционален ее незавершенности, и характеризует дефекты опсонизации и киллинга фагоцитирующих клеток или переваривающей способности фагоцитов.
NK-клетки (или натуральные киллеры) способны лизировать клетки, инфицированные возбудителем, или собственные измененные клетки. Известно 3 фенотипа NK-клеток, различающихся наличием на клеточной поверхности рецепторов к Fc-фрагменту IgG (CD16+) и нейрональных молекул клеточной адгезии (neural cell adhesion molecule, NCAM) (CD56+). Общее число NK-клеток и их цитолитические свойства (которые оценивались по содержанию внутриклеточного перфорина) изменены не были. Однако наблюдалось нарушение соотношения между фенотипами в популяции NK-клеток. Количество NK-клеток с низкой и высокой цитолитической активностью (CD16+56--NK и CD16-56+-NK) оказалось значительно выше верхней границы нормы у 61 и 64% больных соответственно, в то время как число NK-клеток с умеренной цитолитической активностью (CD16+56+-NK), которые составляют большую часть естественных киллеров, было снижено у 64% больных. Возможно, данные изменения свидетельствуют о нарушении клеточного звена иммунной защиты при хроническом воспалительном процессе нижних мочевых путей.
При анализе популяционного состава лимфоцитов не было выявлено количественных изменений, однако имелись изменения функциональных показателей Т-клеток. У 58% обследованных количество активированных CD4+HLA-DR+-Т-лимфоцитов было снижено, что может свидетельствовать о недостаточной антигенной стимуляции Т-клеток. Таким образом, можно предположить, что при длительных вялотекущих инфекциях иммунная система не всегда распознает возбудителя в качестве антигена, вследствие чего возникает недостаточность Т-клеточного звена иммунитета.
Отдельного внимания заслуживают CD4+25+-Т-клетки, популяция которых была увеличена у 73% обследованных нами больных. Эти клетки являются естественными регуляторами или супрессорами активности других Т-клеток, а повышение их количества и активности свидетельствует о наличии у больного интенсивной или продолжительной иммунной реакции, то есть длительного воспалительного процесса. Что касается CD8+-Т-клеток (цитолитические клетки/супрессоры), то у 52% больных регистрировались признаки их активации, что выражалось в повышении количества CD8+CD25+-Т-клеток. При этом дифференцировка CD8+-Т-клеток была замедленной: на фоне повышения количества «наивных» CD8+45RA+-Т-клеток (у 50% больных) количество CD8+28--Т-клеток, «стареющих» после реакции на антиген, было снижено у 48% больных.
Данные изменения указывают на наличие длительной иммунной реакции, отражающей хронический воспалительный процесс, и недостаточность Т-клеточного звена иммунитета. Существенных изменений состояния гуморального иммунитета у наших больных выявлено не было. Таким образом, учитывая наличие нарушений иммунной системы при хроническом простатите, одним из путей повышения эффективности антибактериальной и противовоспалительной терапии является применение иммуномодулирующих препаратов.
В настоящее время на фармацевтическом рынке представлено большое количество различных иммунных препаратов. Хорошо себя зарекомендовали в клинической практике отечественные синтетические и природные препараты, одним из которых является Полиоксидоний.
В клинике урологии Первого МГМУ им. И.М. Сеченова было проведено исследование по оценке клинической эффективности применения Полиоксидония в лечении хронического бактериального простатита. В это исследование были включены 140 пациентов с хроническим простатитом [36]. Для оценки эффективности иммуномодулирующей терапии Полиоксидонием все больные были разделены на 2 сопоставимые группы. Лечение пациентов первой – основной – группы (n = 70) проводилось антибактериальным препаратом в течение 28 дней и иммуномодулятором Полиоксидоний, который назначали по 6 мг внутримышечно 1 раз в сутки, первые две инъекции ежедневно, затем через день (всего 10 инъекций). Вторая – контрольная – группа (n = 70) получала только антибактериальные препараты в течение 28 дней. При анализе субъективной и объективной симптоматики определялась заметная положительная динамика в группе больных, получавших Полиоксидоний в сочетании с антибактериальным препаратом (1-я группа). После лечения жалобы полностью отсутствовали у 33 из 46 больных (таблица), у 4 (5,7%) отмечалось уменьшение выраженности клинической симптоматики.
При монотерапии антибактериальными препаратами у 14 (31,9%) из 44 больных хроническим простатитом в той или иной степени сохранялась субъективная симптоматика. По результатам контрольных обследований были получены следующие итоговые показатели эффективности лечения: в 1-й группе возбудителей не обнаружено у 62 из 70 (88,6%), во 2-й группе – у 51 из 70 пациентов (72,9%). Больным, у которых при контрольном обследовании выявлены инфекции, проводился повторный курс антибактериальной терапии.
Таким образом, наибольшая эффективность лечения больных хроническим простатитом была достигнута в первой группе при использовании антибиотиков в сочетании с иммуномодулятором Полиоксидоний. При исследовании иммунного статуса у больных хроническим простатитом отмечены следующие изменения:
Заключение
Таким образом, комбинированная терапия с использованием помимо антибактериальных препаратов иммуномодулятора Полиоксидоний позволяет нанести по возбудителю «двойной» удар. Антибиотик или другое химиотерапевтическое средство понижает функциональную активность микроба, а иммуномодулятор повышает функциональную активность фагоцитарных клеток, за счет чего достигается более эффективная элиминация возбудителя.
Инфекции мочевых путей (ИМП) – одни из самых распространенных инфекционных заболеваний, которые встречаются в амбулаторной и внутрибольничной урологической практике. Причиной до 90% случаев всех ИМП являются бактерии семейства Enterobacteriaceae, а также Pseudomonas aeruginosa, Enterococcus faecalis, Staphylococcus saprophyticus. В свою очередь Staphylococcus aureus, Staphylococcus epidermidis, Gardnerella vaginalis, Streptococcus spp., дифтероиды, лактобациллы, анаэробы практически не вызывают ИМП, хотя также колонизуют кожу, слизистую оболочку прямой кишки и влагалища. Необходимо отметить, что в настоящее время редко регистрируется моноинфекция ИМП. Возникают также трудности с идентификацией организмов, которые во многом обусловлены распространением протопластов и L-форм микроорганизмов, более устойчивых к антибактериальной терапии и не растущих на обычных питательных средах [1–4].
Одной из ключевых причин хронизации ИМП в настоящее время считается нарушение иммунитета. Слизистые оболочки являются естественной первой линией противомикробной защиты. Доказано, что для больных с рецидивирующими ИМП характерны изменения иммунного ответа в виде нарушения отдельных функций нейтрофилов (хемотаксис, фагоцитоз, бактерицидность) [5–9], снижения активности интерлейкина (ИЛ) 2 [10] и уровня ИЛ-8 в моче, способствующего миграции нейтрофилов в просвет мочевого пузыря [7, 8], а также секреторного IgA [11, 12], который блокирует прикрепление бактерий к эпителиальным клеткам.
Под воздействием токсических факторов инфекционных агентов происходят не только деструктивные изменения, но и подавляется фагоцитарная активность лейкоцитов, в крови уменьшается количество NK-клеток (CD16+) [6, 13, 14], снижается абсолютное количество лимфоцитов и уменьшается общая популяция Т-лимфоцитов (CD3+) и Т-хелперов (CD4+). Одновременно увеличивается количество Т-супрессоров (CD8+) [15–17]. Наблюдается снижение уровня всех фракций иммуноглобулинов (IgA, IgM и IgG) и некоторых цитокинов (ИЛ-2) [18, 19].
Благодаря исследованиям последних лет было доказано, что каждая из инфекций органов мочеполовой системы может подавлять Т- и В-клеточные звенья иммунной системы, вызывая нарушения микробиоценоза, которые обусловлены постоянным поступлением в кровь продуктов воспаления, тканевого и клеточного детрита, снижением защитных свойств слизистых оболочек и секрета желез. Все это приводит к развитию аутоиммунного воспаления [20–25].
Иммунодефицит при хронических заболеваниях может быть обусловлен длительно персистирующими микроорганизмами, оказывающими токсическое действие на костный мозг, вилочковую железу, а также Т- и В-лимфоциты [20].
Учитывая доказанную роль иммунных нарушений в развитии хронических ИМП, перспективным представляется применение в комплексной терапии иммуномодуляторов широкого спектра действия, характеризующихся низкой частотой развития побочных эффектов (таких как Полиоксидоний).
Полиоксидоний – отечественный препарат, обладающий не только иммунотропной, но также и выраженной детоксикационной активностью, которая не определяется активацией иммунных механизмов. Положительное действие Полиоксидония на организм человека проявляется в 4 основных его эффектах – иммуномодулирующем, детоксицирующем, антиоксидантном, мембраностабилизирующем [26].
Иммуномодулирующий эффект Полиоксидония связан с его способностью воздействовать на факторы естественной резистентности: моноциты/макрофаги, нейтрофилы и естественные киллеры, а также на факторы приобретенного иммунитета – гуморального и клеточного. Полиоксидоний взаимодействует с внешней мембраной клеток иммунной системы, на поверхности которых формируется сигнал в виде входящих токов ионов кальция, активирующий клетки [27]. Взаимодействие Полиоксидония с нейтрофилами и моноцитами ведет к изменению их функциональной активности, что проявляется усилением синтеза цитокинов и фагоцитоза. При взаимодействии Полиоксидония с нейтрофилами активируется их миграция в очаг воспаления. Взаимодействуя с мононуклеарами периферической крови человека, Полиоксидоний усиливает цитотоксичность NK-клеток, но только в том случае, если эта цитотоксичность была исходно понижена. При нормальном или повышенном уровне цитотоксичности он не оказывает влияния. Таким образом, клетками-мишенями для Полиоксидония являются прежде всего факторы естественной резистентности: моноциты/макрофаги, нейтрофилы и NK-клетки, то есть факторы ранней защиты организма от инфекции. Следует подчеркнуть, что иммуномодулирующее действие Полиоксидония зависит от исходного состояния функциональной активности факторов иммунной системы.
Антиоксидантный эффект Полиоксидония проявляется в способности нейтрализации кислородных радикалов, при этом уменьшается риск повреждения тканей и снижается острота воспалительного процесса [26].
В урологии Полиоксидоний применяют в комплексной терапии хронических ИМП – цистита, пиелонефрита, для лечения простатитов, урогенитальных инфекций. Полиоксидоний назначают парентерально (в/м, внутривенно) или ректально.
С 2010 по 2013 г. в Российско-израильском медицинском центре «РАМБАМ» препаратом Полиоксидоний было пролечено 86 пациенток с хроническим циститом и 18 больных хроническим пиелонефритом. Рассмотрим более подробно несколько клинических случаев.
Клинический пример 1
Больная Д., 26 лет, обратилась с жалобами на учащенное мочеиспускание (15–20 раз в сутки) малыми порциями, сильную резь в промежности, возникающую в конце акта мочеиспускания. Указанные жалобы периодически возобновлялись в течение полутора лет. Больной неоднократно проводилась терапия антибактериальными препаратами – фторхинолонами и макролидами – курсами по 7–10 дней с временным эффектом.
При ультразвуковом исследовании (УЗИ) и экскреторной урографии патологических изменений органов мочевой системы выявлено не было. Исследование, проведенное с помощью методов прямой иммунофлюоресценции (ПИФ) и полимеразной цепной реакции (ПЦР), позволило исключить наличие специфических возбудителей. При двухстаканной пробе количество лейкоцитов в 1-й порции составило 20 в поле зрения, во 2-й порции – 15 в поле зрения. При бактериологическом исследовании мочи была выделена Escherichia coli в титре 5 × 10⁶, с высокой степенью чувствительности к фосфомицину. При цистоскопии были обнаружены гиперемия и отечность слизистой оболочки в области шейки мочевого пузыря с инъекцией сосудов и мелкими петехиальными кровоизлияниями.
Исследование иммунного статуса показало нарушения показателей фагоцитарного звена иммунной системы – был снижен фагоцитарный индекс (3,2). Кроме того, были снижены цитолитическая активность NK-клеток (63% от нормы) и количество NK-клеток, содержащих перфорин (132 кл/мкл).
Больной было проведено лечение фосфомицином по 3 г через 24 часа (всего 2 приема), диклофенаком в/м по 75 мг 1 р/сут, всего 5 инъекций, Вобэнзимом по 2 таблетки перорально 3 р/сут и препаратом Полиоксидоний по 6 мг внутримышечно через день – 5 инъекций, затем 2 раза в неделю – еще 5 инъекций.
Состояние больной стало улучшаться на 2-й день лечения. Контрольное обследование, проведенное через 2 недели после окончания лечения, показало отсутствие клинических проявлений заболевания, микроскопические и бактериологические анализы мочи были в норме. Согласно данным контрольного исследования иммунного статуса, цитолитическая активность NK-клеток нормализовалась. При контрольном обследовании, проведенном через 2 месяца после окончания лечения, анализы мочи были в норме, жалобы у больной отсутствовали.
Клинический пример 2
Больная К., 32 года, обратилась с жалобами на болезненное мочеиспускание. Указанные жалобы периодически возобновлялись в течение 1 года. Больная получала терапию антибактериальными и уросептическими препаратами курсами по 7–14 дней с временным эффектом.
УЗИ не показало патологических изменений органов мочевой системы. ПИФ и ПЦР позволили исключить наличие специфических возбудителей. При двухстаканной пробе мочи количество лейкоцитов в 1-й порции составило 30 в поле зрения, во 2-й порции – 20 в поле зрения. При бактериологическом исследовании мочи был выделен Enterococcus faecalis в титре 1 × 10⁵, с чувствительностью к фторхинолонам, нитрофурантоину.
Больной было проведено лечение Флексидом по 250 мг 1 р/сут в течение 5 дней и препаратом Полиоксидоний по 12 мг ректально через день – 10 суппозиториев на курс.
Состояние пациентки начало улучшаться на 3-й день лечения. При контрольном обследовании, проведенном через 2 недели после окончания лечения, симптомы цистита были выражены незначительно, результаты микроскопического и бактериологического анализов мочи нормализовались. При контрольном обследовании, проведенном через 4 месяца после окончания лечения, анализы мочи были в норме, больная жалоб не предъявляла.
Клинический пример 3
Больная С., 38 лет, обратилась с жалобами на частые рецидивы хронического необструктивного правостороннего пиелонефрита (3 случая за последний год). Больной проводилась терапия антибактериальными препаратами курсами по 10–15 дней с временным эффектом.
При УЗИ патологических изменений органов мочевой системы выявлено не было. По результатам микционной цистографии был исключен пузырно-мочеточниковый рефлюкс.
По результатам общего анализа мочи в момент обострения лейкоциты покрывали все поля зрения. При бактериологическом исследовании мочи был выделен Enterococcus faecalis в титре 5 × 10⁴ с чувствительностью к фторхинолонам (ципрофлоксацин) и устойчивостью к другим группам препаратов.
Больной было проведено лечение ципрофлоксацином по 500 мг 2 р/сут в течение 10 дней, противовоспалительными средствами, препаратами, улучшающими кровоток, и препаратом Полиоксидоний по 6 мг внутримышечно через день – 10 инъекций.
Состояние больной нормализовалось на 5-й день лечения. Общий анализ мочи, проведенный после окончания приема ципрофлоксацина, был в норме. Через 2 месяца на фоне хорошего самочувствия и нормальных анализов мочи пациентке был проведен повторный курс лечения препаратом Полиоксидоний по 12 мг ректально через день – на курс 10 суппозиториев. Через 8 месяцев после окончания последнего курса антибиотиков жалобы у пациентки отсутствовали, анализы были в норме.
Рассмотренные клинические случаи демонстрируют, что применение иммуномодуляторов при хронических ИМП позволяет не только добиться более раннего клинического и лабораторного излечения, но и обеспечить более стойкую ремиссию заболевания.
Опыт применения препарата Полиоксидоний у больных хроническим простатитом
Распространенность хронического простатита в общей популяции составляет 5–8% [28]. По данным отечественных и зарубежных авторов, хроническим простатитом страдают от 20 до 35% мужчин в возрасте от 20 до 40 лет. Кроме того, хронический простатит является первым по частоте урологическим заболеванием у мужчин до 50 лет и третьим – у мужчин старше 50 лет [28–30].
На сегодняшний день для лечения простатита применяется огромное количество лекарственных средств, включая биологически активные добавки. Во многом этот факт обусловлен низкой эффективностью стандартных схем терапии. Среди причин неэффективности традиционных методов ведения больных хроническим простатитом можно выделить следующие:
- изменение спектра возбудителей хронического простатита;
- выбор антибактериального или противомикробного препарата, плохо проникающего в ткань предстательной железы, или препарата с низкой антибактериальной активностью;
- короткий курс лечения (менее 4 недель);
- полирезистентная флора;
- вторичные иммунодефициты.
Наиболее распространенными возбудителями хронического простатита были и остаются грамотрицательные бактерии, которые попадают в предстательную железу из желудочно-кишечного тракта:
- Escherichia coli;
- Enterococcus faecium, Еnterococcus faecalis;
- Enterobacter spp. (Еnterobacter aerogenes, Еnterobacter amnigenus, Еnterobacter agglomerans, Еnterobacter cloacae);
- Proteus mirabilis, Рroteus vulgaris и Рroteus penneri;
- Klebsiella pneumoniae;
- Pseudomonas aeruginosa;
- Staphylococcus saprophyticus, Staphylococcus aureus, Staphylococcus epidermidis.
Многочисленные исследования, посвященные оценке иммунного статуса при инфекционно-воспалительных заболеваниях урогенитального тракта, свидетельствуют об изменении иммунологических показателей [33–35]. Однако следует отметить, что значимые количественные нарушения иммунитета могут отсутствовать, а выявляемые функциональные отклонения не всегда являются патологией. В то же время многие авторы отмечают положительное влияние ряда иммунотропных препаратов на общую эффективность лечения данной группы заболеваний. В этой связи необходимо систематизировать иммунотерапевтические подходы, выработать показания к назначению иммуномодуляторов, а также оценить эффективность иммуномодулирующей терапии.
В клинике урологии Первого МГМУ им. И.М. Сеченова на протяжении более 10 лет проводятся исследования показателей иммунного статуса при различных заболеваниях. Методика исследования иммунного статуса включает определение более 80 параметров. При исследовании иммунного статуса у больных хроническим простатитом в 67 и 70% случаев отмечается изменение свойств фагоцитирующих клеток, выражающееся в увеличении относительного и абсолютного числа моноцитов, что указывает на активацию данного звена иммунитета [36]. Однако у 52% больных индекс фагоцитоза (среднее число бактериальных клеток, поглощенное 1 фагоцитом) остается сниженным, а его среднее значение приближается к нижней границе нормы. Это говорит о дисфункции иммунной системы, когда рост фагоцитарной реакции обратно пропорционален ее незавершенности, и характеризует дефекты опсонизации и киллинга фагоцитирующих клеток или переваривающей способности фагоцитов.
NK-клетки (или натуральные киллеры) способны лизировать клетки, инфицированные возбудителем, или собственные измененные клетки. Известно 3 фенотипа NK-клеток, различающихся наличием на клеточной поверхности рецепторов к Fc-фрагменту IgG (CD16+) и нейрональных молекул клеточной адгезии (neural cell adhesion molecule, NCAM) (CD56+). Общее число NK-клеток и их цитолитические свойства (которые оценивались по содержанию внутриклеточного перфорина) изменены не были. Однако наблюдалось нарушение соотношения между фенотипами в популяции NK-клеток. Количество NK-клеток с низкой и высокой цитолитической активностью (CD16+56--NK и CD16-56+-NK) оказалось значительно выше верхней границы нормы у 61 и 64% больных соответственно, в то время как число NK-клеток с умеренной цитолитической активностью (CD16+56+-NK), которые составляют большую часть естественных киллеров, было снижено у 64% больных. Возможно, данные изменения свидетельствуют о нарушении клеточного звена иммунной защиты при хроническом воспалительном процессе нижних мочевых путей.
При анализе популяционного состава лимфоцитов не было выявлено количественных изменений, однако имелись изменения функциональных показателей Т-клеток. У 58% обследованных количество активированных CD4+HLA-DR+-Т-лимфоцитов было снижено, что может свидетельствовать о недостаточной антигенной стимуляции Т-клеток. Таким образом, можно предположить, что при длительных вялотекущих инфекциях иммунная система не всегда распознает возбудителя в качестве антигена, вследствие чего возникает недостаточность Т-клеточного звена иммунитета.
Отдельного внимания заслуживают CD4+25+-Т-клетки, популяция которых была увеличена у 73% обследованных нами больных. Эти клетки являются естественными регуляторами или супрессорами активности других Т-клеток, а повышение их количества и активности свидетельствует о наличии у больного интенсивной или продолжительной иммунной реакции, то есть длительного воспалительного процесса. Что касается CD8+-Т-клеток (цитолитические клетки/супрессоры), то у 52% больных регистрировались признаки их активации, что выражалось в повышении количества CD8+CD25+-Т-клеток. При этом дифференцировка CD8+-Т-клеток была замедленной: на фоне повышения количества «наивных» CD8+45RA+-Т-клеток (у 50% больных) количество CD8+28--Т-клеток, «стареющих» после реакции на антиген, было снижено у 48% больных.
Данные изменения указывают на наличие длительной иммунной реакции, отражающей хронический воспалительный процесс, и недостаточность Т-клеточного звена иммунитета. Существенных изменений состояния гуморального иммунитета у наших больных выявлено не было. Таким образом, учитывая наличие нарушений иммунной системы при хроническом простатите, одним из путей повышения эффективности антибактериальной и противовоспалительной терапии является применение иммуномодулирующих препаратов.
В настоящее время на фармацевтическом рынке представлено большое количество различных иммунных препаратов. Хорошо себя зарекомендовали в клинической практике отечественные синтетические и природные препараты, одним из которых является Полиоксидоний.
В клинике урологии Первого МГМУ им. И.М. Сеченова было проведено исследование по оценке клинической эффективности применения Полиоксидония в лечении хронического бактериального простатита. В это исследование были включены 140 пациентов с хроническим простатитом [36]. Для оценки эффективности иммуномодулирующей терапии Полиоксидонием все больные были разделены на 2 сопоставимые группы. Лечение пациентов первой – основной – группы (n = 70) проводилось антибактериальным препаратом в течение 28 дней и иммуномодулятором Полиоксидоний, который назначали по 6 мг внутримышечно 1 раз в сутки, первые две инъекции ежедневно, затем через день (всего 10 инъекций). Вторая – контрольная – группа (n = 70) получала только антибактериальные препараты в течение 28 дней. При анализе субъективной и объективной симптоматики определялась заметная положительная динамика в группе больных, получавших Полиоксидоний в сочетании с антибактериальным препаратом (1-я группа). После лечения жалобы полностью отсутствовали у 33 из 46 больных (таблица), у 4 (5,7%) отмечалось уменьшение выраженности клинической симптоматики.
При монотерапии антибактериальными препаратами у 14 (31,9%) из 44 больных хроническим простатитом в той или иной степени сохранялась субъективная симптоматика. По результатам контрольных обследований были получены следующие итоговые показатели эффективности лечения: в 1-й группе возбудителей не обнаружено у 62 из 70 (88,6%), во 2-й группе – у 51 из 70 пациентов (72,9%). Больным, у которых при контрольном обследовании выявлены инфекции, проводился повторный курс антибактериальной терапии.
Таким образом, наибольшая эффективность лечения больных хроническим простатитом была достигнута в первой группе при использовании антибиотиков в сочетании с иммуномодулятором Полиоксидоний. При исследовании иммунного статуса у больных хроническим простатитом отмечены следующие изменения:
- нормализация количества активированных CD4+25+-T-лимфоцитов (у 62,5% больных);
- увеличение числа больных с нормальным содержанием перфорина в NK-клетках (с 70 до 87,5%) и с нормальным количеством NK-клеток с умеренной цитолитической активностью (с 36 до 75%);
- повышение индекса пролиферации Т-лимфоцитов в ответ на активацию фитогемагглютинина (нормальное значение было отмечено у 39% больных исходно и 50% больных после лечения);
- повышение фагоцитарного индекса.
Таким образом, комбинированная терапия с использованием помимо антибактериальных препаратов иммуномодулятора Полиоксидоний позволяет нанести по возбудителю «двойной» удар. Антибиотик или другое химиотерапевтическое средство понижает функциональную активность микроба, а иммуномодулятор повышает функциональную активность фагоцитарных клеток, за счет чего достигается более эффективная элиминация возбудителя.
1. Яковлев С.В. Современные подходы к антибактериальной терапии инфекций мочевыводящих путей // Consilium medicum. 2001. № 7. С. 300–306.
2. Яковлев С.В., Дворецкий Л.И., Суворова М.П. Бактериальные инфекции в амбулаторной практике: выбор оптимального антибактериального препарата // Consilium medicum. 2002. № 1. С. 10–21.
3. Яковлев С.В., Деревянко И.И. Инфекция мочевыводящих путей. Учебно-методическое пособие для врачей. М.: Медиа Медика, 2001.
4. Яковлев С.В., Деревянко И.И. Какие антибиотики действительно нужны для лечения урогенитальных инфекций? // Consilium medicum. 2004. № 1. С. 40–45.
5. Agace W.W., Hedges S.R., Ceska M. et al. Interleukin-8 and the neutrophil response to mucosal gram-negative infection // J. Clin. Invest. 1993. Vol. 92. № 2. P. 780–785.
6. Condron C., Toomey D., Casey R.G. et al. Neutrophil bactericidal function is defective in patients with recurrent urinary tract infections // Urol. Res. 2003. Vol. 31. № 5. P. 329–334.
7. Frendeus B., Godaly G., Hang L. et al. Interleukin 8 receptor deficiency confers susceptibility to acute experimental pyelonephritis and may have a human counterpart // J. Exp. Med. 2000. Vol. 192. № 6. P. 881–890.
8. Godaly G., Bergsten G., Hang L. et al. Neutrophil recruitment, chemokine receptors, and resistance to mucosal infection // J. Leukoc. Biol. 2001. Vol. 69. № 6. P. 899–906.
9. Haraoka M., Hang L., Frendeus B. et al. Neutrophil recruitment and resistance to urinary tract infection // J. Infect. Dis. 1999. Vol. 180. № 4. P.1220–1229.
10. Fleischmann J.D., Wentworth D.B., Thomas K.M. et al. Urinary interleukin-2 inhibition in patients with cystitis // Immunol. Invest. 1989. Vol. 18. № 6. P. 825–831.
11. James-Ellison M.Y., Roberts R., Verrier-Jones K. et al. Mucosal immunity in the urinary tract: changes in sIgA, FSC and total IgA with age and in urinary tract infection // Clin. Nephrol. 1997. Vol. 48. № 2. P. 69–78.
12. Suman E., Gopalkrishna Bhat K., Hegde B.M. Bacterial adherence and immune response in recurrent urinary tract infection // Int. J. Gynaecol. Obstet. 2001. Vol. 75. № 3. P. 263–268.
13. Khan A.J., Kumar K., Evans H.E. Role of neutrophil chemotaxis in the pathogenesis of urinary tract infection // J. Urol. 1987. Vol. 137. № 2. P. 342–344.
14. Tambic A., Kes P., Milutinovic S. et al. Phagocytic function in patients with recurrent urinary tract infections // Acta Med. Croatica. 1992. Vol. 46. № 1. P. 21–25.
15. Hoepelman A.I., van Buren M., van den Broek J. et al. Bacteriuria in men infected with HIV-1 is related to their immune status (CD4+ cell count) // AIDS. 1992. Vol. 6. № 2. P. 179–184.
16. Hopkins W.J., James L.J., Balish E. et al. Congenital immunodeficiencies in mice increase susceptibility to urinary tract infection // J. Urol. 1993. Vol. 149. № 4. P. 922–925.
17. Su H., Caldwell H.D. CD4+ T-cells play a significans role in adoptive immunity to Chlamydia trachomatis infection of the mouse genital tract // Infect. Immunol. 1995. Vol. 63. № 9. P. 3302–3308.
18. Mattila J., Linder E. Immunoglobulin deposits in bladder epithelium and vessels in interstitial cystitis: possible relationship to circulating anti-intermediate filament autoantibodies // Clin. Immunol. Immunopathol. 1984. Vol. 2. № 1. P. 81–89.
19. Mattila J., Harmoinen A., Hällström O. Serum immunoglobulin and complement alterations in interstitial cystitis // Eur. Urol. 1983. Vol. 9. № 6. P. 350–352.
20. Дидковский Н.А., Малашенкова И.К. Принципы иммунокорригирующей терапии вторичных иммунодефицитов, ассоциированных с хронической вирусно-бактериальной инфекцией // Русский медицинский журнал. 2002. Т. 10. № 21. С. 973–977.
21. Leonardo E., Dogliotti C., Navone R. Autoimmune aspects of a case of chronic interstitial cystitis // Minerva Med. 1986. Vol. 77. № 27. P. 1323–1326.
22. Mattila J. Vascular immunopathology in interstitial cystitis // Clin. Immunol. Immunopathol. 1982. Vol. 23. № 3. P. 648–655.
23. Naber K.G., Bergman B., Bishop M.C. et al. EAU Guidelines for the management of urinary and male genital tract infections // Eur. Urol. 2001. Vol. 40. № 5. P. 576–588.
24. Naber K.G., Bergman B., Bishop M.C. et al. Guidelines on urinary and male genital tract infections. EAU, 2000 // www.uroweb.org.
25. Ochs R.L., Stein T.W. Jr., Peebles C.L. et al. Autoantibodies in interstitial cystitis // J. Urol. 1994. Vol. 151. № 3. P. 587–592.
26. Петров Р.В., Хаитов Р.М., Некрасов А.В. и др. Полиоксидоний – иммуномодулятор последнего поколения: итоги трехлетнего клинического применения // Аллергия, астма и клиническая иммунология. 1999. № 3. С. 3–6.
27. Султанова Е.А. Диагностика и коррекция иммунных нарушений при хронических неосложненных инфекциях нижних мочевых путей, вызванных условно-патогенной микрофлорой: дис. ... канд. мед. наук. М., 2006.
28. Ткачук В.Н., Горбачев А.Г., Агулянский Л.Н. Хронический простатит. Л., 1989. 208 с.
29. Лопаткин Н.А., Сивков А.В., Аполихин О.И. и др. Хронический простатит: монография на CD-ROM. М.: НИИ урологии МЗ РФ, 2004.
30. Nickel J.C. Prostatitis: evolving management strategies // Urologic Clinics of North America. 1999. Vol. 26. № 4. P. 737–751.
31. Рациональная фармакотерапия в урологии / под ред. Н.А. Лопаткина, Т.С. Перепановой. М.: Литтерра, 2006. 824 с.
32. Степенский А.Б., Попов С.В., Муфагед М.Л. Диагностика и лечение хронического простатита // Consilium medicum. 2003. Т. 5. № 7. С. 396–401.
33. Разумов С.В., Медведев А.А., Чирун Н.В. и др. Роль цитокинов в диагностике хронического простатита // Урология. 2003. № 6. С. 25–28.
34. Алленов С.Н., Иванов О.Л. Иммунологические аспекты применения Полиоксидония в комплексной терапии осложненного урогенитального хламидиоза // Рос. журн. кож. и вен. болезней. 2002. № 2. С. 58–61.
35. Дубенский В.В. Болезнь Рейтера (обзор литературы) // Рос. журн. кож. и вен. болезней. 1999. № 5. С. 26–29.
36. Шпоть Е.В., Султанова Е.А. Оптимизация лечения больных хроническим простатитом // Эффективная фармакотерапия. Урология. 2011. № 4. С. 42–49.
Polyoxidonium in the treatment of urological diseases
Ye.A. Sultanova1, Ye.V. Shpot2
1 The Russian-Israeli medical center ‘Rambam’
2 I.M. Sechenov First Moscow State Medical University
Contact person: Yelena Anatolyevna Sultanova, elesultanova@rambler.ru
The article substantiates expediency of complex treatment of inflammatory urological diseases. The advantages of the use of immunomodulating and antibacterial therapy, compared with monotherapy with antibiotics are shown. In the example of Polyoxidonium have been demonstrated the efficacy of inclusion of immunomodulators in the treatment of cystitis, pyelonephritis, prostatitis.
Key words: urinary tract infections, cystitis, pyelonephritis, prostatitis, immunomodulatory therapy, Polyoxidonium
Ye.A. Sultanova1, Ye.V. Shpot2
1 The Russian-Israeli medical center ‘Rambam’
2 I.M. Sechenov First Moscow State Medical University
Contact person: Yelena Anatolyevna Sultanova, elesultanova@rambler.ru
The article substantiates expediency of complex treatment of inflammatory urological diseases. The advantages of the use of immunomodulating and antibacterial therapy, compared with monotherapy with antibiotics are shown. In the example of Polyoxidonium have been demonstrated the efficacy of inclusion of immunomodulators in the treatment of cystitis, pyelonephritis, prostatitis.
Key words: urinary tract infections, cystitis, pyelonephritis, prostatitis, immunomodulatory therapy, Polyoxidonium
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье обосновывается целесообразность комплексного лечения воспалительных урологических заболеваний. Показаны преимущества назначения иммуномодулирующей и антибактериальной терапии по сравнению с монотерапией антибиотиками. На примере препарата Полиоксидоний продемонстрирована эффективность включения иммуномодуляторов в терапию цистита, пиелонефрита, простатита.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
