Применение препаратов Роноцит® и Кокарнит® у пациентов с неврологическими осложнениями метаболического синдрома
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В ходе проспективно-ретроспективного обследования 98 пациентов с сахарным диабетом (СД) 2-го типа и метаболическим синдромом (МС) изучалась эффективность препаратов Роноцит® и Кокарнит®. Оценивались состояние когнитивных функций, выраженность полиневропатии (ПНП), эффективность лечения.
Результаты. Одновременное применение препаратов Роноцит® и Кокарнит® способствовало более выраженному и стойкому эффекту в виде улучшения когнитивных функций. На фоне применения препарата Кокарнит® у пациентов с диабетической ПНП отмечался противоболевой эффект
на протяжении не менее семи недель. Нежелательные явления развивались редко, носили легкий характер, не влияли на выбранный режим терапии. Случаев лекарственных взаимодействий не зарегистрировано.
Заключение. Результаты проведенного исследования продемонстрировали высокую эффективность одновременного применения препаратов Кокарнит® и Роноцит® у пациентов как с СД 2-го типа, так и с МС с поражением центральной и периферической нервной системы.
Материал и методы. В ходе проспективно-ретроспективного обследования 98 пациентов с сахарным диабетом (СД) 2-го типа и метаболическим синдромом (МС) изучалась эффективность препаратов Роноцит® и Кокарнит®. Оценивались состояние когнитивных функций, выраженность полиневропатии (ПНП), эффективность лечения.
Результаты. Одновременное применение препаратов Роноцит® и Кокарнит® способствовало более выраженному и стойкому эффекту в виде улучшения когнитивных функций. На фоне применения препарата Кокарнит® у пациентов с диабетической ПНП отмечался противоболевой эффект
на протяжении не менее семи недель. Нежелательные явления развивались редко, носили легкий характер, не влияли на выбранный режим терапии. Случаев лекарственных взаимодействий не зарегистрировано.
Заключение. Результаты проведенного исследования продемонстрировали высокую эффективность одновременного применения препаратов Кокарнит® и Роноцит® у пациентов как с СД 2-го типа, так и с МС с поражением центральной и периферической нервной системы.


Метаболический синдром (МС) в целом и его отдельные компоненты, в частности гипергликемия, связаны с вовлечением в патологический процесс различных органов и систем организма. На фоне МС повышается риск развития цереброваскулярной и сердечно-сосудистой патологии, поражения центральной и периферической нервной системы [1]. МС рассматривают также в качестве фактора риска развития когнитивных нарушений (КН) [2]. Повреждение центральной нервной системы (ЦНС) обусловлено не только непосредственно гипергликемией, которая, несомненно, оказывает негативное влияние, но и инсулинорезистентностью, нарушением микро- и макроциркуляции, активацией процессов перекисного окисления липидов и воспаления, многими другими факторами [3, 4]. Вклад в формирование и прогрессирование цереброваскулярной и нейродегенеративной патологии вносит и поражение периферической нервной системы. Полиневропатия (ПНП) на фоне МС или сахарного диабета (СД) 2-го типа – не только маркер распространенного поражения нервной системы, но и важный патогенетический элемент поражения ЦНС [5].
Ключевым направлением предупреждения неврологических осложнений МС является своевременная (до развития тяжелых структурных изменений в органах) и максимально полная коррекция имеющихся факторов сердечно-сосудистого риска, включая нормализацию пищевого поведения, контроль массы тела, увеличение физической активности [6–8]. Наряду с немедикаментозными методами лечения пациентам обязательно назначают рациональную фармакотерапию, воздействующую на центральную и периферическую нервную систему.
У пациентов с заболеваниями головного мозга, в том числе сопровождающимися КН, высокоэффективен цитиколин (Роноцит®) [9–11]. Применение препарата в комплексе с другими лечебными мероприятиями обеспечивает более полную компенсацию неврологического дефицита, уменьшение выраженности КН, достижение более высокого уровня независимости в повседневной жизни.
У пациентов с поражением нервной системы при МС, нарушением толерантности к глюкозе, СД роль витаминов группы B переоценить сложно [12]. Сбалансированным комплексом витаминов с включением метаболически активных веществ (никотинамид, кокарбоксилаза и проч.), улучшающих обмен веществ в тканях и их энергообеспечение, является препарат Кокарнит®. Показана эффективность препарата у пациентов с диабетической ПНП в виде уменьшения интенсивности болевого синдрома, восстановления сниженной чувствительности [13, 14]. Положительный эффект препарата обусловлен комплексным воздействием на обменные процессы и подавлением хронического воспаления [15, 16].
Ранее эффективность одновременного применения препаратов Роноцит® и Кокарнит® у пациентов с МС и СД не изучалась.
Цель настоящего исследования – оценить эффективность и безопасность препаратов Роноцит® и Кокарнит® у пациентов с нарушениями углеводного обмена в условиях реальной клинической практики.
Задачи исследования:
- проанализировать динамику показателей по Монреальской шкале оценки когнитивных функций (МоСА) у больных СД 2-го типа и МС на фоне применения препаратов Роноцит® и Кокарнит®;
- сравнить динамику показателей по МоСА у больных СД 2-го типа и МС на фоне применения только препарата Роноцит® и его комбинации с препаратом Кокарнит® в отношении выраженности проявлений ПНП;
- оценить влияние препаратов Роноцит® и Кокарнит® на течение ПНП у пациентов с СД 2-го типа и МС;
- определить переносимость препаратов Роноцит® и Кокарнит® в условиях реальной клинической практики, в том числе риск развития лекарственных взаимодействий.
Материал и методы
Проведено проспективно-ретроспективное наблюдательное несравнительное исследование влияния препаратов Роноцит® и Кокарнит® на выраженность неврологических проявлений у пациентов с нарушениями углеводного обмена. Препараты Роноцит® и Кокарнит® назначались в соответствии с инструкциями по их медицинскому применению, исходя из показаний и противопоказаний к их использованию амбулаторно в условиях реальной клинической практики.
Критерии включения в исследование:
- возраст от 45 до 65 лет;
- подтвержденный диагноз МС (наличие трех и более из перечисленных признаков: объем талии > 102 см у мужчин или > 88 см у женщин; концентрация триглицеридов в крови > 150 мг/дл/1,7 ммоль/л; артериальное давление > 130/80 мм рт. ст. или прием антигипертензивных препаратов; уровень холестерина липопротеинов высокой плотности < 40 мг/дл (1,03 ммоль/л) у мужчин или < 50 мг/дл (1,229 ммоль/л) у женщин; содержание глюкозы в плазме крови натощак > 100 мг/дл (5,6 ммоль/л)) или установленный эндокринологом диагноз СД 2-го типа;
- умеренные/мягкие когнитивные нарушения (> 24 баллов по МоСА);
- готовность пациента участвовать в исследовании.
Критерии невключения:
- возраст младше 45 или старше 65 лет;
- выраженные когнитивные нарушения (≤ 24 баллов по МоСА);
- заболевания и поражения головного мозга различной давности и этиологии (сосудистые, травматические, воспалительные) со стойким остаточным неврологическим дефицитом;
- любые новообразования головного мозга различной давности;
- острые заболевания сердечно-сосудистой системы (инфаркт миокарда, острые нарушения мозгового кровообращения);
- тяжелые или находящиеся в стадии декомпенсации соматические заболевания (почечная, печеночная или сердечная недостаточность);
- клинически диагностированные выраженные тревожные/депрессивные расстройства, способные повлиять на возможность участия в исследовании;
- прочие заболевания и состояния, способные, по мнению лечащего врача, повлиять на возможность участия в исследовании;
- непереносимость компонентов препаратов Роноцит® и Кокарнит®;
- одновременный прием препаратов, содержащих витамины группы B, холинергических и противодементных средств;
- нежелание или неготовность участвовать в исследовании.
Пациент мог прекратить участие в исследовании в любое время по разным причинам.
Дизайн исследования предусматривал три визита в лечебное учреждение: визит 1 – включение в исследование/назначение препарата; визит 2 – через четыре недели от начала лечения; визит 3 – через восемь недель от начала лечения (табл. 1).
Всем больным проводилось неврологическое обследование с оценкой состояния когнитивных функций (по МоСА) и периферической нервной системы на наличие ПНП. Выраженность болевого синдрома у пациентов с ПНП оценивали по десятибалльной визуальной аналоговой шкале (ВАШ): 0 баллов – отсутствие боли, 10 баллов – максимально возможная интенсивность боли. Эффективность проведенного лечения оценивали на основании мнения врача и пациента по пятибалльной шкале Лайкерта: значительное ухудшение; ухудшение; без перемен; улучшение; значительное улучшение. В ходе наблюдения за пациентами регистрировали нежелательные явления (НЯ), анализировали их связь с лечением.
Изначально предполагалось проанализировать результаты наблюдений за 125 больными. Однако в силу причин (изменение места проживания, начало терапии, не предусмотренной протоколом исследования, нежелание участвовать в исследовании и др.), не связанных с переносимостью терапии, 27 пациентов выбыли из исследования. В итоге в анализ были включены результаты обследования 98 пациентов.
Первую группу составили 46 пациентов с СД 2-го типа. У 27 из них имели место клинические проявления диабетической ПНП (клинико-лабораторное обследование позволило исключить другие причины ПНП, вследствие чего ее развитие считали связанным с нарушением углеводного обмена). Вторую группу составили 52 пациента с СД 2-го типа и МС. У 16 из них отмечались клинические признаки ПНП. Пациенты первой группы в зависимости от типа проводимой терапии были разделены на две подгруппы. Подгруппу 1А составили 19 пациентов, принимавших Роноцит® по 1000 мг два раза в сутки на протяжении восьми недель, подгруппу 1В – 27 пациентов, получавших Роноцит® по 1000 мг два раза в сутки в течение восьми недель, а также Кокарнит® внутримышечно по стандартной схеме – одна инъекция ежедневно, всего девять инъекций. Пациенты второй группы также в зависимости от терапии были разделены на две подгруппы. Подгруппу 2А составили 36 больных, принимавших Роноцит® по 1000 мг два раза в сутки на протяжении восьми недель, подгруппу 2В – 16 пациентов, получавших Роноцит® по 1000 мг два раза в сутки в течение восьми недель, а также Кокарнит® внутримышечно по стандартной схеме – одна инъекция ежедневно, всего девять инъекций. Помимо указанных препаратов все пациенты получали терапию по поводу основного заболевания (контроль гликемии, артериального давления, липидного профиля, по показаниям антитромботические и другие лекарственные средства). Решение о назначении препаратов Роноцит® и Кокарнит® не влияло на изменение режима приема препаратов базовой терапии.
Статистический анализ результатов исследования проводился с использованием программного пакета SPSS 23.0. Количественные показатели представлены в виде среднего и стандартного отклонения (M ± m), качественные – в виде абсолютного значения и частоты (n/%). Значимость различий количественных показателей при нормальном распределении оценивали с помощью t-критерия Стьюдента. При распределении, отличном от нормального, применяли критерий Манна – Уитни. Различия считали статистически значимыми при p < 0,05.
Результаты
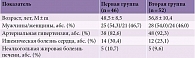
Пациенты обеих групп были сопоставимы по половозрастным характеристикам (табл. 2). Между пациентами двух групп отсутствовали статистически значимые различия в представленности соматических заболеваний, включая артериальную гипертензию, ишемическую болезнь сердца, неалкогольный жировой гепатоз, хотя несколько чаще указанные заболевания отмечались у пациентов первой группы. Отсутствовали также статистически значимые различия в частоте приема антигипертензивных и антитромботических препаратов. Все пациенты получали сахароснижающую терапию.
Исходно между группами не зафиксировано существенных различий в результатах нейропсихологического тестирования (табл. 3). Выявленные нарушения свидетельствовали о наличии у обследованных пациентов мягких КН, обусловленных, вероятно, СД 2-го типа и МС, а также возникшей на их фоне микро- и макроангиопатией с вовлечением в патологический процесс сосудов головного мозга. Существенные различия также отсутствовали при сравнении результатов тестирования по МоСА между подгруппами.
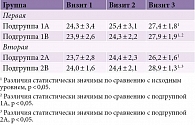
На фоне проведенного лечения наблюдалась тенденция к нарастанию показателей по МоСА. Ни в одной из подгрупп различия через четыре недели не носили статистически значимого характера по сравнению с исходным уровнем. Отсутствовали и существенные различия в результатах тестирования на визите 2 между подгруппами, хотя в подгруппах 1В и 2В показатели оказались более высокими.
При нейропсихологическом тестировании на визите 3 у больных подгрупп 1А и 1В наблюдался статистически значимый прирост показателей на 12,5 и 16,5% соответственно по сравнению с исходным уровнем (визит 1) (p < 0,05). В подгруппе 1В на визите 3 прирост был статистически более значимым, чем в подгруппе 1А.
Результаты тестирования по МоСА во второй группе продемонстрировали более значимый прирост, чем в первой группе. Прирост показателей в подгруппах 2А и 2В носил статистически значимый характер по сравнению с исходным уровнем (на 14,5 и 17,8% соответственно; p < 0,05 для обоих показателей). Следует отметить, что более выраженный прирост отмечался у пациентов подгруппы 2В по сравнению с подгруппой 2А (p < 0,05).
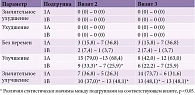
На визите 1 у 12 (44,4%) пациентов подгруппы 1В и 13 (81,2%) пациентов подгруппы 2В имела место сенсорно-моторная ПНП с болевым нейропатическим синдромом (табл. 4). По поводу болевого синдрома пациенты получали терапию, предусмотренную действующими клиническими рекомендациями (противоэпилептические препараты, антидепрессанты). При этом характер проводимого лечения и доза препаратов не менялись на протяжении всего периода наблюдения за больными.
На визите 2 у пациентов обеих подгрупп отмечалось статистически значимое уменьшение болевого синдрома на 24,8 и 32,7% соответственно (p < 0,05 для обоих показателей). Несколько более выраженный эффект наблюдался у пациентов второй группы, однако различия не достигли уровня статистической значимости. К визиту 3 при оценке интенсивности болевого синдрома результаты продемонстрировали незначительное улучшение по сравнению с визитом 2, но были статистически значимо ниже, чем на визите 1. Существенные различия между группами отсутствовали.
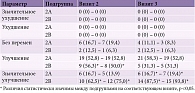
При анализе показателей суммарной эффективности в подгруппах 1А и 1В оказалось, что ни по мнению лечащего врача, ни по мнению пациентов ни у одного из них не наблюдалось ухудшения состояния (табл. 5). На визите 2 у большинства пациентов обеих подгрупп как при самооценке, так и при объективной оценке врачом отмечалась выраженная положительная динамика. То есть число пациентов с улучшением состояния возросло (p < 0,05 для обеих подгрупп). При обследовании на визите 3 в обеих подгруппах наблюдалось дальнейшее увеличение числа пациентов, отметивших значительное улучшение состояния. При этом число таких больных оказалось статистически значимо выше в подгруппе 1В (p < 0,05). Существенных различий в оценке эффективности лечения как по мнению врача, так и по мнению пациентов не зафиксировано.
Результаты оценки эффективности проведенного лечения в подгруппах 2А и 2В продемонстрировали, что к визиту 2 существенно улучшилось состояние всех пациентов, о чем свидетельствовала высокая частота респондентов, расценивших эффективность лечения как хорошую (табл. 6). К визиту 3 выраженность положительной динамики возросла в обеих подгруппах: число пациентов, отметивших выраженное улучшение состояния, статистически значимо увеличилось. Вместе с тем в подгруппе 2В число таких больных оказалось статистически значимо выше, чем в подгруппе 2А (p < 0,05).
Что касается частоты возникновения НЯ, в первой группе зарегистрировано четыре НЯ, во второй – пять. Как правило, пациенты отмечали дискомфорт в месте введения препарата. Указанные НЯ носили легкий характер, не требовали дополнительных лечебных мероприятий, не влияли на выбранный режим терапии. В ходе исследования не зафиксировано ни одного случая лекарственного взаимодействия.
Обсуждение
СД 2-го типа и МС – важные факторы риска развития как сердечно-сосудистых заболеваний, в том числе с поражением головного мозга, так и периферической нервной системы [1, 2]. Кроме того, исследования последних 15 лет продемонстрировали, что инсулинорезистентность, нарушение углеводного обмена и связанные с этим другие метаболические расстройства также ассоциированы с повышением риска развития нейродегенеративных заболеваний, в частности болезни Альцгеймера [17]. Сочетание указанных расстройств значительно повышает риск инвалидизации и снижает качество жизни пациентов. Подобные состояния оказывают взаимноотягощающее влияние. В частности, инсулинорезистентность, как и гипергликемия, негативно влияя на церебральный метаболизм, ухудшает кровоснабжение головного мозга за счет развития макро- и микроангиопатии. ПНП, в частности с вовлечением вегетативных волокон, негативно влияет на многие системы организма, в том числе приводит к нарушению ауторегуляции мозгового кровообращения, поддерживает формирование артериальной гипертензии и в целом служит важным прогностическим маркером развития тяжелых сердечно-сосудистых событий [6, 8, 13].
Патогенез поражения головного мозга, периферической нервной системы у пациентов с СД 2-го типа и МС достаточно сложен. Необходим комплексный подход к лечению и вторичной профилактике таких заболеваний с учетом недостаточной эффективности исключительно немедикаментозных методов терапии (обеспечение правильного пищевого поведения, контроль массы тела, должный уровень физических нагрузок и проч.). Требуется разработка адекватных терапевтических подходов, позволяющих при минимальном риске возникновения НЯ обеспечивать воздействие на различные патогенетические механизмы поражения нервной системы.
Цитиколин (Роноцит®) эффективен у пациентов с различными формами КН. Эффективность препарата подтверждена результатами многочисленных клинических исследований. Не вызывает сомнения и целесообразность применения у пациентов с СД 2-го типа препаратов витаминов группы B. Согласно данным ряда клинических исследований, препарат Кокарнит® эффективен у пациентов с диабетической ПНП. Вместе с тем ранее не проводились исследования одновременного применения указанных препаратов у пациентов с СД 2-го типа и МС.
В настоящем исследовании показана эффективность комбинированной терапии препаратами Роноцит® и Кокарнит® у пациентов с СД 2-го типа и МС. Использование данной комбинации препаратов сопровождалось более ранним улучшением результатов выполнения нейропсихологических тестов. Одновременное применение препаратов Роноцит® и Кокарнит® способствовало более выраженному и стойкому эффекту. Несмотря на то что статистически значимые различия между пациентами, принимавшими только Роноцит®, и пациентами, получавшими Роноцит® и Кокарнит®, через восемь недель лечения отсутствовали, имеются основания полагать, что повторные курсы введения препарата Кокарнит® у части пациентов приведут к более значимому улучшению когнитивных функций по сравнению с применением только препарата Роноцит®. Такое предположение основано на факте снижения обеспеченности больного СД 2-го типа и МС витаминами группы B, в частности цианокобаламином, и роли этих витаминов в реализации когнитивных функций.
В исследовании подтверждена эффективность препарата Кокарнит® у пациентов с диабетической ПНП. Показано противоболевое действие препарата, которое сохранялось на протяжении как минимум семи недель после его внутримышечного введения (девять инъекций).
Особый интерес представляют результаты оценки эффективности проведенного курса лечения. Точка зрения пациентов и врачей оказалась идентичной: большинство пациентов расценили эффект проведенной терапии как очень хороший. Несколько большее число больных, получавших комбинированное лечение, отметили очень хороший эффект. Как и в более ранних исследованиях, в данном исследовании зафиксирована высокая безопасность препаратов Роноцит® и Кокарнит® как в комбинации, так и в режиме монотерапии. Значимых НЯ и случаев лекарственного взаимодействия не зарегистрировано.
Заключение
Применение препаратов Роноцит® и Кокарнит® в комплексной терапии пациентов с МС и СД 2-го типа эффективно и безопасно. Подтверждена не только высокая эффективность препаратов, но также их хорошая переносимость и отсутствие лекарственного взаимодействия даже в случае назначения полиморбидным пациентам, требующим одновременного приема большого количества лекарственных препаратов. Особенностью исследования стало участие в нем пациентов из реальной клинической практики, что делает результаты максимально приближенными к повседневной врачебной деятельности. Дальнейшие исследования позволят установить оптимальные сроки применения обоих препаратов, их возможные комбинации с другими лекарственными средствами.
P.R. Kamchatnov, PhD, Prof., R.A. Cheremin, PhD, L.A. Skipetrova, A.Yu. Kazakov, PhD, Prof., Z.Kh. Osmaeva, N.A. Gorbunov
N.I. Pirogov Russian National Research Medical University
V.M. Buyanov City Clinical Hospital, Moscow
Speech Pathology and Neurorehabilitation Center
Federal Center of Brain and Neurotechnology
Contact person: Pavel R. Kamchatnov, pavkam7@gmail.com
The purpose is to evaluate the efficacy and safety of Ronocit® and Cocarnit® on the severity of neurological manifestations in patients with carbohydrate metabolism disorders in real clinical practice.
Material and methods. In a prospective and retrospective examination of 98 patients with type 2 diabetes
and metabolic syndrome (MS), the efficacy of Ronocit® and Cocarnit® was studied. The state of cognitive functions, the severity of polyneuropathy (PNP), and the effectiveness of treatment were assessed.
Results. The simultaneous use of Ronocit® and Cocarnit® led to a more pronounced and persistent effect
in the form of improved cognitive functions. The use of Cocarnit® in patients with diabetic PNP was accompanied by an analgesic effect for at least 7 weeks. Adverse events were rare, mild, and did not affect the selected therapy regimen. No cases of drug interactions were registered.
Conclusion. The results of the study demonstrated the high effectiveness of the simultaneous use of Cocarnit® and Ronocit® in patients with both type 2 diabetes and MS with lesions of the central and peripheral nervous system.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


