Применение препаратов интерферона в форме суппозиториев при лечении хронического цистита
- Аннотация
- Статья
- Ссылки

При хроническом воспалении стенки мочевого пузыря и интрамурального отдела мочеточника развивается несостоятельность уретро-везикальных соустий, возникают пузырно-мочеточниковый и мочеточниково-лоханочный рефлюкс. Нарушение функции устьев мочеточников с регургитацией мочи при длительно существующем цистите отмечено у 83% девочек. У каждой четвертой женщины, перенесшей в течение жизни 3 и более эпизода обострений цистита, обнаруживается рак мочевого пузыря, а у каждой 5-й развивается интерстициальный цистит.
Среди урологических больных пациенты с циститом составляют 67%. Ежегодная заболеваемость циститом высока и составляет 15000-20000 случаев на 1 млн жителей в год. Заболеваемость циститом у женщин достигает 150-200, а у мужчин – 6-8 случаев на 10000 населения в год. Столь значимые половые различия обусловлены анатомо-физиологическими особенностями женской мочевой системы.
Цистит является полиэтиологическим заболеванием, однако ведущим этиологическим фактором являются инфекционные агенты – разнообразные бактерии, вирусы, хламидии, грибы, простейшие и т.д. Основная роль в развитии циститов принадлежит уропатогенным бактериям, относящимся к микробиоценозу толстого кишечника (в первую очередь – семейству Enterobacteriacea). Согласно данным международного многоцентрового исследования ECO-SENS (252 клиники в 16 странах Европы и Канады), закончившегося в 2003 году, было установлено, что у 77,7% пациенток инфекция мочевых путей была вызвана E. coli, у 5,2% – Proteus mirabilis, у 2,8% – Klebsiella spp., у 3,9% – другими представителями семейства Enterobacteriacea, у 4,6% – Staphylococcus saprophyticus и у 5,8% – другими микроорганизмами.
К факторам риска развития цистита можно отнести анатомические дефекты мочевых путей, функциональные нарушения уродинамики, тяжелые сопутствующие заболевания, использование инструментальных (инвазивных) методов обследования и лечения, пожилой возраст, иммунодефицитные состояния, дисбиоз кишечника и влагалища, хронический венозный застой в органах таза.
Как правило, развитию инфекционно-воспалительного процесса предшествует снижение местного и системного иммунитета, что создает благоприятные условия для жизнедеятельности уропатогенных микроорганизмов. Кроме того, персистирующая бактериальная инфекция приводит к повреждению клеток уротелия, препятствуя синтезу собственного интерферона.
Это позволяет допустить, что включение в состав комбинированной терапии хронического цистита препаратов интерферона может повысить эффективность лечения за счет активизации клеточных иммунных реакций, фагоцитоза и восполнения дефицита эндогенного интерферона.
Среди новых препаратов интерферона интерес представляет отечественный препарат Генферон® (ЗАО «БИОКАД», Россия) – новая лекарственная форма интерферона-α в виде свечей для вагинального и ректального введения. Основными компонентами препарата Генферон® являются интерферон человеческий рекомбинантный α2b, таурин и анестезин. Комбинация активных и вспомогательных веществ, входящих в состав Генферона®, обеспечивает не только сохранение активности и физических свойств препарата, но также усиление и расширение спектра действия основных его компонентов.
Генферон® обладает выраженным противовирусным, противомикробным и иммуномодулирующим действием. Противовирусный эффект опосредован рецептор-зависимой активацией внутриклеточных ферментов 2’5’-олигоаденилатсинтазы и протеинкиназы, а также белков группы MX, ингибирующих репликацию вирусов. Иммуномодулирующее действие проявляется в активации CD-8+ цитотоксических Т-лимфоцитов, NK-клеток, усилении дифференцировки В-лимфоцитов и продукции ими антител со сменой их изотипа и повышением аффинности, активацией моноцитарно-макрофагальной системы и фагоцитоза, а также усилении экспрессии молекул MHC-I, что способствует, в первую очередь, амплификации клеточно-опосредованных реакций иммунной системы.
Таурин – серосодержащая аминокислота, образующаяся в организме в процессе метаболизма цистеина – широко применяется при целом ряде заболеваний. Таурин способствует нормализации метаболических процессов, обладает регенерирующими, репаративными, мембрано- и гепатопротекторными свойствами. Таурин действует и как антиоксидантное средство, непосредственно взаимодействует с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов (воспаление, интоксикация и т.д.). Сочетание интерферона с таурином в одной лекарственной форме позволяет обеспечить широкий спектр действия препарата и пролонгировать действие интерферона.
Анестезин, являясь местным анестетиком, устраняет болезненные ощущения, зуд, жжение при обострении воспаления.
В качестве вспомогательных компонентов в состав Генферона® входит ряд веществ, разрешенных М3 и СР РФ для изготовления медицинских лекарственных форм: «твердый жир», декстран 60000, полиэтиленоксид 1500, твин 80, эмульгатор Т2, натрия цитрат, кислота лимонная.
Цель исследования
Оценка эффективности применения препарата Генферон® (ЗАО «Биокад», Россия) в составе комбинированной терапии хронического цистита в сравнении со стандартной терапией. Оценка проводилась на основании устранения клинических проявлений заболевания, нормализации лабораторных показателей и цистоскопической картины, а также отсутствия рецидивирования через 3 месяца после лечения.
Материал и методы
Открытое сравнительное рандомизированное проспективное клиническое исследование.
Исследование было выполнено на базе кафедры урологии Воронежской государственной медицинской академии им. Н.Н. Бурденко (ВГМА) и урологического отделения ОАО «Дорожная клиническая больница на станции Воронеж-1» в течение 2008 года.
В исследовании приняли участие 60 пациентов, страдающих хроническим циститом. Они были распределены в две равные по количеству испытуемых группы при условии соответствия критериям включения по результатам скрининга. Распределение пациентов по группам (основной и сравнения) проводилось рандомизированно методом случайной выборки.
В первую группу (основная группа) вошли 30 пациентов с хроническим циститом, которые получали стандартную терапию в сочетании с препаратом Генферон® 1 000 000 ME ректально 2 раза в сутки в течение 10 дней, с последующим назначением препарата в режиме 1 раз в два дня (параллельно стандартной этиотропной терапии) в течение последующих 20 дней. Исследуемый препарат вводится ректально, на ночь. Во вторую группу (группа сравнения) вошли 30 пациентов с хроническим циститом, которые получали только стандартную этиотропную терапию. Суммарная продолжительность участия в исследовании одного пациента составила 90 дней.
Стандартная этиотропная терапия включала норфлоксацин per os 400 мг 2 раза в день в течение 4 недель. Данные обо всех побочных эффектах применения Генферона® заносились в индивидуальные регистрационные карты, а затем анализировались согласно критериям оценки переносимости препарата. Оценка эффективности лечения препаратом Генферон® в группах осуществлялась на основании анализа динамики жалоб, симптомов и клинико-лабораторных показателей.
Критерии включения:
- пациенты обоих полов в возрасте от 18 до 59 лет;
- подтвержденный клинический диагноз хронического цистита (с длительностью течения более 1 года);
- возможность выполнять все процедуры исследования.
Критерии исключения:
- наличие сопутствующих серьезных соматических, онкологических или инфекционных заболеваний (в т.ч. ВИЧ, туберкулез и т.д.); гиперчувствительность к препаратам интерферонов или другим компонентам препарата, которая устанавливается по данным анамнеза или в момент первого введения препарата;
- интерстициальный или эозинофильный цистит, а также цистит нейрогенной этиологии;
- органическая инфравезикальная обструкция (критерий отсутствия – возможность беспрепятственного проведения по мочеиспускательному каналу и выведения оливообразного бужа №28 по шкале Шарьера);
- наличие врожденных или приобретенных дефектов мочеполовой системы, требующих хирургического вмешательства;
- наличие психоневрологических заболеваний (в том числе компенсированных или возникших на фоне лечения);
- наркомания, алкоголизм;
- неспособность выполнять требования протокола;
- одновременное участие в других клинических исследованиях или предшествующее участие пациента в данном исследовании.
Критериями эффективности в данном исследовании являлись:
- устранение клинических проявлений заболевания;
- нормализация лабораторных показателей и цистоскопической картины;
- отсутствие рецидивирования через 3 месяца после лечения.
Для сравнения эффективности лечения в различных группах пациентов использовался метод описательной статистики, а также критерии Стьюдента и Вилкоксона и критерий Хи-квадрат.
На скрининговом визите были проведены: сбор анамнеза, физикальное исследование, клинический анализ мочи, УЗИ почек и мочевыводящей системы, анализ мочи по Нечипоренко, бактериологическое исследование мочи, определение чувствительности выделенной микрофлоры к антибиотикам, калибровка уретры оливообразными бужами, цистоскопия с мультифокальной биопсией мочевого пузыря и гистологическим исследованием биоптатов.
Хотя допускалось включение в исследование пациентов обоих полов, в данном исследовании все пациенты были женского пола, что согласуется с литературными данными о том, что у женщин цистит встречается значительно чаще, чем у мужчин.
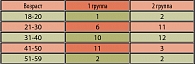
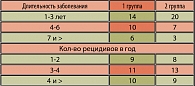
Распределение больных по возрасту, частоте рецидивов в год и длительности заболевания представлены в таблицах 1 и 2. Средний возраст больных первой группы составил 37±8,3 лет, второй группы – 35,9±7,8 лет. В первой группе длительность заболевания составляла от 1,5 до 12 лет, в контрольной группе она была идентичной.
Наиболее часто длительность заболевания составляла от 1 до 3 лет в обеих группах. У большей части пациентов число рецидивов в год составило от 3 до 4 эпизодов в обеих группах.
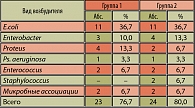
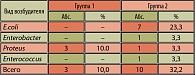
Течение заболевания сопровождалось выраженными неприятными субъективными ощущениями. Основными жалобами у всех пациентов обеих групп были болевые ощущения над лоном, рези и боли в уретре при мочеиспускании. При клинико-лабораторном обследовании в обеих группах (визит № 1) в анализах мочи количество лейкоцитов варьировало от 10-15 до 25-50 (18 ± 4,5) и более в поле зрения, наблюдались эритроциты от 1-3 до 10-12 (3,2 ± 0,2) в поле зрения, при исследовании анализа мочи по Нечипоренко количество лейкоцитов составило от 1,2 х 103 до 12,2 х 103 (в среднем 6,4 ± 2,6 х 103), количество эритроцитов от 0,1 х 103 до 8,4 х 103 (в среднем 2,4 ± 0,3 х 103) клеток в мл. При бактериологическом исследовании проб мочи был выявлен ряд видов возбудителей хронического цистита, представленных в таблице 3, определена степень бактериурии, чувствительность к норфлоксацину.
Результаты бактериологического исследования проб мочи выявили преобладание в обеих группах больных хроническим циститом грамотрицательной микрофлоры: кишечной палочки – 36,7%, протея – 13,3% и 6,7% соответственно, энтеробактера – 10% и 13,3% соответственно. Грамположительная микрофлора составила всего лишь 6,7%. Степень бактериурии составляла у пациентов обеих групп от 10 до 100 КОЕ/мл. Микробные ассоциации отмечены в 6,7% случаев в обеих группах и представлены в первой группе в одном случае кишечной палочкой + стафилококк и во втором случае кишечной палочкой + грибами рода Candida. Во второй группе ассоциации были представлены в одном случае кишечной палочкой + клебсиеллой, во втором – кишечной палочкой + грибами рода Candida. В 23,4% (7 пациентов) случаев у больных первой группы и в 20,0% (6 пациентов) случаев у больных второй группы бактериальный посев мочи был стерилен (таблица 3). Все микроорганизмы обладали чувствительностью к норфлоксацину.
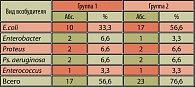
Результаты бактериологического исследования слизистой мочевого пузыря выявили преобладание в обеих группах больных хроническим циститом кишечной палочки (33,3% и 56,6% соответственно). Число случаев обнаружения протея, синегнойной палочки и энтеробактера было одинаковым и составило 6,6% в обеих группах. Бактериальная обсемененность слизистой составляла у пациентов обеих групп от 10 до 107. В 43,4% (13 пациентов) случаев у больных первой группы и в 23,4% (7 пациентов) случаев у больных второй группы бактериальный посев слизистой был стерилен (таблица 4).
При цистоскопии мочевого пузыря отмечалась картина хронического цистита, местами с участками метаплазии уротелия, в основном локализующимися в области треугольника Льето и шейки мочевого пузыря. Всем пациентам проведена калибровка уретры бужом № 28 по шкале Шарьера.
При морфологическом исследовании слизистой мочевого пузыря практически у всех пациентов отмечалась очаговая или диффузная мононуклеарная инфильтрация стромы, истончение высоты уротелия с участками метаплазии.
При ультразвуковом исследовании верхних мочевых путей и мочевого пузыря патологии у пациентов обеих групп не выявлено.
Согласно дизайну исследования, пациентам первой и второй групп назначено соответствующее лечение.
Через 10 дней (2 визит) полученные клинико-лабораторные данные исследования свидетельствовали об отсутствии клинических симптомов заболевания в обеих группах.
В первой группе в анализах мочи количество лейкоцитов в среднем не превышало 5-8 в поле зрения. Во второй группе количество лейкоцитов составило в среднем 8-10 в поле зрения. В анализах мочи по Нечипоренко отмечалась аналогичная динамика уменьшения количества лейкоцитов и эритроцитов в обеих группах.
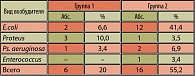
Результаты бактериологического исследования проб мочи во время второго визита выявили отсутствие в первой группе пациентов большинства представителей патогенной микрофлоры, выявленной на первом визите: кишечной палочки, энтеробактера, энтерококка, синегнойной палочки (таблица 5). У 10,0% (3 пациента) была выявлена протейная флора. Степень бактериурии составляла у пациентов первой группы до 103 КОЕ/мл. В 90% случаев бактериальный посев проб мочи стерилен. Во второй группе пациентов наблюдалась несколько другая картина микробного пейзажа: кишечная палочка занимает ведущее место (23,3%) по отношению энтеробактеру, протею и энтерококку (по 3,3%, соответственно). Степень бактериурии от 103 до 105 КОЕ/мл. В 67,8% случаев посев проб мочи оставался стерильным.
Нежелательных явлений у больных первой группы (Генферон®) не отмечено.
На 30 день (3 визит) полученные клинико-лабораторные данные исследования свидетельствовали об отсутствии клинических симптомов заболевания в обеих группах, одна из пациенток второй группы снята с лечения в связи с неявкой (30 – 1 = 29).
В первой группе произошла нормализация общего анализа мочи и анализа мочи по Нечипоренко. Во второй группе наблюдалась несколько худшая картина общего анализа мочи и анализа мочи по Нечипоренко, чем в первой группе.
При бактериальном посеве проб мочи в первой группе в 100% случаев посев стерилен. Во второй группе в одном случае выделен протей 10 КОЕ/мл (видимо, произошла контаминация в результате инструментального исследования), и в одном случае выделен микроорганизм из рода Candida.
Микробный пейзаж слизистой мочевого пузыря выявил преобладание в контрольной группе больных кишечной палочки, которая составила 41,4%, в то время как у пациентов первой группы кишечная палочка составила 6,6%. В первой группе преобладала протейная микрофлора, которая составила 10,0%.
В первой группе посев полученного при биопсии материала был стерилен в 80% случаев, во второй группе в 44,8% (таблица 6). Бактериальная обсемененность составила в 1-й и 2-й группах пациентов от 10 до 104.
Через 90 дней (4 визит, заключительный) в контрольной группе 2 пациента выбыли из исследования в связи с неявкой (29 – 2 = 27 пациентов), 2 пациентки отказались от цистоскопии и биопсии. В первой группе по той же причине выбыла одна пациентка (30 – 1 = 29 пациентов) и 2 отказались от цистоскопии и биопсии.
Данные по результатам бактериологического исследования мочи и слизистой мочевого пузыря на визите № 4 приводятся в таблицах 7 и 8.
Результаты исследования
Сравнительный анализ полученных клинико-лабораторных, инструментальных и аппаратных методов исследования пациентов обеих групп, страдающих хроническим циститом, показывает преимущество комбинированного лечения, включающего стандартную терапию и препарат Генферон®, по сравнению только со стандартной терапией.
Ультразвуковое исследование верхних и нижних мочевых путей в обеих группах не выявило патологических изменений.
Анализ клинико-лабораторных данных показывает, что у больных первой группы количество лейкоцитов при общем анализе мочи и анализе мочи по Нечипоренко через 3 месяца после лечения находилось в пределах нормы. У 37% пациентов второй группы количество лейкоцитов при общем анализе мочи и при анализе по Нечипоренко находилось в диапазоне от 5-12 до 15-25 в поле зрения и от 5,1х103 до 8,2х103 клеток/мл.
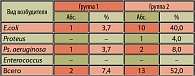
При бактериальном посеве проб мочи в первой группе через 3 месяца после лечения в 100% случаев посев был стерилен. Во второй группе в 25,9% случаев выделены грамотрицательные микроорганизмы. Микробный пейзаж представлен следующим образом в порядке убывания: E. coli – 14,8% (4 пациента), степень бактериурии – 10-105 КОЕ/мл; Proteus – 7,4% (2 пациента), степень бактериурии – 10-103 КОЕ/мл; Ps. aeruginosae – 3,7% (1 пациент), степень бактериурии – 102 КОЕ/мл.
Анализ данных бактериального посева слизистой мочевого пузыря у пациентов с хроническим циститом показал, что микробный пейзаж у больных первой группы представлен всего лишь двумя видами микроорганизмов: E. coli – 3,7% (1 пациент), степень бактериальной обсемененности – 10; Proteus – 3,7% (1 пациент), степень бактериальной обсемененности – 10. У пациентов второй группы микробный пейзаж представлен следующими видами микроорганизмов: E.coli – 40,0% (10 пациентов), степень бактериальной обсемененности составила 10 – 104; Ps.aeruginosae. – 8,0% (2 пациента), степень бактериальной обсемененности – 102; Proteus – 4,0% (1 пациент), степень бактериальной обсемененности составила 10.
Морфологическое исследование биоптатов слизистой мочевого пузыря через три месяца после лечения выявило уменьшение патологических очагов воспаления в обеих группах с существенной разницей между ними: в первой группе уменьшение в сравнении с исходным составило 78,0%, во второй группе – 36%.
Анализ полученных данных исследования показал, что общая эффективность лечения, рассчитанная на основании результирующего значения всех исследуемых параметров, в первой группе пациентов составила 92,6%, во второй группе – 40,0%.
Статистическую обработку данных проводили методом вариационной статистики. Достоверность разности полученных результатов оценивали с помощью критерия Стъюдента и Хи-квадрат. В соответствии с целью и задачами исследования проведена клиническая оценка эффективности препарата Генферон® у больных хроническим циститом.
При оценке безопасности препарата Генферон® ни у одного пациента в наблюдаемой группе не было зарегистрировано неблагоприятных или серьезных неблагоприятных явлений (НЯ или СНЯ).
Заключение
На основании изучения терапевтической эффективности и переносимости препарата Генферон® получены убедительные доказательства его клинической эффективности у пациентов с хроническим циститом, что позволяет рекомендовать данный препарат в клинической практике при лечении вышеуказанной патологии нижних мочевых путей.
Выводы
- Суппозитории Генферон® являются эффективным препаратом в терапии хронического цистита.
- Генферон® безопасен при ректальном введении при лечении хронического цистита, хорошо переносится больными, не вызывает развития побочных эффектов.
- Дозировка 1 000 000 МЕ ректально 2 раза в сутки в течение 10 дней, с последующим назначением препарата в режиме один раз в два дня в течение последующих 20 дней при лечении хронического цистита является оптимальной.
- Препарат Генферон® рекомендуется к широкому применению в клинической практике как препарат выбора в комплексной терапии хронического цистита.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.