Применение цетиризина и левоцетиризина у пациентов с хронической крапивницей и другими аллергодерматозами: вопросы повышения дозировки и длительности применения. Резолюция совета экспертов
- Аннотация
- Статья
- Ссылки
- English
В Москве 30 июня 2022 г. проводился совет экспертов по теме «Применение цетиризина и левоцетиризина у пациентов с крапивницей и другими аллергодерматозами: вопросы повышения дозировки и длительного применения». В заседании приняли участие эксперты в области дерматовенерологии и аллергологии-иммунологии.
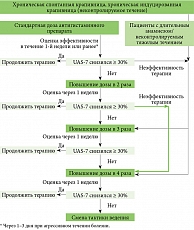
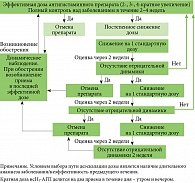
Предметом дискуссии стал алгоритм эскалации и последующей деэскалации дозы антигистаминных препаратов.
Антигистаминные препараты: общие вопросы
Согласно классификации экспертов Европейской академии аллергологии и клинической иммунологии 2003 г., принято выделять два поколения блокаторов Н1-гистаминовых рецепторов: первое поколение, или седативные антигистаминные препараты (АГП), и второе поколение, или неседативные АГП (нсН1-АГП) [1]. К препаратам первого поколения относятся хлоропирамин, клемастин, дифенгидрамин, ципрогептадин, мебгидролин, хифенадин, диметинден и др. Большинство из них были синтезированы в середине прошлого века, однако с успехом применяются и в настоящее время. К особенностям этой группы препаратов можно отнести быстрое начало эффекта, наличие инъекционных форм, маленькую продолжительность терапевтического действия (1,5–6 часов) и ряд побочных эффектов, ограничивающих их длительное применение в клинической практике. Большинство антигистаминных препаратов первого поколения являются конкурентными блокаторами Н1-рецепторов. Они характеризуются высокой липофильностью, обеспечивающей проникновение через гематоэнцефалический барьер (ГЭБ), выраженным воздействием на центральную нервную систему, развитием побочных эффектов, таких как сонливость, сухость слизистых оболочек, нарушение когнитивных функций, усиливающихся при совместном применении с алкоголем или седативными средствами. Неполное связывание с Н1-рецепторами (30%) обусловливает необходимость использования высоких терапевтических доз и частую кратность приема, а также быстрое развитие тахифилаксии к данным препаратам [2]. Седативные антигистаминные препараты, за исключением доксиламина, угнетают быструю фазу сна (rapid eye movement), после чего развивается выраженный синдром отмены [3]. Еще одной особенностью АГП первого поколения является низкая избирательность действия. Помимо Н1-гистаминовых рецепторов они блокируют рецепторы других типов: М-холинорецепторы, α-адренорецепторы, серотониновые и брадикининовые рецепторы. Именно поэтому большинство седативных АГП имеют ряд серьезных ограничений для применения у пациентов с глаукомой, бронхиальной астмой, доброкачественной гиперплазией предстательной железы, сердечно-сосудистой патологией, патологией желудочно-кишечного тракта и т.д. [3].
Ограничение использования АГП первого поколения для длительного контроля симптомов аллергических заболеваний из-за развития тахифилаксии и различных побочных эффектов способствовало созданию новых блокаторов Н1-гистаминовых рецепторов. Для блокаторов Н1-гистаминовых рецепторов второго поколения характерны высокое сродство с Н1-рецепторами и высокая специфичность.
Согласно рекомендациям европейских экспертов, использование антигистаминных препаратов первого поколения было ограничено у детей до шести лет, и они были изъяты из безрецептурной продажи в странах Евросоюза и США [4–7].
НcН1-АГП являются разнородной группой, прежде всего в силу особенностей их метаболизма.
Среди АГП второго поколения выделяют две подгруппы:
- метаболизируемые препараты, которые оказывают эффект только после прохождения метаболизма в печени с участием изофермента CYP3A4 системы цитохрома Р450 с образованием активных соединений (лоратадин, эбастин, терфенадин, астемизол);
- активные метаболиты – препараты, которые сразу поступают в организм в виде активного вещества (цетиризин, левоцетиризин, дезлоратадин, фексофенадин).
Индивидуальной вариабельностью активности системы цитохрома Р450 может быть объяснена различная эффективность метаболизируемых препаратов у разных лиц. При недостаточном метаболизме возрастает риск возникновения побочных токсических эффектов со стороны сердечно-сосудистой системы (удлинение интервала QT и нарушение желудочкового ритма), что было отмечено у терфенадина и астемизола.
Активные метаболиты обладают более высоким профилем безопасности.
Эффект данных препаратов более предсказуем и не зависит от активности ферментов системы цитохрома Р450, следовательно, их применение является предпочтительным [3].
Крайне важными в лечении крапивницы и других аллергодерматозов являются высокое сродство АГП второго поколения с Н1-рецепторами, быстрое начало действия, его высокая избирательность, возможность однократного приема в сутки. Эти препараты не проникают через ГЭБ, поэтому практически не вызывают сонливости. НсН1-АГП не только взаимодействуют с H1-гистаминовыми рецепторами по принципу обратных агонистов, но и подавляют высвобождение провоспалительных медиаторов, уменьшают экспрессию молекул адгезии (ICAM-1), подавляют индуцированную эозинофилами выработку интерлейкина 8 (ИЛ-8), гранулоцитарно-макрофагального колониестимулирующего фактора из эпителиальных клеток. В результате они оказались более эффективны, чем АГП первого поколения [8].
Согласно международным и российским согласительным документам, в качестве препаратов первой линии при лечении крапивницы назначаются нсН1-АГП.
Необходимость применения блокаторов Н1-гистаминовых рецепторов при аллергодерматозах имеет высокую доказательную базу и обусловлена механизмом их действия, позволяющим подавлять гистамин-опосредованные эффекты аллергического воспаления, зуд и улучшить качество жизни пациентов [9–11].
Особая роль АГП второго поколения при зудящих аллергодерматозах определяется их противозудным, противовоспалительным и противоаллергическим эффектами [12–14].
Цетиризин и левоцетиризин
Эффективность и безопасность
Современные тенденции требуют определения клинического или клинико-лабораторного фенотипа заболевания у каждого пациента, что и является основой для выбора персонализированной терапии. Персонализированным также является выбор препарата для купирования зуда и воспаления у пациентов с аллергодерматозами.
Анализ возможностей купирования гистамин-опосредованных проявлений аллергодерматозов показал наибольший потенциал цетиризина и левоцетиризина среди других АГП второго поколения [15–18].
Результаты клинического изучения и данные реальной клинической практики свидетельствуют о том, что золотым стандартом терапии среди нсН1-АГП заслуженно считается цетиризин – первый высокоизбирательный блокатор Н1-рецепторов [3, 17–21]. В отношении цетиризина проведено большее количество клинических исследований, чем в отношении других антигистаминных препаратов. Показано, что для пациентов, которые плохо отвечают на действие других блокаторов Н1-гистаминовых рецепторов, предпочтителен именно цетиризин [3, 18].
Цетиризин обладает высокоизбирательным сродством с периферическим Н1-рецептором гистамина. Сродство цетиризина с Н1-рецептором выше, чем у лоратадина, и такое же, как у астемизола, терфенадина и гидроксизина [3]. При этом специфичность связывания Н1-рецепторов оказывается очень высокой: даже в высоких концентрациях цетиризин не блокирует серотониновые (5-НТ2), дофаминовые (D2), М-холинорецепторы и α1-адренорецепторы [18].
Действие цетиризина распространяется не только на раннюю, но и на позднюю фазу аллергической реакции.
Цетиризин in vitro тормозит активацию эозинофилов, вызванную ИЛ-8, лейкотриеном В4 и компонентом комплемента С5а, хемотаксис этих клеток, вызванный фактором активации тромбоцитов или хемотаксическим агентом формил-метионил-лейцил-фенилаланином. В таких же концентрациях цетиризин тормозит стимулированную специфическим аллергеном цитотоксичность тромбоцитов [3].
Для цетиризина характерны низкий объем распределения (0,56 л/кг массы тела) по сравнению с другими антагонистами Н1-рецепторов и высокая способность проникновения в кожу. Преимущество низкого объема распределения включает минимально зависимую от дозы клеточную и органную токсичность, минимальную индивидуальную вариабельность терапевтического эффекта, низкую вероятность развития нежелательных взаимодействий с другими лекарственными средствами и отсутствие аккумуляции в таких жизненно важных органах, как сердце и печень, а следовательно, потенциально хорошую переносимость и высокую безопасность.
В терапевтических дозах цетиризин тормозит выход гистамина в межклеточное пространство, вызванный длительным контактом специфического аллергена с кожей [3, 22].
В последнее время получены сведения о выраженном действии цетиризина на персистирующее воспаление в тканях и перестройку профиля продуцируемых цитокинов [12].
Кроме того, в отличие от других препаратов, применяемых при кожных проявлениях аллергии, цетиризин не только блокирует H1-гистаминовые рецепторы, но и подавляет кожный ответ на тромбоцит-активирующий фактор [22, 23]. Это подтверждено результатами сравнительных исследований: способность кумулироваться в коже позволяет цетиризину тормозить волдырную и гиперемическую реакцию более эффективно, чем эбастин, биластин, фексофенадин, лоратадин и дезлоратадин [24–26].
Левоцетиризин не только является мощным антигистаминным средством, но также обладает противоаллергическими/противовоспалительными свойствами, часть из которых не связана с блокадой H1-рецепторов. Он эффективно подавляет кожную аллергическую реакцию, и его ингибиторная активность коррелирует с высокой занятостью рецепторов [16, 27].
В исследованиях эффективности подавления гистамин-индуцированной реакции левоцетиризин показал лучшие результаты, чем эбастин, фексофенадин, лоратадин и мизоластин [28].
Из-за низкого объема распределения (0,4 л/кг) левоцетиризин обнаруживается только там, где это необходимо, а именно на клеточной мембране, и не проникает внутрь клетки.
В ряде исследований установлено, что относительно высокие концентрации левоцетиризина на клеточной поверхности в рецепторных участках обусловливают выраженный эффект и длительную активность действия.
Левоцетиризин создает высокие концентрации в коже [16]. Он практически не проникает через ГЭБ, и его седативный потенциал еще меньше, чем у цетиризина, лоратадина и дезлоратадина.
Клинически значимые взаимодействия с пищей и лекарственными препаратами отсутствуют [29, 30].
Согласно результатам сравнительных исследований, левоцетиризин в дозе 5 мг значимо эффективнее и быстрее, чем дезлоратадин в дозе 5 мг, воздействует на симптомы хронической спонтанной крапивницы (ХСК). Левоцетиризин лучше подавляет воспаление, чем дезлоратадин, за счет значительного снижения уровня таких провоспалительных цитокинов, как ИЛ-1β и ИЛ-8. Установленное клиническое преимущество левоцетиризина над дезлоратадином при применении 5 мг/сут утром может служить основанием для предпочтительного назначения первого взрослым пациентам с ХСК [27, 31].
Препарат быстро всасывается из желудочно-кишечного тракта, не взаимодействует с системой цитохрома Р450, начинает действовать через 12 минут, достигая максимальной концентрации в плазме через 54 минуты [32, 33].
Таким образом, данные об эффективности и безопасности подтверждают наибольшую приемлемость для длительного использования в клинической практике АГП второго поколения из группы активных метаболитов. Цетиризин и левоцетиризин соответствуют требованиям к нсН1-АГП для длительного контроля аллергических заболеваний или крапивницы [27].
Использование дженериков Н1-антигистаминных препаратов при крапивнице и других аллергодерматозах является очень важным сегментом оптимальной высокоэффективной длительной финансовосберегающей терапевтической схемы с минимальной фармаконагрузкой, сохраняющей качество жизни «трудных» пациентов. Именно поэтому чрезвычайно важно владение врачом принципами рациональной фармакотерапии, позволяющими выбрать Н1-антигистаминный препарат с учетом всех его возможных характеристик.
Одним из высокоэффективных воспроизведенных цетиризинов является Цетрин®. Препарат действует быстро, длительно. Обладает хорошим профилем безопасности.
Цетрин® практически не метаболизируется в организме.
Максимальная концентрация в сыворотке крови достигается через час после приема.
При продолжительном применении не накапливается в организме.
Начало эффекта после разового приема 10 мг препарата – через 20 минут.
Цетрин® полностью биоэквивалентен референтному препарату. Он эффективен при крапивнице, в том числе хронической спонтанной. Следует подчеркнуть, что из числа разных представителей цетиризина, зарегистрированных в нашей стране, Цетрин® (компания ООО «Др. Редди'с Лабораторис») отличают большая доказательная база и длительный опыт применения [3, 33]. Наличие в показаниях для применения препарата Цетрин® крапивницы, других зудящих аллергических дерматозов, таких как атопический дерматит, является основанием для назначения его в рамках существующих нормативных документов [34].
В отношении антигистаминного препарата Аллервэй (левоцетиризин) также доказаны биоэквивалентность и терапевтическая эквивалентность референтному препарату [35, 36].
Кроме того, Аллервэй имеет оригинальную форму выпуска – Аллервэй Экспресс. Это диспергируемые таблетки, аналогов которым среди левоцетиризинов в России нет. Данная лекарственная форма помогает пройти курс терапии при сопутствующих симптомах дисфагии, детям старше шести лет, а также хорошо подходит для использования в дороге, во время путешествий.
Препараты Аллервэй и Аллервэй Экспресс зарегистрированы для лечения аллергического ринита, крапивницы, аллергического конъюнктивита, поллиноза, аллергических дерматозов, сопровождающихся зудом и высыпаниями, их применение возможно у беременных и кормящих грудью [32, 35, 37].
Таким образом, оба препарата демонстрируют соответствие всем принципам рациональной фармакотерапии. Наряду с эффективностью в отношении купирования гистамин-опосредованных эффектов (зуда и воспаления) они характеризуются высоким уровнем безопасности и комплаенса, что подтверждается клинической практикой.
Вопросы длительного применения
В настоящее время получены данные об эффективности и безопасности длительного применения цетиризина и левоцетиризина у пациентов с различными аллергическими заболеваниями.
В ряде исследований безопасность и эффективность левоцетиризина в дозе 5 мг/сут были продемонстрированы на протяжении 18 месяцев, в том числе у детей раннего возраста [27, 38, 39].
Эффективность длительного применения цетиризина также была подтверждена в ряде исследований. Полученные результаты позволили сделать вывод, что с учетом доказанной безопасности цетиризина длительное (до 18 месяцев) его использование может помочь сократить продолжительность применения и количество топических кортикостероидов, применяемых для лечения детей с атопическим дерматитом. В ходе исследований не было отмечено развития тахифилаксии к цетиризину, его эффективность сохранялась на протяжении всего периода наблюдения [40, 41].
Данные об эффективности и о безопасности применения высоких доз
Сложность купирования гистамин-опосредованного зуда при различных формах крапивницы в существенном количестве случаев требует применения высоких доз нсН1-АГП. Обоснование и разрешение четырехкратного увеличения стандартной дозы АГП второго поколения отражено в рекомендательных письмах экспертов Европейской академии аллергологии и клинической иммунологии и Всемирной организации по аллергии начиная с 2006 г. [42].
Данная практика применения цетиризина и левоцетиризина широко изучена в двойных слепых плацебо-контролируемых исследованиях. Так, в ходе тройного слепого сравнительного рандомизированного исследования при повышении суточной дозы антигистаминных препаратов в два и четыре раза цетиризин показал хорошую эффективность и несколько более быстрое снижение дерматологического индекса качества жизни (Dermatology Life Quality Index – DLQI) по сравнению с фексофенадином, эбастином, биластином и дезлоратадином. Кроме того, для купирования симптомов при тяжелом течении хронической крапивницы только у 10,7% пациентов в группе цетиризина суточная доза постепенно была увеличена до четырех таблеток по сравнению c 40,0% в группе фексофенадина, которым требовалось увеличение дозы до четырехкратной (р = 0,03) [26].
В ходе проспективного рандомизированного открытого сравнительного исследования эффективности цетиризина при хронической крапивнице установлено, что купирование симптомов и улучшение качества жизни у пациентов с первично недостаточным ответом на лечение были лучше в группе, получившей увеличенную суточную дозу цетиризина до 20 мг на втором этапе, чем в группе, в которой была проведена замена нсН1-АГП [43].
Результаты двойного слепого плацебо-контролируемого исследования показали, что трехнедельное применение цетиризина в дозе 20 мг/сут у лиц с холинергической крапивницей привело к статистически значимому уменьшению волдырей (р = 0,015), эритемы (р = 0,033), зуда (р = 0,006) и других симптомов (р = 0,013). При этом не отмечено повышение количества нежелательных явлений по сравнению с группой, получавшей плацебо [44].
В клинической практике цетиризин продемонстрировал эффективность при различных формах крапивницы и для уменьшения зуда при атопическом дерматите. При этих состояниях для достижения наилучшего эффекта часто рекомендуются дозы свыше 10 мг (до 40 мг). Подбирать индивидуальную дозу следует исходя из степени выраженности симптомов [10, 17, 45].
Цетиризин рекомендован в составе комплексной терапии при мастоцитозе, особенно у детей [46]. Препарат может быть использован в схемах терапии пруриго, в том числе в кратных дозах [47, 48].
Клинический опыт свидетельствует о полном контроле уртикарных высыпаний у 75% пациентов с крапивницей на фоне четырехкратного увеличения дозы левоцетиризина с восстановлением параметров качества жизни и сохранением полного спектра параметров безопасности [49].
По мнению исследователей, высокоэффективной также является тактика постепенного увеличения дозовой нагрузки нсН1-АГП у пациентов с резистентными формами ХСК. Так, в открытом проспективном клиническом исследовании с участием 113 пациентов установлено, что последовательное повышение дозы левоцетиризина способствовало прогрессивному улучшению как контроля крапивницы (Urticaria Activity Score 7 – UAS-7), так и качества жизни (Chronic Urticaria Quality of Life questionnaire – CU-Q2oL) без значительного увеличения сонливости [50].
Безопасность высокой дозовой нагрузки левоцетиризина продемонстрирована в исследовании индийских коллег. Так, четырехкратное увеличение дозы у пациентов с хронической крапивницей непрерывно рецидивирующего течения в течение четырех недель сопровождалось незначительным седативным эффектом (0 – отсутствует, 1 – незначительная, 2 – умеренная, 3 – значительная), а двукратное увеличение дозы не вызывало сонливости [51].
Доказательная база эффективности высоких доз левоцетиризина при ХСК также включает результаты исследований по оценке уровня инозитола трифосфата (посредника, принимающего участие в передаче сигнала в клетке и образующегося в результате распада мембранных фосфолипидов под действием фосфолипазы С), при трехкратном увеличении терапевтической дозы, коррелирующего с контролем уртикарных высыпаний [52].
В связи с тем что ранее были зафиксированы нежелательные явления со стороны сердечно-сосудистой системы при использовании некоторых АГП второго поколения – терфенадина и астемизола, при выборе препарата важно учитывать риск развития нежелательных явлений, особенно у пациентов с нарушением ритма или изменениями на электрокардиограмме в анамнезе. Безопасность высоких доз левоцетиризина в этом аспекте подтверждена результатами ряда исследований. Так, в двойном слепом плацебо-контролируемом исследовании по оценке влияния на интервалы QT здоровых добровольцев шестикратных доз левоцетиризина было показано, что однократный прием высокой дозы в течение последующих 24 часов не вызывал нарушения деятельности сердечно-сосудистой системы [53].
В последнее время все большую актуальность представляют вопросы персонализированного подхода к терапии различных заболеваний, в том числе аллергодерматозов, а также прогнозирования эффективности лекарственных препаратов у конкретного больного. Так, в проспективном рандомизированном тройном слепом исследовании прогностической роли результатов кожного prick-теста с гистамином у пациентов с ХСК в течение 24 часов после приема одного из антигистаминных препаратов (цетиризина, фексофенадина, биластина, дезлоратадина или эбастина) в течение восьми недель, причем после четырех недель у «неответчиков» доза АГП увеличивалась, зафиксировано, что изменение диаметра гистамин-индуцированного волдыря через 24 часа обратно коррелировало с показателями DLQI. При этом DLQI и диаметр гистамин-индуцированного волдыря оказались наиболее чувствительными критериями эффективности терапии. Таким образом, диаметр гистамин-индуцированного волдыря может быть инструментом прогнозирования эффекта терапии АГП. В отношении выявления «неответчиков» этот метод оказался не столь эффективным [26].
Выводы
- Антигистаминные препараты второго поколения являются препаратами первой линии при лечении больных хронической крапивницей (индуцированной, спонтанной), при этом в большинстве случаев пациенты нуждаются в длительной терапии нсН1-АГП.
- Антигистаминные препараты второго поколения могут стать препаратами выбора при лечении пациентов с другими аллергодерматозами, сопровождающимися зудом, например с атопическим дерматитом, при этом в ряде случаев больные будут нуждаться в длительной терапии нсН1-АГП.
- Для длительных курсов терапии антигистаминными препаратами следует отдавать предпочтение наиболее безопасным нсН1-АГП. К таким препаратам относятся цетиризин и левоцетиризин, доказавшие свою безопасность в многочисленных плацебо-контролируемых исследованиях, в том числе у детей раннего возраста.
- При неэффективности стандартной суточной дозы нсН1-АГП у пациентов с крапивницей рекомендуется ее повышение. Эффективность и безопасность цетиризина отмечены при увеличении дозы до 40 мг. Левоцетиризин показывает высокую эффективность и безопасность у пациентов с хронической крапивницей в высокой дозе – 10–20 мг/сут. При первичном выборе антигистаминного препарата в случае наличия информации о недостаточной эффективности одобренных доз АГП для купирования обострения крапивницы в анамнезе следует рассмотреть левоцетиризин в качестве препарата первого выбора, особенно для коморбидных пациентов, на постоянной основе принимающих большое количество лекарственных средств, а также в педиатрии.
- Эскалация суточной дозы нсН1-АГП может проводиться поэтапно или одномоментно (до четырехкратной стандартной суточной дозы) в зависимости от клинической ситуации.
- Советом экспертов предложен алгоритм дифференцированного подхода к эскалации и деэскалации суточной дозы нсН1-АГП (рис. 1 и 2).
Заключение
Оценивая антигистаминные препараты второго поколения цетиризин (Цетрин®) и левоцетиризин (Аллервэй), эксперты высказались о научной обоснованности и высоком потенциале их эффективности и безопасности для длительного контроля заболевания у пациентов с хронической крапивницей и другими аллергодерматозами. Было отмечено, что исследования длительного применения (12–18 месяцев) и высоких доз (до четырехкратного увеличения одобренной дозы) проведены по высоким стандартам и подтверждают эффективность и безопасность препаратов. На основании результатов обсуждения был предложен алгоритм эскалации и деэскалации доз антигистаминных препаратов второго поколения, в том числе у пациентов с хронической крапивницей.
Конфликт интересов
Материалы по продуктам были предоставлены ООО «Др. Редди’с Лабораторис».
Все решения по финальному тексту принимали авторы публикации.
Авторы публикации: Е.Р. Аравийская, д.м.н., профессор кафедры дерматовенерологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, руководитель последипломного цикла обучения по косметологии для врачей, консультант Санкт-Петербургского института красоты «ГАЛАКТИКА», член совета директоров Европейской академии дерматологии и венерологии, член европейских комитетов по лечению акне, розацеа и активной косметике, почетный член Общества дерматологов Франции и Сербии (Санкт-Петербург); А.Л. Бакулев, д.м.н., профессор кафедры дерматовенерологии и косметологии Центральной государственной медицинской академии Управления делами Президента Российской Федерации (Москва); О.Г. Елисютина, д.м.н., в.н.с. отделения иммунопатологии кожи Института иммунологии Федерального медико-биологического агентства (Москва); А.Г. Гаджигороева, д.м.н., руководитель отдела клинической дерматовенерологии и косметологии Московского научно-практического центра дерматовенерологии и косметологии, главный врач клиники «Институт Красивых Волос», президент ассоциации «Профессиональное общество трихологов» (Москва); Е.С. Галимова, д. м. н., профессор кафедры пропедевтики внутренних болезней Башкирского государственного медицинского университета (Уфа); И.В. Данилычева, к.м.н., в.н.с. отделения аллергологии и иммунотерапии Института иммунологии Федерального медико-биологического агентства (Москва); О.Р. Зиганшин, д.м.н., профессор, заведующий кафедрой дерматовенерологии Южно-Уральского государственного медицинского университета, главный врач Челябинского областного клинического кожно-венерологического диспансера, главный внештатный специалист по дерматовенерологии и косметологии Министерства здравоохранения Челябинской области (Челябинск); Н.И. Ильина, д.м.н., профессор кафедры клинической аллергологии и иммунологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова, профессор кафедры иммунологии медико-биологического факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, член ученого совета и заместитель председателя диссертационного совета Института иммунологии Федерального медико-биологического агентства, первый вице-президент и генеральный директор Российской ассоциации аллергологов и клинических иммунологов, заместитель директора по клинической работе Института иммунологии Федерального медико-биологического агентства (Москва); М.М. Кохан, д.м.н., профессор, заведующая научным клиническим отделом дерматологии Уральского научно-исследовательского института дерматовенерологии и иммунопатологии (Екатеринбург); Л.С. Круглова, д.м.н., профессор, заведующая кафедрой дерматовенерологии и косметологии, проректор по учебной работе Центральной государственной медицинской академии Управления делами Президента Российской Федерации (Москва); А.Н. Львов, д.м.н., профессор, руководитель отдела аспирантуры и ординатуры, профессор кафедры дерматовенерологии и косметологии Центральной государственной медицинской академии Управления делами Президента Российской Федерации, главный научный сотрудник Московского государственного университета им. М.В. Ломоносова (Москва); Е.В. Матушевская, д.м.н., профессор кафедры дерматовенерологии и косметологии Института повышения квалификации Федерального медико-биологического агентства (Москва); Н.Б. Мигачева, д.м.н., профессор, заведующая кафедрой педиатрии Института профессионального образования Самарского государственного медицинского университета, врач аллерголог-иммунолог высшей категории Самарской областной клинической больницы им. В.Д. Середавина (Самара); Н.Н. Мурашкин, д.м.н., профессор, заведующий отделением дерматологии с группой лазерной хирургии, заведующий лабораторией патологии кожи у детей, руководитель Научно-исследовательского института детской дерматологии Национального медицинского исследовательского центра здоровья детей (Москва); О.Б. Немчанинова, д.м.н., профессор, заведующая кафедрой дерматовенерологии и косметологии Новосибирского государственного медицинского университета (Новосибирск); Н.М. Ненашева, д.м.н., профессор, заведующая кафедрой аллергологии и иммунологии Российской медицинской академии непрерывного профессионального образования (Москва); О.Ю. Олисова, д.м.н., профессор, член-корреспондент Российской академии наук, заведующая кафедрой кожных и венерических болезней им. В.А. Рахманова Первого Московского государственного медицинского университета им. И.М. Сеченова, директор клиники кожных и венерических болезней им. В.А. Рахманова (Москва); Е.Б. Павлинова, д.м.н., профессор, заведующая кафедрой госпитальной педиатрии, проректор по учебной работе Омского государственного медицинского университета (Омск); О.А. Притуло, д.м.н., профессор, заведующая кафедрой дерматовенерологии и косметологии Медицинской академии им. С.И. Георгиевского Крымского федерального университета им. В.И. Вернадского, главный внештатный специалист по дерматовенерологии и косметологии Министерства здравоохранения Крыма (Симферополь); М.Н. Репецкая, д.м.н., профессор, заведующая кафедрой детских болезней лечебного факультета Пермского государственного медицинского университета им. акад. Е.А. Вагнера (Пермь); А.В. Самцов, д.м.н., профессор, заслуженный деятель науки РФ, заведующий кафедрой кожных и венерических болезней Военно-медицинской академии им. С.М. Кирова, вице-президент Российского общества дерматовенерологов и косметологов (Санкт-Петербург); О.А. Сидоренко, д.м.н., профессор, заведующая кафедрой кожных и венерических болезней Ростовского государственного медицинского университета (Ростов-на-Дону); Е.С. Снарская, д.м.н., профессор кафедры кожных и венерических болезней им. В.А. Рахманова Первого Московского государственного медицинского университета им. И.М. Сеченова (Москва); Е.В. Соколовский, д.м.н., профессор, заведующий кафедрой дерматовенерологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова (Санкт-Петербург); О.Б. Тамразова, д.м.н., профессор кафедры дерматовенерологии с курсом косметологии факультета непрерывного медицинского образования Медицинского института Российского университета дружбы народов (Москва); Н.С. Татаурщикова, д.м.н., заведующая кафедрой клинической иммунологии, аллергологии и адаптологии факультета непрерывного медицинского образования Медицинского института Российского университета дружбы народов (Москва); Е.С. Феденко, д.м.н., профессор, заведующая отделением аллергологии и иммунопатологии кожи Института иммунологии Федерального медико-биологического агентства, заместитель главного редактора «Российского аллергологического журнала» (Москва); Н.В. Федотова, к.м.н., заведующая Краснодарским краевым аллергологическим центром Научно-исследовательского института – Краевой клинической больницы № 1, главный внештатный специалист аллерголог-иммунолог Министерства здравоохранения Краснодарского края (Краснодар); Н.В. Шартанова, д.м.н., заведующая поликлиническим отделением Института иммунологии Федерального медико-биологического агентства (Москва); Л.А. Юсупова, д.м.н., профессор, заведующая кафедрой дерматовенерологии и косметологии Казанской государственной медицинской академии – филиала Российской медицинской академии непрерывного профессионального образования, главный внештатный специалист по дерматовенерологии и косметологии Министерства здравоохранения Республики Татарстан (Казань).
The advisory board, held on June 30, 2022, has become a platform for consideration the accumulated clinical and organizational problems in the field of managing patients with chronic urticaria and other allergic dermatoses. The board also discussed the possibility of long-term use of cetirizine and levocetirizine and the use of high doses of these drugs. The subject of discussion was the question of the algorithm for escalation and subsequent de-escalation of the dose of non-sedating H1-antihistamines. Based on the results of the discussion, an algorithm for escalation and de-escalation of doses of antihistamines was created, which can be recommended for use in clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.