Применение урсодезоксихолевой кислоты (Урсосана) при лекарственно-индуцированном поражении печени на фоне противотуберкулезной терапии
- Аннотация
- Статья
- Ссылки
- English
Введение
Противотуберкулезная полихимиотерапия (одновременный прием четырех – шести противотуберкулезных препаратов – туберкулостатиков) создает высокую медикаментозную нагрузку на больного. В большей степени страдает печень – центральный орган химического гомеостаза. По данным различных авторов, на долю лекарственного поражения печени приходится от 7 до 74% среди всех причин патологии печени у больных туберкулезом [1–5]. Подобное осложнение является одной из главных причин недостаточной эффективности противотуберкулезной химиотерапии, поскольку требует изменения ее режима [4].
Сочетание туберкулеза и поражения печени чрезвычайно неблагоприятно и имеет взаимоотягощающее влияние. С одной стороны, из-за отмены эффективных туберкулостатиков ухудшаются возможности лечения и создаются условия для неблагоприятного течения и исходов туберкулеза. С другой стороны, при продолжении противотуберкулезной терапии возникает угроза тяжелого поражения печени с опасным для жизни и здоровья прогнозом. Таким образом, необходимы раннее выявление и этиологическая расшифровка поражения печени при туберкулезе, а также разработка эффективных мер по ее защите.
Согласно современным воззрениям, в патогенезе, развитии и течении заболеваний печени особое место занимает апоптоз (программированная гибель клетки). Все больше исследований посвящается изучению роли апоптоза при различных патологических состояниях, в том числе при заболеваниях печени различной этиологии. Существуют разные методики регистрации апоптоза клеток. Мы использовали способ окрашивания ДНК лимфоцитов периферической крови (ЛПК) йодистым пропидием в качестве флуорохрома и измерение процента гиподиплоидных клеток на проточном цитофлуориметре клеток EPICS – XL (Beckman Coulter). В качестве нормы апоптоза ЛПК применялись данные, приведенные в работе Н.В. Матаниной [3].
Клинический случай
Пациентка 11 лет поступила в детско-подростковое отделение НИИ фтизиопульмонологии 8 февраля 2008 г. Наблюдалась с диагнозом инфильтративного туберкулеза верхней доли правого легкого (С2, С3, С6) в фазе распада. Выявлены микобактерии туберкулеза в мокроте методом посева (МБТ+).
Из анамнеза известно, что раннее развитие без особенностей. Из перенесенных заболеваний – острые респираторные заболевания пять раз в год. Аллергоанамнез не отягощен. У специалистов не наблюдалась. Контакт с больным туберкулезом не установлен.
Девочка больна в течение двух месяцев. Имели место малопродуктивный кашель, периодические подъемы температуры тела до 38,5 ºС, резкое снижение массы тела, снижение аппетита.
Рентгенологически диагностированы двусторонняя полисегментарная пневмония, кистозная гипоплазия легкого. На фоне проводимой терапии антибиотиками широкого спектра действия отмечалась замедленная рентгенологическая динамика. С подозрением на туберкулез пациентку направили в НИИ фтизиопульмонологии.
При поступлении состояние средней тяжести, жалобы на слабость, утомляемость, повышенную потливость, снижение аппетита, малопродуктивный кашель, боли в грудной клетке. При осмотре кожа бледная, периорбитальный цианоз, сыпи нет. В легких в межлопаточных областях, в большей степени справа – обилие влажных разнокалиберных хрипов. Живот мягкий, безболезненный. Печень и селезенка не увеличены.
Общий анализ крови: выражены воспалительные изменения – лейкоцитоз 11,9 × 109/л, нейтрофилез – до 70%, лимфопения – до 17%, скорость оседания эритроцитов – 40 мм/ч.
Общий анализ мочи без патологии.
Биохимический анализ крови: уровни общего билирубина – 8,1 мкмоль/л (норма до 20,0 мкмоль/л), прямого билирубина – 2,8 мкмоль/л (норма до 4,0 мкмоль/л), аланинаминотрансферазы (АЛТ) – 12,7 Е/л (норма 0–40 Е/л), аспартатаминотрансферазы (АСТ) – 17,9 Е/л (норма 0–40 Е/л). Маркеры вирусов гепатита B и C отрицательные.
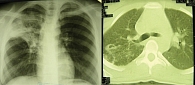
Анализ мокроты методом посева: обнаружены МБТ 2+ (умеренный рост). При рентгенологическом обследовании выявлен инфильтративный туберкулез верхней доли правого легкого в фазе распада (рис. 1).
С 8 февраля 2008 г. назначена противотуберкулезная терапия: изониазид 0,2 г/сут внутривенно и 0,3 г/сут перорально, пиразинамид 1,0 г/сут, рифампицин 0,5 г/сут, Ципролет® 0,2 г/сут, канамицин 0,8 г/сут внутримышечно.
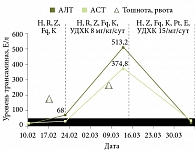
Через две недели (22 февраля 2008 г.) от начала терапии появились жалобы на слабость, тошноту, повторную рвоту. При осмотре кожа и склеры обычной окраски, гепатомегалия (+1 см), при пальпации печень чувствительна. Стул обычной окраски. Биохимический анализ крови: уровни общего билирубина – 14,6 мкмоль/л, прямого билирубина – 6,56 мкмоль/л, АЛТ – 68 Е/л (1,5 нормы), АСТ – 27,1 Е/л.
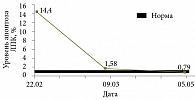
У пациентки определены показатели апоптоза ЛПК. Выявлен резко повышенный апоптоз ЛПК – 14,4% (норма 0,77 ± 0,05%).
Диагностировано лекарственно-индуцированное поражение печени (ЛИПП) смешанного типа с незначительно выраженным синдромом холестаза и цитолиза, в связи с чем временно отменен прием рифампицина, Ципролета, назначены дезинтоксикационная терапия, гепатопротектор – препарат урсодезоксихолевой кислоты (УДХК) Урсосан® в дозе 8 мг/кг/сут.
На фоне проводимой терапии через три дня симптомы интоксикации и диспепсические явления купированы, печень у края реберной дуги, при пальпации чувствительна. Из-за активности туберкулезного процесса и незначительно выраженных симптомов поражения печени было решено продолжить прием противотуберкулезных препаратов – изониазида, пиразинамида, рифампицина, Ципролета, канамицина. Через две недели вновь появились повторная рвота, головная боль, боль в животе. При осмотре кожа обычной окраски, склеры субиктеричные. Живот болезненный в правом подреберье, гепатомегалия (+2 см). Стул обычной окраски. Биохимический анализ крови: уровни общего билирубина – 26,4 мкмоль/л, прямого билирубина – 12,0 мкмоль/л, АЛТ – 513,2 Е/л (13 норм), АСТ – 374,8 Е/л (девять норм). Апоптоз ЛПК снизился, но все еще превышал норму – 1,58%. Диагностировано ЛИПП смешанного характера, с резко выраженным синдромом цитолиза, умеренно выраженным холестатическим синдромом. В связи с этим отменены рифампицин, Ципролет®, назначена инфузионная терапия с целью дезинтоксикации, доза Урсосана увеличена до 15 мг/кг/сут.
На фоне проводимой терапии в течение трех дней симптомы интоксикации и диспепсические явления купированы, при пальпации печень (+1 см) чувствительна. Скорректированная противотуберкулезная терапия продолжена на фоне применения Урсосана. Биохимический анализ крови от 3 апреля 2008 г. продемонстрировал нормализацию показателей: уровни общего билирубина – 16,4 мкмоль/л, прямого билирубина – 2,89 мкмоль/л, АЛТ – 19,5 Е/л, АСТ – 32,4 Е/л. Апоптоз ЛПК перед выпиской в пределах нормы – 0,79% (рис. 2–4).
Заключение
На данном примере показан вариант лекарственно-индуцированного поражения печени смешанного характера у ребенка с туберкулезом легких. ЛИПП развилось в первый месяц пребывания в стационаре. Первый эпизод ЛИПП отмечался через две недели лечения, протекал с маловыраженным цитолитическим (АЛТ – 1,5 нормы) и холестатическим синдромом (уровень прямого билирубина – 1,6 нормы). Его удалось купировать временной отменой противотуберкулезных препаратов и назначением патогенетического лечения (инфузионной терапии, Урсосана 8 мг/кг/сут). После возращения к приему отмененных противотуберкулезных средств возник повторный эпизод ЛИПП, но уже с резко выраженным цитолитическим синдромом (АЛТ – 13 норм), умеренным холестазом (прямой билирубин – три нормы), что подтверждало лекарственную этиологию поражения печени. ЛИПП удалось купировать временной отменой всех туберкулостатиков с дальнейшей коррекцией противотуберкулезной терапии и назначением адекватной дозы Урсосана 15 мг/кг/сут.
Обратите внимание: приведенный пример иллюстрирует дозозависимый эффект препаратов УДХК. Именно доза УДХК 15 мг/кг/сут оказалась достаточной для купирования ЛИПП и уже через две недели позволила возобновить противотуберкулезную терапию в необходимом объеме. Апоптоз ЛПК резко возрос уже при первом эпизоде ЛИПП, впоследствии снизился, при втором эпизоде оставался повышенным и нормализовался в течение двух месяцев на фоне применения Урсосана с одновременным купированием клинико-лабораторных симптомов ЛИПП. Можно предположить, что препараты УДХК (Урсосан®) регулируют апоптоз ЛПК. Это может благоприятно сказываться на течении не только ЛИПП, но и туберкулеза в целом.
S.N. Borzakova, A.R. Reyzis, S.M. Kavtarashvili
Russian National Research Medical University named after N.I. Pirogov
Central Research Institute of Epidemiology Russian Federal Service for Surveillance on Consumer Rights Protection and Human Wellbeing
Research Institute of Phthisiopulmonology First Moscow State Medical University named after I.M. Sechenov
Contact person: Svetlana Nikolayevna Borzakova, abbsnb@mail.ru
Here we describe a clinical case of developed drug-induced liver injury caused by anti-TB polychemotherapy. It was demonstrated that hepatoprotective agent ursodeoxycholic acid (Ursosan®) positively acted not only on clinical and laboratory symptoms of liver injury, but parameters of lymphocyte apoptosis from peripheral blood as well.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.