Риски инфекционных заболеваний у пациентов с псориазом кожи, принимающих генно-инженерные препараты: данные собственного исследования
- Аннотация
- Статья
- Ссылки
- English
Вирус иммунодефицита человека
Распространенность вируса иммунодефицита человека (ВИЧ) среди пациентов с псориазом приблизительно такая же, как и среди населения в целом [1]. Однако псориаз может быть начальным проявлением ВИЧ [2–4]. По мнению некоторых ученых, внезапное развитие псориаза у здоровых людей, имеющих факторы риска, должно вызвать подозрение на ВИЧ-инфекцию [4–6]. Считается, что каплевидный, инверсный и эритродермический псориаз чаще встречается у лиц, инфицированных ВИЧ. Однако бляшечный псориаз остается наиболее частым типом псориаза у ВИЧ-инфицированных лиц, живущих в западных странах [1, 2].
Как правило, псориаз становится более тяжелым при прогрессировании ВИЧ-инфекции и снижении количества CD4. По оценкам, у людей с количеством CD4 < 200 вероятность развития псориаза в девять раз выше, чем у людей с количеством CD4 > 200 [7]. У пациентов с ранее существовавшим псориазом внезапное изменение клинической картины, тяжести заболевания или развитие резистентности к терапии должно вызвать мысль о проведении тестирования на ВИЧ [1]. Если тест на ВИЧ положительный, важно направить пациента к специалисту для начала антиретровирусной терапии (АРВТ). Наличие ВИЧ не исключает лечения биологическими препаратами. В некоторых случаях сообщалось, что начало АРВТ может привести к полной регрессии псориаза [1, 3, 8–10]. В других случаях после начала АРВТ тяжесть псориаза может стать контролируемой до такой степени, что лечение системным препаратом больше не требуется, а местная терапия обеспечивает адекватный контроль заболевания. Поэтому всем пациентам с ВИЧ, которым требуется биологическая терапия псориаза, рекомендовано наблюдение инфекциониста для контроля количества CD4+ и вирусной нагрузки.
Несколько согласительных документов, в том числе Американской академии дерматологии (AAD)/Национального фонда псориаза (NPF), предлагают проводить предварительный скрининг на ВИЧ только у определенных пациентов [11, 12]. В других руководствах рекомендуется назначать базовые лабораторные исследования на ВИЧ-инфекцию всем пациентам до начала биологической терапии [13–15]. Рекомендации Британской академии дерматологии являются наиболее подробными в отношении тестирования на ВИЧ [13]. Они советуют проводить тестирование на наличие антител к ВИЧ-1, ВИЧ-2 и антигена ВИЧ до начала биологической терапии всем пациентам. При положительном скрининговом тесте следует проводить подтверждающий иммунодифференцировочный тест на антитела. Если подтверждающий тест отрицательный, то проводится тест для определения присутствия антигена p24 в качестве окончательного подтверждающего исследования. Предпоследним подтверждающим тестом является количественная полимеразная цепная реакция вирусной РНК ВИЧ.
Пациентам, имеющим факторы риска ВИЧ-инфекции и принимающим генно-инженерные биологические препараты (ГИБП), необходим полноценный лабораторный мониторинг во время всего периода биологической терапии. Согласно основным согласительным документам, пациентов с ВИЧ, находящихся на генно-инженерной биологической терапии (ГИБТ), можно лечить биологическими препаратами. Хотя данные ограничены, пациенты с ВИЧ-инфекцией успешно проходили терапию этанерцептом, адалимумабом, инфликсимабом, устекинумабом, секукинумабом, иксекизумабом и гуселькумабом, одновременно получая АРВТ [16–19].
Туберкулез
Туберкулез (ТБ) является одной из 10 ведущих причин смерти в мире. Согласно данным ВОЗ, ежегодно в мире ТБ заболевают до 10 млн человек и около 1,5 млн человек умирают от этой болезни, в том числе 20% от коинфекции ВИЧ и ТБ. В последние годы в Российской Федерации отмечен один из самых впечатляющих темпов снижения заболеваемости и смертности от ТБ в мире, что является фактом, признанным ВОЗ. Так, число заболевших за период с 2000 по 2019 г. снизилось более чем в два раза (с 133 229 человек в 2000 г. до 60 531 человека в 2019 г.), а умерших от ТБ – более чем в четыре раза (с 29 966 человек в 2000 г. до 7264 человек в 2019 г.). Однако все еще остается большое количество случаев латентной формы ТБ (ЛТБ). Внедрение терапии ингибиторами фактора некроза опухоли (ФНО) привело к всплеску реактивации ЛТБ [20]. В FDA разработали руководство по скринингу и мониторингу туберкулезной инфекции [11, 12, 14]. Скрининг на ЛТБ до начала применения ГИБП является наиболее эффективной стратегией предотвращения прогрессирования как ЛТБ, так и активной формы ТБ. Скрининг всех пациентов должен включать тщательный сбор анамнеза, физикальное обследование и лабораторные исследования. Тщательный сбор анамнеза должен проводиться не только до начала лечения ГИБП, но и повторяться ежегодно. Следует указать, что все существующие рекомендации имеют уровни доказательности (level of evidence) не выше категории C (неконтролируемые и/или нерандомизированные клинические исследования или обсервационные исследования) и по большей части относятся к категории D (согласованное мнение экспертов и/или клинический опыт).
Факторы риска заражения ТБ отличаются от факторов риска прогрессирования ЛТБ в активный ТБ во время биологической терапии. Это различие особенно важно для лиц, живущих с ВИЧ-инфицированными, или тех, у кого в анамнезе была трансплантация органов, с повышенным риском неблагоприятного исхода (менингит, диссеминированное заболевание или смерть) в случае развития активного ТБ [21].
Первоначально в нашей стране методической основой для проведения этих мероприятий служило пособие для врачей. В настоящее время создано несколько регламентирующих документов, однако отмечается несогласованность отдельных положений методических и нормативных документов различного уровня. В частности, согласно рекомендациям АРР и методическим рекомендациям 2018 г., обследование на ТБ пациентов, получающих лечение ГИБП, следует проводить в плановом порядке не реже одного раза в шесть месяцев. Контрольное обследование должно включать в том числе проведение рентгенографии легких в двух проекциях. С позиций высокого риска развития ТБ у лиц, получающих лечение ГИБП, такая периодичность обследования вполне оправданна и понятна. В то же время санитарно-эпидемиологические правила СП 3.1.2.3114-13 «Профилактика туберкулеза» (постановление Главного государственного санитарного врача РФ от 22.10.2013 № 60 не вступило в силу) определяют, что взрослые лица, получающие кортикостероидную, лучевую и цитостатическую терапию, ГИБП, проходят профилактические медицинские осмотры один раз в год. Санитарные правила и нормы СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» (утверждены постановлением Главного государственного санитарного врача РФ от 28.01.2021 № 4, вступили в действие с 1 сентября 2021 г.), приказ МЗ РФ от 21.03.2017 № 124н «Об утверждении порядка и сроков проведения профилактических медицинских осмотров граждан в целях выявления туберкулеза» для взрослых лиц, получающих кортикостероидную, лучевую, цитостатическую и иммуносупрессивную терапию (ГИБП отдельно вовсе не упомянуты), устанавливают сроки проведения осмотра один раз в год [22].
Доступны три скрининговых теста на ТБ: туберкулиновый кожный тест TST (tuberculin skin test) с туберкулином АТК (нем. Alt Tuberculin Koch, старый туберкулин Коха) или с туберкулином PPD (purified protein derivative), два анализа высвобождения гамма-интерферона IGRA: QuantiFERON-TB Gold In-Tube (QFT-GIT) и T-SPOT. Кожный туберкулиновый тест используется гораздо реже в связи с меньшей чувствительностью по сравнению с IGRA и перекрестной реакцией с вакцинацией БЦЖ [23]. Предпочтительно проведение исследования сыворотки крови. Однако у IGRA также есть ограничения [24]. T-SPOT обладает большей чувствительностью по сравнению с QFT-GIT, но их специфичность аналогична [25, 26].
Однако, если пациент имеет отрицательный результат скринингового теста ТБ, все еще существует риск ТБ. По оценкам, ложноотрицательные результаты тестов TST и IGRA составляют от 10 до 30% [25]. Систематическое обследование больных псориазом, получавших ГИБП, у которых развился активный ТБ, показало, что у значительной части (63%) пациентов скрининговые тесты перед лечением были отрицательными. При этом у 67% больных отсутствовали факторы риска развития первичного ТБ. Из 23 пациентов с положительным скрининговым тестом 78% получили профилактику ЛТБ, но у них все же развился активный ТБ [25]. Таким образом, медицинские работники должны сохранять бдительность в отношении развития активного ТБ и информировать пациентов о необходимости сообщать медицинскому работнику, если у них появится кашель, ночная потливость, потеря веса, лихорадка или кровохарканье.
Европейскими согласительными документами предписаны стандартный скрининг на ТБ и стандартное лечение ЛТБ в случае выявления. В американских руководствах AAD и NPF рекомендуется предварительное тестирование с помощью TST/PPD, T-SPOT.TB или QFT-GIT. Рентгенограмма грудной клетки показана только лицам с положительным скрининговым тестом на ТБ [12]. Большинство других мировых руководств рекомендуют рентгенографию грудной клетки в дополнение к скрининговому тесту на ТБ, вероятно, в ответ на более высокую исходную заболеваемость ТБ в соответствующих популяциях [12–15]. Согласно российским методическим рекомендациям от 2018 г., необходимо проведение комплексного обследования, обязательно включающего клиническое, рентгенологическое и микробиологическое исследование мокроты или иного патологического материала, если таковой имеется. Флюорографическое исследование пациентов при скрининге на ТБ перед назначением ГИБП нецелесообразно, и необходимо проводить как минимум рентгенографическое исследование органов грудной клетки в двух проекциях. Проведение компьютерной томографии грудной клетки необходимо в тех случаях, когда следует особо надежно документировать исходное состояние паренхимы легких, внутригрудных лимфатических узлов, плевры, бронхиального дерева и средостения [27].
Риск реактивации туберкулеза
Показано, что Т-хелперы 1 (Th1) играют важную роль в контроле Mycobacterium tuberculosis благодаря их способности повышать уровень гамма-интерферона [20]. Кроме того, ФНО-α участвует в формировании туберкулезной гранулемы. Считается, что интерлейкин (ИЛ) 12 и ФНО-α являются ключевыми цитокинами, ответственными за поддержание ЛТБ.
Ингибиторы ФНО-α. Наибольшее количество публикаций о реактивации туберкулезной инфекции при приеме ГИБП принадлежит группе ингибиторов ФНО-α, так как данный цитокин участвует в контроле инфекционного процесса [13, 26]. Метаанализы показали четырехкратное увеличение заболеваемости ТБ у тех, кто лечился ингибиторами ФНО-α, по сравнению с теми, кто не использовал данные препараты [26]. Однако риск реактивации ТБ сильно зависит от региональной распространенности ТБ. ГИБП адалимумаб, инфликсимаб и, вероятно, цертолизумаб имеют более высокий риск реактивации, чем этанерцепт. Однако все ингибиторы ФНО-α имеют значительно высокий риск реактивации ТБ [26, 28]. Более того, у пациентов, получающих комбинированную терапию ингибиторами ФНО-α и метотрексатом, риск реактивации ТБ выше, чем у пациентов, получающих только ингибиторы ФНО-α [11, 29]. Активная форма ТБ у пациентов, получающих ГИБП, обычно проявляется в течение первых нескольких месяцев лечения. Отмечено, что у 33% пациентов активная форма ТБ развивалась в течение первых трех месяцев биологической терапии, а у 51% – в течение первых шести месяцев. Среднее время до возникновения активной формы ТБ было меньше для инфликсимаба и адалимумаба, чем для этанерцепта (три – шесть месяцев в сравнении с одним годом) [26]. Приблизительно у двух третей больных развилась внелегочная реактивация ТБ, а у одной трети – диссеминированное заболевание [26]. Летальность составляла от 12 до 18% от числа заболевших [26].
Ингибиторы ИЛ-12/23. Степень риска прогрессирования ЛТБ в активный ТБ у пациентов, принимающих устекинумаб, до конца не изучена. Устекинумаб связывается с субъединицей р40 как ИЛ-12, так и ИЛ-23. Среди 167 пациентов с подтвержденной ЛТБ только у одного пациента, не получавшего профилактику изониазидом, развилась реактивация ТБ [30]. В другом исследовании в Южной Корее из 2803 пациентов, получавших устекинумаб, только у трех развилась активная форма ТБ. Поэтому авторы пришли к выводу, что устекинумаб не увеличивает риск ТБ по сравнению с общей популяцией [31]. Однако есть исследования, в которых реактивацию ТБ связывают и с устекинумабом [25]. Авторы предполагают, что устекинумаб, как и ингибиторы ФНО-α, может повышать риск прогрессирования ЛТБ в активную форму ТБ.
Ингибиторы ИЛ-23. Связь между ИЛ-23 и иммунитетом к ТБ до конца все еще не ясна. Данные доклинических исследований показывают, что функция ИЛ-23 в ответ на ТБ менее важна, чем функция других цитокинов, связанных с Th1. Анализ исследований трех селективных ингибиторов ИЛ-23 выявил один случай ТБ, развившегося после отрицательного TST на этапе скрининга до терапии ГИБП [20]. При изучении влияния гуселькумаба и рисанкизумаба на риски ТБ выявлено, что ни у одного пациента среди принимавших данные ГИБП не было ЛБТ и не развилась активная форма ТБ [20, 32].
Ингибиторы ИЛ-17. Подобно ИЛ-23 функция ИЛ-17 в защите от M. tuberculosis изучена не полностью. Исследование с использованием модели микрогранулемы человека in vitro показало, что ингибирование ИЛ-17A мало влияло на реактивацию ТБ [20]. В других исследованиях сообщается о пяти случаях активной формы ТБ de novo у пациентов, получавших секукинумаб, и один случай ТБ при лечении иксекизумабом в стране с высокой распространенностью ТБ. Ни в одном из этих случаев не сообщалось о реактивации [33, 34].
Когортное исследование 20 пациентов с подтвержденной ЛТБ в Китае показало, что три пациента получали профилактику ТБ до начала лечения секукинумабом, а 17 – нет. Контроль пациентов проводили с помощью опросника клинических симптомов, рентгенографии или компьютерной томографии грудной клетки, скорости оседания эритроцитов, высокочувствительного С-реактивного белка и анализа крови каждые 12–20 недель. Ни у одного пациента не было признаков реактивации ТБ. Также следует отметить, что только один пациент прошел полный профилактический курс. Один участник прекратил участие из-за анафилаксии, а другой отказался от участия после стойкого повышения уровня печеночных трансаминаз. Авторы предположили, что вместо обязательной химиопрофилактики для всех пациентов с ЛТБ, начавших принимать ингибиторы ИЛ-17, лучшей альтернативой может быть тщательный мониторинг. Они подчеркнули важность междисциплинарного сотрудничества для наблюдения за пациентами, включая пульмонолога и инфекциониста. Кроме того, авторы данного исследования также не рекомендуют использовать ингибиторы ФНО-α в качестве первой линии терапии при рисках ТБ и у пациентов с ЛТБ [35].
Ограничением подобных исследований является меньшая распространенность ТБ в странах, где проводится большинство рандомизированных контролируемых исследований (США и страны Западной Европы), чем в других странах мира [26]. Необходимы дополнительные исследования для определения риска реактивации ЛТБ у пациентов, принимающих ГИБП, а также проведение ежегодного лабораторного мониторинга ТБ у таких пациентов. Лицам, не относящимся к группе высокого риска, рекомендуется пройти скрининг по усмотрению лечащего дерматолога [11]. В рекомендациях также подчеркивается важность скрининга пациентов, принимающих именно ингибиторы ФНО-α [11].
Согласно одним исследованиям, лечение ингибиторами ФНО-α снижает чувствительность IGRA, однако IGRA все равно чувствительнее TST [26]. В другом исследовании сообщается, что ежегодный повторный скрининг с помощью TST или QFT-GIT может выявить 12,5% пациентов с ТБ, принимающих ингибиторы ФНО-α, с исходно ложноотрицательным тестом на ТБ (лабораторная/тестовая конверсия). Значение тестовой конверсии остается неясным. В когортном исследовании был проведен повторный скрининг пациентов с помощью TST, QFT-GIT и T-SPOT. Обнаружено, что ни одному из 60% пациентов, прошедших тестирование, не проводилась профилактика и ни у одного из них не развилась активная форма ТБ [36]. С учетом путаницы в отношении истинного риска прогрессирования ТБ и риска ложноотрицательных результатов тестирования во время терапии ингибиторами ИЛ-17 и селективными ингибиторами ИЛ-23 авторы большинства исследований рекомендуют базовое тестирование перед началом терапии ГИБП и не рекомендуют проводить рутинный ежегодный скрининг. А вот пациентам, получающим ингибиторы ФНО-α и устекинумаб, согласно рекомендациям AAD-NPF, следует проводить и базовый скрининг, и ежегодное тестирование (особенно рекомендуется для лиц с высоким риском заражения ТБ или прогрессирования от ЛТБ к активной форме ТБ). Для пациентов, не входящих в группу высокого риска, ежегодное тестирование остается на усмотрение лечащего врача.
Лечение латентной формы туберкулеза
Несмотря на доказанную эффективность изониазида в лечении ЛТБ, отмечается большое количество побочных эффектов, развивающихся при приеме данного препарата, поэтому в рекомендациях CDC и Национальной ассоциации по борьбе с ТБ предпочтение отдают схемам с использованием рифампицина, а не монотерапии изониазидом [37]. Несмотря на одинаковую эффективность, курсы применения рифампицина меньше по длительности и лучше переносятся пациентами [37]. Лечение ЛТБ обычно проводят после консультации с инфекционистом. Рекомендуется проводить лечение за один-два месяца до начала ГИБП [11]. Биологическую терапию не следует начинать больным с активной формой ТБ до тех пор, пока процесс не будет контролироваться и пока врач-инфекционист не даст свое согласие на проведение терапии.
Таким образом, перед началом лечения ингибиторами ФНО-α или устекинумабом следует провести базовое тестирование на ТБ с использованием IGRA или TST. Ежегодную оценку риска следует проводить всем пациентам, принимающим ингибиторы ФНО-α или устекинумаб, или пациентам из группы высокого риска. Для пациентов, не относящихся к группе высокого риска, по усмотрению врача, назначившего препарат, можно рассмотреть возможность ежегодного тестирования.
Для тех, кто лечится либо селективными ингибиторами ИЛ-23, либо ингибиторами ИЛ-17, базовое тестирование на ТБ должно проводиться с помощью IGRA или TST. Также рекомендуется проводить ежегодную оценку рисков, однако ежегодный скрининг не требуется.
Если выявлена ЛТБ, дерматологи должны направить пациентов к фтизиатру для рассмотрения соответствующей терапии. Для пациентов с ЛТБ лечение либо ИЛ-17, либо селективным ингибитором ИЛ-23 предпочтительнее, чем ингибитором ФНО-α или устекинумабом. Перед началом ГИБТ рекомендуется лечение ЛТБ в течение одного-двух месяцев. Если выявлен активный ТБ, необходимо незамедлительное направление к специалисту, а ГИБТ не следует начинать до тех пор, пока врач-фтизиатр не сочтет ее безопасной и допустимой у конкретного пациента.
Гепатит В
В России заболеваемость вирусным гепатитом В (ВГВ) в 2021 г. оценивалась в 4,8 на 100 тыс. человек, распространенность вируса хронического гепатита В в США составляет 1,6 млн человек, или примерно 0,5% населения. В развитых странах заражение чаще всего происходит в результате полового контакта с инфицированным партнером, рождения у инфицированной матери или совместного использования игл, бритв и/или зубных щеток [38].
Как и в случае с ТБ, хотя и не в такой степени, терапия ингибиторами ФНО-α сопровождается реактивацией гепатита В [39]. ФНО-α играет роль в выведении вирусных частиц из инфицированных клеток печени. В частности, он активирует противовирусный механизм, что приводит к деградации ДНК в клетках, инфицированных ВГВ [11, 40–42]. Несмотря на то что биологическая терапия не является непосредственно гепатотоксичной, ингибиторы ФНО-α связаны с лекарственным поражением печени независимо от наличия вирусного гепатита [39]. Реактивация латентного ВГВ у пациентов с псориазом может привести к циррозу печени, печеночной недостаточности, фульминантному гепатиту и/или смерти [38].
После инфицирования ВГВ может возникнуть широкий спектр клинических проявлений. Серология гепатита B используется для выявления различных фаз инфекции, включая активную инфекцию, разрешившуюся инфекцию и иммунитет после вакцинации. Среди иммунокомпетентных взрослых более 95% пациентов с симптоматическим острым гепатитом В выздоравливают спонтанно [43]. У многих из этих пациентов серологическая картина будет свидетельствовать о разрешенном ВГВ. Другие пациенты могут стать скрытыми носителями, что определяется наличием ДНК ВГВ в крови лиц с отрицательным тестом на HBsAg (+/- анти-HBc) [44]. Скрытые инфекции чаще наблюдаются у беременных женщин, потребителей внутривенных наркотиков и пациентов с сопутствующим гепатитом С или ВИЧ [38]. Кроме того, пациенты с ВГВ могут иметь активную или неактивную инфекцию, что определяется уровнем ДНК вируса, сывороточными маркерами и функциональными печеночными тестами.
Диагностика
Перед началом биологической терапии всем пациентам рекомендуется проводить скрининг на гепатит В. Скрининг может выявить лиц с недиагностированной или нераспознанной хронической инфекцией гепатита В. Рекомендуемый скрининг включает тройной тест на HBsAg, анти-HBs и анти-HBc. Если HBsAg окажется положительным, перед началом лечения ГИБП необходима консультация инфекциониста или гепатолога. Этим пациентам должен оказываться междисциплинарный подход с целью правильной оценки состояния их заболевания, функции печени, а также подбора терапии.
У пациентов с известным анамнезом разрешенного ВГВ или скрытой инфекции (+/- анти-HBc) рекомендуется провести предварительное тестирование с количественным определением ДНК ВГВ для установления исходного уровня [45]. Для этих пациентов также рекомендуется направление в специализированное отделение гепатологии для обследования до начала лечения и долгосрочного ведения [11]. У пациентов с разрешившимся или скрытым ВГВ следует рассмотреть возможность постоянного мониторинга с помощью HBsAg, анти-HBc и функциональных печеночных тестов [11].
Если у пациента все отрицательные результаты серологического анализа на ВГВ, то есть он никогда не был вакцинирован или не подвергался воздействию вируса, дерматолог должен рекомендовать вакцинацию [45].
Постоянный мониторинг ВГВ не требуется [11], но любой пациент, у которого во время лечения ГИБП развивается необъяснимое повышение уровня трансаминаз, должен пройти повторное тестирование на ВГВ [13]. Наконец, для тех, кто получает ГИБТ, не вакцинирован и находится в группе высокого риска заражения, следует проводить периодический мониторинг ВГВ.
Риск реактивации
Пациенты с хронической инфекцией гепатита В, получающие любые иммунодепрессанты, включая ГИБП, подвергаются риску реактивации инфекции ВГВ. Однако этот риск не является одинаковым среди различных групп ГИБП. Риск реактивации ВГВ минимален для пациентов с серопозитивностью к кóровым антителам HBcAg, получающих биологические препараты (1–3%) [39, 46]. Пациенты с хроническим неактивным заболеванием подвергаются наибольшему риску реактивации (14–34%), за ними следуют носители и, наконец, пациенты с разрешившейся инфекцией [41, 46, 47]. Лица с высоким риском реактивации должны получать противовирусные препараты [38] и тщательно обследоваться перед началом ГИБТ [41, 47]. Предикторами и факторами риска реактивации являются HBsAg-положительный результат, отсутствие профилактики [46]. Сывороточная ДНК ВГВ не является предиктором реактивации [46].
Пациентов следует информировать о риске реактивации и рекомендовать незамедлительно обратиться за медицинской помощью в случае развития симптомов. Симптомы реактивации включают потерю аппетита, утомляемость, тошноту, генерализованный зуд, болезненность в правом подреберье, желтуху, потемнение мочи и ахоличный кал [45]. Однако реактивация ВГВ может протекать и бессимптомно [11, 47]. В некоторых исследованиях сообщается о возможности профилактировать реактивацию благодаря своевременному скринингу и назначению профилактической противовирусной терапии [15].
Ингибиторы ФНО-α. Исследование пациентов с положительным HBsAg или анти-HBc, получавших ингибиторы ФНО-α, выявило различный риск реактивации ВГВ среди этих когорт. У 39% пациентов с положительным HBsAg развилась реактивация и только у 5% – среди положительных на коровые антитела [68]. Реактивация чаще наблюдалась у тех, кто не получал профилактику (62% в сравнении с 23%) [49]. Другие исследования обнаружили еще более низкие показатели реактивации после профилактики у HBsAg-позитивных пациентов, принимающих ингибиторы ФНО-α (1–10%) [50]. В целом большинство случаев реактивации ВГВ после применения ингибиторов ФНО-α происходит при недерматологических заболеваниях [51]. В некоторых исследованиях утверждается, что этанерцепт может быть самым безопасным в отношении ВГВ среди ГИБП этого класса [50].
Ингибиторы ИЛ-12/23. Исследования показали, что ИЛ-12 играет существенную роль в способности организма реагировать на гепатотропные вирусы [50]. Несмотря на это, не было показано, что устекинумаб обладает существенно высоким риском реактивации ВГВ, причем скорость реактивации аналогична таковой для ингибиторов ФНО-α [50]. В одном исследовании выявлен уровень реактивации 17,4% среди пациентов, не получавших профилактику, по сравнению с 0% у тех, кто ее получал [52]. Авторы других исследований указывают, что устекинумаб безопасно использовать при положительных серологических исследованиях на ВГВ при условии, что пациент получает профилактику и находится под совместным наблюдением смежных специалистов [53, 54].
Ингибиторы ИЛ-23. В литературе имеется несколько сообщений о лечении селективными ингибиторами ИЛ-23 пациентов с положительным серологическим тестом к ВГВ [50, 55]. Никаких исследований или случаев с участием пациентов с положительной серологией ВГВ, получавших тилдракизумаб или рисанкизумаб, не имеется [55]. Сообщалось о двух случаях применения гуселькумаба: в одном были положительные анти-HBc, а в другом – HBsAg, анти-HBc и анти-HBsAg. Оба пациента были успешно вылечены без реактивации [56, 57]. В рандомизированном контролируемом исследовании III фазы гуселькумаба (n = 739) был зарегистрирован один случай ВГВ [58].
Ингибиторы ИЛ-17. Установлено, что у лиц с хроническими заболеваниями печени, в том числе вследствие вирусной инфекции, ИЛ-17 участвует в процессах развития фиброза. Предполагается, что ингибирование ИЛ-17 может обеспечить защиту от прогрессирования цирроза печени [50]. В исследовании секукинумаба отмечена реактивация ВГВ у 7 (15,2%) из 46 пациентов, не получавших противовирусную профилактику [59]. Пациенты с положительным HBsAg имели значительно более высокий риск по сравнению с HBsAg-отрицательными пациентами и положительными анти-HBc (24,0% в сравнении с 4,17%) [59]. Сообщалось о двух случаях применения иксекизумаба у лиц с положительными серологическими тестами на гепатит В. Оба пациента выздоровели без признаков реактивации [60, 61].
Большинство авторов рекомендуют ингибиторы ИЛ-17 в качестве терапии первой линии, селективные ингибиторами ИЛ-23 – второй линии для пациентов с коморбидным гепатитом В [55]. С учетом немногочисленности данных влияние многих новых ГИБП на реактивацию гепатита оценить полностью не представляется возможным [45].
Схема лечения
Предыдущая или текущая инфекция ВГВ не является абсолютным противопоказанием для ГИБТ. Однако должен осуществляться тщательный мониторинг совместно с инфекционистом, гастроэнтерологом или гепатологом [11]. Пациентов можно контролировать с помощью серологических исследований, а также одновременно назначать противовирусные препараты.
Пациентам с положительным HBsAg рекомендуется начинать противовирусную терапию за две – четыре недели до начала приема биологического препарата, независимо от класса ГИБП [15]. В систематическом обзоре 2017 г. показано, что у 2 (1,1%) из 175 пациентов с положительным анти-HBc наблюдалась реактивация вируса [39]. Если у пациента положительный тест на анти-HBc, то это может быть разрешившаяся прошлая инфекция, либо сероположительная скрытая инфекция гепатита В, либо ложноотрицательный результат, либо репликативная HBsAg-отрицательная инфекция [39]. Положительный серологический результат на анти-HBc не исключает лечения биологическими препаратами, однако необходима предварительная консультация инфекциониста или гепатолога.
Гепатит С
Российская Федерация относится к странам со средним уровнем эндемичности по гепатиту С. По расчетным данным, число лиц, инфицированных вирусом гепатита С (ВГС), является самым большим в Европе (около 5 млн), а распространенность ВГС-инфекции в общей популяции достигает 4,1%. Примерно в 25% случаев происходит спонтанное излечение от инфекции ВГС [62]. В остальных случаях применяют противовирусные препараты прямого действия (ПППД). Терапия ПППД в течение 8–12 недель эффективна у 90% лиц, инфицированных ВГС [63].
По данным исследований, у пациентов с псориазом отмечается повышенная распространенность инфекции ВГС, но не ВГВ [64]. Другое исследование также показало, что в коже пациентов с ВГС повышено количество ключевых провоспалительных медиаторов в сравнении с пациентами с псориазом и без ВГС [65]. У 31 из 37 пациентов с ВГС и сопутствующим псориазом, принимавших ПППД, наблюдалось резкое улучшение состояния со стороны кожного патологического процесса во время терапии ПППД, у 24 из 31 течение псориаза ухудшилось после прекращения терапии ПППД [66].
Диагностика
Предварительный скрининг на антитела к гепатиту С должен быть проведен у всех пациентов до начала приема ГИБП [11]. Пациентов с положительным результатом теста на антитела следует направить к своему лечащему врачу или соответствующему специалисту для дальнейшего обследования с целью оценки активной инфекции (вирусной нагрузки РНК ВГС).
Для тех, кто прошел терапию ВГС, нет противопоказаний к биологической терапии, и пациенты могут начать лечение. Следует отметить, что у пациентов, прошедших лечение, тест на антитела будет положительным всю жизнь. Если у пациента в анамнезе имеется терапия ПППД, подходящим скринингом является определение вирусной нагрузки, а не антител к гепатиту С. Во время лечения ГИБП не рекомендуется проводить регулярный постоянный скрининг на гепатит С. Повторное тестирование с учетом вирусной нагрузки оправдано, если у пациента во время приема биологической терапии разовьется необъяснимое повышение уровня трансаминаз или возникнет новый риск реинфекции [13].
Риск реактивации и схема лечения
Реактивация гепатита С встречается крайне редко и аналогична реактивации гепатита В [41]. Исследования показали, что обострению хронического гепатита С может способствовать активация цитокинов, таких как ФНО-α [39]. Таким образом, высказано предположение, что лечение ингибиторами ФНО-α может быть полезным для пациентов с ВГС [61, 65]. В исследованиях показано, что у пациентов, инфицированных ВГС, получавших ингибиторы ФНО-α, уровень реактивации вируса составляет примерно 3%, что аналогично скорости колебаний вирусной нагрузки среди пациентов с ВГС без ГИБТ [39]. Среди класса ингибиторов ФНО-α этанерцепт является лучшим вариантом с учетом его возможного использования в качестве дополнительного лечения у пациентов с ВГС [50, 67, 68]. В целом большинство исследователей приходят к выводу, что ингибирование ФНО-α не представляет никакого риска реактивации ВГС [50].
У одного из девяти пациентов с ВГС, получавших устекинумаб, развилась реактивация ВГС [50, 51, 53]. Данных об использовании селективных ингибиторов ИЛ-23 у ВГС-положительных пациентов нет. В проспективном многоцентровом исследовании пациентов с ВГС-инфекцией, получавших секукинумаб, реактивация произошла у одного из 14 пациентов, не получавших противовирусную профилактику [69].
Пациентов с гепатитом С в анамнезе или в настоящее время можно лечить биологическими препаратами, однако необходим междисциплинарный подход (инфекционист, гепатолог). Целью лечения гепатита С является устойчивый вирусологический ответ, определяемый как отсутствие обнаруживаемой РНК ВГС через три месяца после завершения терапии ВГС. Однако если пациенты не получают ПППД, их следует контролировать с помощью регулярных функциональных печеночных тестов в дополнение к вирусной нагрузке РНК ВГС. В настоящее время имеется мало исследований по одновременному лечению ПППД и ГИБП. Из биологических препаратов, используемых при псориазе, в европейских рекомендациях (European Association for the Study of the Liver) упоминается только этанерцепт. Сообщается, что клинически значимого взаимодействия не отмечали [50, 69].
Перед началом биологической терапии всем пациентам необходимо пройти тестирование на ВГВ и ВГС. Для пациентов с серопозитивностью к ВГВ ингибиторы ИЛ-17 могут быть препаратами выбора. Препаратами второй линии могут быть селективный ингибитор ИЛ-23, затем ИЛ-12/23 или ингибитор ФНО-α. Пациентам с активным ВГС рекомендуется лечение ПППД. Биологические препараты можно назначать одновременно при условии мультидисциплинарного ведения со специалистом. Для пациентов с ВГС ингибиторы ФНО-α, а именно этанерцепт, могут рассматриваться как препараты первой линии. Имеются ограниченные сообщения о пациентах, получавших устекинумаб и секукинумаб. При развитии симптомов реактивации пациентам следует незамедлительно обратиться за медицинской помощью. Мультидисциплинарный подход имеет важное значение в этой группе населения.
Собственное исследование
Цель исследования – изучить профиль безопасности (в отношении инфекционных заболеваний) и эффективности ГИБП из группы ингибиторов ИЛ-17А (нетакимаб) у пациентов с псориазом гладкой кожи, воспалительной болью в спине.
Материал и методы
Дизайн исследования: проспективное многоцентровое исследование. Оценку эффективности проводили с учетом общепринятых индексов тяжести псориаза (PASI и BSA) и псориатического артрита (ПсА) (BASDAI, DAPSA, ACR20).
Критерии включения больных в исследование: возраст 18 лет и старше; подтвержденный псориаз кожи (среднетяжелое/тяжелое течение); хроническая боль в спине (три месяца и более); не принимавшие ранее ГИБП, метотрексат, синтетические базисные противовоспалительные препараты (сБПВП), таргетные синтетические базисные противовоспалительные препараты (тсБПВП); без установленного ранее ПсА; удовлетворяющие критериям воспалительной боли в спине ASAS, с признаками МРТ-активного сакроилеита; отрицательный ревматоидный фактор, подписанное информированное согласие на участие в исследовании. Критерии невключения: диагностированный ПсА; указание в анамнезе на раннее лечение метотрексатом/ГИБП/сБПВП/тсБПВП; пациенты, имеющие воспалительные заболевания кишечника; пациенты с механической или смешанной болью в спине. Критерии исключения: непереносимость лекарственных средств (ГИБП, метотрексат, глюконат кальция, тиосульфат натрия); клинически значимые инфекции в фазе обострения (в том числе ВИЧ, гепатит В и С, ТБ легких); наличие сопутствующих декомпенсированных заболеваний; выраженная почечная и/или печеночная недостаточность; нарушения со стороны кроветворения; язвы желудочно-кишечного тракта; беременность; период лактации; иммунодефицитные состояния; отсутствие данных об аллергических реакциях на препараты или их компоненты.
Перед назначением препарата и в ходе терапии пациенты прошли обследование в соответствии с клиническими рекомендациями при назначении биологической терапии (клинический анализ крови, мочи, биохимический и общий анализ крови, anti-HCV, HBsAg, anti-HIV, MP/RPR, диаскин- или SPOТ-тест, флюорограмма или компьютерная томография органов грудной клетки) и получили консультации ревматолога, инфекциониста с дальнейшим мониторингом.
Под нашим наблюдением находился 51 пациент (24 (47,1%) мужчины и 27 (46,2%) женщин) в возрасте 18–64 года (средний возраст – 39,7 ± 1,4 года), которые получали ГИБП из группы ингибиторов ИЛ-17А (нетакимаб) в дозировке 120 мг подкожно на 0-й, 1-й, 2-й неделях и затем 120 мг каждый месяц на протяжении 52 недель. Средняя продолжительность псориаза кожи составила 13,2 года. Среднее значение PASI – 28,5 балла, BSA – 33 балла, также отмечалась высокая активность ПсА со средним значением BASDAI 6,2 (SD = 0,6) балла. Период наблюдения составил 52 недели.
Результаты
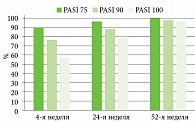
Со стороны кожного патологического процесса отмечалась положительная динамика уже через один месяц после начала терапии нетакимабом – 90,2% (n = 46) пациентов достигли уровня PASI 75; 76,5% (n = 39) – PASI 90 и 56,9% (n = 29) – PASI 100. К 24-й неделе также отмечалась положительная динамика со стороны патологического кожного процесса, при которой PASI 75 наблюдали у 96,1% (n = 49), PASI 90 – у 88,2% (n = 45) и PASI 100 – у 80,4% (n = 41). К 52-й неделе 100% (n = 51) пациентов достигли уровня PASI 75; 98,0% (n = 50) – PASI 90 и 96,7% (n = 48) – PASI 100 (рис. 1).
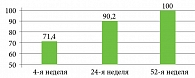
На фоне терапии нетакимабом пациенты отметили значительное улучшение качества жизни. К 4-й, 24-й и 52-й неделям дерматологический индекс качества жизни (ДИКЖ) < 5 был у 71,4; 90,2 и 100% пациентов соответственно (рис. 2).
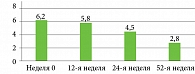
Жалобы со стороны костно-суставной системы, а именно ноющая, тянущая боль в спине или шее, скованность в спине или шее, уменьшились уже к концу первого месяца терапии у 66,7% пациентов (n = 34). К 12-й, 24-й и 52-й неделям терапии нетакимабом все пациенты отмечали уменьшение воспалительной боли в спине или шее, отсутствовала скованность в спине/шее. До терапии отмечалась высокая активность заболевания со стороны костно-суставной системы со средним значением BASDAI 6,2 (SD = 0,7) балла. Среднее значение BASDAI в указанные временные точки составило 5,8 (SD = 2,5), 4,5 (SD = 1,4) и 2,8 (SD = 1,1) балла соответственно (рис. 3). Установлено, что 92,2% (n = 47) пациентов достигли ACR20 к концу исследования на 52-й неделе. Большинство пациентов (76,5%) достигли ремиссии или низкой активности заболевания по DAPSA через 24 недели терапии. Среднее значение ASDAS на 12-й, 24-й, 52-й неделях составило 3,4 (0,8), 2,7 (0,3) и 2,2 (0,9) соответственно. При проведении магнитно-резонансной томографии крестцово-подвздошных сочленений в режиме STIR с подавлением жира не было обнаружено признаков активного воспалительного процесса.
За анализируемый период никто из лиц, получавших лечение ГИБП из группы ингибиторов ИЛ-17А (нетакимаб), не заболел ТБ, вирусными гепатитами В и С или ВИЧ-инфекцией. На этапе предварительного скрининга был выявлен единичный клинический случай активного ТБ легких. Пациент был направлен на консультацию к фтизиатру для прохождения соответствующего лечения. Наиболее распространенными инфекционными заболеваниями у пациентов на ГИБП были инфекции верхних дыхательных путей (два пациента), герпесвирусные инфекции (простой герпес – у двух пациентов, опоясывающий лишай – у одного пациента), кандидозная инфекция в области половых органов (три пациента). Во всех случаях возникновения инфекционных заболеваний не требовалось отмены ГИБП, а также ограничений в использовании основной терапии во время инфекционного процесса. Все случаи инфекционных заболеваний заканчивались полным выздоровлением пациентов после терапии при отсутствии каких-либо осложнений.
Заключение
Для успешного внедрения в России методов биологической терапии хронических воспалительных заболеваний представляется абсолютно необходимым создание системы мероприятий по выявлению, диагностике и профилактике инфекционных заболеваний у данной группы больных. Следует учитывать расширение показаний к применению ГИБП, появление все новых препаратов данного класса и значительный рост числа больных, получающих ГИБП в течение длительного времени (в перспективе – пожизненно). Перед началом лечения биологическим препаратом необходим предварительный скрининг на ТБ, ВГВ и ВГС. Предварительный скрининг на ВИЧ в европейских согласительных документах рекомендуется только пациентам с факторами риска. Однако согласно рекомендациям в РФ скрининг на ВИЧ-инфекцию необходим [70]. Наличие хронической инфекции не исключает лечения ГИБП, однако таким пациентам требуется междисциплинарный и персонализированный подход. Необходимо проведение дальнейших рандомизированных клинических исследований для определения тактики ведения таких пациентов.
L.S. Kruglova, PhD, Prof., N.O. Pereverzina, PhD
Central State Medical Academy of Department of Presidential Affairs, Moscow
Contact person: Natalia O. Pereverzina, natalia.pereverzina@gmail.com
It is known that biological agents is associated with a risk of development/exacerbation of chronic infections, such as human immunodeficiency virus, tuberculosis, viral hepatitis B and C. A number of medical communities have developed recommendations for the treatment of biological agents in psoriasis patients. But the vast majority of these guidelines contain few recommendations regarding laboratory monitoring of such patients. According to our study, none of the patients (n = 51) who received treatment with a biological agents IL-17A inhibitors (netakimab) developed tuberculosis, viral hepatitis B and C, or HIV infection. The most common infectious diseases were upper respiratory tract infections (n = 2), herpes viral infections (n = 2), infection Candida in the genital area (n = 3). In all cases of the occurrence of infectious diseases, there was no need to discontinue the pharmacological therapy, nor were there any restrictions on the use of primary therapy during the infectious process. All cases of infectious diseases resulted in complete recovery of patients after therapy in the absence of any complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.