Принципы диагностики хронического гастрита, ассоциированного с патологическим дуоденогастральным рефлюксом: серия клинических наблюдений
- Аннотация
- Статья
- Ссылки
- English
Внимание отечественных и зарубежных исследователей, а также практикующих специалистов к проблеме ведения больных хроническим гастритом обусловлено не только высокой заболеваемостью и риском развития рака желудка при формировании атрофии слизистой оболочки желудка [1]. В последние десятилетия наметилась тенденция к изменению структуры этиологии гастрита с уменьшением доли вклада инфекции Helicobacter pylori и накоплением данных об участии других инфекционных и неинфекционных этиологических факторов, что обусловливает необходимость актуализации имеющихся сведений о других типах хронического гастрита.
Помимо H. pylori-ассоциированного к числу наиболее часто диагностируемых в реальной клинической практике следует отнести аутоиммунный и химический гастрит, который может быть связан как с приемом ряда лекарственных средств (лекарственно-индуцированная гастропатия) [2], так и с развитием патологического дуоденогастрального рефлюкса (ДГР) [3, 4]. Билиарный гастрит (БГ) представляет собой вариант химического гастрита, где в качестве ведущего повреждающего фактора выступают желчные кислоты (ЖК), которые при длительном контакте со слизистой оболочкой желудка вследствие патологического ДГР приводят к ее повреждению [5, 6]. При этом может иметь место развивающаяся очаговая кишечная метаплазия как отражение реактивной перестройки слизистой оболочки, самостоятельно не имеющая отношения к предраковому каскаду [7–9].
Настоящая публикация подготовлена с целью систематизации и анализа имеющихся данных о встречаемости, факторах риска, механизмах формирования, а также ключевых клинических, эндоскопических и патоморфологических признаках хронического гастрита, ассоциированного с патологическим ДГР, и проиллюстрирована серией наблюдений из реальной клинической практики.
Традиционно рефлюкс-гастрит считался частым осложнением частичной гастрэктомии (Бильрот II), применяемой при доброкачественных состояниях, таких как язва желудка. С момента открытия H. pylori в качестве этиологического фактора язвенной болезни и использования эффективных схем лечения антрэктомия по Бильрот II встречается все реже. Ожидается, что в дальнейшем распространенность такой ассоциированной с оперативным вмешательством гастропатии будет только снижаться [6, 8].
Существование стойкого рефлюкса желчи с забросом компонентов содержимого просвета двенадцатиперстной кишки (ДПК) в нормальный (неоперированный) желудок трудно верифицировать в клинической практике, поэтому истинная частота таких событий требует дальнейшего уточнения. Однако реактивные изменения слизистой оболочки желудка в отсутствие сведений о приеме лекарственных препаратов из группы нестероидных противовоспалительных средств, аспирина или каких-либо других специфических причин чаще всего индуцированы именно ДГР [6, 9].
По данным эпидемиологических исследований, на долю химического гастрита, ассоциированного с билиарным рефлюксом, приходится около 22% всех случаев хронического гастрита [10].
Известные на сегодня факторы риска, которые могут способствовать появлению патологического ДГР [6, 9, 11–15], можно разделить на несколько групп:
- анатомические изменения в зоне дуоденогастрального перехода (резекция желудка, гастроэнтеростомия, рукавная гастрэктомия, энтеростомия, пилоропластика);
- патология желчевыводящих путей (желчнокаменная болезнь (ЖКБ), включая период после холецистэктомии, глистно-паразитарные инвазии);
- моторные нарушения верхних отделов пищеварительного тракта.
Нарушение моторики верхних отделов желудочно-кишечного тракта вызывает первичный БГ, а у лиц, у которых имеются структурные изменения, развивается вторичный БГ.
В основе развития БГ можно выделить два ключевых патогенетических фактора:
наличие патологического ДГР. В развитии ДГР наряду с антиперистальтическим механизмом участвуют фактор повышения давления в ДПК и следующее за ним развитие хронической дуоденальной непроходимости (ХДН). Различают три стадии течения синдрома ХДН: компенсированную, субкомпенсированную и декомпенсированную [16, 17];
состав рефлюктата и его агрессивные свойства. В состав дуоденального содержимого, попадающего в просвет желудка при ДГР, входят желчные кислоты, панкреатический и дуоденальный сок с содержащимися в них ферментами. Основным компонентом желчи являются ЖК, среди которых выделяют первичные и вторичные. Первичные ЖК (холевая и хенодезоксихолевая) синтезируются из холестерина в гепатоцитах и находятся в конъюгированном состоянии с аминокислотами глицином или таурином в составе желчи в желчном пузыре вне процесса пищеварения [18]. При поступлении пищевого химуса происходит сокращение желчного пузыря, желчь выделяется в просвет ДПК, где она участвует в эмульгации жиров, активации липазы поджелудочной железы и всасывании гидрофобных веществ (холестерин, жирорастворимые витамины, растительные стероиды и др.). Часть первичных ЖК в терминальном отделе подвздошной кишки подвергается деконъюгации и с портальным кровотоком возвращается в печень, другая часть, достигая толстой кишки, дегидроксилируется под действием 7-α-гидроксилазы бактерий с образованием вторичных ЖК (литохолевая, дезоксилитохолевая) [19, 20]. Дезоксилитохолевая кислота путем пассивной диффузии может попадать в системный кровоток и участвовать в энтерогепатической циркуляции наравне с первичными ЖК, тогда как литохолевая кислота не реабсорбируется из-за ее плохой растворимости и выводится с калом [21]. Описанный цикл энтерогепатической циркуляции ЖК может повторяться до 10 раз в течение суток [22].
Известно, что ЖК и их соли оказывают основной повреждающий эффект на слизистую оболочку желудка. Во-первых, ЖК ингибируют активность фермента синтетазы оксида азота, способствуя таким образом повреждению ДНК, апоптозу и мутации клеток. Во-вторых, в условиях изменения рН ЖК видоизменяются, приобретая еще более цитотоксические свойства, которые обусловливают проникновение через клеточные мембраны, повреждая межклеточные контакты. Кроме того, на фоне низкого рН происходят увеличение обратной диффузии Н+, стимуляция тучных клеток с последующей их дегрануляцией и высвобождением большого количества гистамина. В свою очередь, гистамин опосредует усиление секреции соляной кислоты, которая не только является фактором агрессии по отношению к слизистой оболочке желудка, но и потенцирует негативное действие самих ЖК. В-третьих, лизолецитин в составе желчи разрушает фосфолипидный слой клеточных мембран эпителия слизистой оболочки желудка [23–26].
Формированию порочного круга способствует то, что ДГР увеличивает секрецию гастрина G-клетками, который не только повышает продукцию соляной кислоты, но и ингибирует сокращение пилорического сфинктера [27].
Патогенез БГ также можно рассмотреть через призму дисбаланса между факторами агрессии и факторами защиты. Преобладание факторов агрессии ведет к снижению резистентности слизистой оболочки желудка [28].
Клиническая картина БГ складывается из синдрома диспепсии, а также симптомов, связанных с патологией гепатобилиарной системы, в ряде случаев заболевание протекает асимптомно [15]. Клинический симптомокомплекс синдрома диспепсии не имеет характерных отличий и может быть представлен как по типу эпигастральной боли, постпрандиального дистресс-синдрома, так и в смешанном варианте. Вместе с тем рядом авторов отмечена несколько более частая встречаемость в сравнении с гастритом, ассоциированным с инфекцией H. pylori, симптомов диспепсии, характерных для постпрандиального дистресс-синдрома (чувство тяжести в эпигастрии, чувство раннего насыщения) [6, 15, 29].
При опросе необходимо выяснить сопутствующие заболевания, сведения о приеме пациентом лекарственных препаратов и биологически активных добавок, способных вызвать лекарственно-индуцированную гастропатию, наследственный анамнез в отношении рака желудка. Диагностический поиск начинается с рутинных общеклинических обследований с оценкой симптомов тревоги, ультразвукового исследования (УЗИ) органов брюшной полости (скрининговое исследование для выявления патологии печени, билиарного тракта и поджелудочной железы), выяснения статуса инфицирования H. pylori, проведения эндоскопического исследования желудка с забором гастробиоптатов по протоколу и последующим их патоморфологическим исследованием [30].
Методом выбора в отношении диагностики патологического ДГР в настоящее время является суточная рН-импедансометрия, которая позволяет проводить дифференциальную диагностику между физиологическим и патологическим ДГР, количественный анализ эпизодов кислого, слабокислого и некислого рефлюкса [31]. Данный метод относится к инвазивным и имеет высокую чувствительность, но низкую специфичность и не применяется в рутинной практике.
Эндоскопическая диагностика воспалительных и дистрофических изменений слизистой оболочки желудка на фоне ДГР и установление их причинно-следственной связи представляют определенные трудности, что влечет за собой недооценку визуальных данных и ошибки в преемственности этапов обследования пациента: клиницист – эндоскопист – морфолог – клиницист. Основная проблема заключается в отсутствии валидированных эндоскопических критериев для определения формы ДГР: транзиторный или патологический рефлюкс. Именно второй вариант представляет наибольший интерес в качестве потенциального повреждающего слизистую оболочку желудка агента и должен подвергаться комплексной клинической и морфологической оценке.
Известно, что сама процедура эзофагогастродуоденоскопии (ЭГДС) провоцирует ретроградное поступление дуоденального содержимого в желудок [32, 33]. Транзиторный билиарный рефлюкс характеризуется непродолжительным контактом со слизистой оболочкой желудка и, по-видимому, не приводит к ее значимому повреждению.
У пациентов с патологическим ДГР значение pH в просвете желудка значительно выше, поэтому отмечается более выраженная активность, степень воспаления, чем у пациентов без ДГР. Механизм повреждающего действия ДГР рассматривается как реализация прямого химического эффекта компонентов рефлюктата с нарушением целостности эпителиального барьера слизистой оболочки желудка. Нарушение функции эпителиального барьера приводит также к обратной диффузии ионов водорода и вторичному повреждению. Таким образом, подобный сочетанный характер повреждения приводит к ускоренному клеточному обновлению и гистамин-опосредованной сосудистой реакции в слизистой оболочке, которая проявляется отеком и гиперемией. Длительное повреждение эпителия способствует высвобождению других провоспалительных медиаторов, таких как тромбоцитарный фактор роста, который стимулирует пролиферацию гладкомышечных клеток.
У пациентов с ДГР в слизистой оболочке желудка развивается отек, появляются эрозивные дефекты. У пациентов после гастрэктомии с ДГР также может иметь место формирование полиповидных образований. Поверхностные эрозии могут возникать в более проксимальных участках культи желудка [6, 9].
В исследовании Y.J. Na и соавт. [34] было проведено комплексное клинико-лабораторное, инструментальное и морфологическое обследование 75 человек с ДГР по данным ЭГДС. В качестве группирующей переменной был использован гистологический индекс билиарного рефлюкса. В исследовательских группах без статистических различий были выявлены следующие визуальные изменения слизистой оболочки желудка: очаговая гиперемия (38,7%), эрозии (37,3%), атрофические изменения (28,0%), рефлюкс-эзофагит (7,4%) и язвенные дефекты (8,0%).
В другом исследовании на основании эндоскопических данных проводили сравнительную оценку ДГР [35]. В исследовательской группе А ДГР характеризовался как однородная светло-желтая и зеленоватая желчь (ДГР типа А), у обследуемых исследовательской группы В в просвете желудка выявлялась неоднородная, вязкая, липкая желчь (ДГР типа В). Также была сформирована группа контроля – отсутствие ДГР и визуально различимых признаков повреждения слизистой. Количественно ДГР рассчитывали путем измерения кумулятивной радиоактивности над областью желудка при гепатобилиарной сцинтиграфии. Авторы пришли к выводу, что в сравнении с типом А эндоскопический тип В характеризовался избыточным ДГР и ассоциировался с большей степенью выраженности воспаления, увеличением частоты встречаемости кишечной метаплазии и эпителиальных образований слизистой оболочки желудка.
В исследовании D. Li и соавт. был выполнен сравнительный анализ тяжести поражения слизистой оболочки желудка на фоне ДГР в зависимости от степени выраженности и без ДГР в трех группах: хронический гастрит (n = 27 807), предраковые поражения слизистой оболочки желудка (n = 1943) и рак желудка (n = 715). Степень ДГР классифицировали на основании состояния слизистого озера при эндоскопии следующим образом: степень I – слизистое озеро без примесей дуоденального содержимого или светло-желтое слизистое озеро; степень II – желтовато-зеленое слизистое озеро и степень III – темно-желтое, вязкое и мутное слизистое озеро с включениями желчных пятен. На основании полученных данных была установлена положительная корреляционная связь между степенью ДГР и тяжестью поражения слизистой оболочки желудка, в том числе в аспекте риска рака желудка. Степени ДГР II и III с высокой частотой встречались в группах предраковых заболеваний и рака желудка [7].
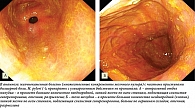
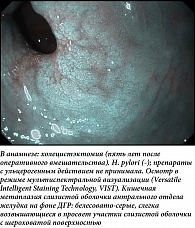
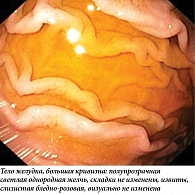
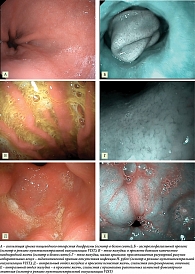
С практической точки зрения, не имея в клинической практике доступных методик оценки количественного и качественного состава дуоденального рефлюктата в желудке, целесообразно детально описывать его визуальные характеристики во время рутинной ЭГДС. Эндоскопическими признаками потенциально патологического ДГР следует считать большой объем мутной, неоднородной желчи (в виде хлопьев, тяжей, комков), распределенной по всем стенкам желудка, в сочетании с ее высокими адгезивными свойствами (эвакуация рефлюктата частичная, полное отмывание слизистой возможно только при форсированной подаче воды) (рис. 1). После эвакуации из желудка дуоденального секрета в участках контакта рефлюктата со слизистой оболочкой желудка определяются гиперемия, выраженный отек и утолщение складок желудка, в антральном отделе желудка с высокой частотой выявляется эндоскопически различимая кишечная метаплазия слизистой оболочки желудка (рис. 2). Транзиторный ДГР имеет иные визуальные характеристики (рис. 3): светлая, однородная желчь в виде светло-желтого и зеленоватого полупрозрачного озера, локализованного по большой кривизне желудка, без следов желчи по другим стенкам, рефлюктат полностью эвакуируется из желудка, подлежащая слизистая без явных патологических изменений.
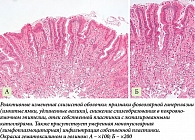
Микроскопически реактивный гастрит в ответ на заброс рефлюктата характеризуется фовеолярной гиперплазией различной степени с появлением извитости контура ямок и удлинением желудочных валиков, наличием регенераторных изменений эпителия, а также снижением продукции муцина, уменьшением высоты с потерей столбчатой формы эпителия (так называемая кубоидизация), увеличением числа митозов, гиперхромией ядер, иногда поверхностными эрозиями, а также признаками полнокровия сосудов и отеком собственной пластинки слизистой оболочки желудка с пролиферацией пучков гладкомышечных клеток. Прекращение поступления рефлюктата обычно приводит к восстановлению слизистой оболочки желудка. В ответ на повреждение может развиваться очаговая кишечная метаплазия, которая не имеет отношения к канцерогенезу. Обычно развитие таких изменений ограничивается антральным отделом. Для обсуждения данного риска имеет смысл характеризовать изменения по принятым системам мониторинга, прежде всего OLGA-system, поскольку изменения, обусловленные ДГР, могут накладываться/сочетаться с проявлениями Η. pylori-ассоциированного и эксхеликобактерного гастрита [6, 9, 36].
С целью демонстрации этапности обследования пациентов с БГ приводим собственные клинические наблюдения.
Клиническое наблюдение 1
Пациентка М., 49 лет, обратилась к гастроэнтерологу с жалобами на умеренной интенсивности боли в эпигастральной области и в правом подреберье преимущественно после еды без иррадиации, чувство тяжести, переполнения в эпигастральной области после еды. Преимущественно по утрам и при погрешностях в питании отмечала горечь во рту, отрыжку воздухом, реже – съеденной пищей; стул ежедневный, оформленный, без видимых патологических примесей.
Анамнез жалоб около трех лет с прогрессивным нарастанием частоты и выраженности симптомов за последний год, самостоятельно принимала ингибиторы протонной помпы, антациды, спазмолитики с нестойким положительным эффектом. Обследовалась на инфекцию H. pylori три года назад методом быстрого уреазного теста биоптата, полученного при ЭГДС. Из заключения протокола ЭГДС: эритематозная гастропатия, очаговая атрофия слизистой оболочки антрального отдела желудка. Проведена эрадикационная терапия – стандартная тройная схема, продолжительностью 10 дней, контроль лечения – антиген H. pylori в кале не обнаружен. Хронические заболевания отрицает. Перенесенные оперативные вмешательства: плановая лапароскопическая холецистэктомия пять лет назад по поводу хронического калькулезного холецистита, протекавшего с частыми эпизодами билиарной боли. При объективном осмотре: кожный покров и видимые слизистые нормальной окраски и влажности, язык влажный, обложен налетом желтоватого цвета на спинке, живот мягкий, не вздут, при пальпации болезненный в эпигастрии и по ходу ободочной кишки, печень по краю реберной дуги, селезенка не пальпируется.
Проведено общеклиническое лабораторное обследование, включавшее клинический анализ крови, биохимический анализ крови с оценкой печеночных проб – показатели в пределах референсных значений.
Результаты 13С-уреазного дыхательного теста – 2,1‰ (референсные значения < 3,0‰).
Выполнено УЗИ органов брюшной полости, по результатам которого выявлены признаки диффузных изменений печени; конкрементов, расширения общего желчного протока не выявлено.
По результатам колоноскопии органических заболеваний толстой кишки и терминального отдела подвздошной кишки не выявлено.
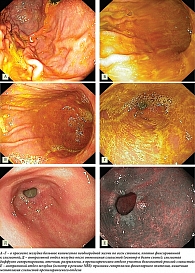
Пациентке проведена ЭГДС: пищевод без визуальных изменений; кардия смыкается; в просвете желудка большое количество неоднородной желчи в виде хлопьев и нитей по всем стенкам, плотно фиксированной к слизистой (выполнено отмывание слизистой, содержимое полностью аспирировано) (рис. 4). Перистальтика симметричная, прослеживается по всем стенкам; складки средней величины, отечные, полностью не расправляются при инсуффляции. Слизистая оболочка в теле желудка неравномерно гиперемирована, отечная, разрыхлена, изменения более выражены по вершинам складок, рисунок собирательных венул по малой кривизне сохранен, граница атрофии на уровне верхней трети по малой кривизне. Слизистая антрального отдела диффузно гиперемирована, отечная, с очаговой атрофией, в препилорическом отделе несколько приподнятые участки белесоватой рыхлой слизистой, при осмотре в режиме узкоспектральной визуализации – эндоскопические признаки кишечной метаплазии.
Выполнена биопсия по Сиднейскому протоколу: два биоптата из антрального отдела (малая/большая кривизна), один биоптат из угла желудка, два биоптата из тела желудка (малая/большая кривизна). В отдельный флакон помещены два биоптата слизистой оболочки препилорического отдела желудка с эндоскопическими признаками кишечной метаплазии.
Луковица ДПК не деформирована, содержимое – желчь, слизистая не изменена, слизистая постбульбарных отделов не изменена, в просвете большое количество пенистой желчи. Большой дуоденальный сосочек в типичном месте, не изменен. Заключение: эритематозная гастропатия (может соответствовать гастропатии, ассоциированной с патологическим дуоденогастральным рефлюксом); очаговая атрофия слизистой оболочки антрального отдела желудка (С-1 по Kimura – Takemoto); эндоскопические признаки кишечной метаплазии слизистой препилорического отдела желудка.
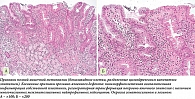
По результатам морфологического исследования с оценкой гастробиоптатов по системе OLGA: стадия I, степень II, в образцах из препилорического отдела полная (тонкокишечная) метаплазия (рис. 5).
По результатам комплексного обследования установлен диагноз: «Хронический гастрит, ассоциированный с патологическим дуоденогастральным рефлюксом, стадия I, степень II. Стеатоз. ЖКБ. Состояние после лапароскопической холецистэктомии. Дисфункциональное расстройство сфинктера Одди по билиарному типу».
Пациентке рекомендовано сбалансированное питание три-четыре раза в день, ведение пищевого дневника для выявления продуктов – триггеров симптомов диспепсии.
Медикаментозная терапия включала итоприда гидрохлорид 50 мг три раза в день в течение четырех недель, ребамипид 100 мг три раза в день в течение восьми недель, урсодезоксихолевую кислоту 500 мг однократно перед сном в течение 12 недель.
На фоне проводимого лечения через четыре недели абдоминальный болевой синдром купирован, уменьшились проявления диспепсии. При контрольной ЭГДС на 12-й неделе отмечена положительная эндоскопическая динамика в виде уменьшения гиперемии, отека слизистой.
Клиническое наблюдение 2
Пациент М., 18 лет, обратился к гастроэнтерологу с жалобами на умеренной интенсивности приступообразные боли в эпигастрии, чувство тяжести, переполнения, раннего насыщения, отрыжку горьким, по утрам тошноту; изжога несколько раз в неделю. Симптомы усиливались при употреблении жирной пищи, алкоголя. Стул оформленный или полуоформленный один-два раза в день, кал без видимых патологических примесей.
Жалобы разной степени выраженности беспокоят с подросткового возраста, неоднократно обследовался, лечился у педиатра, детского гастроэнтеролога с нестойким положительным эффектом. Ранее ЭГДС не проводили, согласно протоколу УЗИ из детской поликлиники – перегиб желчного пузыря. По данным записей амбулаторной карты, в анамнезе пролапс митрального клапана второй степени; плоско-вальгусные стопы, плоскостопие третьей степени; сколиоз второй степени; диспластические изменения шейного отдела позвоночника.
При объективном осмотре: астенического телосложения, пониженного питания, рост 189 см, вес 63 кг, индекс массы тела по Кетле 17,6 кг/м2 (дефицит массы тела), кожные покровы и видимые слизистые нормальной окраски и влажности, язык слегка обложен белым налетом. Живот мягкий, симметрично участвует в акте дыхания, при пальпации чувствительный в эпигастрии, печень по краю реберной дуги, селезенка не пальпируется.
Проведено обследование: клинический, биохимический анализы крови с оценкой печеночных проб – показатели в пределах нормы; 13С-уреазный дыхательный тест на H. pylori – отрицательный. По данным УЗИ органов брюшной полости: аномалия формы желчного пузыря, признаки билиарного сладжа (в просвете желчного пузыря взвесь гиперэхогенных частиц в виде точечных множественных смещаемых гиперэхогенных образований, не дающих акустической тени, выявляется при изменении положения тела пациента), нефроптоз с обеих сторон.
Протокол ЭГДС: просвет пищевода округлой формы, свободно проходим, в просвете слизь, желчь в большом количестве (рис. 6). Слизистая пищевода в нижней трети утолщена. Сосудистый рисунок дистальной части пищевода не прослеживается; кардия не смыкается, чрезмерно подвижна, расположена на уровне 38 см от резцов, хиатальное сужение на уровне 40 см от резцов, при срыгивании определяется гастроэзофагеальный пролапс. Желудок с каскадной деформацией, хорошо расправляется при инсуффляции, в просвете большое количество желчи, слизистая отмыта, содержимое аспирировано. При инверсионном осмотре: кардия не полностью охватывает аппарат, при срыгивании определяется гастроэзофагеальный пролапс. Складки слизистой средней величины, извиты, при инсуффляции расправляются практически полностью. Слизистая в теле желудка умеренно диффузно гиперемирована, отечная, по малой кривизне прослеживается регулярный рисунок собирательных венул. Слизистая антрального отдела умеренно гиперемирована, отечная. Привратник округлой формы, смыкается, свободно проходим, во время проведения исследования выраженный ДГР.
Выполнена биопсия по Сиднейскому протоколу: два биоптата из антрального отдела (малая/большая кривизна), один биоптат из угла желудка, два биоптата из тела желудка (малая/большая кривизна).
Луковица ДПК округлой формы, не деформирована, слизистая не изменена. Постбульбарные отделы ДПК не деформированы, слизистая розовая. В просвете пенистая желчь. Большой дуоденальный сосочек визуально не изменен. Заключение: эндоскопические признаки грыжи пищеводного отверстия диафрагмы; эритематозная гастропатия (может соответствовать гастропатии, ассоциированной с патологическим ДГР).
По результатам морфологического исследования гастробиоптатов с оценкой по OLGA: стадия 0, степень II, фовеолярная гиперплазия (рис. 7).
Выполнена рентгеноскопия пищевода (с функциональными пробами на грыжу пищеводного отверстия диафрагмы), желудка, двенадцатиперстной кишки. Заключение: аксиальная хиатальная грыжа пищеводного отверстия диафрагмы, каскадная деформация желудка.
По результатам обследования пациенту установлен диагноз: «Гастроэзофагеальная рефлюксная болезнь, неэрозивная форма, неосложненное течение. Скользящая аксиальная грыжа пищеводного отверстия диафрагмы. Хронический гастрит, ассоциированный с патологическим дуоденогастральным рефлюксом, стадия 0, степень II. ЖКБ. Предкаменная стадия: билиарный сладж в виде взвеси гиперэхогенных частиц».
Пациенту даны рекомендации по коррекции образа жизни и питанию. Медикаментозная терапия включала рабепразол 20 мг за 30 минут до завтрака в течение четырех недель, ребамипид 100 мг три раза в день в течение четырех недель, урсодезоксихолевую кислоту 750 мг перед сном в течение 12 недель с последующим УЗИ-контролем, суспензию натрия альгинат + натрия гидрокарбонат + кальция карбонат 10 мл по требованию при изжоге.
При контрольном осмотре через две недели отмечена положительная динамика в виде купирования изжоги, уменьшения абдоминального болевого синдрома.
Приведенные клинические наблюдения наглядно демонстрируют два наиболее типичных клинических фенотипа пациентов с БГ. В первом случае четко прослеживается нарастание симптомов диспепсии в отдаленном периоде после холецистэктомии. Длительный и стойкий рефлюкс дуоденального содержимого, по-видимому с измененным составом желчных кислот, вызвал воспалительно-дистрофические изменения слизистой оболочки желудка. Оценку эндоскопических и морфологических данных осложняло наличие в анамнезе H. pylori-ассоциированного гастрита, о чем свидетельствовали характер распространения атрофии слизистой оболочки и кишечная метаплазия. Кишечную метаплазию в антральном отделе желудка можно гипотетически расценивать в качестве проявления перенесенного H. pylori-ассоциированного гастрита, а также как компенсаторную реакцию слизистой оболочки желудка на длительный контакт с агрессивным дуоденальным содержимым. Более надежным критерием БГ могут служить изменения фовеолярного эпителия, которые косвенно оценивают при эндоскопическом исследовании и верифицируют морфологически.
Второе клиническое наблюдение демонстрирует другой важный аспект в развитии БГ – диспластикозависимые состояния. Для пациента характерны множественные внешние и висцеральные стигмы недифференцированной дисплазии соединительной ткани: астеническое телосложение, изменения костно-мышечной системы, висцероптоз, малые аномалии строения внутренних органов. Патогенез развития БГ в данном случае является полифакторным, что обусловливает необходимость индивидуализированного подхода к его коррекции. С практической точки зрения пациенты с дисплазией соединительной ткани должны составлять отдельную группу риска по развитию моторно-тонических расстройств пилоробульбарной зоны и формированию условий для развития патологического ДГР.
Заключение
Несмотря на увеличение доли БГ в общей структуре хронических гастритов, осведомленность клиницистов о методах диагностики и подходах к терапии заболевания остается крайне низкой. БГ развивается вследствие патологического ДГР, который может быть связан с нарушением моторики верхних отделов пищеварительного тракта, анатомическими изменениями в зоне дуоденогастрального перехода в результате хирургических вмешательств и при наличии сопутствующей патологии желчевыводящих путей. При патологическом ДГР воздействие агрессивных компонентов рефлюктата ассоциировано с развитием реактивных изменений слизистой оболочки желудка (фовеолярная гиперплазия) при отсутствии выраженных признаков хронического воспаления и колонизации Н. pylori на фоне характерной эндоскопической картины (гиперемия и отек слизистой оболочки пилородуоденальной зоны, пятна желчи на поверхности, эрозии). Однако указанные признаки являются неспецифичными, поэтому для верификации БГ необходимо сопоставление эндоскопической и морфологической картины с клиническими данными, направленными, прежде всего, на выявление факторов риска формирования патологического ДГР (наличие сопутствующих заболеваний билиарного тракта, предшествующие оперативные вмешательства на органах брюшной полости в анамнезе) и исключение других этиологических факторов (прием лекарственных препаратов, инфекция H. pylori).
D.S. Bordin, PhD, Prof., S.V. Shchelochenkov, PhD, M.A. Livzan, PhD, Prof., Corresponding member of the RAS, S.I. Mozgovoy, PhD, Prof., O.V. Gaus, PhD
A.S. Loginov Moscow Clinical Scientific and Practical Center
Russian University of Medicine, Moscow
The Immanuel Kant Baltic Federal University
Tver State Medical University
Omsk State Medical University
Contact person: Olga V. Gaus, gaus_olga@bk.ru
In recent years in the structure of the incidence of chronic gastritis, there has been a decrease in the proportion of Helicobacter pylori-associated gastritis, but the contribution of other etiological factors is increasing. In addition to H. pylori, one of the most frequently diagnosed gastritis in real clinical practice is chemical gastritis, associated with the development of pathological duodenogastric reflux. The increase in prevalence makes the issue of diagnosing biliary gastritis relevant. This publication was prepared with the aim of systematizing and analyzing available data on the incidence, risk factors, mechanisms of formation, as well as clinical, endoscopic and pathomorphological signs of biliary gastritis and is illustrated by a series of observations from real clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.