Профилактика и лечение дисфункции левого желудочка и сердечной недостаточности, связанных с противоопухолевой терапией: возможности и перспективы
- Аннотация
- Статья
- Ссылки
- English
Введение
В настоящее время в мире прослеживается устойчивая тенденция к повышению заболеваемости злокачественными новообразованиями (ЗНО) [1]. В России прирост впервые выявленных ЗНО за десять лет превысил 20% [2]. В то же время ранняя диагностика и совершенствующиеся подходы к лечению онкологических больных позволили значимо увеличить их выживаемость [3]. Сегодня в мире насчитывается несколько десятков миллионов человек, получающих лечение по поводу ЗНО, и так называемых онкологических долгожителей. По расчетным данным, их число будет прогрессивно увеличиваться [4]. Вместе с тем улучшение безрецидивной выживаемости сопровождается ростом сердечно-сосудистых заболеваний (ССЗ), занимающих второе место в структуре смертности онкологических больных [5].
Онкологические и сердечно-сосудистые заболевания нередко представляют собой коморбидную патологию, развитию которой способствуют общие факторы риска, такие как пожилой возраст, курение, ожирение, малоподвижный образ жизни [6]. Значение также имеют взаимное влияние и усиление ряда механизмов патогенеза, в частности воспаление, окислительный стресс, эндотелиальная дисфункция, нарушение апоптоза, дисрегуляция ангиогенеза, эпигенетические и другие факторы [7]. Пожалуй, максимальный вклад в развитие сердечно-сосудистой патологии у онкологических больных вносят токсические эффекты противоопухолевой терапии.
Одними из наиболее значимых сердечно-сосудистых осложнений (ССО) противоопухолевого лечения считаются дисфункция левого желудочка (ЛЖ) – снижение фракции выброса (ФВ) ЛЖ более чем на 10 процентных пунктов от исходной величины и ниже 50% [8, 9] и сердечная недостаточность (СН). Дисфункция ЛЖ и СН, обусловленные противоопухолевой терапией, могут привести к ее прерыванию или преждевременной отмене и тем самым снизить шансы на излечение. Будучи поздним проявлением кардиотоксичности противоопухолевой терапии, СН способна не только ухудшить качество жизни, но и значимо повлиять на прогноз пациентов, успешно пролеченных по поводу ЗНО. Уровень общей смертности больных СН (6%) превышает популяционный в десять раз [10]. Исследования как прошлых, так и последних лет свидетельствуют о том, что пациенты с поздно дебютировавшей СН, связанной с противоопухолевой терапией (свыше пяти лет после ее окончания), имеют более неблагоприятный прогноз, чем пациенты с СН, вызванной иными причинами [11, 12].
Развитие дисфункции ЛЖ и СН могут обусловливать различные виды лекарственной противоопухолевой терапии, включая антрациклины (доксорубицин, эпирубицин, даунорубицин, идарубицин), таргетные препараты (трастузумаб, пертузумаб), ингибиторы тирозинкиназ (сунитиниб, сорафениб, понатиниб, нилотиниб, дазатиниб и др.), ингибиторы протеосом для лечения множественной миеломы (карфилзониб, бортезомиб), ингибиторы контрольных точек (иммунотерапия), а также лучевая терапия, затрагивающая область сердца [9].
Дисфункция ЛЖ в ответ на тот или иной вид терапии развивается в определенном временном интервале. Так, при использовании антрациклинов дисфункция ЛЖ и СН наблюдаются по окончании лечения. На фоне применения таргетных препаратов (например, трастузумаба) нарушение функции сердца отмечается в ходе терапии. Учитывая это, врач может оценить риск дисфункции ЛЖ и СН у онкологических больных до начала лечения, выбрать стратегию наблюдения во время и после окончания лечения, что, безусловно, будет способствовать раннему выявлению симптомов кардиотоксичности, назначению кардиопротективной терапии (при необходимости), снижению риска клинически значимых осложнений и достижению эффективности лечения ЗНО. В целях улучшения сердечно-сосудистых и онкологических исходов у данной категории пациентов в современной системе здравоохранения сформированы специализированные кардиоонкологические службы, координирующие медицинскую помощь между кардиологами и онкологами [13, 14].
Рассмотрим подходы к профилактике и лечению дисфункции ЛЖ, связанной с противоопухолевой лекарственной терапией, ведению онкологических пациентов с дисфункцией ЛЖ и СН, которым необходима потенциально кардиотоксичная противоопухолевая терапия, а также обсудим перспективы лечения больных СН, вызванной антрациклинсодержащей химиотерапией.
Профилактика дисфункции ЛЖ и СН, связанных с противоопухолевым лечением
При планировании мероприятий по профилактике дисфункции ЛЖ и СН у онкологических больных учитывается ряд факторов, в частности предполагаемая схема противоопухолевой терапии, наличие и риск развития ССЗ. Оценка риска развития дисфункции сердца – важнейший этап, предшествующий противоопухолевому лечению. Одним из наиболее значимых факторов, позволяющих отнести пациента к группе высокого риска развития дисфункции ЛЖ и СН, связанной с противоопухолевой терапией, является высокая суммарная доза антрациклина (для доксорубицина > 250 мг/м2, для эпирубицина 600 мг/м2). Однако и в относительно низких дозах антрациклины способны оказывать кардиотоксический эффект. Речь идет о ситуациях, когда проводится сопутствующая лучевая терапия на область средостения либо левую половину грудной клетки или лечение проводится другими кардиотоксичными средствами, такими как трастузумаб, циклофосфамид. Наличие двух и более факторов риска ССЗ (артериальной гипертонии, курения, дислипидемии, сахарного диабета, ожирения) и сердечно-сосудистая патология (инфаркт миокарда в анамнезе, умеренные и тяжелые клапанные пороки сердца), исходная дисфункция ЛЖ (фракция выброса ЛЖ менее 55%) и возраст более 60 лет вносят дополнительный вклад в повышение риска развития или прогрессирования дисфункции ЛЖ независимо от доз используемых препаратов [15].
Всем больным до начала потенциально кардиотоксичного противоопухолевого лечения необходимо оценить общий сердечно-сосудистый риск. Пациентам, у которых риск противоопухолевого лечения сопряжен с дисфункцией ЛЖ и СН, а исходный сердечно-сосудистый риск высок, рекомендуется консультация кардиолога (при наличии кардиоонкологической службы – кардиоонколога).
Все больные независимо от ЗНО, его стадии и планируемого лечения должны придерживаться здорового образа жизни, который предполагает не только регулярные физические нагрузки, но также выявление и контроль традиционных факторов риска (курение, артериальная гипертония, сахарный диабет, дислипидемия, ожирение) до начала, во время и по окончании противоопухолевого лечения [8, 9]. Особое внимание уделяется коррекции терапии ССЗ, согласно общепринятым рекомендациям [8, 9].
Основными специфическими для онкологических больных направлениями профилактики дисфункции ЛЖ и СН являются изменение противоопухолевой терапии с целью снижения ее потенциальной кардиотоксичности и использование кардиопротективных препаратов. Очевидно, что сочетание различных мер профилактики – залог ее максимальной эффективности.
Известно несколько принципов классификации профилактики дисфункции ЛЖ и СН. Так, в ряде публикаций первичная профилактика предполагает проведение профилактических мероприятий до появления каких-либо признаков кардиотоксичности, вторичная – применение кардиопротективных препаратов при наличии признаков субклинической кардиотоксичности (бессимптомное повышение уровня биомаркеров повреждения миокарда и снижение показателей деформации миокарда). На основании классификации, предложенной в Brompton hospital и предусматривающей шесть классов кардиотоксичности [13], можно говорить о профилактике ранней биохимической и функциональной кардиотоксичности, профилактике дисфункции ЛЖ при выявлении признаков ранней кардиотоксичности и профилактике СН при бессимптомной дисфункции ЛЖ. В клинической практике удобнее рассматривать профилактические мероприятия на разных этапах ведения пациентов: до начала, во время и по окончании противоопухолевого лечения.
До начала потенциально кардиотоксичной противоопухолевой терапии всем больным необходимо пройти комплексное обследование, включающее сбор жалоб и анамнеза, оценку клинического состояния, проведение электрокардиографии (ЭКГ) и эхокардиографии (ЭхоКГ). Больным с высоким риском дисфункции ЛЖ и СН также целесообразно определить общую продольную деформацию миокарда ЛЖ (GLS) и сердечные биомаркеры (тропонин и натрийуретические пептиды) [8, 9, 15, 16]. Помимо модификации факторов риска и коррекции терапии имеющихся ССЗ у больных с высоким риском развития дисфункции ЛЖ на этом этапе следует рассмотреть возможность использования менее кардиотоксичных «безантрациклиновых» режимов терапии, если имеются доказательства их сопоставимой противоопухолевой эффективности [8, 9, 17].
При противоопухолевом лечении необходимо сочетать различные профилактические стратегии, позволяющие максимально снизить риск кардиотоксичности.
Важным аспектом профилактики дисфункции ЛЖ и СН у онкологических больных в рамках рекомендаций по соблюдению здорового образа жизни являются регулярные физические нагрузки [18]. Аэробная нагрузка ослабляет кардиотоксическое действие доксорубицина за счет различных механизмов, в том числе уменьшения образования активных форм кислорода, снижения активации проапоптотических сигнальных путей, поддержания пролиферации кардиомиоцитов, нормализации кальциевого обмена и улучшении энергообеспечения миокарда [19]. Физическая нагрузка, будучи эффективным немедикаментозным методом, положительно влияет на показатели гемодинамики и модифицируемые факторы риска ССЗ [20, 21] и ассоциируется с улучшением сердечно-сосудистого прогноза у онкологических больных. Имеются свидетельства благоприятного влияния тренировочных программ на качество жизни, приверженность лечению, выраженность симптомов заболевания и побочных эффектов терапии, снижение риска ССО, а также общий прогноз у больных раком молочной железы (РМЖ) и другими онкологическими заболеваниями [22–25].
При использовании антрациклинов у пациентов с высоким риском развития дисфункции ЛЖ необходимо рассмотреть варианты модификации противоопухолевой терапии: ограничение суммарной дозы антрациклинов в рекомендованных пределах, изменение режима и продолжительности введения препаратов и применение усовершенствованных способов доставки антрациклинов (липосомальных форм).
Соблюдение рекомендованных суммарных доз антрациклинов является одним из основных способов профилактики дисфункции ЛЖ и СН, так как кардиотоксический эффект носит дозозависимый характер [26]. Поскольку выраженность кардиотоксического действия антрациклинов зависит от пиковой концентрации, а противоопухолевая эффективность от средней концентрации в плазме (площади под фармакокинетической кривой) [27], дробное или пролонгированное введение препаратов снижает риск развития дисфункции ЛЖ и СН без потери эффективности противоопухолевой терапии [28, 29].
Еще один способ снижения кардиотоксичности доксорубицина у больных высокого риска развития дисфункции сердца – использование его липосомальной формы. Благодаря своим фармакологическим свойствам липосомальный доксорубицин гораздо реже вызывает дисфункцию ЛЖ и СН по сравнению с обычным доксорубицином и не уступает последнему в противоопухолевой эффективности [30]. Применение липосомальных форм доксорубицина одобрено при раке яичников, ВИЧ-ассоциированной саркоме Капоши, множественной миеломе при неэффективности по крайней мере одной линии предшествующей терапии, а также метастатическом РМЖ [31].
Дексразоксан – единственный одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) препарат для профилактики дисфункции ЛЖ и СН, обусловленных применением антрациклинов, при различных онкологических заболеваниях у взрослых и детей [8, 32]. Дексразоксан является хелатором железа, уменьшает образование свободных радикалов, а также предотвращает образование комплекса «антрациклин – топоизомераза-IIb – ДНК» в кардиомиоцитах, что и лежит в основе его защитного действия [33, 34]. Кардиопротективный эффект дексразоксана подтвержден результатами многочисленных исследований [35, 36].
Согласно метаанализу десяти рандомизированных клинических исследований (РКИ), на фоне применения дексразоксана совместно с антрациклинами риск СН у больных РМЖ снижается на 82% [37]. Использование дексразоксана при прогрессирующем или метастатическом РМЖ одобрено у взрослых, если суммарная доза доксорубицина превышает 300 мг/м2 (эпирубицина – 540 мг/м2) и целесообразно продолжение терапии антрациклинами [38, 39].
В последние годы опубликованы результаты ряда исследований профилактики кардиотоксичности с помощью препаратов, традиционно используемых в кардиологической практике. В большинстве исследований в качестве профилактических средств применялись ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецептора ангиотензина II (БРА), бета-адреноблокаторы, антагонисты минералкортикоидных рецепторов (АМКР) и статины. Несмотря на то что препараты всех представленных групп продемонстрировали потенциальные кардиопротективные свойства, небольшое число участников исследований, недостаточная продолжительность наблюдения для оценки риска клинически значимой дисфункции сердца и зачастую противоречивые результаты исследований не позволяют рекомендовать эти средства для первичной профилактики всем больным, которым проводится потенциально кардиотоксичная терапия. Решение о целесообразности и возможности использования указанных лекарственных средств зависит не только от характеристик пациента (сопутствующие заболевания, уровень артериального давления, частота сердечных сокращений и ритм, почечная функция и противопоказания к применению), но и от схемы предполагаемого противоопухолевого лечения.
Бета-адреноблокаторы продемонстрировали кардиопротективный эффект в профилактике поражения сердца, вызванного как антрациклинами, так и трастузумабом. Защитный механизм действия бета-адреноблокаторов связан с уменьшением последствий окислительного стресса [40] и активацией способствующих выживанию клеток сигнальных путей [41]. Однако нет оснований считать кардиопротективное действие этих препаратов на фоне кардиотоксичной терапии класс-эффектом. Так, метопролол не оказывает защитного влияния на фоне применения антрациклинов [42, 43], а пропранолол потенцирует кардиотоксический эффект [44]. В то же время неселективный бета-адреноблокатор с антиоксидантными свойствами карведилол ослабляет токсическое воздействие антрациклинов на миокард. Это установлено как в доклинических [45, 46], так и в клинических испытаниях. Карведилол положительно влияет на показатели деформации миокарда [47], систолическую и диастолическую функцию ЛЖ [48].
В недавно опубликованном проспективном плацебоконтролируемом исследовании по оценке профилактики антрациклин-индуцированной кардиотоксичности с участием 192 больных РМЖ карведилол не предупреждал снижения ФВ ЛЖ > 10% в ранние сроки после химиотерапии, но способствовал уменьшению частоты развития диастолической дисфункции и предотвращал повышение уровня тропонина [49].
В исследовании M. Guglin и соавт., включавшем 468 больных HER2+ РМЖ, на фоне применения карведилола снижался риск дисфункции ЛЖ и связанного с ней прерывания терапии трастузумабом только у пациентов, ранее пролеченных антрациклинами [50].
Кардиопротективный эффект имел место и при использовании бета-адреноблокатора небиволола на фоне терапии антрациклинами. Так, в небольшом проспективном двойном слепом плацебоконтролируемом исследовании небиволол предотвращал ремоделирование ЛЖ, а также повышение уровня NT-proBNP у больных РМЖ [51].
Несмотря на то что в РКИ по предупреждению трастузумаб-ассоциированного ремоделирования ЛЖ у больных HER2+ РМЖ (MANTICOR 101-Breast) бета-адреноблокатор бисопролол не влиял на изменение конечного диастолического объема ЛЖ, профилактическое применение препарата предотвращало незначительное снижение ФВ ЛЖ и сокращало частоту прерывания противоопухолевой терапии вследствие дисфункции сердца [52].
Как показал ретроспективный анализ, длительное использование бета-адреноблокаторов у больных РМЖ на фоне лечения антрациклинами и трастузумабом способствовало снижению риска развития СН в течение пятилетнего периода наблюдения [53]. Тем не менее необходимы проспективные исследования, подтверждающие роль бета-адреноблокаторов в снижении риска клинически значимых ССО, в том числе СН, у больных, получивших кардиотоксичное противоопухолевое лечение.
Помимо бета-адреноблокаторов для профилактики дисфункции ЛЖ и СН, связанной с противоопухолевой лекарственной терапией, предлагается использовать ингибиторы ренин-ангиотензин-альдостероновой системы (РААС). Их кардиопротективное действие заключается в ослаблении окислительного стресса [54], нормализации внутриклеточного обмена кальция [55], снижении блокирующего влияния ангиотензина на ErbB2(HER2 neu)-систему [56], изменении экспрессии генов, ответственных за метаболизм кардиомиоцитов и функцию митохондрий [57], уменьшении образования интерстициального фиброза [58].
Несмотря на многообещающие результаты доклинических работ, в клинических исследованиях профилактики кардиотоксичности с использованием ингибиторов РААС получены неоднозначные результаты. Так, в РКИ с длительным периодом наблюдения применение эналаприла больными лимфомами, получавшими доксорубицин, не влияло на частоту развития СН [42]. Первичная профилактика связанной с антрациклинами дисфункции ЛЖ и СН может быть более эффективна при совместном использовании иАПФ и бета-адреноблокаторов. Об этом свидетельствуют результаты исследования OVERCOME, в котором больные онкогематологическими заболеваниями получали высокодозную антрациклинсодержащую химиотерапию. Применение эналаприла в сочетании с карведилолом не только предотвращало снижение ФВ ЛЖ, но и положительно влияло на комбинированную конечную точку, включавшую снижение ФВ ЛЖ менее 45%, СН и смерть [59].
В упомянутом исследовании MANTICOR 101-Breast иАПФ периндоприл не предотвращал ремоделирование ЛЖ, однако минимизировал связанное с дисфункцией ЛЖ прерывание противоопухолевой терапии [52].
Результаты нескольких исследований свидетельствуют об эффективности БРА в снижении риска дисфункции сердца, обусловленной применением антрациклинов. Телмисартан, назначаемый на фоне высокодозной терапии эпирубицином, предупреждает повреждение миокарда ЛЖ за счет подавления окислительного стресса и воспаления [60].
В РКИ PRADA по оценке первичной профилактики дисфункции сердца, связанной с использованием антрациклинов, с участием 130 больных РМЖ без значимых ССЗ зарегистрирован кардиопротективный эффект кандесартана [43]. В то же время роль БРА в первичной профилактике трастузумаб-индуцированной дисфункции ЛЖ неясна. В рандомизированном плацебоконтролируемом исследовании, в котором участвовали больные HER2+ РМЖ, уже пролеченные антрациклинами, применение кандесартана в ходе терапии трастузумабом не снижало риск развития дисфункции ЛЖ [61].
Назначение ингибиторов конечного этапа активации РААС также представляется перспективным направлением в предотвращении связанной с противоопухолевой терапией дисфункции сердца. Так, в небольшом проспективном плацебоконтролируемом исследовании спиронолактон оказывал защитное влияние в отношении не только систолической, но и диастолической функции ЛЖ у больных РМЖ, получавших антрациклины [62].
Благодаря плейотропным антиоксидантным и противовоспалительным свойствам статины могут быть эффективным средством профилактики дисфункции сердца, обусловленной кардиотоксичным противоопухолевым лечением. В наблюдательном когортном исследовании применение на фоне антрациклинсодержащей терапии статинов, назначенных по другим показаниям, ассоциировалось со снижением риска СН у больных РМЖ [63].
В небольшом проспективном исследовании профилактическое назначение аторвастатина на фоне лечения антрациклинами предотвращало снижение ФВ ЛЖ в контрольной группе [64].
В настоящее время проводится более масштабное и продолжительное проспективное исследование эффективности аторвастатина в профилактике антрациклин-индуцированной сердечно-сосудистой токсичности (PREVENT, NCT01988571). Однако, опираясь на результаты завершенных исследований, уже сейчас можно сделать вывод, что назначение статинов пациентам с дислипидемией, получающих кардиотоксичную терапию, вполне оправданно.
Несмотря на то что исследования первичной профилактики кардиотоксичности демонстрируют определенную пользу кардиопротективных препаратов, нельзя не отметить ряд ограничений. Во-первых, исследования проводились в различных популяциях онкологических больных, многие из которых исходно относились к категории низкого и умеренного сердечно-сосудистого риска. Во-вторых, использовались различные схемы противоопухолевой терапии. Наконец, исследования имели различные сроки наблюдения и конечные точки, в том числе суррогатные. Таким образом, для определения оптимальных подходов к профилактике клинически значимой дисфункции ЛЖ и СН, связанной с противоопухолевым лечением, необходимы дальнейшие исследования в группах пациентов с разной степенью риска.
По мнению многих авторов, профилактика с использованием кардиопротективных препаратов должна осуществляться у пациентов с высоким риском, но не рекомендуется всем онкологическим больным, получающим кардиотоксичные препараты. Многим пациентам с исходно низким сердечно-сосудистым риском, получающим потенциально кардиотоксичную противоопухолевую терапию, кардиозащита может не потребоваться. Кроме того, необходимо помнить о потенциальных побочных эффектах кардиологических препаратов, например гипотонии, которая нередко отмечается у онкологических больных. В связи с этим при лечении больных, не имеющих ССЗ и их факторов риска и соответственно безусловных показаний к применению кардиологических средств, наиболее целесообразной представляется тактика наблюдения и выявления ранних маркеров кардиотоксичности.
Двумя наиболее изученными стратегиями наблюдения являются серийное определение сердечных биомаркеров (тропонина и натрийуретических пептидов) и выполнение ЭхоКГ с оценкой общей продольной деформации левого желудочка (global longitudinal strain, GLS). Известно, что повышение уровня тропонина и снижение GLS – надежные предвестники последующего снижения ФВ ЛЖ и развития СН [65–68].
Большинство экспертов поддерживают тактику регулярного измерения биомаркеров и визуализации сердца у пациентов, получающих кардиотоксичную терапию, связанную с риском развития дисфункции ЛЖ и СН [8, 9, 15]. В то же время предложить единый алгоритм мониторинга для всех пациентов не представляется возможным, поскольку многие факторы, включая исходные ССЗ и факторы риска их развития, предыдущее и запланированное противоопухолевое лечение (схема, прогнозируемая суммарная доза препаратов), влияют на решение о частоте и объеме обследования в процессе терапии.
В рекомендациях Европейского общества медицинской онкологии (European Society for Medical Oncology, ESMO) 2020 г. для бессимптомных пациентов с нормальной ФВ ЛЖ, получающих антрациклины, предложен подход, предусматривающий определение уровня тропонина на каждом цикле химиотерапии и выполнение ЭхоКГ после суммарной дозы доксорубицина 250 мг/м2 (или эквивалентной дозы других антрациклинов), а впоследствии при каждом увеличении суммарной дозы на 100 мг/м2 и по окончании химиотерапии. Пациентам с сохранной систолической функцией сердца, получающим трастузумаб, рекомендовано проведение ЭхоКГ после каждых четырех циклов лечения (один раз в три месяца). Однако пациентам с исходно высоким риском развития дисфункции ЛЖ может потребоваться более частое наблюдение [8].
При обнаружении ранних маркеров кардиотоксичности (увеличение уровня тропонина выше референсных значений или снижение GLS более 12% от исходной величины) необходимо рассмотреть вопрос о назначении кардиопротективной терапии с целью предотвращения развития и прогрессирования дисфункции ЛЖ.
Целесообразность стратификации риска с помощью биомаркера повреждения миокарда тропонина продемонстрирована в работах D. Cardinale и соавт. Назначение эналаприла больным с повышенным вследствие антрациклинсодержащей химиотерапии уровнем тропонина I способствовало предотвращению снижения ФВ ЛЖ и сокращению частоты развития сердечно-сосудистых событий (сердечная смерть, отек легких, СН, нарушение ритма сердца) [69].
Исследование ICOS-ONE не показало преимуществ стратегии первичной профилактики (назначение эналаприла до начала терапии антрациклинами) перед стратегией, ориентированной на биомаркеры (назначение эналаприла только при повышении уровня тропонина в процессе лечения антрациклинами), в эффективности предотвращения как ранней субклинической кардиотоксичности, так и дисфункции ЛЖ [70].
Таким образом, определение уровня тропонина в ходе химиотерапии позволяет, с одной стороны, выделить группу высокого риска развития дисфункции ЛЖ, в которой применение кардиопротективных препаратов оправданно, с другой – минимизировать их назначение онкологическим больным без исходной сердечно-сосудистой патологии.
В настоящее время проводятся рандомизированные плацебоконтролируемые исследования, результаты которых помогут ответить на вопрос, насколько эффективна вторичная профилактика дисфункции ЛЖ у больных при снижении GLS, вызванном противоопухолевой терапией [71].
Мы располагаем результатами единичных работ, в которых изучалась роль бета-адреноблокаторов. Например, в небольшом исследовании назначение бета-адреноблокаторов пациентам с обусловленным антрациклинами или трастузумабом снижением GLS более 11% приводило к достоверному повышению GLS и ФВ ЛЖ, в то время как в контрольной группе улучшения функции сердца не наблюдалось [72]. Однако убедительные данные о положительном влиянии кардиопротективной терапии на значимые ССО в этой клинической ситуации отсутствуют.
Опыт кардиоонкологической службы Brompton hospital свидетельствует о том, что противоопухолевое лечение не должно прерываться у пациентов с ранней субклинической кардиотоксичностью и может быть безопасным на фоне более тщательного мониторинга и использования кардиопротективных препаратов (бета-адреноблокаторов и/или иАПФ/БРА) [13].
Особого внимания требуют пациенты с бессимптомной дисфункцией ЛЖ, получающие трастузумаб. С учетом значимого улучшения выживаемости больных HER2+ РМЖ, обусловленного терапией трастузумабом, ее прерывание крайне нежелательно.
По мнению ряда исследователей, большинство пациентов с бессимптомным снижением ФВ ЛЖ в диапазоне 40–49% могут продолжать лечение трастузумабом на фоне применения бета-адреноблокаторов и/или иАПФ/БРА и регулярной оценки функции сердца. В исследовании SAFE-HEaRt такой подход позволил завершить таргетную терапию (трастузумаб ± пертузумаб) в полном объеме у 90% больных HER2+ РМЖ с бессимптомной дисфункцией ЛЖ. Противоопухолевая терапия была прекращена досрочно из-за бессимптомного снижения ФВ ЛЖ менее 40% у одного и развития клиники СН у двух из 30 включенных в исследование больных [73].
В небольшом исследовании SCHOLAR с участием больных HER2+ РМЖ с бессимптомным снижением ФВ ЛЖ до 40–54% или более 15% от исходного значения, ранее пролеченных антрациклинами и нуждавшихся в терапии трастузумабом, получены сходные результаты. У 18 из 20 участников исследования применение кардиопротективных препаратов и тщательный эхокардиографический мониторинг позволили провести запланированную противоопухолевую терапию в полном объеме. Лишь у двух больных она была приостановлена из-за развития СН [74].
В любом случае решение о продолжении противоопухолевой терапии у данной категории пациентов принимается кардиологами совместно с онкологами с учетом потенциальных рисков и пользы.
После завершения противоопухолевого лечения, сопряженного с риском развития дисфункции ЛЖ и СН, пациенты также должны находиться под наблюдением.
Индуцированная антрациклинами кардиотоксичность – прогрессирующий процесс. В крупном когортном исследовании, включавшем 2625 больных, пролеченных антрациклинами, при динамической эхокардиографической оценке функции ЛЖ новые случаи дисфункции ЛЖ выявлены у 9% пациентов, причем в 98% случаев в течение первого года после завершения лечения [75]. Патологический процесс сначала проявляется бессимптомным нарушением функции сердца, в дальнейшем, при естественном течении, завершается развитием симптомов и признаков СН. То есть симптомная дисфункция ЛЖ – последняя стадия кардиотоксичности. Момент времени, когда кардиотоксичность становится клинически очевидной, варьируется в широких пределах. Но на этом этапе поражение сердца может быть необратимым. Чем позже диагностируется СН, тем тяжелее ее течение [76, 77]. Своевременная диагностика ранних проявлений дисфункции сердца и проведение профилактических и лечебных мероприятий могут иметь принципиальное прогностическое значение для больного.
Дисфункция ЛЖ, связанная с применением антрациклинов, в большинстве случаев развивается по окончании лечения онкологического заболевания, когда пациент уже не находится под пристальным наблюдением онколога, а восстановление функции сердца зависит от своевременности начала лечения СН. В связи с этим крайне важно информировать пациента о риске поздних ССО противоопухолевого лечения и необходимости проведения ЭхоКГ через 6–12 месяцев после окончания антрациклинсодержащей химиотерапии даже в отсутствие симптомов СН [8, 9, 15].
Лечение онкологических больных с дисфункцией ЛЖ и СН
Сердечная недостаточность представляет значимую клиническую проблему как для онкологических больных, нуждающихся в кардиотоксичной противоопухолевой терапии, так и для пациентов, уже пролеченных по поводу ЗНО. Увеличению популяции онкологических больных c СН способствует ряд факторов. Прежде всего количество больных СН возрастает по мере старения населения и улучшения прогноза при различных ССЗ [78]. Таким образом, увеличивается число больных ССЗ, в том числе СН, к моменту установления диагноза ЗНО [79].
В последние годы появляются свидетельства того, что СН сама по себе может быть фактором риска развития онкологического заболевания [80]. Кроме того, возрастает число больных, пролеченных по поводу ЗНО, у которых СН является следствием проведенной кардиотоксичной терапии.
Можно ли начать или продолжить потенциально кардиотоксичное лечение пациента с ЗНО? Это главный вопрос, который возникает у врача при ведении онкологического больного с дисфункцией ЛЖ и СН. Принятие решения в такой непростой клинической ситуации требует совместного обсуждения мультидисциплинарной командой онкологов и кардиологов и зависит от многих факторов. Прежде всего необходимо оценить прогноз имеющихся у пациента сердечно-сосудистого и онкологического заболеваний, в том числе на фоне потенциально кардиотоксичной противоопухолевой терапии и в ее отсутствие. Следует рассмотреть возможность применения альтернативных некардиотоксичных методов (при их наличии и сопоставимой противоопухолевой эффективности), а также снижения дозы или модификации способа введения кардиотоксичного препарата. На выбор тактики лечения будут влиять уровень ФВ ЛЖ, натрийуретических пептидов, наличие симптомов СН, анамнестические указания на госпитализацию по поводу декомпенсации СН и других ССО, а также переносимость препаратов. Необходимо обсудить план наблюдения и предусмотреть оценку клинического состояния пациента, определение уровня сердечных биомаркеров, использование визуализирующих методов (ЭхоКГ), ЭКГ. Частота их выполнения зависит от клинической ситуации.
Как показывает опыт кардиоонкологических клиник, использование потенциально кардиотоксичной терапии, в том числе антрациклинов и трастузумаба, может быть относительно безопасным у пациентов с дисфункцией ЛЖ, при назначении кардиопротективных препаратов и тщательном мониторинге функции сердца [13]. Тем не менее в ряде случаев тяжесть СН настолько высока, что кардиотоксичная терапия ЗНО абсолютно противопоказана.
Пациенты с исходной дисфункцией ЛЖ и СН, которым назначается кардиотоксичная противоопухолевая терапия, оказываются в группе наиболее высокого риска [79]. В связи с этим на этапе планирования противоопухолевого лечения крайне важно провести их детальное обследование для определения этиологии, степени тяжести СН, наличия симптомов и признаков, в частности связанных с задержкой жидкости. Лечение СН следует проводить в соответствии с действующими рекомендациями [10, 81]. Для пациентов с СН и сниженной ФВ (СНнФВ) лечение включает иАПФ или БРА в сочетании с бета-адреноблокаторами и АМКР при условии хорошей переносимости и отсутствия противопоказаний.
У пациентов с СН, не получающих оптимальных доз препаратов, важен их пересмотр с повышением до рекомендованных (терапевтических) под контролем артериального давления, частоты сердечных сокращений, функции почек и уровня калия в сыворотке крови [10, 81]. У ряда больных повышать дозы иАПФ/БРА или бета-адреноблокаторов приходится уже после начала противоопухолевого лечения, когда его невозможно отложить. В такой ситуации целесообразно начать с некардиотоксичных режимов, а после оптимизации терапии и стабилизации состояния пациентов рассмотреть возможность применения потенциально кардиотоксичных препаратов [82].
Если пациенты с дисфункцией ЛЖ или СН нуждаются в антрациклинсодержащей химиотерапии, в качестве первичной профилактики может использоваться дексразоксан [8]. Его применение у взрослых одобрено лишь при метастатическом РМЖ, если доза доксорубицина превышает 300 мг/м2. Тем не менее в серии клинических наблюдений показано, что у пациентов с различными онкологическими заболеваниями и кардиопатией назначение дексразоксана на фоне антрациклинов позволяет провести противоопухолевую терапию без декомпенсации СН [83].
При дисфункции ЛЖ, впервые выявленной в процессе противоопухолевого лечения, выбор наиболее рациональной тактики ведения больного определяется множеством ранее упоминавшихся факторов, включающих степень снижения и абсолютное значение ФВ ЛЖ, наличие симптомов СН, онкологический прогноз и эффективность противоопухолевой терапии. При развитии СН противоопухолевую терапию следует приостановить. Пациентам с дисфункцией ЛЖ, даже в отсутствие клинических проявлений, необходимо как можно раньше назначать общепринятую терапию СН [9, 75]. Решение о продлении противоопухолевого лечения должна принимать многопрофильная команда (в идеале – в кардиоонкологической службе). Пациентам необходимо предоставить информацию о рисках и преимуществах продолжения лечения.
Особую категорию представляют больные, завершившие противоопухолевое лечение, ассоциируемое с поздней кардиотоксичностью, прежде всего антрациклинами. Известно, что симптомы СН могут развиться спустя месяцы и даже годы после окончания лечения ЗНО. В случае позднего выявления (более 12 месяцев) СН может быть более резистентной к стандартному лечению [12].
В исследованиях D. Cardinale и соавт. показана зависимость эффективности терапии СН от своевременности ее назначения. Так, при назначении эналаприла и карведилола больным с вызванной антрациклинами дисфункцией ЛЖ (ФВ ЛЖ < 45%) и СН в 55% случаев улучшалась систолическая функция ЛЖ. Выраженность ответа на лечение снижалась с увеличением периода времени от окончания химиотерапии до начала кардиопротективной терапии. При продолжительности этого периода свыше шести месяцев не зафиксировано ни одного случая полного восстановления ФВ ЛЖ. В группе эффективной кардиопротективной терапии также наблюдалась меньшая частота других ССО [84].
При раннем обнаружении антрациклин-индуцированной дисфункции ЛЖ и назначении стандартной терапии СН на основе эналаприла в комбинации с бета-адреноблокаторами (карведилол или бисопролол) или без них в 11% случаев отмечалась нормализация, а в 71% – частичное восстановление ФВ ЛЖ. При этом комбинированная терапия была эффективнее монотерапии [75]. Однако при оценке результатов следует учитывать открытый несравнительный характер приведенных исследований.
Антрациклиновая кардиомиопатия считается одной из наиболее агрессивных форм кардиомиопатий: по данным опубликованного в 2000 г. исследования, двухлетняя смертность при этом заболевании превышает 50% [11]. СН, развившаяся вследствие кардиотоксичной противоопухолевой терапии, ассоциируется с более неблагоприятным прогнозом, чем СН иной этиологии [11, 12]. Поскольку специфического медикаментозного лечения СН, связанной с противоопухолевой терапией, не существует, лечение должно проводиться на основании общепринятых рекомендаций [10, 81]. Пациентам с рефрактерной СНнФВ может потребоваться лечение, включающее ивабрадин и/или комплекс «валсартан + сакубитрил» [10, 81]. Наконец, могут быть рассмотрены хирургические и электрофизиологические методы лечения СН, предполагающие имплантацию кардиовертеров-дефибрилляторов, бивентрикулярных электрокардиостимуляторов для проведения ресинхронизирующей терапии, использование аппаратов вспомогательного кровообращения и трансплантацию сердца, особенно если после завершения лечения ЗНО прошло более пяти лет и признаки рецидива отсутствуют.
Более высокий риск осложнений и незначительная предполагаемая продолжительность жизни до недавнего времени ограничивали применение хирургических и электрофизиологических методов лечения у онкологических больных. Однако данные крупных регистров свидетельствуют о том, что эффективность этих видов лечения при антрациклиновой кардиомиопатии не уступает таковой при кардиомиопатии иной этиологии [85–88].
В 2017 г. в Российские клинические рекомендации по диагностике и лечению хронической СН был включен комплекс «валсартан + сакубитрил» – препарат из класса нейрогормональных модуляторов – блокатор неприлизина и рецепторов ангиотензина [10].
В многоцентровом рандомизированном исследовании PARADIGM-HF с участием 8442 пациентов с хронической СН (ХСН) функционального класса (ФК) II–IV и низкой ФВ ЛЖ продемонстрировано преимущество комплекса «валсартан + сакубитрил» перед эналаприлом – золотым стандартом терапии ХСН. Это проявлялось в снижении относительного риска по первичной конечной точке (совокупное снижение сердечно-сосудистой смертности и госпитализаций в связи с СН) на 20% (отношение шансов (ОШ) 0,80; 95%-ный доверительный интервал (ДИ) 0,73–0,87; р < 0,001), общей смертности – на 16% (ОШ 0,84; 95% ДИ 0,76–0,93; р < 0,001), сердечно-сосудистой смертности – на 20% (ОШ 0,80; 95% ДИ 0,71–0,89; p < 0,001), первой госпитализации по поводу обострения СН – на 21% (ОШ 0,79; 95% ДИ 0,71–0,89; p < 0,001), а также улучшении клинического состояния пациентов (по Канзасскому опроснику качества жизни у пациентов с кардиомиопатиями (KCCQ); р = 0,001) [89]. Кроме того, продемонстрирована лучшая переносимость комплекса «валсартан + сакубитрил». Подтверждение тому – меньшая частота прекращения приема препарата в связи с нежелательными явлениями, такими как нарушение функции почек, опасная гиперкалиемия (> 6,0 ммоль/л) и кашель [89, 90]. Важно, что преимущество комплекса «валсартан + сакубитрил» перед иАПФ не зависело от тяжести состояния и возраста пациентов, характера основного ритма, величины исходной ФВ ЛЖ (все пациенты имели СНнФВ), исходного уровня систолического артериального давления (САД), проводимого сопутствующего лечения, а также этиологии заболевания [89–91]. Однако интерполировать результаты PARADIGM-HF на категорию онкологических больных не представляется возможным, поскольку наличие известного ЗНО служило критерием невключения пациентов в исследование.
Результаты пилотного исследования
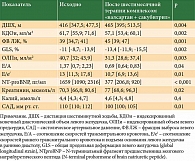
С 2018 г. в ФГБУ «НМИЦ кардиологии» Минздрава России проводится проспективное несравнительное исследование эффективности и безопасности комплекса «валсартан + сакубитрил» у больных ХСН, развившейся вследствие антрациклинсодержащей химиотерапии. В исследование включаются больные ХСН со сниженной систолической функцией ЛЖ II–III ФК по NYHA в стадии компенсации при наличии документального подтверждения о проведенной ранее антрациклинсодержащей химиотерапии по поводу онкологического/онкогематологического заболевания и отсутствии ССЗ, которые могли бы быть самостоятельной причиной развития ХСН у данных пациентов (постинфарктный кардиосклероз, дилатационная, гипертрофическая и рестриктивная кардиомиопатия, значимые пороки сердца). Рассмотрим первые результаты исследования, полученные при наблюдении за 20 больными, получавшими валсартан + сакубитрил в течение шести месяцев.
100% включенных в исследование – женщины, медиана возраста – 61 [51,5; 67] год. Анамнез артериальной гипертонии имели восемь (40%) пациенток, сахарным диабетом 2-го типа страдала одна (5%) больная. Наиболее частым онкологическим заболеванием, по поводу которого ранее проводилась антрациклинсодержащая терапия, был РМЖ – 17 (85%) больных. Онкогематологические заболевания имели место в трех (15%) случаях. Медиана времени от окончания химиотерапии до включения в исследование и соответственно начала терапии комплексом «валсартан + сакубитрил» – 3 [1; 11] года. Хирургическое лечение по поводу онкологического заболевания выполнено 15 (75%) больным, лучевая терапия на грудную клетку – 15 (75%). Все пациентки до назначения комплекса «валсартан + сакубитрил» находились на терапии иАПФ или БРА (препараты отменены за 36 часов до начала лечения указанной комбинацией). Исходно 17 (85%) больных принимали бета-адреноблокаторы, 12 (60%) – АМКР, 10 (50%) – петлевые диуретики.
За шесть месяцев наблюдения не зафиксировано ни одного случая декомпенсации СН, которая потребовала бы госпитализации или увеличения дозы петлевого диуретика, а также других ССО. Целевой дозы комплекса «валсартан + сакубитрил» (400 мг/сут) достигли 11 (55%) больных. Средняя доза препарата составила 289 ± 149,1 мг/сут.
В процессе лечения комплексом «валсартан + сакубитрил» уровень САД достоверно снизился (таблица). У восьми (40%) пациенток отмечались связанные с гипотонией слабость и головокружение, что не позволило увеличить дозу препарата. В ряде случаев ее пришлось снизить. Несмотря на повышение уровня креатинина, медиана этого показателя оставалась в пределах нормальных значений. Значимой динамики уровня калия не установлено, за исключением одной больной, у которой наблюдалось его повышение до 6 ммоль/л с последующей нормализацией на фоне коррекции дозы препарата.
Исходно 16 больных имели ХСН II ФК и четыре пациентки – III ФК по NYHA. Через шесть месяцев приема комбинации «валсартан + сакубитрил» к III ФК можно было отнести одну больную, к II ФК – 12 пациенток, к I ФК – семь больных. Таким образом у 50% больных отмечалось улучшение ФК СН, что подтверждалось достоверным увеличением дистанции шестиминутной ходьбы (таблица).
К окончанию шестимесячного периода лечения комплексом «валсартан + сакубитрил» отмечалось значимое улучшение ряда эхокардиографических показателей: снижение индексированного конечного диастолического объема ЛЖ, повышение ФВ ЛЖ, GLS (таблица). Зафиксирована положительная динамика параметров, характеризующих не только систолическую, но и диастолическую функцию ЛЖ: уменьшение индексированного объема левого предсердия, снижение соотношения E/A и Е/е/. Ожидаемо снизился уровень NT-proBNP, что свидетельствовало об улучшении нейрогуморального статуса больных (таблица).
Согласно результатам пилотного исследования, терапия комплексом «валсартан + сакубитрил» ассоциируется с улучшением систолической и диастолической функции ЛЖ, нейрогуморального и функционального статуса у больных онкологическими/онкогематологическими заболеваниями и хронической СН, развившейся вследствие антрациклинсодержащей химиотерапии.
Лечение комплексом «валсартан + сакубитрил» проводится под наблюдением кардиолога и требует контроля гемодинамических и биохимических показателей в целях безопасной титрации дозы препарата.
Заключение
В настоящее время прослеживается устойчивая тенденция к увеличению числа лиц, излеченных от рака или живущих с онкологическим заболеванием, контролируемым на фоне постоянного лечения.
Сердечная недостаточность у онкологических больных обусловлена, с одной стороны, увеличением исходного сердечно-сосудистого риска к моменту диагностики онкологического заболевания, с другой – кардиотоксичностью противоопухолевой терапии.
Базовая оценка риска ССЗ до начала противоопухолевого лечения, наблюдение за больными с применением современных биохимических и визуализирующих методов, использование в ходе лечения кардиопротективных стратегий и по его завершении программ длительного наблюдения продлевают жизнь без ЗНО и СН.
M.V. Vitsenya, PhD, A.V. Potekhina, PhD, S.V. Gavryushina, PhD, N.M. Ibragimova, V.P. Masenko, PhD, Prof., F.T. Ageyev, PhD, Prof.
National Medical Research Center for Cardiology
Contact person: Marina V. Vitsenya, marinavitsenya@gmail.com
Left ventricular dysfunction and heart failure are significant complications of antitumor therapy. The article discusses approaches to the prevention and treatment of these complications, tactics of cardiological management of patients receiving potentially cardiotoxic antitumor therapy, and cancer patients with left ventricular dysfunction and heart failure. Presented the first results of the pilot study of the efficacy and safety of valsartan + sacubitril combination therapy in patients with heart failure developed as a result of anthracycline-containing chemotherapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.