Влияние тромбофилии и гестационной гипертензии на риск развития сосудистых заболеваний сетчатки при беременности
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. На сроках 8–38 недель гестации проведено офтальмологическое обследование 60 беременных (120 глаз) в возрасте 22–33 лет с артериальным давлением ≥ 150/90 мм рт. ст. и умеренной протеинурией (≤ 1 г/л). Отягощенный акушерский анамнез имел место у 27 пациенток, в частности диагностирована преэклампсия легкой и средней степени на фоне сосудистой патологии сетчатки и зрительного нерва. Контрольную группу составили 40 беременных в возрасте 22–37 лет с физиологическим течением беременности и без признаков преэклампсии.
Результаты. У беременных с преэклампсией выявлена комбинированная тромбофилия, характеризующаяся гиперкоагуляционным синдромом и эндотелиальной дисфункцией. ВА может играть определенную роль в патогенезе острых сосудистых нарушений сетчатки и опасных форм периферической витреохориоретинальной дистрофии у беременных с преэклампсией.
Заключение. Беременным с артериальной гипертензией и протеинурией необходимо проводить офтальмологический мониторинг и исследование системы гемостаза, включая определение ВА, для своевременной диагностики и лечения сосудистых осложнений.
Материал и методы. На сроках 8–38 недель гестации проведено офтальмологическое обследование 60 беременных (120 глаз) в возрасте 22–33 лет с артериальным давлением ≥ 150/90 мм рт. ст. и умеренной протеинурией (≤ 1 г/л). Отягощенный акушерский анамнез имел место у 27 пациенток, в частности диагностирована преэклампсия легкой и средней степени на фоне сосудистой патологии сетчатки и зрительного нерва. Контрольную группу составили 40 беременных в возрасте 22–37 лет с физиологическим течением беременности и без признаков преэклампсии.
Результаты. У беременных с преэклампсией выявлена комбинированная тромбофилия, характеризующаяся гиперкоагуляционным синдромом и эндотелиальной дисфункцией. ВА может играть определенную роль в патогенезе острых сосудистых нарушений сетчатки и опасных форм периферической витреохориоретинальной дистрофии у беременных с преэклампсией.
Заключение. Беременным с артериальной гипертензией и протеинурией необходимо проводить офтальмологический мониторинг и исследование системы гемостаза, включая определение ВА, для своевременной диагностики и лечения сосудистых осложнений.
Введение
Беременность – уникальный физиологический процесс, который может осложняться патологическими состояниями, возникающими исключительно в этом периоде и обычно разрешающимися после родов или в раннем послеродовом периоде. Традиционно такие состояния классифицировались как токсикозы и гестозы. Однако современный подход к классификации и терминологии отражает углубленное понимание патофизиологических механизмов.
В настоящее время от термина «токсикоз» практически отказались, а понятие гестоза заменено более точными, описывающими суть патологии терминами, объединенными в группу гипертензивных расстройств беременности (ГРБ). Подобные расстройства являются одной из ведущих причин материнской и перинатальной заболеваемости и смертности в мире и требуют пристального внимания и своевременной диагностики. Согласно данным Всемирной организации здравоохранения, ГРБ осложняют 5–10% всех беременностей.
Современная классификация ГРБ включает [1]:
- гестационную гипертензию – повышение уровня артериального давления (АД) (≥ 140/90 мм рт. ст.), впервые выявленное после 20-й недели беременности, без протеинурии или других признаков повреждения органов-мишеней;
- преэклампсию (ПЭ) – гестационную гипертензию, сопровождающуюся протеинурией (≥ 300 мг/сут) и/или признаками поражения органов-мишеней, такими как тромбоцитопения, нарушение функции печени или почек, отек легкого, неврологические расстройства [1]. ПЭ подразделяется на ПЭ без признаков тяжести и ПЭ с признаками тяжести, что имеет значение для определения тактики ведения больных;
- эклампсию – возникновение у женщин с ПЭ судорог, которые невозможно объяснить другими причинами;
- хроническую гипертензию – повышение уровня АД (≥ 140/90 мм рт. ст.), имевшее место до беременности или выявленное до 20-й недели беременности;
- хроническую гипертензию, осложненную ПЭ: у пациенток с хронической гипертензией развивается ПЭ (протеинурия de novo или значительное увеличение существующей протеинурии, появление иных признаков повреждения органов-мишеней).
Признано, что в основе патофизиологии ГРБ лежит нарушение плацентации, приводящее к эндотелиальной дисфункции и системному воспалению. Дисбаланс между вазоконстрикторными и вазодилатирующими факторами, а также активация коагуляционного каскада играют ключевую роль в развитии клинических признаков.
В России применяются клинические рекомендации, основанные на международном опыте, но имеющие некоторые терминологические особенности. Крайне важно следовать актуальным клиническим протоколам, утвержденным Минздравом России.
Беременность сопровождается значительными физиологическими изменениями, включая гемодинамические и гемостатические сдвиги, которые, хотя и необходимы для поддержания беременности, могут предрасполагать к тромбоэмболическим осложнениям [1]. В частности, сосудистые заболевания сетчатки, такие как окклюзии артерий и вен сетчатки, представляют серьезную угрозу для зрения, что требует незамедлительной диагностики и лечения [2]. Рутинные гематологические исследования не всегда выявляют нарушения гемостаза. В ходе клинического обследования можно обнаружить признаки гиперкоагуляции [3].
Случаи окклюзии как ветвей, так и центральной артерии сетчатки имеют место при беременности [4]. Окклюзия обеих центральных артерий сетчатки редко вызывается эмболией амниотической жидкостью – потенциально смертельным состоянием [5]. Окклюзии вен сетчатки встречаются реже, чем артериальные окклюзии, но также могут приводить к значительной потере зрения [6].
Кроме того, беременность иногда осложняется другими системными заболеваниями, влияющими на сосуды сетчатки, такими как диссеминированное внутрисосудистое свертывание (ДВС-синдром), тромботическая тромбоцитопеническая пурпура и антифосфолипидный синдром.
ДВС-синдром характеризуется распространенным тромбозом мелких сосудов, часто сопровождающимся кровотечениями и некрозом тканей, и может быть обусловлен отслойкой плаценты, тяжелой ПЭ, осложненным выкидышем и внутриутробной гибелью плода [7]. Наиболее частым офтальмологическим проявлением считается поражение сосудистой оболочки (хориоидеи), приводящее к потере зрения вследствие инфаркта, кровоизлияния, отслойки пигментного эпителия сетчатки или ее серозной отслойки [8].
Тромботическая тромбоцитопеническая пурпура – редкое, но опасное состояние, проявляющееся тромбозом мелких сосудов, тромбоцитопенией, микроангиопатической гемолитической анемией, неврологическими нарушениями, поражением сетчатки и лихорадкой. Офтальмологические симптомы включают серозную отслойку сетчатки, сужение ее артерий, кровоизлияние и отек диска зрительного нерва [9].
Синдром антифосфолипидных антител является приобретенной тромбофилией, характеризующейся рецидивирующими артериальными и/или венозными тромбозами, повторяющимися выкидышами и лабораторным подтверждением наличия антифосфолипидных антител или волчаночного антикоагулянта (ВА) [10]. Офтальмологические проявления могут включать тромбозы сосудов сетчатки, хориоидеи, зрительного нерва и зрительного тракта, а также поражение глазодвигательных нервов [11].
Особое внимание следует уделять ПЭ – распространенному осложнению беременности (2–8% случаев), характеризующемуся повышением АД и протеинурией после 20-й недели гестации [12, 13]. Тяжелая ПЭ способна приводить к эклампсии (судорогам), отслойке плаценты, HELLP-синдрому и другим серьезным осложнениям [14]. Несмотря на снижение в развитых странах материнской смертности, ПЭ остается одной из ведущих причин материнской заболеваемости и смертности в мире [15]. Ключевым звеном в патогенезе ПЭ считается эндотелиальная дисфункция (ЭД), вызванная дисбалансом между вазоконстрикторами (эндотелин, катехоламины) и вазодилататорами (оксид азота, простациклин), а также окислительным стрессом [16, 17]. В офтальмологическом аспекте эндотелий сосудов играет важную роль в регуляции кровотока в сетчатке, зрительном нерве и хориоидее. Дисбаланс между оксидом азота и эндотелином с преобладанием последнего может способствовать развитию различных офтальмологических патологий. Важно, что ЭД, возникнув во время осложненной беременности, может сохраняться в течение длительного периода после родов (до 15–25 лет) [18], увеличивая риск развития сердечно-сосудистых заболеваний и смерти от всех причин в долгосрочной перспективе.
В норме эндотелий обеспечивает адекватную перфузию органов и тканей, однако при ЭД происходят ангиоспазм и тромбоз сосудов, приводящие к ишемии и венозному застою.
По данным исследований, у 25% женщин с тяжелой ПЭ развиваются зрительные расстройства, такие как затуманивание зрения, снижение зрения, фотопсии и скотомы [19]. В тяжелых случаях не исключены диплопия, амавроз, гомонимная гемианопсия и кортикальная слепота [20]. К окулярным осложнениям ПЭ относят окклюзию центральной артерии сетчатки, папиллофлебит, ишемическую оптическую невропатию с атрофией зрительного нерва, оптический неврит и ретинопатию Пурчера [21]. В большинстве случаев зрительные функции восстанавливаются в течение нескольких недель или месяцев после родов, но иногда отмечается стойкое снижение зрения, вплоть до слепоты [22].
Учитывая повышенную тромбогенность, характерную для беременности и послеродового периода, необходимо особое внимание у женщин с ПЭ уделять состоянию гемостаза [23]. Пациенткам с отягощенным акушерским анамнезом и ГРБ (отеки, протеинурия, гипертония) рекомендуется динамическое исследование тромбоцитов, фактора Виллебранда (ФВ), растворимых фибринмономерных комплексов (РФМК), фибриногена по Клаусу, антитромбина III, активированного частичного тромбопластинового времени (АЧТВ), фактора свертывания крови VIII, а также определение ВА [24].
Тромбофилия, предрасположенность к тромбообразованию, может быть как генетической, так и приобретенной и требует тщательной оценки факторов риска у беременных с ПЭ. Антифосфолипидные антитела, в том числе ВА, представляют собой гетерогенную группу иммуноглобулинов, ассоциированных с повышенным риском тромбозов, и должны быть исследованы у женщин с ПЭ и другими осложнениями беременности.
Данных о комплексной оценке сосудисто-тромбоцитарного гемостаза у беременных с ГРБ недостаточно. Повреждение гематоретинального барьера при ПЭ – установленный факт, но необходимы дальнейшие исследования для полного понимания механизмов и разработки эффективных стратегий профилактики и лечения офтальмологических осложнений, связанных с ПЭ.
Цель – изучить динамику параметров в системе гемостаза и уровней ВА у беременных с гипертензивными расстройствами во время беременности, осложненной сосудистой патологией сетчатки и зрительного нерва.
Материал и методы
В исследование было включено 60 беременных (120 глаз) в возрасте 22–33 лет со сроком гестации от восьми до 38 недель. У 27 пациенток имел место отягощенный акушерский анамнез: преждевременная отслойка нормально расположенной плаценты (n = 6), варикозная болезнь вен нижних конечностей (n = 5), кровотечение в родах (n = 7), привычное невынашивание (n = 9). У ряда беременных наблюдались повышение АД (около 150/90 мм рт. ст.) и умеренная протеинурия (до 1 г/л).
Участницы исследования были разделены на четыре группы. В первую вошли десять пациенток с опасными формами периферических витреохориоретинальных дистрофий (ПВХРД) с прогрессированием и ГРБ, во вторую – 17 пациенток с гРБ, отягощенными акушерским анамнезом и острой сосудистой патологией сетчатки. Третью группу составили 33 пациентки с физиологической беременностью. Контрольную группу представляли 40 беременных со сроком гестации 8–38 недель, физиологическим течением беременности, без признаков ГРБ.
Исследование системы гемостаза
Исследование выполняли скрининговыми и специальными методами автоматизированной коагулометрии на анализаторах с использованием реагентов Dade Behring и Siemens. Определяли активность ФВ, антитромбина III, фактора VIII, активированное парциальное тромбопластиновое время, резистентность фактора V к активированному протеину C, количественное содержание РФМК (фирма «Технология-стандарт») и концентрацию фибриногена (метод Клауса). Функциональную активность тромбоцитов оценивали с помощью агрегометрии, определяя спонтанную и индуцированную агрегацию (индукторы аденозиндифосфат (АДФ), адреналин).
Выявление волчаночного антикоагулянта
Обнаружение ВА осуществлялось с использованием ядовых тестов, что подтверждалось тестами с добавлением донорской плазмы и корригирующих фосфолипидов. Повторное исследование проводилось через 12 недель.
Молекулярно-генетическое тестирование
Для выявления генетических маркеров тромбофилии применяли метод полимеразной цепной реакции в режиме реального времени. Анализ выполняли в лаборатории биохимии Российского научно-исследовательского института гематологии и трансфузиологии ФМБА России.
Офтальмологическое обследование
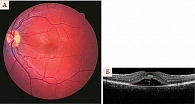
Использовались стандартные и специальные методы: офтальмоскопия с применением линзы Гольдмана, флуоресцентная ангиография глазного дна, оптическая когерентная томография, ультразвуковое исследование в А- и В-сканах.
Статистическая обработка данных
Для создания базы данных использовали редактор электронных таблиц Microsoft Excel. Статистическую обработку данных осуществляли с помощью программы SPSS. Статистически значимыми считались различия при p < 0,05.
Результаты и обсуждение
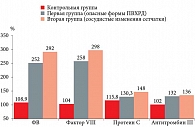
По сравнению с беременными контрольной группы у 27 женщин с ГРБ выявлены статистически значимые отклонения параметров гемостаза. В частности, отмечалось повышение уровней следующих факторов (соответственно для первой и второй групп пациенток с ГРБ по сравнению с контрольной группой): ФВ – в 2,3 и 2,7 раза, фактора VIII – в 2,48 и 2,86 раза, протеина C – в 1,13 и 1,29 раза, антитромбина III – в 1,29 и 1,33 раза.
Сравнение указанных показателей между группами пациенток с гРБ демонстрирует увеличение ФВ на 15,8%, фактора VIII – на 17,8%, протеина C – на 13,8%, антитромбина III – на 3%.
У всех пациенток с ГРБ обнаружена ЭД, маркером которой служит повышенный уровень ФВ. Это подтверждает патогенетическую роль ЭД в формировании сосудистой ретинальной патологии [19, 20]. В проведенных исследованиях отмечалось повышение уровня протеина C, однако его концентрация была значительно ниже, чем концентрация прокоагулянтов ФВ и фактора VIII. Это можно объяснить высоким потреблением и активностью прокоагулянтного звена гемостаза у пациенток с гРБ (рис. 1).
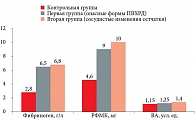
По сравнению с беременными контрольной группы у пациенток с гРБ отмечалось увеличение АЧТВ в 1,27 и 1,44 раза соответственно, фибриногена – в 2,32 и 2,42 раза, РФМК – в 1,96 и 2,17 раза, ВА – в 1,09 и 1,28 раза (рис. 2). Повышение уровня фибриногена, РФМК и ВА в крови по сравнению с показателями контрольной группы свидетельствует о наличии гиперкоагуляции, тромбинемии и повреждении сосудистой стенки.
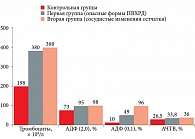
Показатели тромбоцитарного гемостаза у пациенток представлены на рис. 3. Увеличение концентрации тромбоцитов в первой и второй группах по сравнению с показателями контрольной группы в 1,92 и 2,01 раза соответственно сопровождалось ростом агрегации тромбоцитов с АДФ в концентрациях 2,0 мкмоль/л (в 1,3 и 2,64 раза) и 0,1 мкмоль/л (в 4,9 и 9,6 раза). При сравнении этого показателя между группами пациенток с ГРБ установлено его увеличение на 3,2 и 9,6% соответственно (рис. 3).
Повреждение эндотелия сосудистой стенки запускает каскад гемостатических реакций, характеризующихся повышенной адгезией и агрегацией тромбоцитов на участке повреждения. Формирование тромбоцитарного тромба служит триггером активации коагуляционного каскада и приводит к гиперкоагуляции в сосудистом русле сетчатки. Клиническим следствием данного процесса считается развитие ретинального геморрагического синдрома, проявляющегося характерными изменениями на глазном дне.
По сравнению с показателями контрольной группы в исследуемых группах наблюдалось статистически значимое увеличение АЧТВ – в 1,27 и 1,44 раза. Концентрация фибриногена возросла в 2,32 и 2,42 раза, уровень РФМК – в 1,96 и 2,17 раза. ВА обнаруживался в 1,09 и 1,28 раза чаще.
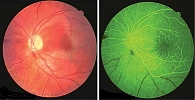
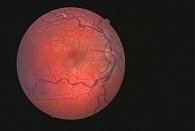
Повышение уровней ФВ и фактора VIII, протромбинового комплекса и РФМК у женщин с ГРБ указывает на повышенную уязвимость эндотелия и наличие активного патологического процесса на уровне микроциркуляторного русла сетчатки. Это проявляется прогрессированием решетчатой ПВХРД с формированием витреоретинальных тракций. В первой группе (n = 10) у трех пациенток произошла отслойка сетчатки: у одной на 27-й неделе беременности, у двух других – непосредственно в послеродовом периоде. Во второй группе наблюдались проявления ретинального тромбогеморрагического синдрома: окклюзия артерий сетчатки – в четырех случаях (рис. 4), центральная серозная хориоретинопатия – в шести (рис. 5), окклюзия вен сетчатки – в четырех (рис. 6), эпиретинальная мембрана – в трех случаях.
Гиперагрегация тромбоцитов в ответ на использованные индукторы у женщин с ГРБ указывает на повреждение сосудистой стенки микроциркуляторного русла. Вероятно, повреждение сопровождается повышением проницаемости эндотелия, что клинически проявляется отеком и геморрагиями на глазном дне.
При исследовании параметров системы гемостаза – ФВ, фактора VIII, протеина C, РФМК и фибриногена – у беременных с ГРБ зафиксировано повышение их уровней по сравнению с аналогичными показателями у беременных с физиологическим течением беременности. Данный факт свидетельствует о сдвиге баланса в системе гемостаза в сторону прокоагуляции. Острые сосудистые изменения в сетчатке глаза и зрительном нерве, выявленные офтальмологически, подтверждают наличие ЭД в сосудах микроциркуляторного русла глаза, а также системной и регионарной тромбинемии и гиперкоагуляционного синдрома. Повышение уровня протеина C – физиологического антикоагулянта, активируемого тромбином, рассматривается как компенсаторная реакция, направленная на ограничение тромбообразования. Активированный протеин C стимулирует высвобождение тканевого активатора плазминогена эндотелиальными клетками, усиливая фибринолиз [2, 15]. Однако в условиях выраженной гиперкоагуляции эффективность данной аутосанации может быть ограничена, а чрезмерный фибринолиз в сочетании с гиперактивностью естественных антикоагулянтов теоретически способен привести к тромбогеморрагическим осложнениям, характеризующимся микротромбозами с нарушением функции органов и кровоизлиянием.
У 12 (44,4%) пациенток с ГРБ выявлен ВА – диапазон 1,3–1,4 усл. ед., что может указывать на наличие антифосфолипидного синдрома. Циркуляция ВА в крови беременных с ГРБ стимулирует систему коагуляции и способствует тромбообразованию как в венозном, так и в артериальном русле, особенно в сосудах мелкого калибра. Это отягощает течение беременности, роды и послеродовой период, негативно влияет на развитие плода и может способствовать прогрессированию превитреоретинальной геморрагии и других опасных форм ПВХРД.
Результаты офтальмологических исследований и анализа системы гемостаза в исследуемой группе женщин наглядно демонстрируют роль ВА в развитии тромбозов и претромботических состояний в сосудах сетчатки. Наличие ВА у беременных говорит о приобретенной тромбофилии, требует углубленного изучения системы гемостаза, особенно при отягощенном акушерском анамнезе, и проведения тщательного офтальмологического мониторинга с целью своевременной диагностики тромбозов сосудов сетчатки и ПВХРД.
Выводы
На основании полученных результатов можно сделать следующие выводы.
- У беременных с ГРБ имеет место комплексная тромбофилия, характеризующаяся гиперкоагуляционным синдромом и ЭД.
- ВА участвует в патогенезе острой сосудистой патологии сетчатки и развитии тяжелых форм ПВХРД у женщин с ГРБ.
- Необходимы офтальмологический мониторинг беременных и исследования системы гемостаза, крови на наличие ВА. Своевременная диагностика и профилактика окклюзионных поражений сосудов сетчатки с использованием антикоагулянтной и антиагрегантной терапии может способствовать сохранению зрения и улучшению исходов беременности для матери и плода.
T.V. Shelkovnikova, PhD, Ye.V. Sibirskaya, PhD, Prof., G.V. Vavin, PhD, Ye.S. Polennikova, P.O. Nikiforova
International Scientific and Practical Center for Tissue Proliferation, Moscow
S.V. Belyaev Kuzbass Clinical Hospital, Kemerovo
N.I. Pirogov Russian National Research Medical University
Russian Children’s Clinical Hospital – a Branch of N.I. Pirogov Russian National Research Medical University
Russian University of Medicine
Medical Clinic Laser Optic, Kemerovo
Contact person: Yelena V. Sibirskaya, elsibirskaya@yandex.ru
Purpose to assess changes in hemostasis parameters and lupus anticoagulant (LA) levels in pregnant women with arterial hypertension and proteinuria, complicated by vascular disorders of the retina and optic nerve.
Material and methods. At 8–38 weeks of gestation an ophthalmological examination was performed on 60 pregnant women (120 eyes) aged 22–33 years with blood pressure ≥ 150/90 mmHg and moderate proteinuria (≤ 1 g/L). A complicated obstetric history was noted in 27 patients. 27 women were diagnosed with mild to moderate preeclampsia, accompanied by vascular pathology of the retina and optic nerve. The control group consisted of 40 pregnant women (22–37 years old) with a physiological course of pregnancy and no signs of preeclampsia.
Results. Pregnant women with preeclampsia were found to have combined thrombophilia, characterized by a hypercoagulable syndrome and endothelial dysfunction. The presence of LA may play a role in the pathogenesis of acute retinal vascular disorders and dangerous forms of peripheral vitreochorioretinal dystrophy in pregnant women with preeclampsia.
Conclusion. Pregnant women with arterial hypertension and proteinuria require ophthalmological monitoring and investigation of the hemostasis system, including the determination of LA, for timely diagnosis and treatment of vascular complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.