Профилактика железодефицитных состояний у детей раннего возраста
- Аннотация
- Статья
- Ссылки
![Таблица 1. Физиологические потребности и рекомендуемые нормы потребления железа для детей первых двух лет жизни и беременных женщин [22]](/upload/resize_cache/iblock/aaa/195_350_1/friso1.jpg)
![Таблица 2. Содержание железа в продуктах животного происхождения [23]](/upload/resize_cache/iblock/a4d/195_350_1/friso2.jpg)
![Таблица 3. Содержание железа в растительных продуктах (мг/100 г) [23]](/upload/resize_cache/iblock/389/195_350_1/friso3.jpg)

Выраженность дефицита железа во многом определяется особенностями питания, возрастом, социально-экономическими факторами. В детской популяции наиболее уязвимыми группами по развитию ЖДС являются дети раннего возраста и подростки [1,2], и в нашей стране, по различным данным, у 6–40% детского населения регистрируется ЖДА [3,4,5]. Развитию ЖДС у детей способствуют несколько факторов. Во‑первых, это повышенная потребность организма в железе в периоды интенсивного роста: у детей в возрасте от 5 месяцев до 5 лет и подростков [1,3,6]. Во‑вторых, разнообразные алиментарные факторы – качественный или количественный дефицит микронутриентов, несбалансированный рацион, редуцированные диеты [7,8]. В‑третьих, это может быть повышенная потеря железа, к которой следует отнести диапедезную кровопотерю через кишечник у младенцев (при использовании на 1‑м году жизни цельного молока), менструальную кровопотерю у девушек, особенно в период становления генеративной функции (в первые 2–3 года после менархе), гемолиз и повышенное разрушение эритроцитов у юных спортсменов [6–12]. Длительный некомпенсируемый дефицит железа ведет к развитию ЖДА и сопровождается выраженными нарушениями различных функций и систем организма, последствия которых, несмотря на восстановление запасов железа, могут сохраняться в течение длительного времени и даже пожизненно. В связи с серьезными последствиями дефицита железа ВОЗ придает этой проблеме глобальное значение [1,2].
Хорошо известно, что железо является незаменимым элементом для жизнеобеспечения важнейших функций организма. Железо участвует в продуцировании и транспорте железосодержащих молекул (гемоглобин, миоглобин), поддержании прооксидантно-антиоксидантного баланса, полноценном функционировании железозависимых реакций, которые необходимы для продукции интерлейкинов, Т-киллеров, Т-супрессоров, металоферментов и др. Благодаря своей уникальной способности к быстрому окислению и восстановлению железо катализирует процессы транспорта электронов и окисление-восстановление органических субстратов [13]. В головном мозге железо содержится в составе ферментов‑оксидаз, которые поддерживают нормальное функционирование нейротрансмиттерных систем с участием дофамина, серотонина и гамма-аминомасляной кислоты (ГАМК). Дофамин, являясь основным нейротрансмиттером экстрапирамидной системы, поддерживает когнитивные и аффективные реакции, а серотонин- и ГАМК-эргические системы регулируют поведение, сон, двигательную активность, эмоциональный тонус и другие реакции. Очевидно, что ЖДС оказывают системное влияние на жизненно важные функции организма ребенка, особенно в периоды интенсивного роста и умственного развития. Дефицит железа у детей раннего возраста сопровождается задержкой психомоторного развития, запаздыванием предречевых и речевых навыков, нарушением координации движений, снижением когнитивных функций и умственных способностей [14].
Обоснованно считается, что конкретные профилактические меры способны предотвратить развитие ЖДС [1,2,15]. Тем не менее, предметом постоянных дискуссий являются вопросы коррекции ЖДС с помощью как обогащенных железом продуктов, так и разных ферропрепаратов (ФП). Разрабатываются наиболее оптимальные формы соединений железа для включения в состав молочных смесей и продуктов детского питания, обсуждаются схемы профилактики с использованием различных ФП [8,15,16].
Известно, что в организме доношенного новорожденного содержится 250–300 мг железа, что в пересчете на килограмм массы тела в несколько раз превышает его содержание у взрослого человека (3000–5000 мг). Это обусловлено депонированием железа в период внутриутробного развития и высокой концентрацией фетального гемоглобина (HbF) [17]. Накопление железа в организме плода происходит наиболее интенсивно после 28 недель гестации, поэтому недоношенные дети составляют группу риска по развитию ЖДС. Железо, содержащееся в организме каждого ребенка при рождении, составляет определенную константу в 70–75 мг/кг, и оно израсходуется к тому моменту, когда вес ребенка удвоится, т. е. к 4–6 месяцам [17]. До этого момента у детей, находящихся на грудном вскармливании, дефицит железа, как правило, не развивается, что объясняется уникальными свойствами женского молока: при относительно невысоком содержании в нем железа (0,2–0,4 мг/л) его абсорбция достигает 50–60%, чему в значительной мере способствует содержащийся в женском молоке лактоферрин [18–20]. После 6 мес. жизни потребность детей в железе увеличивается до 10 мг/сут, которые необходимы для гемоглобинообразования, депонирования в тканях, роста и пролиферации клеток [17,21]. Однако железа грудного молока хватает лишь для покрытия физиологических потерь, но недостаточно для поддержания положительного баланса железа.
Огромную роль в обеспечении младенцев железом играет питание беременной и кормящей женщины, так как только полноценная и сбалансированная по основным ингредиентам диета позволяет обеспечить организм ребенка этим эссенциальным микроэлементом. Существующие нормы потребления железа (табл. 1) в несколько раз превышают физиологические потребности, поскольку биодоступность железа из обычного рациона, как правило, не превышает 10%.
В этой связи большое значение среди профилактических мер принадлежит диетическим рекомендациям. Железо в продуктах питания присутствует в гемовой и негемовой формах. Источниками гемового железа являются продукты животного происхождения (мясо животных и птиц), негемового железа – растительные продукты (овощи, фрукты, злаки), а также молоко и рыба. Большая часть поступающего с пищей железа (около 90%) представлена негемовой формой (табл. 2 и 3).
Существенное влияние на всасывание негемового железа оказывают факторы, способные активировать или ингибировать его абсорбцию в кишечнике. Активаторами всасывания являются животный белок (мясо животных, птиц, рыбы), аскорбиновая, молочная и янтарная кислоты. Ингибируют абсорбцию железа такие компоненты, как соевый белок, кальций, фитаты, танины, пищевые волокна, полифенолы (бобы, орехи, чай, сыр и некоторые овощи). В конечном итоге, биодоступность железа из продуктов питания зависит от того, в какой форме представлено железо, и определяется как набором различных продуктов в рационе, так и их сочетанием при одновременном употреблении.
Кроме рационального питания беременных и кормящих женщин, профилактика ЖДС у детей первых месяцев жизни включает своевременное лечение ЖДА у матерей. Однако профилактическое назначение ФП беременным требует серьезного подхода, так как при концентрации Hb ниже 104 г/л возрастает частота преждевременных родов и рождения маловесных детей, но аналогичный риск возникает и при Hb свыше 132 г/л [24].
У детей первых месяцев жизни естественной профилактикой ЖДС считается исключительно грудное вскармливание до 4–6 мес. жизни. Однако в странах с низким экономическим развитием получены убедительные данные о высокой распространенности ЖДА и дефицита других микроэлементов среди детей, находящихся на грудном вскармливании, что связывают с высокой частотой ЖДС у кормящих женщин [2, 25, 26].
У грудных детей дефицит железа в 95% случаев связан с неправильным односторонним вскармливанием, поэтому решить эту проблему несложно. Так, высокий риск развития ЖДА существует у младенцев, получающих цельное коровье молоко, что связано с низким содержанием в нем железа (около 0,3 мг/л), его низкой биодоступностью, ингибирующим влиянием на абсорбцию железа кальция и белков коровьего молока, но главное – отсутствием в питании других источников железа [2,8,15]. Доказано, что значительная квота цельного коровьего молока или цельного кефира в диете восприимчивых младенцев может индуцировать диапедезные желудочно-кишечные кровотечения, способствовать хронической кровопотере и развитию ЖДА [10,27,28]. С возрастом подобная восприимчивость уменьшается и редко встречается после двух лет, поэтому детям первого года жизни не рекомендуется потребление цельного коровьего молока и неадаптированных смесей [9, 29, 30].
При искусственном вскармливании детей первого полугодия жизни используют смеси с содержанием железа от 0,4 до 0,8 мг/100 мл, что является вполне достаточным, т. к. еще используются антенатальные запасы железа. К 4–6 мес. запасы истощаются, и метаболизм железа становится абсолютно зависимым от его поступления с пищей. Поэтому содержание железа в «последующих» адаптированных молочных смесях (для детей старше 5–6 мес.) возрастает до 0,9–1,6 мг/100 мл (Фрисолак 2 Голд, ФризлендКампина, Голландия; Нутрилон 2, Нутриция, Голландия; НАН 2, Нестле, Швейцария и др.).
Детям старше 4–6 мес. рекомендуется вводить продукты прикорма промышленного производства, обогащенные железом (инстантные каши, фруктовые соки, фруктовые и овощные пюре), с помощью которых на 10–30% покрывается потребность ребенка в железе. При этом входящие в их состав другие нутриенты (аскорбиновая кислота, яблочная и лимонная кислоты) повышают биодоступность негемового железа, в то время как «обычные» продукты содержат ряд ингредиентов, снижающих абсорбцию железа. Помимо белка и кальция, к ним относятся пищевые волокна, которыми богаты крупы, некоторые свежие овощи и фрукты (свекла, морковь, яблоки). Пищевые волокна практически не перевариваются и не всасываются в кишечнике, но способны фиксировать железо на своей поверхности и выводить его с калом [9]. В состав этих продуктов входят фосфаты, фитаты и оксалаты, ингибирующие абсорбцию железа на уровне энтероцита.
Справедливо будет отметить, что за последние 30–40 лет потребление железа детьми в возрасте 5–6 месяцев заметно возросло: с 9,1 мг/сут (1960–70‑е гг.) до 16,0 мг/сут (с середины 1990‑х годов) [29,30]. Это связано с тем, что дети второго полугодия стали чаще получать вместо коровьего молока «последующие» молочные смеси, в которых содержание железа повышено. Отмечено, что обогащенные железом адаптированные смеси полностью обеспечивают потребности грудных детей в железе, минеральных веществах, витаминах, что способствовало снижению частоты ЖДС и ЖДА в странах Европы и США [1, 2, 29, 31].
На втором полугодии жизни вводят мясорастительные и рыборастительные пюре, которые служат источником наиболее ценного и высоко усвояемого гемового железа, что обеспечивает до 20–60% суточной потребности ребенка в железе и играет важную роль в профилактике ЖДС [32]. Гемовое железо, содержащееся в мясорыбных продуктах, улучшает абсорбцию железа из фруктов и овощей при их совместном употреблении.
Детям старше 6–8 мес. можно ввести специальную детскую колбаску с добавлением картофельного крахмала,* который не снижает абсорбцию железа. Цельное немодифицированное молоко (коровье, козье) следует вводить в рацион только после 12 мес. из-за опасности диапедезных кровотечений. Но при употреблении смесей, сделанных из сухого молока, такой опасности нет, поскольку в процессе обработки молочный белок изменяет свою структуру [9,10].
Исключение составляют дети из групп высокого риска, куда относятся недоношенные и маловесные дети, дети от многоплодной беременности, от матерей с гестационной ЖДА, из неблагополучного социума, дети, получающие неадаптированные молочные смеси. Медикаментозная профилактика ЖДС с использованием ФП проводится на протяжении первого года жизни, начиная с 2–3 мес. жизни ребенка.
Абсолютными противопоказаниями к назначению ФП являются:
- острые вирусные и бактериальные инфекционные заболевания,
- заболевания, сопровождающиеся кумуляцией железа (гемохроматоз, наследственные и аутоиммунные гемолитические анемии);
- заболевания, сопровождающиеся нарушением утилизации железа (сидеробластная анемия, α– и β–талассемия, анемия при отравлении свинцом); заболевания, сопровождающиеся костномозговой недостаточностью (апластическая анемия, анемия Фанкони, Блекфана-Даймонда и др.).
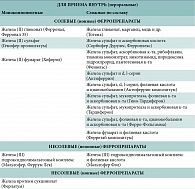
Выбор того или иного ФП для профилактики ЖДС (табл. 4) зависит от возраста ребенка, сопутствующей патологии, социального статуса семьи, лекарственной формы ФП (сироп, капли, раствор для приема внутрь). Важное значение имеет степень абсорбции железа из конкретного ФП. Так, уровень абсорбции достигает 15–30% у сульфатных солей железа и гидроксидполимальтозного комплекса трехвалентного железа (ГПК-Fe 3+), в то время как у других ФП (глюконат, сукцинилат, хлорид и др.) он не превышает 5–10% [3,8]. На сегодня не существует однозначного мнения, какие из ФП наиболее предпочтительны для профилактики – монокомпонентные или комбинированные. Парентеральные ФП не используют в целях профилактики дефицита железа.
У грудных детей, как правило, для профилактики ЖДС используют жидкие лекарственные формы ФП: это могут быть раствор или капли для приема внутрь (Актиферрин, Мальтофер, Феррум Лек, Тотема, Ферлатум), либо сироп (Актиферрин, Мальтофер, Феррум Лек). Как известно, энтеральный путь введения наиболее оправдан с физиологической точки зрения. К тому же маленьким детям удобно давать жидкие лекарственные формы, так как их можно добавить в питье или просто дать с ложечки.
Расчет дозы ФП производят по элементарному железу (мг) на 1 кг массы тела в сутки (мг/кг/сут), в зависимости от массы тела ребенка при рождении:
- при массе менее 1000 г – 4 мг/кг/сут,
- при массе 1000–1500 г – 3 мг/кг/сут,
- при массе 1500–3000 г – 2 мг/кг/сут.
В остальных случаях профилактическая доза ФП составляет 1 мг/кг/сут.
Здоровым доношенным детям, находящимся исключительно на грудном вскармливании, с 5–6‑месячного возраста до 1 года также можно рекомендовать назначение ФП из расчета 1 мг/кг/сут. Однако возможен и альтернативный путь, когда препарат железа назначают кормящей матери в дозе 1–2 мг/кг/сут (как правило, не более 100 мг/сут) в течение всего периода лактации.
При использовании оральных ФП редко могут наблюдаться побочные эффекты, связанные как с химическими свойствами солей железа, так и с повышенной чувствительностью к отдельным компонентам сложных ФП [33,34]. Проявлениями побочных эффектов могут быть металлический привкус во рту, потемнение зубов и десен, диспепсические расстройства из-за раздражения слизистой оболочки ЖКТ (тошнота, отрыжка, рвота, понос, запор), темное окрашивание стула, аллергические реакции (по типу крапивницы), некроз слизистой оболочки кишечника (наблюдается при передозировке или отравлении солевыми ФП).
Указанные нежелательные эффекты можно легко предупредить, если строго соблюдать правильный режим дозирования и прием ФП. Прежде всего это относится к солевым ФП, лечение которыми целесообразно начинать с ½–⅓ расчетной дозы, с постепенным достижением полной дозы в течение 7–10 дней. Принимать солевые ФП следует между приемами пищи (примерно через 1–2 ч. после, но не позже, чем за 1 ч. до еды), запивая небольшим количеством любого фруктового сока с мякотью. Не следует запивать солевые ФП чаем или молоком, т. к. они содержат компоненты, ингибирующие абсорбцию железа. Потемнения зубов и десен также можно избежать, если давать ФП в разведенном виде (можно развести фруктовым соком) или на кусочке сахара. Аллергические реакции обычно связаны с другими компонентами, входящими в состав сложных ФП. Некроз слизистой оболочки кишечника развивается в крайне редких случаях передозировки или отравления солевыми ФП. Темное окрашивание стула не имеет клинического значения, но об этом следует обязательно предупредить родителей ребенка, а для врача это самый простой и надежный способ контроля за приемом ФП.
При появлении нежелательных побочных эффектов следует снизить дозу ФП или заменить его другим. Важно также учитывать взаимодействие солевых ФП с пищевыми продуктами и другими лекарственными средствами (табл. 5).
ФП на основе ГПК-Fe3+ лишены указанных выше взаимодействий, их прием не лимитируется диетическими или режимными ограничениями, поэтому профилактику начинают сразу с расчетной дозы, что делает их более привлекательными с точки зрения удобства приема и безопасности, повышает комплаентность к терапии [8, 33, 34].
Таким образом, дефицит железа у детей раннего возраста можно предотвратить, зачастую для этого просто следует провести «ревизию» рациона ребенка и кормящей матери, помочь в выборе адаптированной смеси и продуктов прикорма. Особого внимания требуют дети высокого риска по развития ЖДС (недоношенные, маловесные, от многоплодной беременности, от матерей с анемией, из неблагоприятного социума и др.), которым необходимо проводить профилактику ЖДС с помощью эффективных и безопасных ферропрепаратов. Современные достижения в разработке адаптированных продуктов для детского рациона, а также результаты сравнительных исследований по эффективности и безопасности различных препаратов железа способствуют активному внедрению в практику детского здравоохранения приемлемых и действенных схем профилактики железодефицитных состояний у детей раннего возраста.
* Продукты производятся по специальной рецептуре на Воскресенском заводе детского питания (Россия).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.