Пролонгированное транстубарное интратимпанальное введение дексаметазона пациентам после стапедопластики с целью коррекции кохлеовестибулярных нарушений (сообщение 1)
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – рассмотреть влияние дексаметазона, вводимого интратимпанально в полость среднего уха в ранние послеоперационные сроки после стапедопластики, на вестибулярную и кохлеарную функции внутреннего уха и оценить эффективность применяемой методики пролонгированной доставки дексаметазона к структурам внутреннего уха посредством катетеризации слуховой трубы.
Цель исследования – рассмотреть влияние дексаметазона, вводимого интратимпанально в полость среднего уха в ранние послеоперационные сроки после стапедопластики, на вестибулярную и кохлеарную функции внутреннего уха и оценить эффективность применяемой методики пролонгированной доставки дексаметазона к структурам внутреннего уха посредством катетеризации слуховой трубы.


Введение
Отосклероз – прогрессирующее заболевание проводящего аппарата среднего уха, при котором наблюдается фиксация подножной пластины стремени в овальном окне за счет образующихся костных очагов, вследствие чего развивается потеря слуха.
По данным литературы, распространенность отосклероза среди населения земного шара составляет около 0,19–2,1%. Клинически выраженный отосклероз встречается в 0,1–1% случаев и завершается хирургическим лечением.
Отосклерозом заболевают преимущественно люди молодого и среднего возраста. Согласно отечественным источникам, максимальная заболеваемость приходится на возраст 25–36 лет, что бесспорно говорит о высокой социальной и экономической значимости заболевания.
Эффективным методом хирургического лечения отосклероза является стапедопластика. Несмотря на постоянное усовершенствование хирургического оснащения и рост количества пациентов с отосклерозом, получающих хирургическое лечение, тенденции к снижению осложнений в послеоперационном периоде не прослеживается.
Головокружение – одно из самых тяжелых осложнений в раннем послеоперационном периоде, значительно ухудшающих качество жизни больных. Вестибулярные нарушения, возникающие после стапедопластики, проявляются рядом периферических вестибулярных симптомов, в частности системным и позиционным головокружением, нарушением постуральной устойчивости, вегетативными реакциями.
В раннем послеоперационном периоде вестибулярная дисфункция возникает в 45–49% случаев [1], при видеоокулографическом исследовании обнаруживается в 49–52% случаев. Явные головокружения и нарушения равновесия регистрируются у 25% пациентов. В результате повторного вмешательства на стремени вестибулярные нарушения отмечаются у 64% пациентов [2].
Доказана достоверная прямая корреляция между выраженностью нарушения вестибулярной функции и повышением порогов звуковосприятия на высоких частотах [3]. Полная потеря слуха, по данным литературы, может наступить в 0,9–3,4% случаев в течение года после оперативного вмешательства.
Как известно, даже самое деликатное вмешательство в области подножной пластины стремени влечет за собой вестибулярную и кохлеарную реакцию. Причина – анатомическая близость хирургических манипуляций к структурам внутреннего уха. Расстояние от подножной пластины стремени до утрикулюса и саккулюса крайне невелико. Z.M. Wang в 2005 г. определил среднее расстояние от подножной пластины стремени до утрикулюса – 1,1 мм, до саккулюса – 1,67 мм [1]. По данным отечественных авторов, расстояние от подножной пластины стремени до мешочка составляет 0,75 мм, до маточки – 0,5 мм [4].
Имеются данные о мембранных соединениях между утрикулюсом и центральной, а также задней частью подножной пластины стремени (26% случаев), которые могут повреждаться при стапедопластике.
Гидродинамический удар, неизбежно наносимый на структуры внутреннего уха в ходе операции отохирургом в области овального окна, также влечет за собой кохлеарную и вестибулярную реакции.
Среди других причин возникновения вестибулярных нарушений в послеоперационном периоде выделяют перилимфатическую фистулу, репаративную гранулему, глубокое погружение протеза в преддверие лабиринта, отолитиаз, серозный лабиринтит.
Согласно гистологическим исследованиям височных костей пациентов, оперированных по поводу отосклероза (материал получен при аутопсии), имеют место следующие изменения: атрофия сосудистой полоски, дисбаланс ионного состава эндолимфы, спайки в области преддверия лабиринта, грануляции, признаки акустической травмы, возникающей вследствие работы микроинструментов в области подножной пластины стремени, попадания в лабиринт костных отломков, а также попадания во внутреннее ухо ферментов крови через перфоративное отверстие в овальном окне.
В ходе оперативного вмешательства, а также после него, по мнению J.B. Causse, происходит выброс протеолитических ферментов, повышается давление внутри лабиринта, нарушается кровоснабжение лабиринта, возникает реакция «антиген – антитело». Это негативно сказывается на вестибулярном аппарате.
На сегодняшний день вопрос вестибулярных и кохлеарных нарушений в результате неизбежной травматизации структур внутреннего уха во время операции на стремени остается нерешенным.
При развитии в послеоперационном периоде выраженных кохлеовестибулярных нарушений золотым стандартом в качестве первого фармакологического средства являются системные глюкокортикостероиды (ГКС). Однако, как показали многочисленные исследования, при системном применении ГКС в безопасных для организма дозах невозможно достичь высокой концентрации препарата в жидкостях внутреннего уха. Высокие дозы, необходимые для достижения хороших результатов лечения острых кохлеовестибулярных нарушений, могут негативно сказываться на организме. Возрастает риск развития побочных эффектов ГКС: язва желудка, катаракта, гипергликемия, недостаточность надпочечников и др. В группе риска находятся пациенты с сахарным диабетом, артериальной гипертензией. Им системное введение ГКС противопоказано.
В последнее время стали появляться сообщения об интратимпанальном введении ГКС. Впервые о таком способе доставки лекарственных препаратов к структурам внутреннего уха заговорили в 1956 г. Интратимпанальный способ введения препарата позволяет достигать более высоких доз в жидкостях внутреннего уха за счет диффузии через мембраны круглого и овального окон улитки [5]. В то же время исключаются побочные эффекты, наблюдаемые при системном применении высоких доз ГКС.
После стапедопластики препарат проникает к структурам внутреннего уха и через перфоративное отверстие в подножной пластине стремени. Можно предположить, что через перфоративное отверстие диффундирует во внутреннее ухо достаточное количество препарата.
В исследовании 2021 г. S.H. Jeong и соавт. доказали, что дексаметазон, нанесенный на полуповрежденную мембрану овального окна, через 30 минут достигает максимальной концентрации в жидкостях внутреннего уха. На протяжении еще 90 минут концентрация препарата остается на том же уровне. В случае неповрежденной мембраны достигаемая концентрация дексаметазона в жидкостях внутреннего уха в 2,5 раза ниже [6].
Дексаметазон, синтетически полученная фторированная форма природного гидрокортизона, относится к препаратам длительного действия (период полувыведения из плазмы 3–5 часов, период полувыведения из тканей 36–54 часа), применяется как системно, так и местно, оказывает противовоспалительное, противоаллергическое и иммуносупрессивное действие. ГК-рецепторы, посредством которых осуществляется действие ГКС, имеются почти во всех клетках организма человека, в частности во внутреннем ухе. В многочисленных исследованиях доказано, что ГКС улучшают кохлеарный кровоток, уменьшают или предотвращают кохлеарную ишемию [7], обеспечивают защиту улитки от катаболитов воспаления и цитокинов (интерлейкинов (ИЛ) 1 и 6) [8], предупреждают снижение слуха, вызванное шумовым воздействием, регулируют Nа/К-секрецию сосудистой полоской, что обеспечивает постоянство внутриулиткового давления, регулируют синтез белка во внутреннем ухе. Установлена способность ГКС модифицировать и прерывать воспалительный каскад, приводящий к гибели сенсорных клеток. Экспериментально доказан ингибирующий эффект ГКС на рост отосклеротической ткани за счет уменьшения активности ИЛ-6 и соответственно замедления процесса воспаления [9, 10].
Перечисленные доводы обусловливают выбор препарата для коррекции вестибулярной и кохлеарной дисфункций у пациентов после стапедопластики в раннем послеоперационном периоде. Открытым остается вопрос обеспечения доставки лекарственного препарата к внутреннему уху.
К настоящему моменту разработано множество способов доставки препаратов во внутреннее ухо. К известным и успешно применяемым способам относятся:
- введение лекарственных средств в полость среднего уха через слуховую трубу классическим металлическим катетером;
- интратимпанальное введение через шунт;
- меатотимпанальное шунтирование барабанной полости [11];
- введение препарата с помощью специального микрокатетера – Silverstone MicroWick;
- доставка препарата к мембране круглого окна через искусственно созданный канал под барабанной перепонкой – IntraEar Round Window μ-CathTM и E-CathTM;
- пролонгированное дренирование слуховой трубы;
- интратимпанальное введение лекарственного препарата путем тимпанопункции;
- введение препарата с наложением перфорации в барабанной перепонке СО2-лазером, радиоволновым аппаратом [12].
Известно о применении препаратов с замедленным высвобождением лекарственного вещества в течение определенного периода времени, к которым относятся липосомы, биоразлагаемые микросферы, полимерные конъюгаты и гели [13]. Разрабатываются способы внутрилабиринтной доставки вещества через круглое окно, полукружные каналы, костную капсулу лабиринта и эндолимфатический мешок [14]. Применяется неинвазивный способ трансмембранного транспорта лекарственного препарата во внутреннее ухо путем воздействия электрического поля, оказывающего электропоративный и ионофоретический эффекты. Встречаются сообщения об ускоренной диффузии лекарственного препарата с помощью специальных веществ-носителей и его последующего фагоцитоза [15].
Сообщается об успешном интратимпанальном применении ГКС при болезни Меньера, острой сенсоневральной тугоухости, субъективном ушном шуме [16–20].
Имеются единичные работы, посвященные изучению действия дексаметазона, введенного пациентам интратимпанально в послеоперационном периоде после стапедопластики. В работах указаны способы, обеспечивающие доставку ГКС к структурам внутреннего уха и пролонгацию действия препарата в барабанной полости: с помощью шунта, интраоперационно установленного в барабанную перепонку, посредством меатотимпанального шунтирования [11]. Существует способ пролонгации действия лекарственного препарата, введенного в барабанную полость интратимпанально после стапедопластики перед возвращением меатотимпанального лоскута, за счет укладывания в область круглого и овального окон кусочков гемостатической коллагеновой губки, смоченных в растворе дексаметазона [21].
Способы решения проблемы кохлеовестибулярных расстройств в раннем послеоперационном периоде посредством интратимпанального введения ГКС после стапедопластики недостаточно изучены. Остается открытым и вопрос поиска безопасного и щадящего способа доставки препарата к структурам внутреннего уха после стапедопластики, который не нарушал бы целостность анатомических структур и процесс заживления меатотимпанального лоскута.
Цели исследования – оценить эффективность метода пролонгированной катетеризации слуховой трубы с последующим введением интратимпанально дексаметазона в ранние послеоперационные сроки после стапедопластики в отношении вестибулярной и кохлеарной функций и провести сравнительный анализ кохлеарной и вестибулярной функций в раннем послеоперационном периоде в двух группах пациентов, которым выполнялась стапедопластика с применением СО2-лазера. Пациенты первой группы в послеоперационном периоде получали дексаметазон (4 мг/мл) внутривенно по нисходящей схеме (12, 8, 8, 4, 0, 4 мг), пациенты второй – дексаметазон 4 мг/мл интратимпанально в объеме 1 мл два раза в сутки на протяжении четырех дней. Пролонгированная интратимпанальная доставка дексаметазона к структурам внутреннего уха пациентам данной группы осуществлялась с помощью микрокатетера, установленного в слуховой трубе.
Материал и методы
Нами была исследована группа из 41 пациента (17 мужчин и 24 женщины), средний возраст которых составил 39 [34–47,5] лет. Все пациенты находились на лечении в клинике оториноларингологии Военно-медицинской академии им. Кирова и во взрослом хирургическом отделении Санкт-Петербургского научно-исследовательского института уха, горла, носа и речи по поводу отосклероза. У 77% пациентов выявлено двустороннее поражение отосклерозом. В 100% случаев стапедопластика выполнялась с применением СО2-лазера под эндотрахеальным наркозом. Пациенты первой группы (60%) в послеоперационном периоде получали дексаметазон системно по нисходящей схеме, у пациентов второй группы (40%) стапедопластика была дополнена пролонгированной катетеризацией слуховой трубы с последующим введением дексаметазона интратимпанально в течение четырех суток после операции.
Мы применяли собственный способ катетеризации слуховой трубы (патент на изобретение № 2783256), предусматривающий пролонгированную доставку дексаметазона к структурам внутреннего уха после стапедопластики. Преимуществом топического введения дексаметазона является отсутствие нарушения целостности анатомических структур, рисков негативного влияния на функцию внутреннего и среднего уха. Данный способ введения дексаметазона не нарушает нормального процесса приживления меатотимпанального лоскута. Используемый нами способ пролонгированной доставки лекарственного средства к структурам внутреннего уха после стапедопластики считается наиболее щадящим из всех известных на сегодняшний день.
Пациентам обеих групп выполнялось полное обследование, включавшее стандартный спектр предоперационной подготовки: сбор жалоб, анамнеза жизни и заболевания, лабораторные исследования (клинический и биохимический анализы крови, общий анализ мочи), осмотр врачом-терапевтом. Проводились классический осмотр лор-органов, отомикроскопия. Всем больным выполнена компьютерная томография височных костей и околоносовых пазух. Оценка функции слуха включала исследование шепотной и разговорной речи, проведение камертональных проб, тональную пороговую аудиометрию по костной и воздушной проводимости, импедансометрию (тимпанометрию). Вентиляционную функцию слуховой трубы анализировали с помощью простых качественных проб (исследование при обычном глотании, опыт Тойнби, опыт Вальсальвы).
О состоянии вестибулярного аппарата судили по результатам компьютерной видеонистагмографии и компьютерной стабилометрии с биологической обратной связью на стабилоанализаторе «Стабилан–01–2» с программным обеспечением StabMed 2.7.
Функция равновесия, являющаяся объектом исследования стабилометрии, находится под влиянием множества систем, в частности вестибулярной, зрительной, проприоцептивной. В качестве диагностической методики мы использовали тест Ромберга, который состоит из пробы с открытыми глазами и пробы с закрытыми глазами длительностью 60 секунд каждая. Пациент встает на стабилоплатформу с расположенными вдоль туловища руками, пятки вместе, носки врозь («европейский» вариант постановки стоп на платформе). Показатели регистрируются после проведения теста.
Ухудшение качества функции равновесия (КФР) при закрытых глазах по сравнению с КФР при открытых глазах свидетельствует о вестибулярной дисфункции. Это объясняется тем, что при выключении зрительной системы вестибулярная дисфункция проявляется гораздо сильнее. Средняя скорость перемещения центра давления также позволяет на основании изменения скорости проанализировать нарушение вестибулярной системы (чем выше скорость смещения центра давления, тем более выражено повреждение вестибулярной системы, и наоборот, чем меньше скорость, тем система более сохранна).
Состояние вестибулярного анализатора оценивали до операции, на вторые и седьмые сутки после операции. Выполнялись компьютерная стабилометрия и компьютерная видеонистагмография. Тональная пороговая аудиометрия по воздушной и костной проводимости осуществлялась до оперативного лечения и на седьмые сутки после операции (после удаления тампонов из прооперированного уха).
Критериями включения пациентов в исследование были кондуктивное или смешанное снижение слуха, тимпанограммы типа А или Аs, отсутствие стапедиальных рефлексов, отсутствие патологии со стороны носа и околоносовых пазух, а также верхних дыхательных путей.
Критерии исключения: повторная ревизионная операция на ухе, наличие патологии со стороны носа, околоносовых пазух и верхних дыхательных путей.
Всем пациентам выполнялась стапедопластика, 40% пациентов проведена катетеризация слуховой трубы на операционном столе непосредственно перед началом операции.
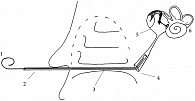
Катетеризация слуховой трубы проводилась следующим образом. Под эндовидеоконтролем эндоскопами 00 после предварительной анемизации слизистой оболочки полости носа по общему носовому ходу вдоль нижней носовой раковины продвигали кончик микрокатетера (использовался силиконовый микрокатетер с наружным диаметром 1,05 мм и внутренним диаметром 0,6 мм) с установленным в него проводником из специализированной металлической проволоки (длина проводника – 25 см, диаметр – 0,5 мм, кончик изгибали вручную в зависимости от анатомического расположения глоточного устья слуховой трубы на 30–90°) (рис. 1).
Визуализировали устье слуховой трубы, куда устанавливали микрокатетер, при попадании в слуховую трубу ощущался характерный «провал». Микрокатетер устанавливали в трубу на 2,5–3,0 см. После этого из него аккуратно удаляли проводник. Свободный конец микрокатетера крепили лейкопластырем на спинке носа пациента (рис. 2).
В течение первых суток после операции пациенты соблюдали строгий постельный режим. По истечении этого периода режим расширялся до общего.
Пациентам на протяжении четырех суток после операции два раза в сутки в барабанную полость по микрокатетеру вводили раствор дексаметазона 4 мг/мл в объеме 1 мл (рис. 3).
Субъективно пациенты ощущали чувство распирания в прооперированном ухе, пощелкивание и потрескивание, что подтверждало попадание лекарства в среднее ухо.
Введение дексаметазона по микрокатетеру осуществлялось в положении пациента лежа на спине, с валиком под плечами, повернутой головой на 45° в сторону здорового уха. В течение 30 минут после введения дексаметазона пациентам запрещалось разговаривать. Необходимо было также минимизировать глотательные движения. Подобные мероприятия сокращают возможность сглатывания и обратного стекания дексаметазона через слуховую трубу в носоглотку, способствует тому, чтобы максимальное количество введенного дексаметазона оказало действие в области перфорированной мембраны овального окна и целой мембраны круглого окна. Время нахождения пациента в таком положении составляло 30 минут. На четвертые сутки после операции микрокатетер удаляли.
Следует отметить, что несомненными преимуществами данного метода являются его атравматичность для окружающих тканей, отсутствие нарушения естественных барьеров, высоких экономических затрат. Кроме, того, установка катетера не вызывает затруднений.
Все статистические анализы проводились с помощью коммерчески доступного программного обеспечения (IBM SPSS Statistics для Windows, v. 26, IBM Corp., Армонк, штат Нью-Йорк, США). Распределение переменных проверяли с использованием критерия Шапиро – Уилка в каждой группе. Числовые переменные показали ненормальное распределение. В отсутствие нормального распределения количественные данные описывали с помощью медианы (Ме) и нижнего и верхнего квартилей [Q1–Q3]. Для сравнения трех и более связанных выборок применяли критерий Фридмана (Friedman Test).
Результаты и обсуждение
Костно-воздушный интервал (КВИ) во второй группе статистически значимо уменьшился на 23 дБ и на седьмые сутки после операции составил 12 [8,5–24,0] дБ (p = 0,008). В то же время в первой группе КВИ статистически значимо уменьшился только на 12 дБ и на седьмые сутки после операции составил 15,5 [7,7–19,5] дБ (p = 0,002).
Звукопроведение по воздуху статистически значимо возросло на 21 дБ во второй группе (p = 0,008).
У пациентов второй группы зафиксировано статистически значимое увеличение средней скорости перемещения центра давления на вторые сутки после операции на 0,3 мм/с по сравнению с исходным значением (p = 0,046), а к седьмым суткам его снижение на 1,8 мм/с (p = 0,012). В первой группе статистически значимых изменений данного показателя обнаружить не удалось.
Во второй группе зарегистрировано статистически значимое увеличение КФР на вторые сутки на 2% по сравнению с предоперационными данными (p = 0,004) с последующим сокращением к седьмым суткам на 3,6% (p = 0,002). В первой группе на вторые сутки после операции установлено статистически значимое увеличение КФР на 6,3% (p = 0,014) и его снижение к седьмым суткам на 5,7% (p = 0,001). Это говорит о достижении полной компенсации вестибулярной функции и нормализации постуральной устойчивости к седьмым суткам у пациентов второй группы и сохранении к этому времени вестибулярных нарушений у пациентов первой группы. Полученные данные говорят также о том, что у пациентов второй группы на фоне интратимпанального введения дексаметазона ко вторым суткам функциональные результаты (меньшее нарушение вестибулярной функции) были лучше, чем у пациентов второй группы.
По данным компьютерной видеонистагмографии, зафиксированы статистически значимое увеличение средней скорости медленной фазы нистагма (срСМФ) от исходного значения (в обеих группах – 0,0°/с) ко вторым суткам после операции во второй группе на 1,5°/с (p = 0,004) и снижение до 0,85°/с к седьмым суткам (p = 0,002). В первой группе на вторые сутки после операции зарегистрированы статистически значимое увеличение срСМФ до 2,2°/с (p = 0,002) и снижение лишь до 1,95°/с к седьмым суткам (p = 0,008). Это свидетельствует о том, что на фоне интратимпанально вводимого дексаметазона у пациентов второй группы асимметрия по лабиринтам ко вторым суткам после операции увеличилась и была менее выраженной, чем в первой группе. На седьмые сутки у пациентов второй группы этот показатель фактически вернулся к исходному уровню, в то время как у пациентов первой группы возбуждение лабиринта оставалось практически на прежнем уровне.
Сравнительный анализ среди пациентов обеих групп показал лучшие результаты кохлеарной и вестибулярной функций у пациентов, которым стапедопластика выполнялась с применением СО2-лазера и была дополнена пролонгированной катетеризацией слуховой трубы с последующим интратимпанальным введением дексаметазона в полость среднего уха в течение четырех суток после операции. Это говорит о положительном влиянии дексаметазона, вводимого интратимпанально в ранние сроки после оперативного лечения, на снижение возбуждения вестибулярного аппарата.
Выводы
Результаты проведенного исследования подтверждают эффективность интратимпанального применения дексаметазона в раннем послеоперационном периоде у пациентов после стапедопластики. Подобная методика может применяться в качестве профилактики возникновения нежелательных кохлеовестибулярных осложнений. В качестве безопасного и физиологичного метода интратимпанального введения дексаметазона может рассматриваться пролонгированная катетеризация устья слуховой трубы.
Полученные данные свидетельствуют о том, что стапедопластика с применением СО2-лазера, дополненная пролонгированным введением дексаметазона в полость среднего уха посредством микрокатетера в раннем послеоперационном периоде, позволяет достичь лучших результатов (по сравнению с контрольной группой). Такой метод наиболее щадящий, а значит, наиболее предпочтительный в отношении кохлеарной и вестибулярной функций.
Введение дексаметазона в раннем послеоперационном периоде способствует более быстрому восстановлению раздраженного лабиринта на стороне операции, снижает риск его угнетения, а также оказывает положительный эффект на сокращение КВИ сразу после удаления тампонов. Согласно полученным данным, стапедопластика с установкой микрокатетера дает лучшие функциональные результаты, позволяет быстрее достигать компенсаторного восстановления вестибулярной системы, улучшает и стабилизирует слуховые показатели, что в конечном итоге приводит к повышению качества жизни пациента.
Используемый нами способ катетеризации слуховой трубы с целью обеспечения пролонгированной доставки дексаметазона к структурам внутреннего уха после стапедопластики не нарушает целостность анатомических структур, не несет на себе риска негативного влияния на функцию внутреннего и среднего уха, не препятствует физиологичному процессу приживления меатотимпанального лоскута. Метод прост в выполнении, не требует больших экономических затрат и может быть рекомендован пациентам с отосклерозом после стапедопластики для коррекции и предупреждения возникновения кохлеовестибулярных осложнений.
M.L. Blinova, A.Ye. Golovanov, PhD, V.S. Isachenko, PhD, I.A. Anikin, PhD, Prof., S.V. Astashchenko, PhD, V.V. Dvoryanchikov, PhD, Prof.
Saint-Petersburg Research Institute of Ear, Throat, Nose and Speech
Kirov Military Medical Academy
Contact person: Marina L. Blinova, m.blinova@niilor.ru
Recently, there has been an increasing interest in solving problems associated with the occurrence of vestibular and cochlear dysfunction in the early postoperative period in patients after stapedoplasty. Vestibular dysfunction occurs in 45–49% of cases in early postoperative periods, in 25% of cases it is accompanied by dizziness and impaired postural stability. The risks of developing deafness were recorded in 0.9–3.4% of cases, which may occur within a year after surgical treatment.
The aim of the study is to examine the effect of dexamethasone administered intratympanally into the middle ear cavity in early postoperative periods to patients after stapedoplasty on the vestibular and cochlear functions of the inner ear and to evaluate the effectiveness of the technique of prolonged delivery of dexamethasone to the structures of the inner ear by catheterization of the auditory tube.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


