Развитие гиперкалиемии у коморбидной пациентки на фоне бесконтрольного совместного применения блокаторов ренин-ангиотензиновой системы и антагонистов минералокортикоидных рецепторов
- Аннотация
- Статья
- Ссылки
- English

![Таблица 2. Алгоритм назначения БРАС [8]](/upload/resize_cache/iblock/b37/195_350_1/Fomina5.jpg)
![Таблица 3. Алгоритм назначения АМКР [8]](/upload/resize_cache/iblock/583/195_350_1/Fomina6.jpg)
Введение
При уровне калия свыше 6,5 ммоль/л и/или наличии характерных электрокардиографических (ЭКГ) признаков гиперкалиемии возникает угроза жизни [1]. Причины развития подобного электролитного нарушения разнообразны. Их выявление и коррекция должны проводиться незамедлительно. Особого внимания требуют коморбидные пациенты с хронической сердечной недостаточностью (ХСН) в сочетании с сахарным диабетом (СД) и хронической болезнью почек (ХБП). Пациенты с ХСН нуждаются в постоянном приеме блокаторов ренин-ангиотензиновой системы (БРАС) и антагонистов минералокортикоидных рецепторов (АМКР), имеющих доказанную прогностическую значимость. Однако следует помнить, что на фоне применения БРАС и АМКР может возникнуть гиперкалиемия. Кроме того, необходим регулярный контроль уровней креатинина и электролитов крови [2].
Одним из доступных методов диагностики тяжелой гиперкалиемии является ЭКГ [3]. В реальной клинической практике при оценке ЭКГ-изменений нередко ошибочно устанавливают альтернативные диагнозы, что приводит к отсрочке назначения терапии, направленной на снижение уровня внеклеточного калия [4].
В представленном клиническом случае идиовентрикулярный ритм на ЭКГ в сочетании с нестабильностью гемодинамики в отсутствие типичной ангинозной боли был ошибочно интерпретирован как острый коронарный синдром (ОКС). Однако при дополнительном обследовании у пациентки была выявлена тяжелая коморбидная патология, послужившая основной причиной развития гиперкалиемии с вышеописанными ЭКГ-изменениями на фоне приема БРАС и АМКР. Своевременная терапия, направленная на снижение уровня калия крови, способствовала стабилизации гемодинамических показателей и нормализации ЭКГ. Однако последующий бесконтрольный совместный прием БРАС и АМКР на амбулаторном этапе, вероятно, привел к развитию гиперкалиемии и неблагоприятному исходу.
Клинический случай
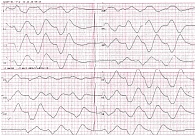
Пациентка Ф. 82 лет поступила в приемное отделение кардиологического диспансера 2 декабря 2020 г. с жалобами на слабость, интенсивную боль в руках, ногах, невозможность самостоятельно совершать активные движения. Ангинозная боль, одышка не беспокоили. В анамнезе ишемическая болезнь сердца, ХСН, последние пять лет – артериальная гипертензия, СД 2-го типа (на инсулине). Пациентка регулярно принимала лозартан, спиронолактон (дозы лекарственных препаратов уточнить не смогла). Настоящее ухудшение отметила 29 ноября 2022 г., когда появились указанные выше жалобы. Бригадой скорой медицинской помощи была зафиксирована выраженная гипотония: артериальное давление 70/40 мм рт. ст. Первичная ЭКГ: ритм с широкими комплексами QRS (рис. 1), что впоследствии было расценено как замещающий ритм на фоне электролитных нарушений. Пациентку госпитализировали с диагнозом: ОКС. Кардиогенный шок. На догоспитальном этапе начата тройная антитромботическая терапия в нагрузочных дозах, введен Мезатон. С учетом данных ЭКГ, нестабильности гемодинамических показателей пациентку разместили в палате реанимации и интенсивной терапии инфарктного отделения.
Первичный медицинский осмотр: состояние тяжелое. Сознание ясное. Кожные покровы бледные, прохладные на ощупь. Показатели артериального давления без поддержки вазопрессорами 115/60 мм рт. ст. Тоны сердца приглушены, ритм неправильный, частота сердечных сокращений – 72 удара в минуту. Данных об острой правожелудочковой и левожелудочковой недостаточности не получено. Однако степень насыщения крови кислородом ниже нормы (89%). Живот мягкий, безболезненный. Отеков нет.
Установлен предварительный диагноз: ОКС(?). Гипертоническая болезнь 3-й степени. СД 2-го типа (на инсулине). Ожирение 2-й степени. Риск IV.
С учетом тяжести состояния и неуточненного диагноза в неотложном порядке был проведен диагностический поиск.
В результатах лабораторных исследований – выраженная гиперкалиемия. Показатели биомаркеров некроза миокарда – в пределах референсных значений. В общем анализе крови – лейкоцитоз (14,0 × 109/л), в биохимическом анализе крови – повышение уровней креатинина, мочевины, а также гипергликемия. По другим показателям отклонений от нормальных значений не выявлено. Результаты лабораторных методов исследования представлены в табл. 1.
В общем анализе мочи (лейкоциты – 6–8 в поле зрения, эритроциты – 15–17 в поле зрения) и анализе мочи по Нечипоренко (лейкоциты – 8,0 × 106/л, эритроциты сплошь) – гематурия и лейкоцитурия.
Обращали на себя внимание результаты инструментальных исследований. Так, отмечалась динамика ЭКГ: при поступлении (2 декабря) регистрировался идиовентрикулярный ритм с периодами асистолии, затем (3 декабря) восстановился синусовый ритм. Возможны рубцовые изменения по нижней стенке левого желудочка. В дальнейшем – без динамики.
Результаты эхокардиографии: сохраненная фракция выброса левого желудочка (63%), зоны нарушения локальной сократимости сердца не выявлены. При измерении объемных параметров камер сердца отклонений от нормальных значений не выявлено. Однако имел место клапанный аортальный стеноз с систолическим градиентом давления 56 мм рт. ст.
Из-за отсутствия данных об ОКС и наличия гиперкалиемии, которая в данном случае обусловливала тяжесть состояния пациентки, лозартан и спиронолактон были отменены. Начата медикаментозная терапия, направленная на восстановление электролитного состава крови: внутривенное струйное введение кальция хлорида 10% 3,0 мл, кальция глюконата 10,0 мл два раза в день, внутривенное струйное введение фуросемида 20 мг, внутривенное капельное введение натрия хлорида 0,9%. Для снижения гипергликемии назначили инсулин короткой и средней продолжительности действия с дальнейшим подбором дозы в зависимости от уровня гликемии. С учетом лейкоцитурии назначили антибактериальную терапию: цефтриаксон 1 г один раз в день внутримышечно. Внутрь: ацетилсалициловая кислота, аторвастатин, бисопролол, гликлазид. Уровень натрия, корригированный относительно уровня гипергликемии, находился в пределах референсных значений. Коррекции его показателей не требовалось.
С целью контроля сердечного ритма и проводимости 15 декабря проведено холтеровское мониторирование ЭКГ продолжительностью 25 часов 23 минуты. За время наблюдения зафиксированы синусовый ритм, эпизоды синусовой аритмии, частота сердечных сокращений 70 (63–86) ударов в минуту. Зарегистрированы 52 желудочковые экстрасистолы, 60 наджелудочковых экстрасистол, в том числе предсердные и с аберрантным проведением, один эпизод бигеминии, одна пробежка наджелудочковой тахикардии.
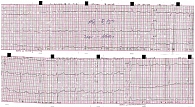
На фоне терапии по мере снижения гиперкалиемии боль в руках и ногах не беспокоила, появилась возможность активного движения. Однако за время госпитализации сохранялись жалобы на слабость и вялость, которые регрессировали к концу госпитализации. Отмечалась стабильная гемодинамика. 21 декабря пациентка была выписана в удовлетворительном состоянии с рекомендациями дальнейшего приема ацетилсалициловой кислоты, аторвастатина, бисопролола, торасемида, а также подкожных инъекций инсулина средней и короткой продолжительности действия. На ЭКГ при выписке – синусовый ритм (рис. 2).
В дальнейшем в поликлинике по месту жительства терапевт рекомендовал пациентке возобновить прием АМКР и БРАС (спиронолактон и лозартан) в отсутствие дальнейшего контроля уровня электролитов крови.
Пациентка 10 июня 2022 г. была повторно госпитализирована в кардиологическое отделение с жалобами на выраженную слабость, онемение верхних и нижних конечностей, головокружение.
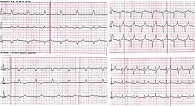
На первичной ЭКГ был зарегистрирован синусовый ритм. Блокада передней ветви левой ножки пучка Гиса. Удлинение интервала PQ. Высокий зубец Т (рис. 3). Эхокардиография отрицательной динамики не показала.
В анализах крови – выраженные электролитные нарушения: гиперкалиемия (8,38 ммоль/л), гипонатриемия (127,1 ммоль/л), натрий, корригированный относительно уровня гипергликемии, 133,3 ммоль/л [5], гипомагниемия (0,53 ммоль/л), гипергликемия (19,9 ммоль/л), повышение уровней мочевины (30,1 ммоль/л) и креатинина (305,9 мкмоль/л). Несмотря на терапию, направленную на снижение уровня калия в сыворотке крови (внутривенное введение фуросемида до 60 мг в сутки, кальция хлорида 20,0 мл два раза в день), гипергликемии (инсулинотерапия), 16 июня у пациентки случилась остановка сердечной и дыхательной деятельности. Реанимационные мероприятия по восстановлению жизненно важных функций организма эффекта не дали. Констатирована смерть.
Заключительный клинический диагноз:
основное заболевание: кальцинированный клапанный стеноз устья аорты (систолический градиент давления 56 мм рт. ст.). Ишемическая болезнь сердца: стенокардия напряжения II функционального класса. Гипертоническая болезнь 3-й степени. СД 2-го типа (на инсулине). Целевой HbA1c ≤ 8,5%. Ожирение 2-й степени. Риск IV;
осложнения основного заболевания: асистолия (16 июня 2022 г.). Гиперкалиемия. ХСН IIА стадии с сохраненной фракцией выброса (63%), функциональный класс III. ХБП С4 (скорость клубочковой фильтрации (СКФ) 20 мл/мин/1,73 м2). Политопная экстрасистолия. Пробежка наджелудочковой тахикардии (15 декабря 2020 г.);
сопутствующее: хронический пиелонефрит.
Обсуждение
В настоящее время врачи амбулаторного звена имеют широкие терапевтические возможности по улучшению прогноза при лечении пациентов с ХСН с использованием современных лекарственных препаратов [6]. Однако особое внимание следует уделять вопросам не только эффективности фармакотерапии, но и безопасности. Необходим постоянный мониторинг лабораторных показателей у пациентов с ХСН в сочетании с СД и ХБП, одновременно принимающих БРАС и АМКР. У таких пациентов возможны ухудшение функции почек и развитие гиперкалиемии.
После оценки уровней креатинина и калия крови лечение начинают с минимальных доз БРАС и АМКР, постепенно титруя дозы до целевых или максимально переносимых, в соответствии с регламентированным алгоритмом (табл. 2 и 3). Для БРАС увеличение дозы при необходимости осуществляется не ранее чем через две недели после начала терапии с контролем уровня креатинина и калия крови через одну-две недели и последующим изменением дозы в дальнейшем один раз в четыре месяца. При необходимости доза АМКР увеличивается через 4–8 недель с контролем уровней калия и креатинина через одну и четыре недели после начала терапии или изменения дозы. В дальнейшем тщательный контроль показателей функции почек и электролитного состава крови осуществляется на 8-й и 12-й неделях, через 6, 9 и 12 недель, далее каждые шесть месяцев [7] с целью своевременной коррекции терапии и предотвращения неблагоприятного прогноза.
Необходимо отметить, что в данном клиническом случае неизвестны дозы принимавшихся лекарственных препаратов, особенности их титрации и исходная СКФ, при которой была начата терапия. В связи с этим однозначно утверждать о нарушениях рекомендаций по старту терапии БРАС и АМКР невозможно.
Не следует также забывать о роли бета-адреноблокаторов в развитии гиперкалиемии. Неселективные бета-адреноблокаторы могут быть причиной гиперкалиемии, а селективные – вызывать и усугублять ее на фоне применения БРАС и АМКР, особенно у пациентов с ХБП. Сниженная СКФ способствует поддержанию более высокой концентрации бета-адреноблокаторов в крови пациента в течение длительного периода времени, тем самым приводя к развитию брадикардии, на фоне которой снижается почечный кровоток и усугубляется течение ХБП. Совместное применение БРАС и АМКР усиливает скорость прогрессирования ХБП и способствует развитию выраженной гиперкалиемии. Последняя в свою очередь также приводит к брадикардии. Таким образом, формируется порочный круг и у отдельных пациентов развивается BRASH-синдром (Bradycardia, Renal failure, AV blockade, Shock, and Hyperkalemia – брадикардия, почечная недостаточность, AV-блокада, шок и гиперкалиемия) [8, 9].
В данном клиническом случае имела место «многоликость» ЭКГ-критериев гиперкалиемии, что в совокупности с неспецифичными клиническими проявлениями затруднило своевременную диагностику жизнеугрожающего состояния.
Заключение
Цель описания данного клинического случая – предостеречь практикующих врачей об опасности назначения БРАС и АМКР при ХСН у пациентов с выраженным нарушением функции почек в отсутствие регулярного мониторинга уровней электролитов крови и креатинина. Важно помнить, что при регистрации высоких, заостренных с узким основанием зубцов Т, нарушений ритма и проводимости на ЭКГ необходимо безотлагательно провести лабораторное исследование и определить уровень калия крови.
Информированное согласие. От родственников пациентки получено письменное добровольное информированное согласие на публикацию клинического случая (10 мая 2023 г.).
Отношения и деятельность. Авторы заявляют об отсутствии потенциального конфликта интересов.
О.А. Fomina, PhD, K.G. Pereverzeva, PhD
Ryazan Regional Clinical Cardiology Dispensary
Ryazan State Medical University
Contact person: Olga A. Fomina, ol.an.fomina@gmail.com
Blockers of the renin-angiotensin system (BRAS) and antagonists of mineralocorticoid receptors (AMCR) have a large evidence base confirming their ability to improve the long-term prognosis in patients with chronic heart failure. Because of this, the frequency of prescribing these drugs has increased. However, the use of BRAS and AMCR by comorbid patients with chronic kidney disease without regular monitoring of serum creatinine and potassium levels can lead to life-threatening hyperkalemia. The presented clinical case illustrates the development of severe hyperkalemia against the background of decompensation of diabetes mellitus, chronic kidney disease and regular intake of BRAS and AMCR.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.