Результаты сравнительного контролируемого исследования безопасности и эффективности уратснижающего действия препарата Ураликс® у пациентов с уратными формами мочекаменной болезни
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить эффективность и безопасность комплекса Ураликс® в терапии уратного нефролитиаза.
Материал и методы. В исследование было включено 120 пациентов с диагнозом «уратный уролитиаз». Все пациенты были рандомизированы в три группы. Пациенты основной группы (n = 59) получали препарат Ураликс® по одной капсуле (300 мг) один раз в день в течение 90 дней и диетические рекомендации. Пациенты контрольной группы (n = 28) получали 200 мг аллопуринола один раз в день в течение 90 дней. Пациенты дополнительной контрольной группы (n = 33) получали диетические рекомендации по сокращению потребления продуктов, богатых пуринами. В качестве критериев эффективности до и после лечения анализировали динамику уровня мочевой кислоты в крови, суточную экскрецию мочевой кислоты с мочой.
Заключение. Препарат Ураликс®, снижая активность ксантиноксидазы, оказывает патогенетический эффект у пациентов с уратным нефролитиазом и может быть рекомендован как в виде монотерапии, так и в сочетании с другими методами лечения.
Цель исследования – оценить эффективность и безопасность комплекса Ураликс® в терапии уратного нефролитиаза.
Материал и методы. В исследование было включено 120 пациентов с диагнозом «уратный уролитиаз». Все пациенты были рандомизированы в три группы. Пациенты основной группы (n = 59) получали препарат Ураликс® по одной капсуле (300 мг) один раз в день в течение 90 дней и диетические рекомендации. Пациенты контрольной группы (n = 28) получали 200 мг аллопуринола один раз в день в течение 90 дней. Пациенты дополнительной контрольной группы (n = 33) получали диетические рекомендации по сокращению потребления продуктов, богатых пуринами. В качестве критериев эффективности до и после лечения анализировали динамику уровня мочевой кислоты в крови, суточную экскрецию мочевой кислоты с мочой.
Заключение. Препарат Ураликс®, снижая активность ксантиноксидазы, оказывает патогенетический эффект у пациентов с уратным нефролитиазом и может быть рекомендован как в виде монотерапии, так и в сочетании с другими методами лечения.


Введение
Обмен пуринов представляет собой сложный биохимический процесс, в котором принимают участие многие ферментные системы человека. Наиболее частыми формами нарушений пуринового обмена являются уратная форма мочекаменной болезни (МКБ), подагра и бессимптомная гиперурикемия.
Несмотря на то что уратная форма МКБ не самая часто встречающаяся, она доставляет пациентам множество неудобств. Уратные камни составляют около 5–10% всех конкрементов в почках (40,3–80,6 тыс. человек на 2022 г.) [1]. Один из недостатков существующих на сегодня методов метафилактики повторного образования камней – это неблагоприятный профиль безопасности имеющейся пероральной терапии. Так, основными лекарственными средствами, применяемыми при уратных формах МКБ на фоне повышения уровня мочевой кислоты, являются аллопуринол и фебуксостат. Аллопуринол в 1 из 1000 случаев может вызывать синдром аллопуриноловой гиперчувствительности с уровнем смертности 20–25% [2] . Частота отказа от лечения аллопуринолом по причине развития побочных эффектов достигает, по разным данным, 11–38% [3, 4]. Более современный препарат фебуксостат также может у 1–10% пациентов вызывать приступы подагры, отеки, диспноэ, артралгию, диарею, нарушение функции печени, кожную сыпь, головную боль [5].
Вследствие этого врачам и пациентам необходимо решение, которое приносило бы минимум побочных эффектов, но воздействовало в первую очередь на механизм развития уратных камней в почках и гиперурикемии в целом. Одним из таких решений может являться биологически активный комплекс Ураликс®, который содержит в своем составе лютеолин, кверцетин, а также экстракт растения смилакса приречного.
Цель исследования – оценить эффективность и безопасность комплекса Ураликс® в терапии уратного нефролитиаза.
Материал и методы
В исследование были включены пациенты, обратившиеся к врачу-урологу в период с января 2021 г. по декабрь 2022 г., с диагнозом уратного уролитиаза, установленным на основании ультразвукового исследования мочеполовой системы, анализа состава конкремента, клинического и биохимического анализов. Всего было набрано 120 пациентов, которые были случайным образом распределены по трем группам:
- первая (основная, n = 59) – получали препарат Ураликс® на регулярной основе по одной капсуле (300 мг) один раз в день в течение 90 дней и диетические рекомендации по сокращению потребления продуктов, богатых пуринами;
- вторая (контрольная, n = 28) – получали 200 мг аллопуринола один раз в день в течение 90 дней;
- третья (дополнительная контрольная, n = 33) – получали диетические рекомендации по сокращению потребления продуктов, богатых пуринами.
В качестве критериев эффективности до и после лечения анализировали динамику уровня мочевой кислоты в крови, суточную экскрецию мочевой кислоты с мочой. Также оценивали показатели биохимического анализа крови и общего анализа мочи.
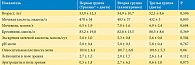
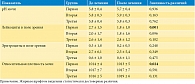
Группы по большинству параметров не различались между собой, за исключением исходного уровня мочевой кислоты в крови (табл. 1). В третьей группе исходный уровень мочевой кислоты был достоверно ниже, чем в первой и второй (р = 0,003).
Результаты
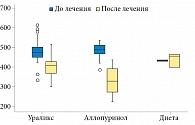
В группах пациентов, принимавших Ураликс® и аллопуринол, отмечено достоверное снижение уровня мочевой кислоты в крови (р < 0,001). При применении Ураликса уровень мочевой кислоты снизился на 15,1% в течение трех месяцев. У пациентов, принимавших 200 мг/сут аллопуринола, уровень мочевой кислоты снизился в среднем на 31,1%. У пациентов, только соблюдавших диету, отмечалась тенденция к росту уровня мочевой кислоты – повышение на 1,9%. Уровень мочевины и креатинина статистически достоверно не изменялся. Однако в группе пациентов, принимавших Ураликс®, отмечена тенденция к снижению уровня мочевины, но данная динамика не преодолела порог статистической значимости (-15,4%; р = 0,094) (табл. 2, рис. 1).
Суточная экскреция мочевой кислоты
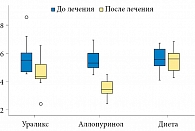
В группах пациентов, принимавших Ураликс® и аллопуринол, отмечено достоверное снижение суточной экскреции мочевой кислоты с мочой. У пациентов, получавших Ураликс®, экскреция снизилась в среднем на 17,9% (р = 0,003), у пациентов, получавших аллопуринол, – на 38,2% (р = 0,002). Соблюдение одних только диетических рекомендаций не привело к снижению экскреции мочевой кислоты (табл. 3, рис. 2).
Показатели общего анализа мочи
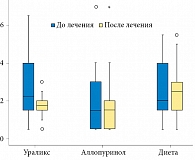
В группах пациентов, получавших аллопуринол и соблюдавших диетические рекомендации, показатели общего анализа мочи достоверно не изменились. Число лейкоцитов, эритроцитов, относительная плотность и рН мочи остались на прежнем уровне. В первой группе достоверно снизился уровень лейкоцитурии. Среднее число лейкоцитов в полях зрения сократилось на 33,3% – с 2,7 ± 1,5 до 1,8 ± 1,0 (p < 0,001). Было также отмечено достоверное, но клинически не значимое снижение относительной плотности мочи с 1014 ± 4 до 1013 ± 5 (р = 0,024) (табл. 4, рис. 3).
Обсуждение
Результаты проведенного исследования показали, что Ураликс® достоверно снижает уровень мочевой кислоты в крови и ее экскрецию с мочой, в первую очередь вследствие ингибирования фермента ксантиноксидазы. Эти данные согласуются с предыдущими исследованиями отдельных компонентов Ураликса, опубликованными в доступных источниках литературы.
Молекулярный докинг (метод молекулярного моделирования, позволяющий предсказать наиболее выгодную для образования устойчивого комплекса ориентацию и конформацию одной молекулы в сайте связывания другой) показывает, что лютеолин связывается с теми же аминокислотными остатками (Gly1204 и Gly737) белка ксантиноксидазы, что и аллопуринол [6]. Результаты сравнительного исследования различных флавоноидов показали, что лютеолин имеет наивысшую эффективность в отношении ингибирования ксантиноксидазы. Также лютеолин обладает выраженной противовоспалительной активностью: в концентрации 10 мкмоль снижает выработку фактора некроза опухоли α (ФНО-α) и интерлейкина 6 (ИЛ-6) на 73 и 81% соответственно по сравнению с дексаметазоном. Кроме того, лютеолин обладает наивысшей среди флавоноидов антиоксидантной и противовоспалительной активностью: IC50 относительно ксантиноксидазы для лютеолина и аллопуринола составляет 4,5 в сравнении с 8,5 мг/мл [7].
Результаты этого исследования свидетельствуют о том, что флавоноиды являются мощными ингибиторами ксантиноксидазы – фермента, участвующего в выработке мочевой кислоты и супероксид-радикалов. Снижение выработки мочевой кислоты автоматически приводит к эквивалентному снижению содержания супероксидного радикала. Это означает, что скорость связывания мочевой кислоты равна скорости связывания супероксида. Кроме того, тестируемые экстракты и их флавоноиды были также мощными поглотителями ферментативно генерируемых супероксидных радикалов.
Пероральное применение лютеолина достоверно снижало уровень мочевой кислоты в сыворотке крови на 34, 44 и 76% в дозировках 20, 40 и 100 мг/кг. При этом лютеолин и лютеолин-4’-О-гликозид по сравнению с контролем во всех изученных дозах выраженно снижают экспрессию белков-транспортеров мочевой кислоты mURAT1 и mGLUT9, активность которых повышается при гиперурикемии [8].
Кроме того, гистологические исследования показывают, что лютеолин восстанавливает функцию почки, нарушенную избыточным уровнем мочевой кислоты. Это происходит в том числе вследствие уменьшения отека, обусловленного отложением кристаллов моноурата натрия и снижением инфильтрации воспалительными клетками. Также лютеолин снижает уровень провоспалительных цитокинов (ИЛ-1β и ФНО-α). Лютеолин способствует уменьшению экспрессии циклооксигеназы 2 и выработке простагландина Е2 [9].
Другим активным компонентом Ураликса является кверцетин. Наиболее вероятным механизмом действия кверцетина является прямое ингибирование ксантиноксидазы, как было показано в исследованиях in vitro. Другим возможным механизмом является усиление почечной экскреции мочевой кислоты вследствие усиления гломерулярной фильтрации. Также эффективность может быть обусловлена непрямым антиоксидантным эффектом, который снижает микрососудистую ишемию клубочков и приводит к локальному повышению кровотока, расширению афферентных артериол и конкурентной реабсорбции натрия и калия [10].
Фармакологический эффект кверцетина обусловлен значительным дозозависимым ингибирующим действием на отеки в экспериментальной модели подагрического артрита. Этот эффект коррелировал с ослаблением рекрутирования лейкоцитов в пораженные суставы, снижением уровней ИЛ-1β, ФНО-α, NO, COX-2 и PGE2, а также со снижением уровней конечного продукта перекисного окисления липидов (МДА) и повышенной антиоксидантной активностью ферментов супероксиддисмутазы, каталазы и глутатион-пероксидазы (SOD, CAT и GSH-PX). Эти терапевтические преимущества были сопоставимы с теми, которые достигаются при лечении индометацином [11].
Смилакс приречный (лат. Smilax riparia, сассапариль) – это многолетняя деревянистая лиана семейства Смилаксовые, или Сассапарилевые. Растение распространено в субтропическом и тропическом климате. Произрастает на территории Китая, Северной Америки, островах Тихого океана, встречается в Европе и Африке. Корни сассапариля содержат стероидные сапонины, горечи, смолы, крахмал, слизь, аминокислоты, железо, кальций, калий, магний и эфирное масло.
В исследованиях показано, что применение экстракта S. riparia вызывает достоверное дозозависимое снижение уровня мочевой кислоты в сыворотке крови, а также снижение экспрессии белка URAT1 в почечной ткани при гиперурикемии [12].
Кроме того, экстракт S. riparia обладает способностью усиливать активность других урикозурических средств, например аллопуринола. При совместном применении аллопуринола и S. riparia отмечается синергизм относительно снижения уровня мочевой кислоты в сыворотке крови, соответствующего повышения уровня мочевой кислоты в моче. Также экстракт S. riparia способствует улучшению функции почек, повреждаемой при уратной нефропатии. Положительный эффект отражается в снижении уровня сывороточного азота мочевины (BUA) и повышении фракционной экскреции уратов (FEUA). Для изучения основных механизмов действия экстракта S. riparia было оценено влияние соединения на активность ксантиноксидазы (XOD). Комбинация аллопуринола и SRS способствовала снижению уровня XOD в сыворотке даже до более низкого, чем у пациентов контрольной группы. Соответственно, комбинированное лечение также вызывало аналогичные изменения в активности XOD в печени, поэтому можно предположить, что эти изменения способствовали наблюдаемым эффектам при комбинированном лечении [13].
Эти же положительные свойства характерны не только для суммарного экстракта S. riparia, но и для отдельных его ингредиентов, в частности паллидифлозида D [14], смилаксохинозидов А и С [15], рипарозида В и тимосапонина J. Кроме того, по результатам гистологических исследований, рипарозид В и тимосапонин J обращают вспять повреждения почечной ткани при гиперурикемии и сопутствующей ей уратной нефропатии, восстанавливается щеточная кайма эпителиальных клеток и структура почечных канальцев [16].
Этилацетатная фракция экстракта S. riparia не только способствует снижению активности ксантиноксидазы, но также улучшению структуры и функции почек, что подтверждено биохимическими и гистологическими данными. Уровень мочевой кислоты в сыворотке крови снижается на 16, 30 и 39%, а уровень азота мочевины – на 20, 27 и 28% при дозировках 125, 250 и 500 мг/кг соответственно. Фракционное выведение уратов из организма повышается на 30, 64 и 91% соответственно [17]. Важным аспектом при длительной терапии уратных форм МКБ и других нарушений пуринового обмена является безопасность применяемых препаратов. Так, согласно рекомендациям Американской урологической ассоциации, из соображений безопасности в рутинной практике не рекомендуется назначать аллопуринол как терапию первой линии пациентам с уратными камнями [18]. Кроме того, по результатам рандомизированных исследований, вероятность развития хотя бы одного побочного эффекта на фоне приема аллопуринола составляет 36,5–85% [4].
Поэтому важно отметить, что в группе пациентов, получавших Ураликс®, не было зарегистрировано нежелательных явлений. При сопоставлении данного факта с тем, что компоненты комплекса обладают высокой эффективностью, можно рекомендовать Ураликс® в качестве альтернативы аллопуринолу и другим ингибиторам ксантиноксидазы.
Заключение
Снижение уровня мочевой кислоты, в первую очередь вследствие снижения ее образования, играет ключевую роль в долгосрочной стратегии ведения пациентов с уратными формами МКБ, поскольку терапия аллопуринолом и цитратами имеет свои недостатки и ограничения в применении. Препарат Ураликс®, снижая активность ксантиноксидазы, оказывает патогенетический эффект у пациентов с уратным нефролитиазом и может быть рекомендован как в виде монотерапии, так и в сочетании с другими методами лечения.
Авторы заявляют об отсутствии конфликта интересов.
Работа выполнена без финансовой поддержки.
Yu.L. Demidko, PhD, M.O. Polozhentseva, S.S. Krasnyak, PhD
I.M. Sechenov First Moscow State Medical University
Polyclinic No. 3 of the Federal Security Service of the Russian Federation, Moscow
N.A. Lopatkin Research Institute of Urology and Interventional Radiology – branch of the Federal State Budgetary Institution "NMIC of Radiology" of the Ministry of Health of the Russian Federation, Moscow
Contact person: Stepan S. Krasnyak, krasnyakss@mail.ru
The urate form of urolithiasis is one of the most common forms of purine metabolism disorders. Urate kidney stones occur in 5–10% of all kidney stones. One of the disadvantages of the existing oral therapy of the urate urolithiasis is negative safety profile.
The purpose of the study is to evaluate the effectiveness and safety of the Uralix complex in urate kidney stones treatment.
Material and methods. The study included 120 patients with an established diagnosis of urate urolithiasis. All patients were randomized into 3 groups. The main group (n = 59) received Uralix one capsule (300 mg) once a day for 90 days and dietary recommendations. Control group (n = 28) received 200 mg of allopurinol once a day for 90 days. An additional control group (n = 33) received dietary recommendations to reduce consumption of purine-rich foods. The dynamics of the uric acid level in the blood and the daily urinary excretion of uric acid were analyzed as criteria of effectiveness before and after treatment.
Conclusion. Uralix, reducing the activity of xanthine oxidase, has a pathogenetic effect in patients with urate nephrolithiasis and can be recommended both as monotherapy and in combination with other treatment methods.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


