Международные и российские рекомендации по уратснижающей терапии у коморбидных пациентов с гиперурикемией или подагрой
- Аннотация
- Статья
- Ссылки
- English
Представлен консенсус экспертов Европейского общества кардиологов и Российского кардиологического общества по ведению пациентов с гиперурикемией и высоким сердечно-сосудистым риском, клинические рекомендации Российского кардиологического общества по терапии артериальной гипертензии.
Особое внимание уделено возможностям фебуксостата (Аденурика) у таких больных. Фебуксостат демонстрирует не только более высокую эффективность в снижении и поддержании уровня мочевой кислоты, но и лучшую переносимость по сравнению с аллопуринолом. Несомненным преимуществом фебуксостата (Аденурика) перед аллопуринолом является возможность применения у пациентов с хронической болезнью почек. Кроме того, у лиц пожилого возраста не требуется коррекции дозы.
Представлен консенсус экспертов Европейского общества кардиологов и Российского кардиологического общества по ведению пациентов с гиперурикемией и высоким сердечно-сосудистым риском, клинические рекомендации Российского кардиологического общества по терапии артериальной гипертензии.
Особое внимание уделено возможностям фебуксостата (Аденурика) у таких больных. Фебуксостат демонстрирует не только более высокую эффективность в снижении и поддержании уровня мочевой кислоты, но и лучшую переносимость по сравнению с аллопуринолом. Несомненным преимуществом фебуксостата (Аденурика) перед аллопуринолом является возможность применения у пациентов с хронической болезнью почек. Кроме того, у лиц пожилого возраста не требуется коррекции дозы.

Введение
Бессимптомная гиперурикемия (ГУ) – повышенный уровень мочевой кислоты (МК) в сыворотке крови без подагрического артрита, тофусов или уратных камней в почках [1–5]. Ее распространенность в Российской Федерации составляет 16,8–25,3% среди мужчин и 11,3% среди женщин в возрасте от 25 до 64 лет [6–10]. Подагрой следует считать хроническое заболевание, связанное с нарушением мочекислого обмена, вследствие чего в крови повышается уровень мочевой кислоты, в тканях откладываются кристаллы натриевой соли (ураты), что клинически проявляется рецидивирующим острым артритом и образованием подагрических узлов (тофусов) [11]. В Российской Федерации подагрой страдает 0,3% взрослого населения [2, 3].
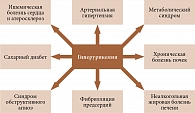
Несмотря на имеющиеся данные о механизмах развития и факторах риска ГУ и подагры, терапия этих состояний не всегда успешна. Одной из причин является высокая частота коморбидных состояний, наиболее значимым из которых признана патология сердечно-сосудистой системы и почек (рис. 1) [12–24].
Согласно результатам проспективных исследований, ГУ служит предиктором ишемической болезни сердца (ИБС), острого инфаркта миокарда (ОИМ), сердечной недостаточности (СН), острого нарушения мозгового кровообращения (ОНМК), сердечно-сосудистой и общей смерти [20–23]. Доказано также, что более высокая концентрация МК в сыворотке крови связана с гиперлипидемией, триглицеридемией, сахарным диабетом (СД) 2 типа и метаболическим синдромом (МС) [21, 25]. Необходимо отметить, что в качестве связующих звеньев подагры, ожирения и дислипидемии указываются инсулинорезистентность и гиперинсулинемия [17]. По данным рандомизированных исследований, при подагре частота встречаемости артериальной гипертензии (АГ) варьировалась от 36 до 41% случаев, при сочетании подагры и МС – увеличивалась до 72% [26]. Риск развития ИБС или цереброваскулярной болезни у больных АГ и ГУ в три – пять раз выше, чем у пациентов с АГ и нормоурикемией [27]. У лиц с СН повышенный уровень МК рассматривался в качестве предиктора плохого прогноза и трансплантации сердца [28]. У пациентов с ИБС при увеличении МК от самого низкого к самому высокому квартилю отмечено повышение смертности в пять раз. В случае увеличения уровня МК на 1 мг/дл (59,5 мкмоль/л) сердечно-сосудистая летальность возрастала на 26% [29]. У больных СД 2 типа подъем уровня МК на каждый квартиль значительно повышал частоту ОНМК. Значения МК более 295 мкмоль/л ассоциировались с возрастанием риска фатального и нефатального ОНМК, при этом связь оставалась значимой даже после исключения других сердечно-сосудистых факторов риска [17]. Установлено, что ГУ вызывает констрикцию почечных сосудов, коррелирует с активностью ренин-ангиотензин-альдостероновой системы, участвует в развитии дисфункции эндотелия [24]. Другие потенциальные механизмы, с помощью которых ГУ и/или повышенная активность фермента ксантиноксидазы (КСО) могут способствовать повреждению сосудов, включают адгезию тромбоцитов, пролиферацию гладкомышечных клеток сосудов и стимуляцию воспалительного ответа [25].
Патология почек при подагре связана со снижением экскреции МК, индуцированной кристаллизацией уратов в почках на фоне повышения их выведения (больше 800 мг/сут). В этих случаях развивается уратная подагрическая нефропатия. При подагрической нефропатии отмечаются мочекислая блокада канальцев почек, мочекислый нефролитиаз и хронический уратный тубулоинтерстициальный нефрит. Необходимо отметить, что в некоторых случаях ГУ дебютирует с клинических проявлений мочекаменной болезни [1].
В настоящее время доказана патогенетическая связь между остеоартритом и ГУ (рис. 2) [12]. Прогрессирование остеоартрита приводит к образованию уратов, а образование уратов способствует дальнейшему прогрессированию заболевания.
Уратснижающая терапия у пациентов с коморбидной патологией способна существенно улучшить общий прогноз.
Рекомендации по уратснижающей терапии при бессимптомной гиперурикемии у коморбидных пациентов
В рекомендациях экспертов Европейского общества кардиологов (European Society of Cardiology – ESC) 2018 г. и Российского кардиологического общества (РКО) 2020 г. гиперурикемия рассматривается как один из факторов сердечно-сосудистого риска, в связи с чем определение уровня МК показано всем пациентам с АГ [28]. Невыполнение данной рекомендации считается дефектом оказания медицинской помощи. Согласно консенсусу ESC и РКО, при бессимптомной ГУ и высоком сердечно-сосудистом риске должна проводиться уратснижающая терапия [30].
При ГУ и высоком сердечно-сосудистом риске рекомендуется:
- считать высоким уровень МК более 360 мкмоль/л;
- оценивать наличие сопутствующих заболеваний;
- считать целевым уровень МК в сыворотке крови ниже 300 мкмоль/л;
- информировать больных о фармакологических и эпидемиологических факторах, влияющих на ГУ, сопутствующих патологиях и сердечно-сосудистых факторах риска;
- информировать пациентов о необходимости изменения образа жизни, диеты;
- информировать пациентов о необходимости снижать массу тела при наличии избыточной массы;
- информировать больных о важности строго придерживаться назначенного лечения;
- по возможности отменять препараты, влияющие на уровень МК;
- начинать терапию аллопуринолом в дозе 100 мг/сут с последующей титрацией до 300–600 мг/сут до достижения целевого уровня МК (ниже 300 мкмоль/л);
- рассмотреть возможность комбинированной терапии (аллопуринол + препарат с урикозурическим действием) у не достигших целевого уровня МК пациентов с АГ, ИБС, ОНМК в анамнезе, СД 2 типа и хронической болезнью почек (ХБП).
Уратснижающая терапия показана лицам со злокачественными новообразованиями при назначении цитостатиков. Таковая необходима для профилактики острой мочекислой нефропатии.
Медикаментозная коррекция бессимптомной ГУ необходима родственникам пациентов с наследственным дефицитом ферментов, регулирующих синтез МК. Речь, в частности, идет о дефиците гипоксантин-гуанинфосфорибозилтрансферазы, который ассоциируется с синдромом Леша – Нихена.
Пациенты с отягощенной наследственностью в отношении дебюта подагры в молодом возрасте должны быть обследованы на предмет увеличения экскреции мочевой кислоты с мочой. Экскреция > 1100 мг/сут связана с 50%-ным риском образования уратов. Нормализацию уровня МК у данных пациентов необходимо начинать с назначения диеты (ограничения пуринов). Если это не способствует уменьшению экскреции МК менее 1000 мг/сут, следует рассмотреть возможность применения ингибиторов КСО. Доза указанных препаратов должна быть скорректирована до достижения целевых значений – менее 800 мг/сут.
Стратегия лечения подагры
Современная стратегия лечения подагры основана на рекомендациях экспертов Ассоциации ревматологов России 2017 г. [7], Европейской антиревматической лиги (Еuropean League Against Rheumatism – EULAR) 2016–2018 гг. и Американской коллегии ревматологов (American College of Rheumatology – ACR) 2020 г. Данные документы содержат информацию о методах лечения острого приступа подагры, показаниях к проведению уратснижающей терапии, мероприятиях по изменению образа жизни и препаратах, которые часто назначаются пациентам с коморбидностью [31].
Общие принципы ведения пациентов с подагрой следующие:
- информировать о патофизиологии заболевания, наличии эффективных методов лечения, принципах терапии острого приступа артрита и элиминации кристаллов уратов путем пожизненного снижения сывороточного уровня МК менее 360 мкмоль/л;
- информировать о необходимости изменения образа жизни (снижение массы тела, отказ от приема алкоголя (особенно пива и крепких алкогольных напитков) и подслащенных напитков, избегание переедания, чрезмерного потребления мяса и морепродуктов, потребление обезжиренных молочных продуктов, регулярные физические упражнения);
- систематически проводить скрининг для выявления коморбидных заболеваний и сердечно-сосудистых факторов риска, включая ХБП, ИБС, СН, ОНМК, атеросклероз периферических артерий, ожирение, гиперлипидемию, АГ, СД 2 типа и курение, а также их профилактику и терапию.
Течение заболевания характеризуется приступами подагрического артрита и периодами ремиссии. Следовательно, будут различаться цели лечения. В первом случае оно направлено на купирование приступа, во втором – на профилактику повторных обострений суставного синдрома, внесуставные проявления подагры (тендиниты, нефропатию и др.).
Как было отмечено ранее, при подагре помимо медикаментозных методов лечения используются немедикаментозные. В частности, из рациона исключают продукты, содержащие большое количество пуринов. Ограничивают потребление соли и жира (жиры обладают гиперурикемическим действием). Добавляют щелочные минеральные воды и цитрусовые для усиленного выведения из организма уратов. Общее количество потребляемой свободной жидкости увеличивают до 2,5 л/сут, если нет противопоказаний со стороны сердечно-сосудистой системы. При сочетании подагры с ожирением назначают гипокалорийный стол – сокращение потребления хлебобулочных изделий, каш, легкоусвояемых углеводов, жиров. При этом больным не рекомендуется голодание, так как оно уже в первые дни приводит к увеличению урикемии.
Для купирования острой подагрической атаки в качестве препаратов первой линии показаны нестероидные противовоспалительные препараты (НПВП) и/или колхицин.
Колхицин является мощным ингибитором фосфатазы. Он тормозит процессы деления клеток. Эффект препарата обусловлен уменьшением высвобождения лизосомальных ферментов из нейтрофилов, снижением образования лактата, стабилизацией рН тканевой жидкости и ограничением кристаллизации МК. Колхицин можно назначать по 0,5 мг каждый час до купирования артрита или до достижения максимально допустимой дозы (6 мг), по 1,0 мг через каждые три часа до максимально допустимой дозы (8 мг), в первый день по 1,0 мг три раза в сутки после еды, во второй – по 1,0 мг утром и вечером, в последующие – по 1,0 мг в сутки. В целях предупреждения повторных атак, особенно в первые месяцы после начала уратснижающей терапии, целесообразно назначение колхицина в дозе 1,0–2,0 мг/сут ежедневно, поддерживающая доза – 0,5–1,0 мг/сут. Абсолютным противопоказанием для назначения колхицина считается сочетание почечной и печеночной недостаточности. При длительном лечении возможно развитие миелосупрессии (лейкопения, агранулоцитоз, апластическая анемия, тромбоцитопения), обратимой алопеции, печеночной недостаточности, миопатии, периферических невритов.
Нестероидные противовоспалительные препараты также широко применяются для купирования подагрической атаки. С учетом развития побочных эффектов, особенно со стороны желудочно-кишечного тракта, предпочтение отдается селективным ингибиторам циклооксигеназы 2 (ЦОГ-2) (например, нимесулиду, эторикоксибу, мелоксикаму).
В случае неэффективности или наличия противопоказаний для применения НПВП и колхицина используют глюкокортикостероиды (ГКС). Так, преднизолон принимают перорально 0,5 мг/кг в первый день, с последующим снижением по 5 мг через день. Дексаметазон – внутримышечно 8 мг, при необходимости введение повторяют через 24–48 часов. Дипроспан вводят периартикулярно, при этом доза зависит от размера сустава. Метилпреднизолон получают внутривенно капельно в дозе 250–500 мг, при необходимости введение повторяют через 24 часа.
У пациентов с частыми приступами артрита и противопоказаниями для назначения колхицина, НПВП и ГКС (перорально и периартикулярно) следует рассмотреть возможность использования ингибиторов интерлейкина 1 (ИЛ-1) (канакинумаба в дозе 150 мг подкожно). При необходимости повторного введения интервал между инъекциями должен быть не менее 12 недель. В отсутствие эффекта после первой инфузии повторные проводить нецелесообразно.
Согласно рекомендациям EULAR 2016 г. [32], показаниями к началу уратснижающей терапии являются повторяющиеся приступы подагрического артрита (не менее двух в год), наличие тофусов, уратная артропатия и/или наличие уратов в почках, молодой возраст пациентов и уровень МК в сыворотке крови выше 8,0 мг/дл (480 мкмоль/л) и/или сопутствующие заболевания, такие как ХБП, АГ, ИБС, СН. Препаратом первого выбора считается аллопуринол. Терапию аллопуринолом необходимо начинать с низких доз (100 мг/сут), при необходимости увеличивать их на 100 мг через каждые две – четыре недели до достижения целевого уровня МК. Длительность такой терапии составляет шесть месяцев. В последующем назначается поддерживающая доза – 100 мг/сут. При недостаточности функции почек доза аллопуринола зависит от величины клиренса креатинина. При значениях более 60 мл/мин аллопуринол назначается в дозе 200 мг/сут, менее 40 мл/мин – 100 мг/сут, менее 10 мл/мин – 100 мг в течение трех дней. Применение более высоких доз может усугубить течение ХБП. Противопоказаниями к применению аллопуринола являются выраженные нарушения функции печени, гемохроматоз, беременность, детский возраст (кроме злокачественных заболеваний с ГУ).
Согласно рекомендациям EULAR, при недостаточной эффективности аллопуринола или наличии противопоказаний для его применения назначают фебуксостат [31].
Фебуксостат (Аденурик®) – непуриновый селективный ингибитор ксантиноксидазы, оказывающий минимальное воздействие на другие ферменты, вовлеченные в пуриновый и пиримидиновый обмен. Препарат метаболизируется исключительно в печени.
Первоначальная доза Аденурика составляет 80 мг/сут.
Если в течение месяца концентрация МК в крови не снижается до целевых значений (менее 360 мкмоль/л), дозу Аденурика увеличивают до 120 мг/сут.
У пациентов пожилого возраста коррекции дозы не требуется.
Применение препарата не зависит от приема пищи.
Противопоказаниями для назначения Аденурика являются индивидуальная непереносимость активного вещества, а также хроническая СН.
С осторожностью следует использовать фебуксостат при развитии ГУ на фоне химиотерапии.
Важно отметить, что прием фебуксостата не приводит к прогрессированию ХБП, в отличие от аллопуринола, доза которого титруется в зависимости от функции почек. Именно поэтому его можно применять лицам с ХБП [33].
Терапевтический эффект Аденурика наступает через четыре-пять недель, исчезновение симптомов подагры – через три-четыре месяца. Фармакокинетика фебуксостата не изменяется у пациентов с легкой или средней степенью почечной дисфункции [34].
Следует подчеркнуть, что фебуксостат отличается от аллопуринола меньшей токсичностью, более высокими биодоступностью и длительностью действия. Фебуксостат в дозе 80 мг/сут соответствует дозе аллопуринола 300 мг/сут.
В соответствии с рекомендациями ACR решение о выборе препарата (аллопуринол или фебуксостат) должно приниматься индивидуально. Полученные данные свидетельствуют об отсутствии существенной разницы в частоте сердечно-сосудистых событий при применении фебуксостата и аллопуринола [35]. Однако необходимо более детальное изучение данного вопроса после получения результатов уже начавшихся и планируемых исследований, посвященных сравнению влияния такой терапии на риск неблагоприятных сердечно-сосудистых событий у пациентов с ГУ.
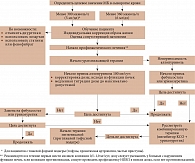
Собранная доказательная база в отношении эффективности и безопасности позволяет рекомендовать Аденурик® для широкого применения при подагрическом артрите (рис. 3) [32].
Показаниями для назначения урикозурических препаратов служат гипоэкскреторный тип подагры в отсутствие подагрической нефропатии, смешанный тип подагры при суточной экскреции МК менее 450 мг/сут, непереносимость аллопуринола. К этой группе препаратов относятся пробенецид (0,5 г по четыре таблетки в день), сульфинпиразон (Антуран) (0,1 г не более 0,6 г в день), Этамид (0,7 г три-четыре раза в день), бензбромарон (Дезурик) (0,08–0,10 г один раз в день до 0,6 г). Кроме того, может применяться комбинированный препарат Алломарон, содержащий в одной таблетке 100 мг аллопуринола и 20 мг бензбромарона. Перспективными представляются новые урикозуретики, точкой приложения которых являются уратные транспортеры, транспортные белки, участвующие в реабсорбции МК в почках. К таковым относятся лезинурад и веринурад.
Пациентам с кристалл-верифицированной тяжелой, изнуряющей хронической тофусной подагрой и низким качеством жизни, у которых целевой сывороточный уровень МК не может быть достигнут при применении любых других доступных лекарственных препаратов в максимальной дозе (включая комбинации), показана пеглотиказа как средство последней надежды. Пеглотиказа – препарат пегилированной уриказы, продуцируемой генетически модифицированным штаммом Escherichia coli и катализирующей окисление мочевой кислоты в аллантоин (рис. 3).
Лечение коморбидных состояний
При подагре терапия коморбидных состояний основывается на следующих рекомендациях:
- коррекция гиперлипидемии, АГ, гипергликемии, ожирения и отказ от курения;
- по возможности замена диуретиков у получающих петлевые или тиазидные диуретики;
- при АГ назначение лозартана и блокаторов кальциевых каналов, так как данные препараты обладают умеренным урикозурическим эффектом;
- при гиперлипидемии предпочтительны статины или фенофибрат;
- отмена низких доз ацетилсалициловой кислоты (при приеме по соответствующим показаниям) условно не рекомендуется.
Заключение
У пациентов с ГУ и подагрой достичь целевого уровня мочевой кислоты в сыворотке крови возможно при соблюдении рекомендаций по изменению образа жизни, коррекции коморбидных состояний и применению уратснижающей терапии.
Представленные данные дают основание полагать, что фебуксостат (Аденурик®) является эффективным средством для снижения уровня мочевой кислоты. Фебуксостат в дозе 80 мг/сут по эффективности превосходит аллопуринол в дозе 300 мг/сут, при этом обладает лучшим профилем безопасности и переносимости. Кроме того, при лечении фебуксостатом не требуется коррекции дозы у пациентов пожилого возраста. Его применение не противопоказано лицам с ХБП.
Аденурик® можно рекомендовать для широкого применения при гиперурикемии и подагре у коморбидных пациентов.
I.B. Belyayeva, MD, PhD, Prof., V.I. Mazurov, Academician of RAS, MD, PhD, Prof., M.S. Petrova, PhD, R.A. Bashkinov, A.Yu. Fonturenko
North-Western State Medical University named after I.I. Mechnikov
Clinical Rheumatology Hospital No. 25, Saint-Petersburg
Contact person: Irina B. Belyayeva, belib@mail.ru
Discussed the influence of hyperuricemia on the formation of inflammation, cardiovascular and renal pathology, as well as on the course and outcome of comorbid conditions.
The consensus of experts of the European Society of Cardiology and the Russian Society of Cardiology on the management of patients with hyperuricemia and high cardiovascular risk, clinical guidelines of the Russian Society of Cardiology for the treatment of hypertension.
Special attention is paid to the possibilities of febuxostat (Adenuric) in such patients.
Febuxostat not only demonstrates higher efficacy in reducing and maintaining uric acid levels, but also better tolerability compared to allopurinol. The undoubted advantage of febuxostat (Adenuric) over allopurinol is the possibility to use in patients with chronic kidney disease. In addition, the elderly do not need to adjust its dose.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.