Роль альфа-липоевой кислоты в лечении диабетической нейропатии
- Аннотация
- Статья
- Ссылки
- English
Введение
Периферическая нервная система человека включает соматические и вегетативные (автономные) волокна.
Соматические нервы содержат волокна разных типов. В зависимости от представленности последних определяется тип нерва – двигательный или чувствительный. Соматические нервы иннервируют мышцы, кожу, суставы. Вегетативные нервы (симпатические и парасимпатические) – внутренние органы, кровеносные сосуды и т.д.
Двигательные и одна часть чувствительных нервных волокон относятся к крупным миелинизированным волокнам, тогда как вегетативные и другая часть чувствительных нервных волокон, отвечающих за болевую чувствительность, – к мелким немиелинизированным. Следует отметить, что в человеческом организме на долю мелких немиелинизированных волокон приходится 70–90%, крупных миелинизированных – 10–30% [1].
При диабетической нейропатии (ДН) поражаются как периферические (спинномозговые), так и вегетативные (автономные) волокна. Мелкие немиелинизированные волокна повреждаются первыми. Получены данные, что задолго до выявления сахарного диабета (СД) у пациентов уже есть признаки поражения автономных волокон [2]. Общемировая тенденция к увеличению количества больных СД 2 типа неизбежно приведет к возрастанию числа больных ДН.
С клинической точки зрения выделяют диабетическую периферическую нейропатию (ДПН) и диабетическую автономную нейропатию (ДАН). Распространенность ДПН и ДАН, по разным данным, варьируется от 28 до 90%, в зависимости от исследуемой выборки и методов диагностики [3, 4]. Помимо того что клинические проявления ДПН значительно снижают качество жизни пациентов, данное осложнение является прогностически значимым фактором риска развития язвенных дефектов стопы (синдрома диабетической стопы нейропатической формы) и нейроостеоартропатии (стопа Шарко). В свою очередь ДАН признана лидирующей причиной безболевых инфарктов миокарда, нераспознаваемых гипогликемий и, как следствие, повышенной смертности у пациентов с СД [5–7].
В связи с вышесказанным своевременное и как можно более раннее лечение ДН является актуальной задачей современной диабетологии.
Патогенез
Ключевая роль в патогенезе нейропатии принадлежит хронической гипергликемии, которая является пусковым механизмом каскада биохимических реакций, приводящих к дегенерации и демиелинизации нервного волокна.
Существующие на данный момент времени теории патогенеза ДПН подразделяют на метаболическую и сосудистую. К метаболическому звену можно отнести активацию полиолового пути обмена глюкозы, окислительный стресс, неферментативное гликирование компонентов клеточных мембран, дефицит миоинозитола, нарушение образования факторов роста нерва. Сосудистый компонент представлен снижением образования оксида азота, который обладает вазодилататорными свойствами, и эндоневральной гипоксией, развивающейся вследствие снижения гибкости эритроцитов, увеличения вязкости крови, повышения эндоневрального давления и образования микротромбов с развитием эндоневрального отека. В настоящее время стало очевидным, что нарушение метаболизма и кровотока в нервном волокне тесно связано на всех этапах патогенеза.
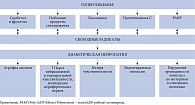
Следует также отметить, что каждый из патогенетических механизмов гипергликемии приводит к образованию свободных радикалов (рисунок) [8]. Окислительный стресс развивается при дисбалансе между количеством образованных свободных радикалов и возможностями их утилизации антиоксидантами. В норме антиоксиданты присутствуют эндогенно или могут поступать экзогенно с продуктами питания или в виде лекарственных препаратов. Такие энзиматические антиоксиданты, как супероксиддисмутаза и каталаза, воздействуя на супероксидный анионный радикал О2-, превращают его сначала в перекись водорода, затем в воду. Глютатион S-трансфераза трансформирует реактивные продукты в гидрофильные соединения, которые элиминируются из организма, витамины С и Е, липоевая кислота участвуют в перекисном окислении липидов [9], флавоноиды напрямую утилизируют свободные радикалы [10].
Чрезмерное содержание свободных радикалов, которое сопровождается снижением антиоксидантной защиты, приводит к структурным изменениям макромолекул (белков, сложных углеводов, жиров, ДНК), дисфункции эндотелия и последующему развитию микро- и макрососудистых осложнений [11], включая ДН. Свободные радикалы разрушают липиды, которые входят в миелиновую оболочку, окружающую аксон, что приводит к утрате им функции проведения импульса [12]. Окислительный стресс является причиной гиперчувствительности афферентных ноцицепторов и центральных нейронов, что вызывает генерацию спонтанных импульсов и возникновение боли в отсутствие прямого воздействия на чувствительные рецепторы периферических нервов [13].
Клинические проявления
Клинические проявления ДН зависят от преимущественного поражения вовлеченных в патологический процесс нервных волокон и стадии процесса. Так, на ранних стадиях ДПН преобладает яркая симптоматика: жжение, боль, покалывание, парестезии и т.д. При этом объективные признаки нарушения чувствительности могут быть минимальными или вообще отсутствовать. На более поздних стадиях, напротив, симптомы менее выражены, однако при осмотре выявляется снижение чувствительности. В запущенных случаях может развиться нейропатическая форма синдрома диабетической стопы, реже – стопа Шарко. Это самый неблагоприятный исход ДПН, так как синдром диабетической стопы – основная причина нетравматической ампутации нижних конечностей у больных СД.
Проявления ДАН отличаются большим разнообразием и зависят от вовлеченности в патологический процесс того или иного органа или системы: кардиальные (кардиоваскулярные), гастроинтестинальные, урогенитальные и т.д. В клинической практике чаще встречается кардиальная ДАН. В дебюте патологии отмечается снижение парасимпатической активности, что сопровождается увеличением активности симпатической нервной системы. Клинически данный дисбаланс проявляется тахикардией в покое (частота сердечных сокращений более 100 в минуту). По мере прогрессирования осложнения активность симпатической системы снижается. Формируется так называемое денервированное сердце. Сердечная мышца перестает реагировать на внешние стимулы. Ритм становится фиксированным вне зависимости от физической нагрузки, частоты и глубины дыхания. Наиболее серьезным осложнением кардиоваскулярной ДАН является безболевая ишемия, включая инфаркт миокарда. В этой связи кардиоваскулярную ДАН следует рассматривать как прогностически неблагоприятный фактор. Риск смерти при наличии кардиальной ДАН составляет 30%, в ее отсутствие – 13% [14]. На более поздних стадиях вследствие десимпатизации сосудистой стенки и поражения барорефлекторной системы развивается ортостатическая гипотензия (снижение систолического артериального давления в положении стоя более чем на 20 мм рт. ст., диастолического – более чем на 10 мм рт. ст.). Гастроинтестинальные симптомы, обусловленные поражением nervus vagus, по большей части носят неспецифический характер и должны быть дифференцированы с сопутствующими заболеваниями и приемом лекарственных препаратов. Например, тошнота и учащенный стул могут сопровождать прием некоторых сахароснижающих препаратов и быть признаками гастроинтестинальной ДАН.
Диагностика
Диагноз ДН необходимо установить как можно раньше с целью назначения лечебно-профилактических мероприятий.
В клинической практике диагностика ДПН состоит из двух частей:
- оценки симптомов;
- клинического неврологического обследования с применением количественных тестов для определения выраженности неврологических расстройств.
При оценке симптомов следует выяснить наличие жалоб на жжение, жгучую или острую боль в стопах, покалывание и онемение в стопах и/или кистях, ощущение ползания мурашек, судороги. При болевом синдроме важно установить, относится он к проявлениям полинейропатии или окклюзии магистральных артерий нижних конечностей. Для этого следует уточнить, когда возникает боль – при ходьбе или в покое, как на нее влияет изменение положения ноги.
Количественная оценка выраженности симптомов нейропатии проводится с помощью шкалы нейропатического симптоматического счета. Каждому симптому присваивается определенный балл. Общая сумма баллов трактуется в соответствии со шкалой.
Жалобы пациента не всегда отражают степень тяжести периферической нейропатии, поэтому для объективной оценки необходимо проведение клинического неврологического обследования. С этой целью широко применяются исследование разных видов чувствительности (тактильной, болевой, температурной и вибрационной), а также оценка коленных и ахилловых рефлексов.
Для оценки тактильной чувствительности применяется стандартная методика с использованием монофиламента весом 10 г (5.07 Semmes-Weinstein). Пациент находится в положении лежа на спине, в спокойном и расслабленном состоянии. Исследователь прикасается монофиламентом к подошвенной поверхности первого пальца, проекции первого и пятого плюснефаланговых сочленений. Тактильная чувствительность не нарушена, если больной ощущает два прикосновения из трех. Тактильная чувствительность нарушена, если два прикосновения не ощущаются.
Болевая чувствительность может быть исследована при помощи тупой иглы или специальных приборов, позволяющих стандартизировать укол: неврологической ручки (Neuropen) или зубчатого колеса (Pinwheel). Исследование проводится на тыльной стороне первого пальца обеих стоп. Укол острым предметом не должен нарушать целостность кожи, вызывать появление крови. Болевая чувствительность считается ненарушенной, если пациент чувствует боль от укола.
Температурную чувствительность оценивают с помощью предметов разной теплопроводности, например металлической и резиновой части неврологического молоточка (площадь поверхности прикосновения должна быть примерно одинаковой), или специального прибора – термического наконечника (Thip-term). Исследование также проводится на тыльной стороне первого пальца обеих стоп. Температурная чувствительность считается ненарушенной, если пациент ощущает разницу температур в указанных точках.
Вибрационную чувствительность оценивают с помощью градуированного камертона, вибрирующего с частотой 128 Гц, или биотезиометра. Исследование проводится на тыльной стороне костного выступа первого плюснефалангового сочленения. При использовании камертона у пациента необходимо выяснить, чувствует ли он вибрацию. Значение на шкале камертона, когда больной перестает ощущать вибрацию, считается порогом вибрационной чувствительности. В случае применения биотезиометра, напротив, необходимо установить момент, когда обследуемый начинает чувствовать вибрацию. Вибрационная чувствительность считается ненарушенной при показаниях шкалы прибора от 7 до 9 вольт.
Для определения тяжести периферической полинейропатии проводится количественная оценка расстройств. Количественная оценка сенсомоторных расстройств может проводиться по шкале нейропатического дисфункционального счета (Neuropathy Dysability Score – NDS), разработанной M.J. Young в 1986 г. и рекомендованной исследовательской группой Neurodiab при Европейской ассоциации по изучению диабета. При использовании NDS каждому виду чувствительности присваивается определенный балл в зависимости от степени нарушения. Затем для каждого вида чувствительности рассчитывается средняя величина по двум ногам, которая делится на два [15].
Лечение и профилактика
Лечебно-профилактические мероприятия при ДН необходимо начинать как можно раньше. В двух крупнейших проспективных исследованиях (DCCT (1993) и UKPDS (1998)) продемонстрировано, что обеспечение контроля углеводного обмена снижает риск развития микрососудистых осложнений СД и нейропатии как у больных СД 1 типа, так и у больных СД 2 типа. Именно поэтому основным методом лечения и профилактики ДН в общемировой практике является компенсация углеводного обмена. С учетом того что в последнее время к факторам риска развития ДН помимо длительно существующей гипергликемии стали относить висцеральное ожирение, артериальную гипертензию, дислипидемию [16], их модификация должна проводиться наряду с коррекцией углеводного обмена.
Лечение ДН можно подразделить на симптоматическое и патогенетическое. Целью симптоматической терапии является купирование боли. В данном аспекте в качестве стандартной терапии показаны трициклические антидепрессанты (амитриптилин), противосудорожные средства (габапентин, карбамазепин), анальгетики (трамадол), средства местного воздействия (капсикам, капсаицин) [17].
Назначение средств патогенетической терапии базируется на воздействии на основные патогенетические компоненты ДПН (см. рисунок). В частности, ингибиторы альдозоредуктазы замедляют полиоловый путь обмена глюкозы, снижая повреждающее воздействие побочных продуктов этого вида обмена. Антиоксиданты, такие как альфа-липоевая (тиоктовая) кислота, влияют на содержание свободных радикалов и, таким образом, на окислительный стресс. Факторы роста нерва предотвращают дефицит нейротрофов и аксонального транспорта. Аминогуанидин подавляет гликирование белков нервных окончаний и сосудистой стенки.
В настоящее время большинство исследований по оценке влияния того или иного вида патогенетической терапии на течение ДПН либо остановлены из-за развития побочных эффектов, либо не завершены. Подтверждена эффективность только ингибиторов альдозоредуктазы и препаратов альфа-липоевой (тиоктовой) кислоты.
Альфа-липоевая кислота
Тиоктовая кислота классифицируется как витаминоид и представляет собой природную простетическую группу в альфа-кетокислотном дегидрогеназном комплексе митохондрий и системе расщепления глицина. Она может существовать в двух структурных формах – липоевая кислота и дигидролипоевая кислота, последняя из которых обладает более высокой биологической активностью.
Как указывалось выше, окислительный стресс – результат повышенной продукции свободных радикалов и дефицита антиоксидантной защиты. Доказано, что при диабетической нейропатии активность свободных радикалов повышена. Одним из повреждающих воздействий свободных радикалов является подавление синтеза оксида азота, что приводит к снижению кровотока в нервном волокне. В результате окислительного стресса возникают дефицит нейропептидов и эндотелиальная дисфункция мелких сосудов, кровоснабжающих нервное волокно. В экспериментальных работах на животных продемонстрировано, что применение тиоктовой кислоты – потенциального липофильного антиоксиданта – предотвращало развитие нейроваскулярных нарушений. Было также выявлено, что препараты альфа-липоевой кислоты улучшают утилизацию углеводов, ингибируют глюконеогенез и кетогенез, нормализуют энергетический метаболизм и аксональный транспорт, связывают свободные радикалы и оксиданты, уменьшая воздействие окислительного стресса.
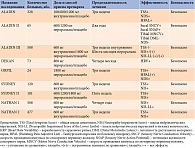
Вышеуказанные эффекты тиоктовой кислоты подтверждены в ряде плацебоконтролируемых исследований (таблица) [8, 18, 19].
Широкую известность препараты тиоктовой кислоты приобрели после получения результатов исследования ALADIN. Внутривенное применение препарата в дозе 600 мг/сут приводило к достоверному снижению выраженности симптомов ДПН, включая боль, парестезии, онемение и т.д., по сравнению с приемом плацебо. В исследовании ALADIN II оценивалась эффективность и безопасность продолжительного (в течение двух лет) приема тиоктовой кислоты в пероральном режиме. В данном исследовании не удалось получить четкого ответа на вопрос об эффективности длительного приема препарата. Однако доказана безопасность как 600 мг, так и 1200 мг тиоктовой кислоты. В исследовании ALADIN III сравнивали разные режимы терапии препаратом (600 мг внутривенно в течение трех недель, 1800 мг (600 мг три раза в день) перорально в течение шести месяцев) с приемом плацебо. В этом исследовании продемонстрировано достоверное снижение нейропатических симптомов при внутривенном введении 600 мг тиоктовой кислоты, а также тенденция к улучшению при приеме 1800 мг перорально. Однако данные, полученные в отношении второго режима, достоверно не отличались от данных для плацебо. Такой результат объяснялся выраженной вариабельностью между центрами в оценке симптомов нейропатии, большим числом исследовательских центров (n = 70). В целом было сделано заключение, что при длительном пероральном приеме тиоктовой кислоты необходимо оценивать не воздействие на симптомы ДПН, а возможность влияния на замедление и прогрессирование нейропатии [19]. В единственном исследовании по оценке эффективности препарата при автономной кардиальной нейропатии DEKAN установлено, что пероральный прием препарата в дозе 800 мг/сут в течение четырех месяцев приводил к достоверному улучшению симптомов автономной кардиальной нейропатии у больных СД 2 типа по сравнению с использованием плацебо. В исследовании ORPIL доказано, что достоверному снижению симптомов нейропатии способствовало не только внутривенное введение 600 мг альфа-липоевой кислоты, но и ее пероральный прием в дозе 1800 мг [18]. Следует обратить особое внимание на то, что препарат назначается при наличии болевой симптоматики ДН и не назначается в запущенных случаях, включая лечение язвенных дефектов при синдроме диабетической стопы. В последнем случае комплекс лечебных мероприятий направлен на заживление язвенного дефекта и профилактику его рецидивов.
Общие выводы по результатам проведенных исследований следующие.
- Введение препарата в дозе 600 мг внутривенно капельно в течение трех недель приводит к достоверному уменьшению основных симптомов ДПН, включая боль, парестезии, онемение. Аналогичным эффектом обладает пероральный прием в дозе 1800 мг/сут в течение трех недель. Однако последнее утверждение требует проведения дополнительных исследований с большим количеством пациентов.
- Помимо влияния на болевую симптоматику такая терапия в течение трех недель приводит к улучшению некоторых объективных показателей чувствительности.
- Пероральный прием препарата в течение четырех – семи месяцев улучшает объективные показатели чувствительности и течение кардиальной автономной нейропатии.
- Прием препарата в течение двух лет способствует стойкому улучшению скорости проведения нервного импульса как по моторным, так и по сенсорным волокнам нижних конечностей.
- Во многих исследованиях подтверждена безопасность препарата.
Заключение
Препараты альфа-липоевой (тиоктовой) кислоты включены в стандарт оказания первичной медико-санитарной помощи при диабетической полиневропатии (приказ Министерства здравоохранения Российской Федерации от 28.12.2012 № 1577н). Рекомендованный режим введения: 600 ЕД внутривенно капельно № 10 (следует отметить, что есть данные о большей эффективности 20 внутривенных капельных вливаний ) с последующим пероральным приемом в дозе 600 мг в течение 140 дней [20]. Однако назначать лечение нужно строго по показаниям с учетом компенсации углеводного обмена и коморбидных состояний.
Ye.Yu. Komelyagina, PhD, M.B. Antsiferov, MD, PhD, Prof.
Endocrinological Dispensary of the Moscow City Health Department
Contact person: Yelena Yu. Komelyagina, komelelena@yandex.ru
On discussion is the pathogenesis of diabetic neuropathy with the emphasis on the contribution of oxidative stress, its clinical manifestations, diagnosis, and principles of therapy. Provided the indications and evidence base for the use of alpha-lipoic acid as a pathogenetic drug.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.