Комплексные подходы к коррекции сердечно-сосудистых показателей и митохондриальной дисфункции при метаболическом синдроме методом гипо-гипероксических тренировок
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В открытое одномоментное одноцентровое исследование сплошным методом были включены 120 амбулаторных пациентов в возрасте от 35 до 75 лет (64,4 ± 5,98 года). Проведены сбор анамнеза, физикальный осмотр, скрининг вероятного полиорганного МС. Мультиморбидность МС рассматривалась при наличии у пациента трех и более любых хронических заболеваний.
Результаты. Все пациенты имели сопутствующие заболевания: у 86,7% отмечалась дислипидемия, у 15,7% – стенокардия напряжения II функционального класса с сердечной недостаточностью 1–2-й степени, у 86,3% – артериальная гипертензия, у 32,8% – нарушение толерантности к глюкозе, у 35,6% – метаболически ассоциированная болезнь печени, у 14,5% – гиперурикемический синдром, у 42,8% – синдром апноэ, у 56,8% – ожирение. Большинство пациентов (82,8%) имели мультиморбидность. В зависимости от клинического анамнеза пациенты были разделены на две группы. В первую (контрольную) группу вошли 56 здоровых лиц без МС, во вторую (основную) – 64 пациента с полиорганным мультиморбидным МС. Пациентам обеих групп проведены интервальные гипо-гипероксические тренировки (ИГГТ). Продолжительность курса в среднем составила 12 дней. Установлено, что применение ИГГТ способствует значимому снижению уровней общего холестерина, липопротеинов низкой плотности, глюкозы, нормализации артериального давления, повышению гипоксической устойчивости, физической выносливости, улучшению психологического статуса, снижению маркеров окислительного стресса и росту активности ферментов антиоксидантной системы.
Заключение. При дозированном воздействии ИГГТ у пациентов с МС отмечались функциональная активация ферментной антиоксидантной системы, нормализация митохондриальной органной дисфункции при ее различном исходном состоянии. Метод ИГГТ может быть включен в протоколы комплексного лечения и реабилитации пациентов с полиорганным мультиморбидным МС.
Материал и методы. В открытое одномоментное одноцентровое исследование сплошным методом были включены 120 амбулаторных пациентов в возрасте от 35 до 75 лет (64,4 ± 5,98 года). Проведены сбор анамнеза, физикальный осмотр, скрининг вероятного полиорганного МС. Мультиморбидность МС рассматривалась при наличии у пациента трех и более любых хронических заболеваний.
Результаты. Все пациенты имели сопутствующие заболевания: у 86,7% отмечалась дислипидемия, у 15,7% – стенокардия напряжения II функционального класса с сердечной недостаточностью 1–2-й степени, у 86,3% – артериальная гипертензия, у 32,8% – нарушение толерантности к глюкозе, у 35,6% – метаболически ассоциированная болезнь печени, у 14,5% – гиперурикемический синдром, у 42,8% – синдром апноэ, у 56,8% – ожирение. Большинство пациентов (82,8%) имели мультиморбидность. В зависимости от клинического анамнеза пациенты были разделены на две группы. В первую (контрольную) группу вошли 56 здоровых лиц без МС, во вторую (основную) – 64 пациента с полиорганным мультиморбидным МС. Пациентам обеих групп проведены интервальные гипо-гипероксические тренировки (ИГГТ). Продолжительность курса в среднем составила 12 дней. Установлено, что применение ИГГТ способствует значимому снижению уровней общего холестерина, липопротеинов низкой плотности, глюкозы, нормализации артериального давления, повышению гипоксической устойчивости, физической выносливости, улучшению психологического статуса, снижению маркеров окислительного стресса и росту активности ферментов антиоксидантной системы.
Заключение. При дозированном воздействии ИГГТ у пациентов с МС отмечались функциональная активация ферментной антиоксидантной системы, нормализация митохондриальной органной дисфункции при ее различном исходном состоянии. Метод ИГГТ может быть включен в протоколы комплексного лечения и реабилитации пациентов с полиорганным мультиморбидным МС.

Введение
Проблема метаболического синдрома (МС), приобретшая за последние 35 лет масштабы пандемии, превращается в демографическую катастрофу. За десять лет компоненты МС увеличились на 16% и представляют собой кластер более чем из пяти неблагоприятных факторов риска сердечно-сосудистых заболеваний, в частности абдоминального ожирения, повышенного уровня артериального давления (АД), холестерина (ХС), липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ), глюкозы, или диагноз диабета с более чем пятью мультиморбидными заболеваниями [1–3]. По мнению экспертов Всемирной организации здравоохранения, к 2025 г. количество пациентов с МС в мире превысит 300 млн. При этом критерии произвольны, и определять МС как диагностическую единицу, а не как патофизиологический параметр нет необходимости [3, 4]. Современная патофизиологическая концепция структуры МС как «синдрома X» объединяет на первый взгляд не связанные друг с другом симптомы, фокусируя внимание на сложном многофакторном влиянии на здоровье [1–4]. Атеросклероз, сахарный диабет (СД) 2-го типа, гиперурикемический синдром, метаболически ассоциированную болезнь печени и артериальную гипертензию (АГ) целесообразно рассматривать как системные расстройства, обусловленные нарушением метаболизма липидного, углеводного, пуринового и гормонального обмена, независимо от возраста. Особенно тяжелые последствия наблюдаются у пациентов старше 60 лет. Дело в том, что указанная возрастная группа растет быстрее, чем какая-либо другая, а ожидаемая продолжительность жизни таких людей за последние 50 лет увеличилась на 50%. МС в данной группе регистрируется в 42–43,5% случаев, частота развития сердечно-сосудистых осложнений выше, частота развития СД 2-го типа достигает 90%. МС – следствие не только образа жизни и характера питания. Частота развития МС зависит также от возраста. При МС в условиях гипергликемии имеет место дисфункция эндотелия, способствующая атерогенезу. В эндотелиальных клетках активируется фермент протеинкиназа С, который увеличивает проницаемость сосудистых клеток для белков и нарушает эндотелий-зависимую релаксацию сосудов в результате активации процессов перекисного окисления липидов (ПОЛ), снижения ферментов антиоксидантной системы (ФАОС), угнетения эндотелиальной продукции оксида азота. Нарушение архитектоники эндотелиальных клеток, повышение их проницаемости для альбумина, усиление секреции сосудосуживающего эндотелина 1 и ремоделирование стенок сосудов приводят не только к развитию, но и к прогрессированию атеросклероза. Гипергликемия, сопутствующая МС, и гликирование белков (гемоглобина, альбумина, фибрина, коллагена, липопротеинов, белков клеточных мембран, в том числе гликопротеиновой системы печени) провоцируют развитие гипоксии тканей с органными ишемическими нарушениями. Гликированные липопротеины очень низкой плотности (ЛПОНП) не распознаются их нормальными рецепторами, дольше циркулируют в плазме, и период полураспада этих соединений в плазме возрастает. Гликирование липопротеинов высокой плотности (ЛПВП), обладающих атеропротекторным действием, напротив, ведет к ускоренному их метаболизму, а гликированный коллаген в два-три раза быстрее связывается с ЛПОНП, приводя к более быстрой липидной инфильтрации сосудистой стенки и образованию атеросклеротических бляшек. К тому же он менее растворим в жидких средах организма и более устойчив к разрушающему действию коллагеназы. Инсулинорезистентность и компенсаторная гиперинсулинемия приводят к АГ за счет повышения реабсорбции натрия в дистальных канальцах почки, задержке воды и увеличению объема циркулирующей жидкости. Повышается активность Na-H ионообменника, снижается активность Ca-Mg-АТФазы, что вызывает накопление Са++ и Na+ в гладкомышечных клетках сосудистой стенки и обусловливает их отек и сокращение, компенсаторное повышение сосудистого тонуса и тонуса симпатической нервной системы за счет продукции ренина. Гиперинсулинемия способствует отложению жира, усилению синтеза в жировой ткани фактора, ингибирующего активатор плазминогена (ИАП-1), тем самым снижая фибринолиз и приводя к клеточной агрегации. Увеличивается концентрация фибриногена в крови, нарушается фибринолитическая активность крови. В качестве тромбообразующего фактора рассматривается усиление реакции высвобождения из активированных тромбоцитов тромбоксана Аг и тромбоцитарного фактора роста, влияющих как на состояние сосудистой стенки, так и на гемокоагуляцию. При этом инсулин непосредственно стимулирует синтез ИАП-1 в печени и опосредованно в эндотелии сосудов.
Гипоксия сопровождается накоплением активных форм кислорода (АФК) с развитием окислительного стресса (ОС) в митохондриальной клетке, усиливается экспрессия генов антиоксидантных ферментов, в частности супероксиддисмутазы (СОД), каталазы, глутатионпероксидазы. Очевидно, что интервальные гипо-гипероксические тренировки (ИГГТ), интермиттируя ОС, стимулируют активность ФАОС. ОС в виде АФК приводит к нарушению функций и структуры артерий, инактивируя оксид азота и уменьшая его вазодилатирующее влияние, повреждает эндотелий сосудистой стенки, одновременно угнетая всю систему антиоксидантной защиты и стимулируя развитие ремоделирования сосудов. МС определяется как системное расстройство, преморбидное состояние с неясной патофизиологической основой метаболического процесса, объединяющее комплекс многофакторных заболеваний, а не клинический диагноз. До сих пор не установлена значимость и эквивалентность отдельных факторов риска, их пороговые значения для различных популяций, поэтому не существует единой таргетной терапии. Следование современным рекомендациям по лечению пациентов с МС предполагает высокую частоту назначения комбинированной терапии с одновременным назначением пяти-шести, а иногда значительно большего количества лекарственных препаратов. Одним из решений проблемы представляется применение так называемой hub-терапии («узловой»), или наднозологической таргетной фармакотерапии, в сочетании с немедикаментозными методами.
В основе патофизиологических механизмов полиорганного МС лежат разноуровневые универсальные «сетевые» узлы взаимодействия (hub), на которые можно влиять через митохондриальные клеточные, антиоксидантные механизмы [5–7] и терапию off-label. Фактически речь идет о методах и классе препаратов с «наднозологическим» действием, корректирующих нарушение баланса между процессами ОС и активностью антиоксидантов на метаболическом митохондриальном уровне [8]. В качестве кандидатов для «узловой», или наднозологической, фармакотерапии [9, 10] можно рассматривать препараты с митохондриальным, антиоксидантным, антигипоксическим действием. Препаратом выбора является таргетный фосфокреатин (Неотон), относящийся к парциальным ингибиторам бета-окисления жирных кислот (pFOX, partial fatty acid oxidation inhibitors). Улучшая эффективность использования кислорода, переключая процессы метаболизма на более экономные пути, фосфокреатин защищает ткани от последствий ОС, уменьшает транспорт активных форм жирных кислот через мембраны митохондрий и их накопление на фоне снижения интенсивности их бета-окисления, тем самым восстанавливая митохондриальную функцию. Сохраняя транспорт аденозинтрифосфата (АТФ) в цитозоль и усиливая гликолиз, при котором для обеспечения энергетических процессов требуется существенно меньше кислорода, фосфокреатин (Неотон) нивелирует наиболее кислородозатратный способ образования АТФ. Именно этот механизм является объединяющим (своего рода «узлом» – hub) в развитии широкого спектра метаболической и сосудистой мультиморбидности при полиорганном метаболическом континууме. Фосфокреатин в условиях ишемии снижает концентрацию карнитина, обеспечивая более экономное потребление кислорода, усиливая образование оксида азота, устранение вазоспазма при активации симпатоадреналовой и ренин-ангиотензиновой систем, тормозит агрегацию тромбоцитов, повышает эластичность мембран эритроцитов, оказывая антитромбогенный эффект, улучшая транскапиллярный обмен и микроциркуляцию. Вследствие энергетического митохондриально-протективного механизма уменьшаются метаболический ацидоз и накопление молочной кислоты, восстанавливается функция эндотелия и митохондрий, нивелируются полиорганный фиброз и ремоделирование на органном уровне.
В качестве немедикаментозной стратегии при полиорганном МС для улучшения митохондриальных метаболических функций сердечно-сосудистой системы рассматривается метод ИГГТ [7]. Гипоксия сопровождается снижением насыщенности кислородом артериальной крови [7–10]. При этом гипоксическое кондиционирование, пассивное (в состоянии покоя) или активное (во время упражнений), периодически воздействует системно, то есть на весь организм и/или локально на отдельные ткани, развитием гипоксии. Путем снижения доступности артериального кислорода гипоксия может улучшать кардиометаболическое здоровье [6–11] и регуляцию обмена веществ [12]. Пассивная и активная гипоксия стимулирует производство HIF-1 [12], улучшает поступление и транспорт глюкозы, гликолиз, процесс образования лактата для обеспечения АТФ [13, 14]. Установлено, что при курсовом применении ИГГТ развивается комплекс компенсаторных ответов: оптимизация функционирования симпатоадреналовой системы, увеличение мощности системы транспорта, захвата и утилизации кислорода и субстратов энергообеспечения, изменение метаболизма липидов и липопротеинов за счет активации ключевых ферментов, катализирующих этерификацию ХС, используемых клетками для предотвращения накопления свободного ХС и регулирующих образование ЛПВП. За счет активации цитохромной системы печени, ответственной за окисление ХС в желчные кислоты, снижение синтеза инсулина и уменьшение инсулиновой реакции на введение глюкозы на фоне активации синтеза инсулиновых рецепторов и повышения чувствительности тканей к инсулину, сокращается синтез ренина и отмечается некоторое снижение уровня АД [15–17]. Такой системный ответ организма крайне важен у лиц с МС и инсулинорезистентностью, нарушением толерантности к углеводам на фоне митохондриальной токсической дисфункции [17].
Как показано в работе Ю.В. Архипенко и Т.Г. Сазонтовой [18], при ИГГТ чередуются периоды дозированной гипоксии и реоксигенации. Периоды реоксигенации индуцируют продукцию АФК, которые запускают сигнальные каскады синтеза защитных внутриклеточных факторов, в том числе с антиоксидантной функцией. Как известно, фактором развития устойчивости организма является не только собственно действие гипоксии, но и результат перехода от гипоксии к нормоксии и реоксигенации. Доказано, что АФК участвуют в начальных этапах внутриклеточной редокс-сигнализации, запускающей передачу сигнала к клеточному ядру. Поступающий при адаптации к периодической гипоксии свободнорадикальный сигнал вызывает повышение резистентности клеток к действию различных повреждающих факторов. В этих условиях возможно усиление интенсивности свободнорадикального сигнала не за счет углубления гипоксического воздействия, а за счет добавления гипероксии. Разработанный метод индивидуально дозированных ИГГТ эффективен в коррекции и минимизации отдельных компонентов МС, профилактике развития метаболических и сердечно-сосудистых митохондриальных нарушений.
В исследованиях, посвященных оценке эффекта низкоинтенсивного тренировочного воздействия (55–65% максимального потребления кислорода) в условиях гипоксии, отмечались более высокие уровни норадреналина, периферическая вазодилатация, увеличение числа митохондрий, активность гликолитических ферментов, чувствительность к инсулину и/или снижение уровня лептина [19–23]. При курсовом применении ИГГТ развивается комплекс компенсаторных ответов с включением симпатоадреналовой системы, возрастают мощность субстратов энергообеспечения системы транспорта, захват и утилизация кислорода. Происходит активация ключевых ферментов, катализирующих липидную этерификацию, цитохромную систему печени, ответственную за окисление ХС в желчные кислоты в ответ на введение глюкозы, изменение метаболизма липидов. За счет активации синтеза инсулиновых рецепторов и повышения чувствительности тканей к инсулину сокращается синтез ренина и снижается АД. Такой системный ответ организма является компенсаторно-адаптационным у лиц с полиорганным МС.
При проведении ИГГТ важно чередование периодов дозированной гипоксии и реоксигенации. Это индуцирует продукцию АФК, запускаются сигнальные каскады синтеза защитных внутриклеточных факторов, в том числе с антиоксидантной функцией. При чередовании и комбинации периодов умеренной гипоксии и гипероксии эффективность адаптации возрастает за счет повышения интенсивности редокс-сигнала без углубления гипоксии, а режим тренировки «гипоксия/гипероксия» более эффективно предупреждает развитие АФК-индуцированных стрессорных нарушений. Регуляция дыхания и кровообращения нормализует доставку кислорода к тканям и его потребление за счет сочетания клеточных и системных процессов. ИГГТ, характеризуясь повторяющимися эпизодами гипоксии и реоксигенации, в значительной степени влияют на восприимчивость миокарда к ишемии/реперфузии, обеспечивая ишемическую устойчивость миокарда, что частично напоминает феномен ишемического прекондиционирования. ИГГТ, увеличивая дыхательный объем, диффузионную способность легких и альвеолярный кровоток, улучшают соотношение вентиляции и перфузии легких, приводят к перераспределению периферического кровотока и увеличению ударного объема сердца [6], значительно уменьшают прирост частоты сердечных сокращений во время гипоксии на фоне активации парасимпатической системы. Это подтверждено в экспериментальных исследованиях.
Цель – проанализировать комплексные подходы к коррекции сердечно-сосудистых показателей и митохондриальной дисфункции при МС методом ИГГТ.
Материал и методы
В открытое одномоментное одноцентровое исследование сплошным методом были включены 120 амбулаторных пациентов в возрасте от 35 до 75 лет (64,4 ± 5,98 года). Проведены сбор анамнеза, физикальный осмотр, скрининг вероятного полиорганного МС. Мультиморбидность МС рассматривалась при наличии у пациента трех и более любых хронических заболеваний. Участники исследования были разделены на две группы. В первую (контрольную) группу вошли 56 здоровых лиц, во вторую (основную) – 64 пациента с полиорганным МС. Все пациенты имели сопутствующие заболевания: у 86,7% подтверждена дислипидемия, у 15,7% – стенокардия напряжения, у 86,3% – АГ, у 32,8% – нарушение толерантности к глюкозе, у 35,6% – метаболически ассоциированная болезнь печени, у 14,5% – гиперурикемический синдром, у 42,8% – синдром апноэ, у 56,8% – ожирение (индекс массы тела более 30 кг/м2). Большинство пациентов (82,8%) имели мультиморбидность. Риск развития СД 2-го типа отмечался у 21,7% пациентов. Пациентам обеих групп проведено по 12 сеансов ИГГТ. Для пациентов второй группы была составлена индивидуальная программа проведения ИГГТ. ИГГТ выполнялись на аппарате российского производства OXYTERRA с большим количеством режимов, в том числе с режимом инверсии (тренировка начинается с фазы гипероксии, что обеспечивает нормализацию сатурации перед каждой гипоксической фазой и делает возможными ИГГТ даже у самых сложных пациентов с пониженным уровнем сатурации). Аппарат позволяет составлять индивидуальные протоколы гипоксических тренировок в зависимости от анамнеза и текущего физического состояния пациента. Методика интервальной дыхательной гипоксической тренировки основана на чередовании фаз с низким содержанием кислорода во вдыхаемом воздухе (гипоксия) и фаз с высоким (гипероксия) или нормальным (нормоксия) содержанием кислорода. Каждому пациенту было выполнено 12 сеансов по три цикла фаз гипо-гипероксии в режиме инверсии. Средняя продолжительность процедуры – 40 минут. Изначально уровень кислорода в гипоксической смеси составлял 16%, далее уменьшался в зависимости от переносимости пациентом фазы гипоксии, уровня сатурации и гемодинамики во время тренировки, количества тренировок. Терапевтический эффект достигался при поддержании уровня сатурации в гипоксической фазе 87–90%, в фазе гипероксии – 96–99%. Сеансы ИГГТ проводились три-четыре раза в неделю с применением модифицированной установки OXYTERRA. Для подбора оптимального режима тренировок предварительно проводили десятиминутный гипоксический тест. Сеансы ИГГТ начинали с подачи через маску гипоксической смеси с 11%-ным кислородом (5–7 минут). Длительность гипоксического воздействия и последующей гипероксии зависела от индивидуальной гипоксической чувствительности пациента в гипоксическом тесте, а их переключение осуществлялось автоматически по специальным алгоритмам (биообратная связь) [15]. Перед процедурой в 1-е и 5–12-е сутки проведения ИГГТ все пациенты проходили комплексное обследование, включавшее сбор анамнеза, оценку пищевого режима, антропометрические измерения (вес, индекс массы тела). Выполнялись электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), регистрировались уровень АД и частота сердечных сокращений (ЧСС). Биохимические исследования с оценкой уровней ХС, ЛПНП, ЛПВП, ТГ, глюкозы, печеночных ферментов (аспартат- и аланинаминотрансферазы), мочевой кислоты, оксида азота проводились на анализаторе Architect c8000. Для оценки выраженности ОС спектрофотометрическим методом определяли уровни ФАОС, ПОЛ: СОД, каталазы, малонового диальдегида (МДА), гидроперекиси до курса ИГГТ и на 5–12-й день после его завершения. ЭхоКГ выполнялась на аппаратах ASPEN (Acuson, США), Sonos 2500 (Hewlett Packard, США). Cтатистическая обработка полученных данных осуществлялась с использованием программы Statistica for Windows 6.0. Достоверность различий средних величин оценивали с помощью непараметрических критериев Манна – Уитни и Вилкоксона.
Результаты
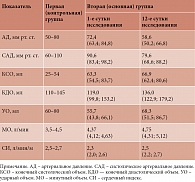
Физическая активность, биохимические показатели крови измерялись до и после последнего сеанса ИГГТ, через 5 и 12 дней после завершения ИГГТ. У всех пациентов по шкале Борга отмечалось улучшение переносимости физической нагрузки на 0,4 балла. У пациентов второй группы наблюдалось большее увеличение дистанции шестиминутной ходьбы – на 106 м, сатурации – на 1,5, а также уменьшение показателей по шкале Борга в виде улучшения переносимости физической нагрузки на 1,4 балла. Анализ антигипертензивного эффекта ИГГТ показал достоверное снижение систолического и диастолического АД в состоянии покоя (160/85 до и 130/75 мм рт. ст. после; р < 0,01). Наибольшее снижение уровня АД зарегистрировано в эукинетической группе, наименьшее – в гипокинетической. 24-часовое мониторирование АД выявило более выраженное его снижение у пациентов второй группы в виде уменьшения ночных и дневных подъемов АД. Зафиксирована нормализация суточного профиля АД с увеличением количества пациентов с адекватным снижением уровня ночного АД. Анализ показателей ЭКГ у 22 пациентов второй группы до и после пятиминутной экспозиции показал значительное увеличение амплитуды зубца Т по сравнению с исходной и смещение сегмента ST к изоэлектрической линии. ЧСС снизилась с 74 ± 2 до 68 ± 1 в минуту, а систолическое АД – с 127 ± 4 до 114 ± 2 мм рт. ст. В ходе выполнения ЭхоКГ отмечалось увеличение фракции выброса левого желудочка – 64,8 ± 5,7 против 56 ± 6,5% (р < 0,01) (табл. 1). Наблюдалась обратная корреляция между показателем оксида азота и длительностью заболевания (r = +0,64; p < 0,05), систолическим и диастолическим АД (r = +0,62; p < 0,05).
Таким образом, полученные данные продемонстрировали, что использование ИГГТ в комплексном лечении пациентов с МС ассоциируется с улучшением сократительной способности миокарда, что можно расценивать как улучшение метаболических процессов в миокарде и устранение митохондриальной дисфункции. Гипоксическое кондиционирование приводило к повышению синтеза оксида азота. Выявленные изменения обусловлены повышением сердечной парасимпатической активности гемодинамических показателей во время адаптации к гипоксии.
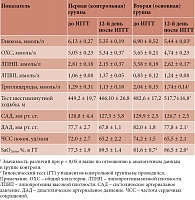
При анализе гликемического профиля зарегистрировано значительное снижение гликемии через 5 и 12 дней (6,28 ± 1,7 ммоль/л против исходного значения 7,32 ± 2,5 ммоль/л; р = 0,038). ИГГТ положительно влияют на гомеостаз глюкозы у пациентов с предиабетом, снижают уровень глюкозы натощак и во время стандартного перорального теста на толерантность к глюкозе. При амбулаторном наблюдении наиболее выраженные положительные эффекты относительно АД и уровня глюкозы наблюдались через месяц после прекращения ИГГТ. Зафиксировано снижение уровня ХС и индекса атерогенности у пациентов второй группы с дислипидемией – 5,65 ± 0,21 и 4,74 ± 0,23 ммоль/л (p < 0,05). Положительное влияние ИГГТ на два основных фактора риска атеросклероза, АГ и гиперхолестеринемию, свидетельствует о целесообразности применения таких тренировок при лечении пациентов с полиорганным МС (табл. 2).
Таким образом, адаптация к ИГГТ приводит к улучшению общего состояния больных, снижению уровней АД, общего ХС, ЛПНП, ТГ, глюкозы в сыворотке крови, улучшению микроциркуляции и оксигенации тканей. Последующие тренировки проводились с постепенным снижением содержания кислорода в гипоксической смеси, но при уровне SaO2 не ниже 80%. Гипокситерапию также можно считать альтернативным нефармакологическим способом лечения пациентов с АГ 1–2-й степени.
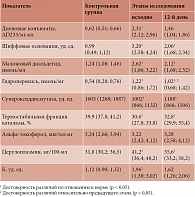
Отмечалось улучшение кардиометаболических показателей. Зарегистрировано уменьшение уровня ТГ после тренировки в гипоксических (SMD = -0,67; 95%-ный доверительный интервал (ДИ) -1,02–-0,32; p < 0,001; I2 = 41%; p = 0,09) и нормоксических условиях (SMD = -0,57; 95% ДИ -0,98–-0,15; p = 0,008; I2 = 61%; p = 0,006). В условиях гипоксии наблюдалась тенденция к снижению уровня глюкозы в крови (SMD = -0,39; 95% ДИ -0,79–0,02; p = 0,06; I2 = 48%; p = 0,06), тогда как в нормоксии изменений не было (SMD = -0,38; 95% ДИ -0,97–0,21; p = 0,21; I2 = 77%; p < 0,001). Уровень диастолического АД снизился после тренировок как в условиях нормоксии (MD = -2,99; 95% ДИ -5,52–-0,47; p = 0,02; I2 = 58%; p = 0,03), так и в условиях гипоксии (MD = -2,67, 95% ДИ -3,59–-1,76; p < 0,01; I2 = 0%; p = 0,61), но между условиями значимых различий не наблюдалось. Аналогично уровень систолического АД снизился после тренировок как в условиях нормоксии (MD = -6,08; 95% ДИ -11,19–-0,97; p = 0,02; I2 = 76%; p < 0,001), так и в условиях гипоксии (MD = -4,96; 95% ДИ -7,90–-2,02; p < 0,01; I2 = 49%; p = 0,07). Протоколы гипокситерапии, которые увеличивают базальный обмен веществ и энергозатраты, способствуют активации антиоксидантной системы. У пациентов второй группы с полиорганным МС отмечался дисбаланс в прооксидантно-антиоксидантной системе, что сопровождалось повышением показателей прооксидантного звена, снижением антиоксидантного потенциала крови и дискоординацией в работе антиоксидантных ферментов (снижение активности СОД, каталазы на фоне некоторого повышения активности церулоплазмина) (табл. 3, рис. 1–3),
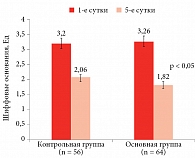
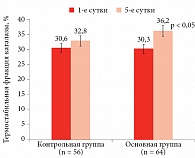
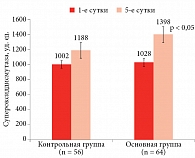
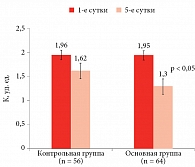
В результате исследования ПОЛ и антиоксидантной системы установлено, что в основной группе, равно как и в контрольной, показатели диеновых конъюгатов были повышены в 3,7 раза (р < 0,05), шиффовых оснований – в 3,2 раза (р < 0,05), активности МДА – в 2,1 раза (р < 0,05), концентрации гидроперекисей – в 2,3 раза (р < 0,05). Каталаза плазмы снизилась ниже нормы на 27,1% (р < 0,05), ее термостабильная фракция – на 24,1% (р < 0,05), активность СОД – на 35,9% (р < 0,05), уровень церулоплазмина оказался повышен, однако степень этих изменений не выходила за пределы статистической погрешности. Полученные результаты свидетельствуют о снижении защитных механизмов антиоксидантных ферментов у пациентов с полиорганным МС (рис. 1–5).
На фоне ИГГТ положительная динамика показателей ПОЛ во второй группе была более выраженной, чем в первой. Как видно из табл. 3, у пациентов с полиорганным МС развился резкий дисбаланс в прооксидантно-антиоксидантной системе, сопровождавшийся повышением показателей прооксидантного звена, а также снижением антиоксидантного потенциала и одновременной дискоординацией в работе антиоксидантных ферментов (снижение активности СОД, каталазы на фоне некоторого повышения активности церулоплазмина и отсутствия изменений неферментативного антиоксиданта альфа-токоферола).
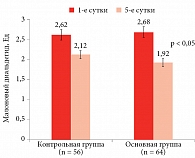
Курс ИГГТ повлиял на маркеры ОС и показатели метаболизма АФК как в первой, так и во второй группе начиная с первых суток после последнего сеанса с повышением активности СОД, каталазы и гидроперекиси к 5-му и 12-му дню. Это указывает на влияние АФК на функциональную активацию ФАОС (табл. 4). Более высокие значения маркеров ОС у пациентов с полиорганным МС уже на 5-е сутки обусловлены усилением влияния АФК на ОС. Как показано в экспериментальных исследованиях, во время ИГГТ возникает артериальная гипоксемия (PaO2 52,0–57,5 мм рт. ст.) на фоне смешанного метаболического и респираторного ацидоза в 1-е сутки после сеанса и компенсированного респираторного алкалоза на 15–30-е сутки. Во время сеансов ИГГТ аккумуляция HIF-1-альфа в миокарде возрастает в 11,6, 6,4 и 2,7 раза на 1-е, 15-е и 30-е сутки адаптации соответственно. На 1–15-е сутки проведения ИГГТ активируются процессы ПОЛ в виде увеличения МДА, повышения активности каталазы и глутатион-S-трансферазы. На 30-е сутки активность ПОЛ снижается, а уровни ферментов антиоксидантной защиты (СОД, МДА, глутатион-S-трансферазы) повышаются (см. табл. 2). Адаптация к ИГГТ приводит к повышению общего числа капилляров на единицу поверхности миокарда (14,0 и 19,8%) на 15-е и 30-е сутки в эксперименте. Таким образом, ИГГТ сопровождаются экспрессией HIF-1-альфа, активацией процессов ПОЛ, возникновением реактивных морфофункциональных изменений в митохондриях миокарда во время первого и последующих гипоксических сеансов. На 15–30-е сутки экспрессия HIF-1-альфа и активность ПОЛ снижаются при повышении активности системы антиоксидантной защиты, увеличении васкуляризации миокарда. Эти метаболические изменения сопровождаются восстановлением митохондриальной функции. Полученные данные свидетельствуют о возможности развития функциональной активности ФАОС вследствие влияния ИГГТ на антиоксидантную систему, что обусловлено индукцией экспрессии их генов субстратами ферментов и АФК, а также продуктами ПОЛ.
Применение метода ИГГТ в комплексном лечении пациентов с полиорганным МС позволяет получать клинически значимые результаты в коррекции полиорганных проявлений, сопровождается значимым уменьшением выраженности отдельных компонентов и проявлений МС, а также повышением устойчивости к физической нагрузке и выносливости, значимым снижением уровней ХС, глюкозы, нормализацией АД, улучшением физиологического и клинического статуса пациента.
Обсуждение
Многочисленные доклинические и клинические исследования свидетельствуют о том, что свободнорадикальные реакции играют существенную роль в патогенезе ишемических и метаболических нарушений. Поскольку при ишемии окисление субстратов цикла Кребса в митохондриях подавлено, возрастает содержание никотинамидадениндинуклеотидфосфата и никотинамидадениндинуклеотида, а это в свою очередь увеличивает одноэлектронное восстановление кислорода. Возникает парадокс: уменьшение концентрации кислорода приводит к увеличению содержания кислородных радикалов и других АФК. На фоне неконтролируемой «утечки» свободных радикалов возникают необратимые повреждения молекул липидов, белков и нуклеиновых кислот. Фосфолипиды, образующие двухслойную липидную мембрану, вследствие высокой ненасыщенности являются первоочередной мишенью для атаки кислородными радикалами. Установлено, что именно липидные компоненты мембраны (главным образом фосфолипиды и ХС) определяют текучесть и микровязкость крови на уровне микроциркуляции.
У пациентов с МС формируется ОС, основанный на накоплении продуктов пероксидации и снижении активности ферментного и неферментного звеньев антиоксидантной защиты в плазме крови. Рассматриваемый метод индивидуально дозированных ИГГТ эффективен в коррекции компонентов МС, профилактике развития метаболически ассоциированных митохондриальных сердечно-сосудистых осложнений. Улучшая метаболический пул, ИГГТ повышают функциональные резервы системы кровообращения и газотранспортной функции крови, стимулируя васкуляризацию ишемизированных тканей за счет улучшения микроциркуляции, повышения кислородной емкости крови и восстановления митохондриальной системы. ИГГТ способствуют снижению степени органного клеточного, митохондриального повреждения, что подтверждается более выраженным уменьшением уровня показателей ПОЛ, повышением уровня ФАОС и положительной динамикой параметров систолической и диастолической функций левого желудочка по сравнению с группой контроля, снижением показателей ПОЛ и ОС, уровней ХС, ЛПНП, купированием метаболического лактат-ацидоза и гипергликемии.
Заключение
В качестве основополагающих механизмов полиорганного МС, обусловливающего органные метаболические и гемодинамические нарушения, рассматриваются метаболическая активация процессов пероксидации и угнетение ФАОС с развитием дисфункции эндотелиальной, митохондриальной и гипоталамо-гипофизарно-надпочечниковой гормональной систем. При полиорганном МС применяемый метод индивидуально дозированных ИГГТ положительно влияет на клиническое течение, функциональные и гемодинамические показатели, оказывает таргетное цитопротективное действие.
Ограничения исследования
Исследование имело некоторые ограничения, а именно было одномоментным и включало амбулаторных пациентов. Это ограничивает возможность экстраполирования результатов на более широкую выборку пациентов аналогичного возраста.
Ключевые моменты
ИГГТ приводит к значительному улучшению кардиометаболических и митохондриальных маркеров: ТГ, ЛПНП, ЛПВП, глюкозы, ферментов антиоксидантной защиты, гемодинамических показателей с нормализацией систолического и диастолического АД, ЧСС, сократительной способности миокарда с возрастанием фракции выброса и повышением толерантности к физическим нагрузкам. ИГГТ можно рассматривать как один из немедикаментозных методов таргетной коррекции полиорганных нарушений при МС.
Источник финансирования. Поисково-аналитическая работа проведена на личные средства авторского коллектива.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
O.Sh. Oynotkinova, PhD, Prof., S.T. Matskeplishvili, PhD, Prof., O.M. Maslennikova, PhD, A.A. Yershov
Research Institute for Healthcare Organization and Medical Management of Moscow Healthcare Department
Medical Research and Educational Center of M.V. Lomonosov Moscow State University
Central State Medical Academy of Department of Presidential Affairs
Contact person: Olga Sh. Oynotkinova, olga-oynotkinova@yandex.ru
Aim – to evaluate complex approaches to correction of cardiovascular parameters and mitochondrial dysfunction in metabolic syndrome (MS) using hypoxic-hyperoxic training.
Material and methods. The open, single-stage, single-center study included 120 outpatients aged 35 to 75 years (64.4 ± 5.98 years) using the continuous method. Anamnesis, physical examination, and screening for probable multiorgan MS were collected. Multimorbidity of MS was considered if the patient had 3 or more chronic diseases.
Results. All patients had concomitant diseases: 86.7% of patients had dyslipidemia, 15.7% had FC II angina with heart failure degree 1–2, 86.3% had arterial hypertension, 32.8% had impaired glucose tolerance, 35.6% had metabolically associated liver disease, 14.5% had hyperuricemic syndrome, 42.8% had apnea syndrome, and 56.8% were obese. Most patients (82.8%) had multimorbidity. Depending on their clinical history, the patients were divided into 2 groups: the 1st control group included 56 healthy individuals without MS, the 2nd group included 64 people with multiple organ multimorbid MS. Patients of groups 1 and 2 underwent interval hypoxic-hyperoxic training (IHHT). The average duration of the course was 12 days. It was found that the use of IHHT leads to a significant decrease in the level of total cholesterol, low-density lipoproteins, glucose, normalization of blood pressure, an increase in hypoxic resistance, physical endurance, improvement of psychological status, a decrease in oxidative stress markers and an increase in the activity of antioxidant enzymes in all study participants.
Conclusion. With a dosed effect of IHHT in patients with MS, functional activation of the antioxidant enzyme system, normalization of mitochondrial organ dysfunction with its different initial state were noted. The IHHT method can be included in the protocols of complex treatment and rehabilitation of patients with multiple organ multimorbid MS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.