Систематический анализ фармакологических свойств протеин сукцинилата железа
- Аннотация
- Статья
- Ссылки
- English
Введение
Анемия широко распространена, особенно у беременных. Уже в первом триместре, на момент постановки на учет по беременности, анемия наблюдается, по разным оценкам, в 15–40% случаев: 17% (n = 3501) в Китае [1], 20% (n = 5228) в Турции [2], 32% (n = 10281) в Эфиопии [3]. При отсутствии адекватной профилактики частота встречаемости анемии нарастает к третьему триместру. По данным Минздрава России, распространенность железодефицитной анемии (ЖДА) у беременных составляет 39–44%, у родильниц – 24–27% [4].
По данным Госкомстата (2017), анемия чаще других патологий осложняет течение беременности и роды. На ее долю приходится 24,8%, нарушения родовой деятельности – 8,3%, болезни системы кровообращения – 5,7%, болезни мочеполовой системы – 5,1%, сахарный диабет – 2,4% [5]. В целом латентный дефицит железа может встречаться у 60–85% россиянок, приходящих на прием к гинекологу [6].
Столь высокая частота анемии существенно повышает риск патологий беременности и плода. Бледность кожи, потеря веса, дизосмия, извращение вкуса (стремление есть глину, штукатурку), быстрая утомляемость, мышечная слабость, снижение когнитивных способностей, головокружение, сердцебиение и нарушения терморегуляции – наиболее известные признаки умеренной или «маргинальной» анемии [7]. Даже умеренная анемия связана с повышенным риском иммунного дефицита [8], вирусных и бактериальных заболеваний, переломов вследствие снижения плотности костной ткани, гиперхолестеринемии и тромбофилии [9].
Основными причинами анемии являются алиментарные факторы: дефициты железа, фолатов, витамина В12 и других микронутриентов. Возникновению анемии способствуют гипоацидный гастрит, заболевания почек, повышенный уровень асептического воспаления (которое приводит к нарушениям обмена железа). У большинства пациенток анемия обусловлена недостатком железа и/или фолатов в пище, поэтому сочетанная терапия органическими препаратами железа и фолатами более эффективна, чем прием только препаратов железа. В настоящей работе последовательно рассматриваются основы диагностики и патофизиологии ЖДА и молекулярные механизмы антианемического действия органических соединений железа и фолатов. Представлены результаты систематического анализа исследований одной из перспективных форм органического железа – протеин сукцинилата железа (ПСЖ).
Диагностика анемий
Клинически у пациентов с анемией преобладают гипоксия тканей и снижение активности многих ферментов. Это проявляется общей слабостью, быстрой утомляемостью, шумом в ушах, головными болями, головокружением, обмороками, одышкой, сердцебиением. Обращают на себя внимание бледность и трофические нарушения кожи, выпадение волос, усиленное разрушение зубов. Гипоксия и тканевой дефицит железа приводят к расстройствам деятельности сердечно-сосудистой, пищеварительной и нервной систем. Наиболее характерные симптомы, такие как слабость, головокружения, головная боль, сердцебиение, одышка, обмороки, снижение работоспособности, наблюдаются при анемии любой этиологии и не специфичны для ЖДА. К симптомам, вызванным собственно дефицитом железа, относятся:
- сухость, шелушение, образование трещин, бледность кожи;
- тусклые, ломкие волосы;
- истончение, ломкость, поперечная исчерченность ногтей;
- синева склеры;
- глоссит с атрофией сосочков, трещины в углах рта;
- иммунодефицитные состояния, снижение Т-клеточного иммунитета;
- диспепсия.
Пониженный уровень гемоглобина в крови – один из основных лабораторных признаков анемии. ЖДА устанавливается при концентрации гемоглобина менее 120 г/л у женщин (у беременных – менее 110 г/л), менее 130 г/л у мужчин. Однако снижение уровней гемоглобина – достаточно поздний признак ЖДА, свидетельствующий об упущенной возможности адекватной профилактики. Это обстоятельство особенно актуально при беременности и обусловливает необходимость использования более чувствительных маркеров, которые позволяют своевременно начать профилактику анемии (по меньшей мере на полтора-два месяца раньше). По результатам метаанализа десяти исследований (n = 620 080), анемия в первом триместре достоверно повышает риск задержки развития плода (в среднем на 11%, p = 0,044) [10].
Более чувствительными лабораторными признаками ЖДА являются гипохромия (цветовой показатель менее 0,8, среднее содержание гемоглобина в эритроците менее 28 пг), микроцитоз (средний диаметр эритроцита менее 7 мкм, средний объем эритроцита менее 80 фл) и анизоцитоз эритроцитов. Значения коэффициента насыщения трансферрина железом у пациентов с ЖДА составляют, как правило, 15–20% (норма 35–50%) [6]. При прогрессировании ЖДА отмечаются ретикулоцитопения, лейкопения, тромбоцитопения. Исследование фармакокинетики метаболитов метилмалоновой кислоты позволяет установить субклинические дефициты витамина B12 и фолатов [11].
Для диагностики анемии могут использоваться критерии, учитывающие несколько показателей (например, уровни эритроцитов и ретикулоцитов, цинк-протопорфирина, соотношение деформированных красных кровяных телец и эритроцитов нормального размера) [12, 13]. На наш взгляд, наиболее перспективным подходом к формулировке надежных диагностических критериев анемии представляется применение современных методов интеллектуального анализа к выборкам данных пациентов с анемией.
Молекулярная патофизиология железодефицитной анемии
Приведенные выше характерные проявления любой анемии (общая слабость, головокружение, головная боль, сердцебиение, одышка) обусловлены гипоксией тканей. Обычно анемию приписывают исключительно дефициту железа (которое непосредственно участвует в транспорте кислорода). Однако для углубленного понимания патофизиологии любой анемии, в том числе ЖДА, следует вспомнить соответствующий физиологический контекст [14].
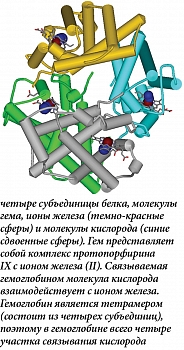
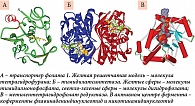
Железо входит в состав гемоглобина – основного транспортного белка кислорода. Гемоглобин (от др. греч. αἷμα – кровь и лат. globus – сфера) – основной белок эритроцитов, обратимо связывается с кислородом в капиллярах легких (рис. 1). Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются ко всем органам и тканям, где кислорода мало, здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Эртироциты также переносят углекислый газ и выделяют его в капиллярах легких одновременно с забором кислорода.
Физиологический контекст кислородного транспорта в организме указывает на несколько возможных механизмов возникновения анемии (то есть фактически функционального дефицита кислорода):
- алиментарная анемия (прежде всего дефицит железа);
- нарушения биосинтеза гема;
- нарушения образования эритроцитов (эритропоэза);
- слишком быстрое разрушение эритроцитов (гемолиз);
- кровопотери (которые неизбежно ведут к гибели эритроцитов) и т.д.
На долю алиментарной анемии приходится по меньшей мере 30% всех анемий. Примерно две трети всех алиментарных анемий связаны именно с дефицитом железа, а остальные случаи – с дефицитами витамина В12, фолатов, цинка, витамина D и др. [15, 16]. Помимо нарушений кишечника наиболее частой и, к сожалению, наименее диагностируемой причиной анемии является количественный и/или качественный голод [14].
Нарушения кроветворения (прежде всего эритропоэза) отмечаются у 10–20% пациентов с анемией. Процесс эритропоэза регулируется гормоном эритропоэтином – фактором роста эритроцитов. Регулировка уровней эритропоэтина в крови осуществляется посредством белков-сенсоров кислорода – факторов, вызываемых гипоксией (Hypoxia-Induced Factor – HIF) [17, 18]. Когда уровни кислорода недостаточны, HIF-белки непосредственно активируют транскрипцию гена эритропоэтина. Уровень эритропоэтина крови – чувствительный показатель гипоксии, который используется в качестве одного из наиболее важных критериев оценки эффективности лечения у пациентов с ЖДА [19]. На фоне ЖДА снижена секреция эритропоэтина, поэтому препараты эритропоэтина иногда применяются в антианемической терапии [20].
Анемия также связана с хроническим воспалением. Анемия часто наблюдается у пациенток, страдающих хроническими воспалительными заболеваниями (ожирением, атеросклерозом, пиелонефритом и др.) [21]. Один из возможных вариантов воздействия провоспалительных цитокинов – торможение синтеза эритропоэтина либо ингибирование его эффектов. Th2-цитокины также могут быть вовлечены в патогенез анемии: например, интерлейкин 10 приводит к анемии у пациентов с воспалительными заболеваниями кишечника [22]. Таким образом, существует ряд параллельных механизмов патогенеза анемии, которые можно объединить в две группы: «строительные материалы» для эритроцитов и «производство эритроцитов».
Молекулярные механизмы транспорта и гомеостаза железа достаточно сложны. Железо в организме человека находится в двух физиологических состояниях: или в виде запасов в ретикулоэндотелиальной системе – печени, селезенке, костном мозге, или в активном функциональном состоянии – в эритроцитах и их предстадиях. Для поддержания баланса между этими двумя состояниями необходимы многочисленные белки. В целом в геноме человека существует не менее 230 генов, белки которых вовлечены в гомеостаз железа или необходимых для проявления биологических функций этого микроэлемента.
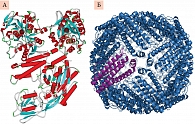
Гомеостаз железа включает десятки различных белков, каждый из них имеет уникальную функцию, без выполнения которой происходят тяжелые нарушения гомеостаза железа. Нами установлено, что в геноме представлены по крайней мере 27 генов, отвечающих за транспорт и гомеостаз железа – сидерофлексины (SFXN1, SFXN2, SFXN4, SFXN5), гены переноса ионов (SLC11A1, SLC11A2, SLC40A1), ферритино-подобные гены (FTH1, FTL, FTHL17, FTMT), фратаксин, церуллоплазмин и др. Наиболее известны из всех белков трансферрин и ферритин – основные транспортные белки железа (рис. 2) [15, 23].
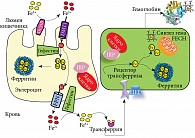
Система гомеостаза железа функционирует следующим образом (рис. 3). Цитохром двенадцатиперстной кишки (DcytB) конвертирует ионы Fe3+ в ионы Fe2+ и затем ионными каналами DMT1 и ZIP14 транспортирует железо в виде Fe2+ внутрь энтероцитов [24, 25]. В энтероцитах железо запасается в ферритиновых гранулах и по мере необходимости секретируется в кровь посредством белка ферропортина, после чего фермент гефестин (ферроксидаза, содержащая шесть ионов меди) окисляет ионы Fe2+ в Fe3+, поскольку именно ионы Fe3+ взаимодействуют с трансферрином.
Два иона Fe3+ активируют молекулу трансферрина, которая взаимодействует с трансферриновым рецептором на поверхности клеток, участвующих в синтезе гема (предшественниках эритроцитов, в клетках печени, почек и др.). Комплекс 2Fe3+-трансферрин-рецептор транспортируется внутрь клеток в мембранном пузырьке (то есть посредством эндоцитоза). Белок HFE регулирует взаимодействие трансферрина с рецепторами.
В ходе транспортировки комплекса 2Fe3+-трансферрин-рецептор рН мембранного пузырька понижается при участии особой разновидности АТФазы. Это приводит к высвобождению двух ионов Fe3+ внутри клетки, а освободившиеся рецептор и молекула трансферрина возвращаются на поверхность клетки для переноса новой порции ионов железа. Ионы Fe3+, высвободившиеся из трансферрина, либо связываются ферритином (который осуществляет внутриклеточное хранение Fe3+ в виде фосфат-оксидного комплекса), либо доставляются в митохондрии, где и включаются в состав гема с участием фермента феррохелатазы. Железорегуляторные белки представляют собой датчики цитоплазматических уровней железа и управляют экспрессией генов, кодирующих основные белки гомеостаза железа: ферритин, ферропортин, DMT1 и др. [26].
Фолаты и анемия
Фолаты – один из важнейших синергистов железа, поскольку принципиально необходимы для поддержки кроветворения. Термин «фолаты» используется для обозначения всех членов семейства соединений, в которых птероевая кислота связана с одной или более молекул L-глутамата. Фолаты необходимы для роста всех типов клеток и обезвреживания гомоцистеина. На уровне клеток фолаты принципиально важны для синтеза нуклеотидов и метилирования ДНК.
Традиционно фолиевый дефицит ассоциируется с фолиево-дефицитной анемией, признанной Всемирной организацией здравоохранения специфической нозологией (код диагноза D52 по Международной классификации болезней 10-го пересмотра). В последующем была замечена связь между дефицитом фолатов в питании и возрастанием риска дефектов развития плода (дефектов нервной трубки, пороков сердца, почек, расщелин неба и т.д.). С биохимической точки зрения фолиевый дефицит сопровождается понижением уровня фолатов в сыворотке и эритроцитах. Референсные значения совокупности всех форм фолатов в сыворотке крови составляют 7,2–15,4 нг/мл (иммуноферментный метод).
Недостаток фолиевой кислоты тормозит переход мегалобластической фазы кроветворения в нормобластическую и приводит к мегалобластической анемии (увеличение размера эритроцитов), при которой процесс кроветворения затормаживается на фазе гигантских незрелых эритроцитов. Эти эритроциты нестойки, быстро распадаются, вследствие чего в сыворотке крови увеличивается содержание билирубина. Несколько позже присоединяются лейко- и тромбоцитопения и еще более повышенная кровоточивость слизистой оболочки пищеварительного тракта, что усугубляет анемию. При остром дефиците (например, после приема антагонистов фолатов) могут отмечаться потеря аппетита, боли в брюшной полости, тошнота и диарея, появляться болезненные язвы во рту и глотке, кожные изменения и выпадение волос.
Среди основных причин фолатного дефицита – низкое потребление витамина с пищей, нарушения абсорбции вследствие атрофии желудочно-кишечного тракта или гастроинтестинальных инфекций (например, Helicobacter pylori), а также алкоголизм, генетические и ятрогенные причины (так называемые антифолиевые препараты, сульфаниламиды, содержащие эстроген пероральные контрацептивы, антибиотики, ацетилсалициловая кислота, антациды и др.) [27].
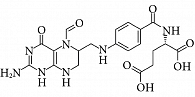
Следует отметить, что фолаты различаются по биологической активности. Например, фолиевая кислота биологически неактивна и при поступлении в организм преобразуется в биологически активные формы в два этапа. На первом этапе фолиевая кислота преобразуется в дигидрофолиевую путем присоединения двух атомов водорода. На втором этапе из дигидрофолата образуется наиболее типичная эндогенная форма фолатов – тетрагидрофолат [28]. В то же время фолиновая кислота (рис. 4), будучи аналогом биологически активного дигидрофолата, преобразуется в тетрагидрофолат в один этап. Кроме того, фолиновая кислота выгодно отличается от фолиевой тем, что не блокирует метаболизм фолатов и не вызывает «фолиевого парадокса» [29]. Фолиевая кислота, наоборот, не является биологически активным эндогенным фолатом, поэтому избыток привнесенной фолиевой кислоты в плазме крови будет ингибировать фолат-транспортер и ферменты метаболизма фолатов (рис. 5), тормозя тем самым метаболизм биологически активных эндогенных фолатов. Фолиновая кислота также является проверенным синергистом высокоусвояемой формы «органического» железа – ПСЖ.
Фармакотерапия анемии и особенности всасывания железа из протеин сукцинилата железа
Для эффективной профилактики ЖДА у беременных целесообразно назначать специализированные витаминно-минеральные комплексы, содержащие органические формы железа [30]. Однако многие женщины либо не принимают витаминно-минеральные комплексы, либо принимают комплексы для беременных, не содержащие железа, либо начинают прием витаминно-минеральных комплексов поздно (например, в третьем триместре).
Лечение уже сформировавшейся ЖДА у беременных следует проводить специальными препаратами органического и низкотоксичного железа. Препараты на основе органических соединений железа (протеин сукцинилат, цитрат, фумарат, лактат и др.) характеризуются меньшей токсичностью и повышенной биодоступностью железа. К сожалению, в большинстве препаратов железа и пищевых добавок по-прежнему используется неорганический сульфат железа, который стимулирует развитие гемосидероза, повышает риск повреждения сосудов и других тканей у беременной и риск формирования пороков пищевода у плода [31]. Данные о тератогенном влиянии сульфата железа на развивающийся плод рассмотрены в работе эксперта Всемирной организации здравоохранения по безопасности лекарственных средств академика РАМН В.К. Лепахина [32].
ПСЖ (субстанция ITF282, соединение 93615-44-2 по базе данных CAS, www.cas.org) – производное железа, предназначенное для перорального приема при ЖДА [33]. Это комплексное соединение железа, характеризующееся наличием белкового компонента (казеина). Сочетание органической соли железа (сукцинилата) с короткими фрагментами полипептидов способствует физиологичному усвоению железа, улучшая всасывание железа в двенадцатиперстной кишке, обеспечивая стабильное повышение уровня ионов железа в плазме крови. Значение LD50 для ПСЖ составило 4000 мг/кг при пероральном приеме, а для сульфата железа – ~320 мг/кг, то есть ПСЖ в 12,5 раз менее токсичен, чем сульфат железа.
ПСЖ содержит 5% элементного железа. Основное свойство ПСЖ – способность удерживать железо прочно связанным в кислой среде желудка, что способствует улучшению его всасывания в кишечнике и переносимости препарата по сравнению с неорганическими соединениями железа при лечении ЖДА [34].
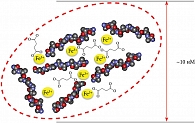
ПСЖ представляет собой комплексное соединение трехвалентного железа, в котором ионы Fe3+ окружены сукцинилат-анионами и пептидными фрагментами, предотвращающими повреждение слизистой оболочки желудка (рис. 6). В эксперименте после однократного приема ПСЖ концентрация свободного железа в желудке составляла менее 10% от концентрации, обнаруженной после приема равной дозы сульфата железа. Таким образом, при приеме ПСЖ не создаются условия для повреждения слизистой желудочно-кишечного тракта, как это происходит в случае приема сульфата железа [35].
Абсорбция железа из ПСЖ была исследована в эксперименте. Абсорбция меченных радиоактивным железом комплексов ([59Fe]-сукцинил-казеин, [59Fe]-альбумин, [59Fe]-ферритин и [59Fe]-сульфат) изучалась на изолированных фрагментах двенадцатиперстной, тонкой и подвздошной кишки мышей. Всасывание всех соединений железа происходило преимущественно в двенадцатиперстной кишке. Инкубация в течение 15 минут в тонкой кишке и 60 минут в подвздошной кишке продемонстрировала крайне низкую степень абсорбции [59Fe] [36].
Высокая степень абсорбции железа при пероральном приеме ПСЖ объясняется ферментативным расщеплением комплекса при его абсорбции. Структуру ПСЖ комплекса исследовали методами мессбауэровской спектроскопии, изучалась кинетика выделения железа с использованием хелаторов. Обработка ПСЖ пепсином и затем панкреатином показала, что механизм абсорбции ПСЖ в организме включает физиологическое пищеварение с последовательной ферментацией, приводящее к формированию растворимых железо-белковых фрагментов приблизительно 10 нм в диаметре (рис. 6) с высокой биодоступностью. Из этих частиц в пристеночном слое слизистой оболочки двенадцатиперстной кишки высвобождается ион Fe3+, который и всасывается энтероцитами (см. рис. 3) [37].
Доказательные данные по препаратам на основе протеин сукцинилата железа
ПСЖ эффективен в терапии ЖДА акушерской или гинекологической этиологии. Пациентки с ЖДА (n = 3200) проходили лечение ПСЖ (80 мг/сут Fe3+, 30 дней и более). ПСЖ обеспечивал достоверное статистически значимое (р < 0,01) повышение средних показателей гемоглобина и сывороточного железа, снижал интенсивность проявления субъективной симптоматики (астении, анорексии) и клинических признаков ЖДА (полипноэ, бледности кожи и слизистых оболочек). Терапия ПСЖ сопровождалась незначительными и достаточно редкими побочными реакциями: диарея, болезненность/дискомфорт в эпигастрии встречались у 2,4% пациентов [38].
При проведении метаанализа исследований по ПСЖ (n = 1800) пациенты были разделены на подгруппы в зависимости от степени тяжести анемии (уровни гемоглобина < 9 г/дл, от 9 до 11 г/дл и > 11 г/дл). В течение 60-дневного курса лечения ПСЖ вызывал наиболее существенный подъем уровня гемоглобина в подгруппе с самой тяжелой анемией. У ПСЖ частота побочных эффектов была существенно ниже, чем у других препаратов (9,4 против 20,4%, р < 0,01). Изучение распределения побочных эффектов в популяции показало, что ПСЖ обеспечивает достоверно лучшую переносимость у беременных (относительный риск 0,321, р < 0,01) [39].
Выполнен ретроспективный анализ 17 исследований ПСЖ (n = 3354, 80 мг/сут Fe3+, 30–120 суток). В исследованиях с контрольными группами частота побочных реакций составила 8,6% (6,2% в педиатрии, 12,3% в акушерстве и 7,3% при ЖДА). Частота побочных реакций при использовании ПСЖ была на 38–72% ниже таковой при приеме препаратов сравнения (сульфата железа, ферритина, полистиролсульфоната железа). Подавляющее большинство побочных реакций было представлено легкими кратковременными эпизодами диареи (2,0%) или болями в эпигастральной области (1,9%). Данный характер побочных реакций был отмечен во всех исследованиях независимо от их цели или типа (за исключением исследований беременных, у которых, как и ожидалось, преобладала тошнота) [40].
Побочные эффекты препаратов на основе протеин сукцинилата железа
Хорошая переносимость и слабая выраженность побочных эффектов ПСЖ – факт, подтвержденный в многочисленных клинических исследованиях. Важно подчеркнуть, что препараты на основе ПСЖ могут применяться в терапии ЖДА у детей, не вызывая при этом существенных побочных эффектов.
Так, было проведено исследование с участием 502 детей в возрасте до 14 лет с ЖДА. 256 детей получали ПСЖ, а 246 – полистиролсульфонат железа (60 и 52,5 мг/сут элементного железа при массе тела до 40 кг и 120 и 105 мг/сут при массе тела более 40 кг соответственно) в течение двух месяцев. К концу курса лечения существенно большее содержание сывороточного железа наблюдалось в группе принимавших ПСЖ. Общая переносимость была значительно лучше при приеме ПСЖ: нежелательные реакции зарегистрированы только у 13 пациентов (1 – жжение за грудиной, 6 – запор, 6 – боль в области желудка). В группе сравнения – у 43 (1 – жжение за грудиной, 2 – боль в эпигастрии, 14 – запор, 14 – боль в области желудка, 3 – кожная сыпь, 14 – рвота) [41].
Сравнительное исследование эффективности и безопасности ПСЖ в сравнении с комплексом полимальтозы гидроксида железа проводилось в ходе терапии детей с сидеропенией или сидеропенической анемией (n = 100, 48% мальчиков, 52% девочек, средний возраст 3,5 ± 3 года). Участники получали ПСЖ (группа А) или комплекс полимальтозы гидроксида железа (группа B) в количестве 4 мг/кг элементного железа (максимально 80 мг/сут) в течение двух месяцев. На фоне приема ПСЖ отмечены более быстрое увеличение уровня гемоглобина, нормализация гематокрита, среднего объема эритроцитов, сывороточного железа и ферритина. Более того, значения этих лабораторных показателей оставались выше в группе А даже после двух месяцев лечения. Оба препарата хорошо переносились и сопровождались незначительными побочными реакциями, сопоставимыми по степени тяжести и частоте встречаемости [42].
При пероральном приеме ПСЖ характеризуется хорошей переносимостью и эффективностью в профилактике и терапии анемии у недоношенных детей (менее 35 недель беременности, n = 60). Группа детей была случайным образом разделена на прием ПСЖ (n = 30) или полисахаридного комплекса железа (n = 30) в добавление к рекомбинантному эритропоэтину. Лечение началось через две недели после рождения. В группе ПСЖ количество эритроцитов и гематокрит, сниженные после рождения, постепенно возрастали на фоне терапии. В группе получавших полисахаридный комплекс железа уровни эритроцитов и гематокрит продолжали снижаться с рождения и до 60-го дня терапии. На 60-й день в группе принимавших ПСЖ отмечены значительно более высокие уровни гемоглобина, эритроцитов, гематокрита, сывороточного железа и ферритина сыворотки, чем в группе полисахаридного комплекса железа (p < 0,05). Никаких заметных побочных эффектов не зафиксировано в обеих группах [43].
Плацебоконтролируемое, двойное слепое многоцентровое исследование ПСЖ было проведено у пациентов с ЖДА или латентным железодефицитом (n = 1095). Основная группа пациентов (n = 549) получала ПСЖ (60 мг/сут), а группа сравнения (n = 546) – сульфат железа (в пролонгированной форме, 105 мг/сут) в течение двух месяцев. К концу лечения показатели гематокрита, гемоглобина и ферритина были значительно выше в группе ПСЖ, что указывает на его более выраженный и устойчивый терапевтический эффект. Общая переносимость была значительно лучше для ПСЖ. В основной группе (ПСЖ) побочные реакции отмечены в 5,75% случаев (63 пациента, в том числе у 25 – жжение за грудиной, 25 – боль в области желудка, 19 – запор и др.). В группе сравнения (сульфат железа) побочные эффекты наблюдались значительно чаще – в 23,2% случаев (127 пациентов, в том числе у 33 человек – жжение за грудиной, 32 – боли в области желудка, 23 – запор, 14 – позывы к рвоте, 8 – кожная сыпь и др.) [44].
В отличие от неорганических соединений железа (сульфаты железа, смеси окислов железа с полисахаридами и т.п.) препараты на основе ПСЖ (например, Ферлатум Фол®) в меньшей степени влияют на моторику кишечника. Это делает перспективным применение препаратов на основе ПСЖ у больных ЖДА, склонных к запорам (прежде всего у беременных).
ПСЖ – эффективное и хорошо переносимое средство для лечения ЖДА у беременных. Было проведено исследование, в которое включали беременных, соответствующих следующим критериям: железодефицитный тип анемии, уровень гемоглобина ниже 11,5 г/дл (первый триместр), 10,9 г/дл (второй триместр) или 10,3 г/дл (третий триместр), а также отсутствие осложнений, связанных с беременностью. Пациентки получали 1600 мг/сут ПСЖ ежедневно в течение четырех месяцев. Большинство симптомов и признаков анемии (бледность слизистой оболочки, поражения кожи и ногтей, глоссит, анорексия, апатия, атаксия, полипноэ, бессонница, нервозность, парестезии) постепенно регрессировали к концу курса терапии. Наблюдалось статистически значимое увеличение уровней гемоглобина, гематокрита, показателей лейкоцитов, среднего объема эритроцитов, среднего содержания гемоглобина в эритроците, тромбоцитов и сывороточного ферритина (p < 0,05). Анемия эффективно лечилась у большинства (n = 100, 95,2%) участниц за исключением пяти (4,8%) пациенток, которые плохо соблюдали протокол лечения. Временные и мягкие побочные эффекты (диарея, эпигастралгия, рвота и тошнота) отмечены у семи (6,6%) женщин, что, однако, не потребовало прекращения курса терапии [45].
ПСЖ хорошо совместим с другими лекарственными средствами. Например, назначение ПСЖ совместно с блокаторами Н2-гистаминовых рецепторов (используемых как гастропротекторы) обеспечивает адекватный уровень клинической эффективности и переносимости без признаков негативного взаимодействия препаратов. Пациентам с латентными железодефицитными состояниями (n = 47) или анемией (n = 53), получавшим Н2-антигистаминные средства, был назначен ПСЖ (60 мг/сут элементного железа, 60 дней). Общая переносимость терапии была несколько лучше в группе пациентов, получавших гастропротекторы (1 случай диареи), чем у пациентов, получавших только ПСЖ (1 случай – жжение за грудиной, 3 – запор, 2 – боль в области желудка). Все единичные случаи непереносимости были преходящими и не требовали снижения дозировки или отмены препарата [46].
Фармакокинетический синергизм протеин сукцинилата железа и фолатов
Помимо фармакодинамического синергизма (кроветворение) фолаты способствуют повышению абсорбции железа в организме при пероральном приеме препаратов железа. Фолиновая кислота не только способствует улучшению эритропоэза, но и улучшает всасывание ионов железа при совместном приеме с ПСЖ. Как показало рандомизированное клиническое исследование, прием 80 мг/сут ПСЖ в сочетании с 370 мкг фолиновой кислоты был более эффективен при лечении ЖДА во время беременности (n = 371, 14–27 недель беременности, 60 дней), чем прием только соединения железа. Увеличение уровня гемоглобина от исходного уровня составляло 1,42 ± 0,14 г/дл для комбинированной терапии и всего 0,80 ± 0,125 г/дл для приема только соединения железа (р < 0,001) [47].
ПСЖ и фолиновая кислота входят в состав препарата Ферлатум Фол (регистрационный номер ЛСР-004031/07 от 21.11.2007). Раствор для приема внутрь (флакон 15 мл) содержит 800 мг ПСЖ (эквивалентно 40 мг элементного железа) в сочетании с 200 мкг фолината кальция (соответствует 185 мкг фолиновой кислоты). Фолиновая кислота добавляется к раствору ПСЖ непосредственно перед употреблением (это позволяет предотвратить окисление фолиновой кислоты и сохранить ее активность). Препарат предназначен для лечения латентной ЖДА (один флакон в сутки) и клинически выраженной ЖДА (один-два флакона в сутки) в период беременности, лактации, активного роста. Кроме того, препарат показан для лечения анемии после длительных кровотечений и алиментарной анемии, возникающей на фоне неполноценного питания.
Заключение
Имеющиеся препараты железа существенно различаются по биодоступности железа, эффективности компенсации ЖДА и безопасности применения. Согласно результатам систематического анализа исследований ПСЖ, синергическая комбинация ПСЖ и фолиновой кислоты позволяет осуществлять эффективную и безопасную патогенетическую терапию ЖДА.
С практической точки зрения для терапии и профилактики ЖДА перспективным следует признать использование именно растворов органических солей железа (в частности, на основе ПСЖ). Растворы существенно повышают всасывание железа в желудочно-кишечном тракте по сравнению с твердыми фармацевтическими формами. Действительно, в жидких формах препаратов ионы железа в комплексе с органическими анионами уже переведены в растворимую биодоступную форму. Это позволяет снизить потери железа, которые неизбежно возникают при растворении частиц из твердых форм в соляной кислоте желудка.
Кроме того, соединения железа следует дополнять фармакокинетическими и фармакодинамическими синергистами железа. Приводимые в настоящей работе данные показывают, что одновременный прием ПСЖ и фолиновой кислоты (Ферлатум Фол) является эффективным и безопасным методом профилактики латентной недостаточности железа и терапии ЖДА.
O.A. Gromova, I.Yu. Torshin, N.K. Tetruashvili, I.V. Gogoleva
Federal Research Center ‘Computer Science and Control’ of Russian Academy of Sciences, Moscow
Ivanovo State Medical Academy
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
The selection of the most appropriate iron preparations for the treatment and prevention of iron deficiency anemia is the contemporary direction of research in the modern clinical medicine. Available iron preparations differ significantly in the bioavailability of iron, the effectiveness and safety of compensation for iron deficiency anemia. In this article, we consider the molecular mechanisms of anemia etiopathology, including alimentary deficiency of iron, folates and vitamin B12, erythropoiesis disorders and chronic inflammation. The results of the systematic analysis of studies of ferrous protein succinilate show that the combined use of ferrous protein succinilate and active folates (drug Ferlatum Fol) allows making pathogenetic therapy of iron deficiency anemia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.