Современная энтеросорбция в коррекции уровня эндотоксинов при неинфекционной диарее
- Аннотация
- Статья
- Ссылки
- English




Повышенный интерес исследователей к эндотоксину (ЭТ) грамотрицательных бактерий, или липополисахариду (ЛПС), обусловлен не только его уникальной структурой и широким разнообразием биологических эффектов. Вызывая активацию лейкоцитов и макрофагов, ЭТ стимулирует продукцию эндогенного пирогена. При этом для развития приступа лихорадки достаточно присутствия в инфузионном растворе бактериальных ЭТ в концентрации 1 нг/мл. Кроме того, происходит активация миелопоэза, системы комплемента, фактора некроза опухоли, антагонистов глюкокортикостероидов, интерферона, интерлейкинов и других медиаторов, синтеза острофазовых белков. Наблюдается также поликлональная активация В-клеток [1].
Рост уровня ЭТ в крови может быть обусловлен как повышением его продукции в кишечнике, так и увеличением проницаемости энтерогематического барьера. Так, I. Bjarnason (1987) отмечал, что по меньшей мере энтеропатия, ассоциированная с нестероидными противовоспалительными средствами, и болезнь Крона – две ситуации, которые действительно соответствуют современным представлениям о патофизиологии повышения проницаемости энтерогематического барьера. При этом степень повышения такой проницаемости, по-видимому, соответствует остроте заболевания и степени тяжести. Эндотоксикоз поддерживает метаболические нарушения, что способствует формированию порочного круга воспаления [2].
Непременное условие возникновения системной эндотоксинемии – недостаточность барьерной функции печени. К факторам риска развития системной эндотоксинемии относятся избыточная гибель кишечной микрофлоры (антибактериальная терапия, дисбактериоз), повышение проницаемости кишечного барьера (шок, дисбактериоз), замедление портального кровотока (застойная сердечная недостаточность, шок, портальная гипертензия любой другой этиологии), болезни печени (цирроз, гепатит) и любые патологические процессы, сопровождающиеся шунтированием портального кровотока (шок, портальная гипертензия любой этиологии) и угнетением функциональной активности системы фиксированных макрофагов печени (шок, острый деструктивный панкреатит, общий наркоз, сахарный диабет и др.) [3].
Синдром эндотоксиновой агрессии сопутствует различным заболеваниям, а следовательно, по своему происхождению является многофакторным и развивается при накоплении ЭТ. Заболевания, которые сопровождаются нарушением кишечного барьера, могут быть самыми разнообразными и протекать как с изолированным поражением желудочно-кишечного тракта (ЖКТ), так и вне пищеварительной системы. Нарушением энтерогематического барьера сопровождаются язвенная болезнь, воспалительные заболевания кишечника, синдром раздраженного кишечника (СРК), инфекционные заболевания, а также хронический запор [4].
А.А. Камалова выявила достоверно высокие уровни ЭТ в сыворотке крови детей с язвенной болезнью двенадцатиперстной кишки и воспалительными заболеваниями желчного пузыря – хроническим холециститом и желчнокаменной болезнью [5].
Предполагается, что эндотоксинемия участвует в патогенезе воспалительных заболеваний кишечника (ВЗК) (язвенный колит, болезнь Крона), колоректального рака и рака молочной железы, заболеваний дыхательной системы (бронхиальная астма, хронический бронхит), аллергии и даже нервно-психических расстройств.
В последние годы интерес к применению ЛАЛ-теста в клинической практике возрос. Уровень ЭТ в целях диагностики при различных патологических процессах определяют редко, несмотря на то что выявление ЭТ в крови внесено в номенклатуру медицинских услуг под кодом А09.05.107. Услуга «Исследование эндотоксина в крови» включена в стандарты медицинской помощи [6].
Воздействовать на уровень ЭТ в крови можно по-разному. Однако наиболее изученной считается энтеральная детоксикация с помощью современных энтеросорбентов. Энтеросорбенты эффективно связывают и выводят из организма эндогенные и экзогенные токсичные соединения, надмолекулярные структуры и клетки, а также используются в лечебных и профилактических целях [7, 8]. Современные энтеросорбенты, которые представлены, в частности, полиметилсилоксана полигидратом (ПМСПГ), имеют относительно высокую молекулярную массу и в отличие от твердых сорбентов на основе угля, глины, диоксида кремния не обладают мембранотропным эффектом, не проникают через энтерогематический барьер, а следовательно, работают только в кишечнике.
Механизм лечебного действия энтеросорбентов связан с прямым и опосредованным эффектом [9]. Прямое действие сводится к извлечению, фиксации и выведению из ЖКТ бактериальных токсинов, поглощению эндогенных продуктов секреции и гидролиза, биологически активных веществ (нейропептидов, простагландинов, серотонина, гистамина), сорбции патогенных, условно патогенных микроорганизмов, вирусов, связыванию газов [10, 11]. Благодаря опосредованному эффекту поддерживается нормальный микробиоценоз кишечника, что улучшает пищеварение и обеспечивает высокую метаболическую активность энтероцитов [12]. Такие частицы размером менее микрометра свободно проникают из кишечника через энтерогематический барьер и попадают в кровь и другие среды организма [13].
ПМСПГ является кремнийорганическим полимером, поровое пространство которого заполнено водой. Пористая структура ПМСПГ образована микрогранулами. На поверхности раздела фаз, то есть на поверхности микроглобул ПМСПГ, присутствуют метильные группы (гидрофобные) и гидроксильные радикалы (гидрофильные). Количество гидрофобных групп превышает число гидрофильных, что в принципе и определяет гидрофобные свойства сорбента [14–17]. Частицы ПМСПГ обычно образуют непрерывную сеть в суспензии для уменьшения взаимодействия гидрофобных групп SiCH3 с водой. Эти частицы можно рассматривать как двумерные листы, а не трехмерные твердые частицы. Водные суспензии ПМСПГ характеризуются высокой вязкостью [18]. Частички ПМСПГ повышенной вязкости покрывают участки слизистой оболочки и защищают ее от повреждающего воздействия токсинов бактерий и различных активных химических соединений, например деконъюгатов солей желчных кислот, повреждающих слизистую оболочку ЖКТ. Поглотительный и защитный эффекты ПМСПГ обусловлены его физико-химическими свойствами. Пористая структура гелеобразующей матрицы определяет поглотительную способность по механизму молекулярной адсорбции и позволяет адсорбировать преимущественно среднемолекулярные токсические вещества и метаболиты (в частности, билирубин, продукты распада белков) [15, 19–21]. Благодаря гелеобразной консистенции ПМСПГ поглощает высокомолекулярные токсические вещества по механизму соосаждения в геле (бактериальные токсины) и проявляет защитные свойства. ПМСПГ характеризуется выраженной способностью поглощать молекулы ЛПС. Суточная доза ПМСПГ связывает 410 мг ЛПС [14]. Сказанное объясняет интерес к полимерным кишечным адсорбентам с относительно высокой молекулярной массой.
Следует отметить, что многие хронические заболевания затрагивают кишечник и сопровождаются диарейным синдромом. Современные энтеросорбенты продемонстрировали эффективность в нормализации уровня ЭТ крови на животных моделях.
Так, показано статистически достоверное сокращение продолжительности лечения диареи неинфекционного генеза на фоне современной энтеросорбционной терапии [22]. В то же время следует признать целесообразным изучение возможностей современной энтеросорбции в коррекции уровня эндотоксинемии как патогенетическое обоснование терапии у пациентов с неинфекционной диареей.
Материал и методы
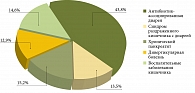
В многопрофильном стационаре в 2017–2018 гг. нами изучалась концентрация ЭТ в сыворотке пациентов с диарейным синдромом неинфекционного генеза различной этиологии: СРК с диареей (СРК-Д), хроническим панкреатитом (ХП) с внешнесекреторной недостаточностью, дивертикулярной болезнью (ДБ) толстой кишки, антибиотик-ассоциированной диареей (ААД), ВЗК, в частности язвенным колитом (рис. 1).
Характеристика пациентов
В исследовании участвовал 171 пациент (64,5% мужчин, 35,5% женщин). У 23 (13,5%) пациентов диагностирован СРК-Д, у 22 (12,9%) – ДБ толстой кишки, у 25 (14,6%) – ВЗК, в частности язвенный колит, у 26 (15,2%) – обострение ХП, протекавшего с внешнесекреторной недостаточностью и синдромом мальабсорбции. Наибольший процент (43,8%) составили пациенты с ААД различной степени тяжести (n = 75). Преобладали мужчины (64,5%).
Ведущей нозологией являлась ААД (51,6%): 81,2% мужчин (средний возраст – 62,7 года), 18,8% женщин (средний возраст – 59,8 года). СРК-Д и ВЗК (язвенный колит) встречались в 12,9% случаев. СРК-Д преобладал у женщин – 75% (средний возраст женщин – 59,3 года, мужчин – 36,5 года), язвенный колит – у мужчин – 75% (средний возраст мужчин – 47,2 года, женщин – 35,3 года). ДБ и ХП диагностированы с одинаковой частотой – 9,7%. При этом и ДБ, и ХП чаще регистрировались у женщин – 66,6% (средний возраст женщин с ДБ – 79 лет, мужчин – 78 лет, средний возраст женщин с ХП – 70,5 года, мужчин – 65 лет).
Все пациенты получали терапию основного заболевания, согласно рекомендациям Российской гастроэнтерологической ассоциации по соответствующей нозологии. Лечение ВЗК проводилось на основании рекомендаций Европейского общества колопроктологов и Европейской организации по изучению болезни Крона и колитов и клинических рекомендаций Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению язвенного колита.
Пациенты случайным образом были разделены на три группы. 60 пациентам первой группы в комплексной терапии назначали ПМСПГ дробно по 15 г три раза в день в суточной дозе 45 г/сут. 56 пациентов второй группы дополнительно к базовой терапии получали диоктаэдрический смектит 3,76 г три пакетика в сутки. Оба препарата назначались в промежутке между приемом пищи и других препаратов. 55 пациентов третьей группы сорбенты не получали.
В ходе исследования оценивали влияние энтеросорбентов на частоту стула и длительность стационарного лечения, сравнивали эффективность ПМСПГ и диоктаэдрического смектита. Кроме того, изучалось наличие корреляции уровня ЭТ сыворотки с патогенезом (воспалительный, дисфункциональный) диарейного синдрома и тяжестью заболевания.
Сыворотка пациентов была исследована на содержание ЭТ с помощью ЛАЛ-теста, основанного на способности белкового лизата циркулирующих амебоцитов краба Lumulus polyphemus сворачиваться (превращаться в гель) при инкубации с липополисахаридами (Limulus Amebocyte Lysate). Чувствительность способа менее 100 нг ЛПС в 1 мл анализируемой пробы.
Концентрацию ЭТ оценивали при поступлении в стационар (на вторые-третьи сутки) и в динамике в процессе терапии. Интервал определяли в зависимости от нозологии и клинической картины. При ВЗК второй забор крови осуществлялся на 15–17-е сутки, при ДБ – на 6–8-е, при ХП – на 8–10-е, при СРК-Д – на 8–9-е, при ААД – на 10–13-е сутки. Некоторым пациентам с сохранявшимся диарейным синдромом забор крови выполняли трехкратно, последний раз – при нормализации стула, как правило на 18–20-е сутки. Клинически значимым считался уровень эндотоксинемии, который отражался в превышенных показателях ЛАЛ-теста. Референсные значения составили 0,3.
Результаты и обсуждение
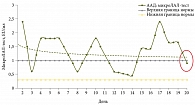
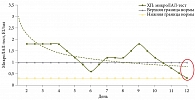
При ААД уровень ЭТ был повышен в начале заболевания и, несмотря на некоторое снижение, оставался повышенным к концу лечения через две недели на фоне положительной клинической динамики в виде купирования диареи или урежения частоты стула (рис. 2).
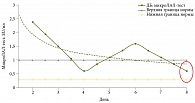
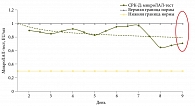
Эндотоксинемия (превышение нормы эндотоксина, определяемого с помощью ЛАЛ-теста) выявлена при ВЗК, ДБ, ХП (рис. 3–5). По мере купирования симптомов обострения основного заболевания эндотоксинемия разрешилась, уровень ЭТ (ЛАЛ-тест) вернулся к нормальным показателям в течение двух недель.
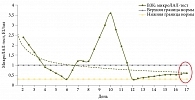
При СРК-Д (рис. 6), несмотря на частый стул, исходный уровень ЭТ был нормальным, к концу терапии несколько снизился. Корреляции между частотой стула и выраженностью эндотоксинемии при ЛАЛ-тестировании при поступлении пациентов в стационар не установлено ни при одной из исследуемых нозологий.
Таким образом, при воспалительных заболеваниях ЖКТ неинфекционного генеза в стадии обострения или при остром течении имеет место избыточная эндотоксинемия. В то же время при функциональных расстройствах кишечника таковой не наблюдается. При этом ААД сопровождается пролонгацией эндотоксикоза даже после купирования диарейного синдрома.
В результате проведенного лечения с применением ПМСПГ удалось в более короткий срок добиться урежения стула независимо от генеза диареи: при ААД – на 13-е сутки (без энтеросорбентов – на 17-е), при ДБ – на 12–13-е (без энтеросорбентов – на 16-е), при ХП – на 9–10-е сутки (без энтеросорбентов – на 12-е сутки). Наилучший эффект достигнут при СРК-Д: на 9-е сутки лечения с применением ПМСПГ удалось практически нормализовать стул (в отсутствие энтеросорбентов сокращение частоты стула до одного-двух раз в день отмечалось на 14-е сутки). При лечении пациентов с ВЗК не установлено достоверной разницы в продолжительности диареи в группах с энтеросорбентом и без такового.
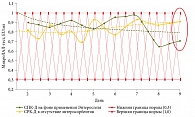
У пациентов с диареей, получавших комплексную терапию с использованием ПМСПГ, уровень ЭТ в крови снижался быстрее, чем у пациентов, не принимавших ПМСПГ (рис. 7–9). У больных ДБ, ХП и ВЗК уровень ЭТ в сыворотке крови нормализовался быстрее, чем у пациентов контрольной группы, что совпало по времени с клиническим излечением. При СРК-Д уровень ЭТ не превышал нормальных значений. При динамическом наблюдении в группе ПСМПГ также наблюдалось некоторое снижение ЭТ (рис. 10).
У больных ААД нормализации повышенного уровня эндотоксина в сыворотке крови, несмотря на некоторое снижение, не зарегистрировано (рис. 11).
Выводы
При воспалительных заболеваниях ЖКТ неинфекционного генеза имеет место повышенный уровень ЭТ, который нормализуется по мере купирования диарейного синдрома. В то же время при функциональных расстройствах кишечника значительного повышения уровня ЭТ не наблюдается.
Уровень ЭТ в сыворотке крови при различных неинфекционных заболеваниях, сопровождающихся диарейным синдромом, зависит от активности воспаления, что позволяет использовать определение концентрации ЭТ сыворотки в динамике для оценки эффективности и коррекции проводимой терапии.
Эффективность ПМСПГ при различных неинфекционных заболеваниях, сопровождающихся диарейным синдромом, может объясняться способностью ПМСПГ снижать повышенный уровень ЭТ в сыворотке крови до нормальных значений. Вероятно, снижение концентрации ЭТ – один из механизмов воздействия ПМСПГ на течение воспалительных заболеваний ЖКТ неинфекционного генеза.
Определение ЭТ с помощью ЛАЛ-теста служит прогностическим маркером тяжести и длительности заболевания, а также позволяет провести дифференциальную диагностику функциональных и органических заболеваний ЖКТ.
A.I. Pavlov, MD, PhD, A.V. Khovanov, PhD, A.K. Khavanshanov, Zh.V. Fadina, A.B. Shames, MD, PhD
A.A. Vishnevsky 3rd Central Military Clinical Hospital
Moscow State University of Food Production
TNK SILMA, LLC
Contact person: Aleksandr I. Pavlov, doctor-pavlov@mail.ru
In clinical practice non-infectious diseases occurring with diarrheal syndrome are often found. Damage to the gastrointestinal mucosa leads to a violation of its barrier function. At the same time, intestinal permeability increases and the risk of developing endotoxin aggression increases. This makes it relevant to use drugs that help restore the integrity of the enterohematological barrier and prevent endotoxemia. The level of endotoxemia also depends on an increase in the production of endotoxin in the intestine and insufficient barrier function of the liver. The concentration of endotoxin in serum can be a diagnostic marker for determining the nature of diarrhea syndrome, a factor in predicting the severity and duration of the disease, as well as the effectiveness of the therapy. The review presents the results of studies proving the feasibility and effectiveness of the use of enterosorbents, in particular polymethylsiloxane polyhydrate, in the complex treatment of non-infectious diarrhea.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.