Современная терапия невропатической боли
- Аннотация
- Статья
- Ссылки



Невропатическая боль снижает качество жизни больных, их социальную адаптацию и трудоспособность и во многих случаях плохо поддается терапии, что обусловливает высокую социальную и медико-экономическую значимость ее своевременной диагностики и лечения. Согласно современной патофизиологической классификации болевых синдромов, основанной на выделении основного механизма формирования боли, невропатическая боль вызывается первичным повреждением или заболеванием соматосенсорных структур.
Таким образом, в основе невропатической боли лежит патологическая активация путей проведения боли, что может быть связано с повреждением нервной системы на уровне периферических нервов и задних корешков (периферическая невропатическая боль) или спинного и головного мозга (центральная невропатическая боль) [1–3]. Типичными примерами периферической невропатической боли являются болевая диабетическая полиневропатия (ДПН), боли при невромах, боли при поражении нервных корешков (дискогенная радикулопатия) или дорзальных ганглиев (постгерпетическая невралгия (ПГН)). Центральная невропатическая боль развивается при поражении спинного (травматическое повреждение и сирингомиелия) и головного (рассеянный склероз, постинсультное состояние) мозга (табл. 1). Невропатическая боль может быть как острой (дискогенная радикулопатия), так и хронической (периферические невропатии, сирингомиелия, постинсультная боль).
Распространенность невропатической боли
Исследования, проведенные в различных странах, показали, что невропатическая боль наблюдается у 6–8% популяции [4, 5] и ассоциирована с хроническими болевыми синдромами, женским полом, пожилым возрастом больных и невысоким уровнем социального положения – данные факторы могут рассматриваться как факторы риска. Невропатическая боль характеризуется большей интенсивностью болевого синдрома и более частым обращением за медицинской помощью.
По результатам Российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу (Russian epidemiological study of Neuropathic Pain prevalence, conditions, underlying NeP and detailed pain characteristics among patients applying for medical care in outpatient neurology units, EPIC), из 85 923 пациентов, обратившихся к врачам-неврологам, жалобы на боль предъявляли 33 664 больных (39%). По результатам тестирования с помощью опросника DN4 [6], невропатическая боль была выявлена у 15 301 пациента (17,8%) [4]. По данным специального исследования, проведенного в Испании, распространенность невропатической боли среди всех обратившихся к врачам-неврологам больных составила всего 3,88% [7]. Исследование EPIC, как и многие зарубежные исследования, показало, что причинами невропатической боли в большинстве случаев (91,74%) являются периферические невропатические боли. По частоте возникновения лидировали боли в спине (50,58%) и болевой синдром при ДПН (10,64%).
Рекомендации по лечению невропатической боли
Лечение невропатической боли базируется на современных представлениях о патофизиологических механизмах ее развития [8] и включает назначение препаратов:
- направленных на уменьшение периферической афферентации, поддерживающей изменение возбудимости ноцицептивных структур спинного и головного мозга;
- уменьшающих возбудимость ноцицептивных нейронов;
- усиливающих супраспинальные нисходящие тормозные антиноцицептивные влияния.
Фармакотерапия невропатической боли
В России зарегистрировано относительно небольшое число препаратов для лечения невропатической боли (табл. 3). Препаратами первой линии для лечения невропатической боли являются антиконвульсанты, антидепрессанты и местные анестетики. Введение местных анестетиков приводит к уменьшению невропатической боли, особенно в тех случаях, когда ее развитие обусловлено патологическими изменениями периферических нервов и спинальных корешков. Наиболее широко применяется лидокаин, который оказывает ингибирующее действие на натриевые каналы. Лидокаин используется для лечебных блокад при корешковой компрессии и накожно в виде пластыря. Основным показанием для применения пластыря с лидокаином является постгерпетическая невралгия при наличии аллодинии. Несомненное действие на периферические механизмы невропатической боли за счет блокады натриевых каналов оказывают антиконвульсанты (габапентин, прегабалин, топирамат, ламотриджин), но в основе их обезболивающего эффекта при невропатическом характере боли лежат другие механизмы.
Антидепрессанты широко распространены в лечении невропатической боли различной этиологии. Высокоэффективны при невропатической боли трициклические антидепрессанты (ТЦА), которые начали использоваться с 1950-х гг. [11]. Основным механизмом действия ТЦА является блокада обратного захвата норадреналина и серотонина в пресинаптическую терминаль за счет влияния на натриевые и кальциевые каналы, что приводит к повышению активности центральных антиноцицептивных структур. Селективные блокаторы обратного захвата серотонина (пароксетин, флуоксетин) имеют меньше побочных эффектов, но их эффективность купирования невропатических болей существенно уступает ТЦА. Ограничения в использовании ТЦА при невропатической боли, особенно у пожилых пациентов, обусловлены многочисленными и иногда тяжелыми побочными эффектами. Ортостатическая гипотония, задержка мочи, запоры, тахикардия, «сухой синдром» могут возникать не только у пожилых людей. Наличие глаукомы и аденомы предстательной железы является противопоказанием для назначения ТЦА. Кроме того, известно, что длительное применение ТЦА в 2,2 раза увеличивает риск развития инфаркта миокарда [12].
К дополнительным недостаткам амитриптилина можно отнести нелинейность фармакокинетики, то есть при приеме невысоких доз концентрация вещества в плазме может быть больше, чем при приеме высоких доз. В последнее время активно разрабатываются так называемые сбалансированные ингибиторы обратного захвата норадреналина и серотонина, обладающие меньшим числом побочных эффектов. Препарат этой группы дулоксетин используется для лечения невропатической боли при ДПН, однако он уступает амитриптилину в эффективности купирования болевого синдрома. Антиконвульсанты стали применять для лечения болевых синдромов с 1940-х гг., когда была показана эффективность фенитоина (Дифенина) в терапии тригеминальной невралгии. В 1962 г. для лечения невралгии тройничного нерва впервые был использован антиконвульсант карбамазепин (Финлепсин), препарат, близкий по своей структуре к ТЦА, который до настоящего времени остается препаратом первой линии в лечении невралгии тройничного нерва. Основной механизм действия фенитоина и карбамазепина заключается в блокировании вольтаж-зависимых натриевых каналов.
В 1990-е гг. проведено изучение механизмов действия и клинической эффективности при невропатической боли нового поколения антиконвульсантов – габапентиноидов (габапентина и прегабалина). Габапентин близок по своей структуре к гамма-аминомасляной кислоте (ГАМК), однако показано, что препарат не взаимодействует с рецепторами к ГАМК. Габапентин уменьшает сенситизацию центральных ноцицепторов, в основном за счет связывания с альфа-2-дельта-субъединицей потенциалзависимых кальциевых каналов мембраны ноцицептивных нейронов, что приводит к блокаде проведения через каналы ионов кальция, уменьшению возбудимости нейронов и уменьшению боли [13].
Кроме того, габапентин обладает способностью блокировать натриевые каналы и дополнительно стимулирует синтез и выделение ГАМК. Результаты экспериментальных исследований свидетельствуют также об ингибирующем влиянии габапентина на выделение специфического альгогена – субстанции Р – из тонковолоконных первичных афферентов [14]. В эксперименте на модели невропатической боли, вызванной наложением лигатуры на седалищный нерв, показано, что габапентин уменьшает возбудимость нейронов головного мозга и улучшает структуру сна [15]. Побочных эффектов у габапентина немного, и, как показано при изучении 2216 пациентов, к наиболее частым относятся сонливость (15,2%), головокружение (10,9%) и атаксия (6,0%), однако тяжесть нежелательных явлений была незначительна, а их длительность не превышала 2–3 недель даже при продолжении приема препарата [16].
Препарат не метаболизируется в печени и выводится в виде неизмененной молекулы через почки, поэтому он не взаимодействует с другими лекарственными средствами, но должен с осторожностью использоваться у больных с нарушением функции почек. Детальное исследование, проведенное в клинике Мэйо (Mayo Clinic) на 729 больных с поражением почек, получавших габапентин, показало, что токсичность габапентина (накопление избыточного содержания вещества в крови) обнаружена только у 5,6% пациентов с выраженным нарушением фильтрационной способности почек и у 77,8% пациентов, находившихся на диализе, причем клинически повышение дозы препарата проявлялось редко. Таким образом, препарат может назначаться больным с поражением почек, но при этом необходимо использовать меньшие дозы и по возможности контролировать его содержание в крови.
Для уменьшения частоты и выраженности побочных эффектов дозу габапентина титруют. Прием габапентина начинают с 300 мг в день (на ночь), затем дозу увеличивают до 600 мг (один прием днем и один прием вечером) и, наконец, дозу повышают до 300 мг 3 раза в день. На фоне приема 900 мг в день анализируют динамику болевого синдрома и в случае отсутствия эффекта дозу поднимают до 1800 мг в день (увеличивая по 300 мг в день). В некоторых исследованиях, результаты которых свидетельствовали о высокой эффективности препарата при лечении невропатической боли, максимальные дозы габапентина достигали 2700 или 3600 мг. При этом большинство исследователей отмечали уменьшение болевого синдрома при различных вариантах невропатической боли уже на первой неделе лечения габапентином.
Другой габапентиноид – прегабалин – также доказал свою эффективность в многочисленных контролируемых исследованиях при диабетической полиневропатии и постгерпетической невралгии. По механизму действия прегабалин близок к габапентину, что объяснимо их структурной близостью. Прием пищи не влияет на биодоступность габапентина и прегабалина. В отношении других антиконвульсантов нового поколения – топирамата, ламотриджина –необходимо отметить следующее. Несмотря на то что в некоторых контролируемых исследованиях показана их эффективность при лечении невропатической боли, они, в отличие от габапентина и прегабалина, не зарегистрированы в России как лекарственные средства для лечения болевого синдрома. Доказательных данных о способе отмены антиконвульсантов (сразу или постепенно) не имеется, хотя большинство исследователей, исходя из личного опыта, рекомендуют его постепенную отмену.
Результаты исследования EPIC
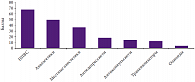
Зарубежные исследования показывают, что наиболее часто при невропатической боли пациентам назначаются нестероидные противовоспалительные средства (НПВС) и простые анальгетики, которые не должны применяться для лечения невропатической боли по причине их неэффективности [17], в то время как препараты, которые относятся к первой линии терапии невропатической боли, используются врачами значительно реже. В результате лечение невропатической боли неэффективно, и более чем 50% больных, используя рекомендованные врачами препараты, продолжают испытывать боль средней и высокой интенсивности, снижающую качество их жизни. В этой связи вызывало интерес, какие именно лекарственные средства используют для лечения невропатической боли отечественные врачи. В исследовании EPIC показано, что принципиальные отличия в отношении использования лекарственных средств для лечения невропатической боли между российскими неврологами и их зарубежными коллегами отсутствуют. Наиболее часто для лечения невропатической боли применялись НПВС и анальгетики, в то время как препараты первой линии лечения невропатических болевых синдромов использовались в терапии значительно реже (рис. 1).
Обращает на себя внимание факт предшествующей анальгетической терапии у 80% больных, обратившихся к врачам-неврологам в рамках исследования EPIC, что свидетельствует о неэффективности назначенного лечения. Особо следует отметить, что средняя интенсивность невропатической боли в этой группе больных была достаточно высокой (6,3 балла по визуально-аналоговой шкале (ВАШ)), а средняя продолжительность болевого синдрома составляла 18,3 месяца. Таким образом, нельзя говорить о том, что пациенты не обращались к врачу вследствие невысокой интенсивности болевого синдрома или его недостаточной продолжительности. Врачи-неврологи, участвовавшие в исследовании EPIC, назначили лечение по поводу невропатической боли 95% больных. Это свидетельствует о том, что до участия в исследовании 15% больных не получали лечения для уменьшения интенсивности боли, хотя в этом нуждались [18].
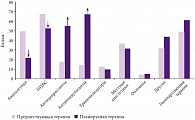
Исследование EPIC показало, что значительно увеличилось число больных, которым было назначено лечение препаратами первой линии терапии невропатической боли в соответствии с европейскими и отечественными рекомендациями (рис. 2), и уменьшилось число больных, которым были рекомендованы анальгетики. Вместе с тем частота назначения НПВС снизилась очень незначительно. Это можно было бы объяснить тем, что в большинстве случаев невропатическая боль отмечалась при болях в спине, когда наряду с невропатическим наблюдается ноцицептивный компонент, обусловленный болевой афферентацией от суставов, связок, мышц и других структур скелетно-мышечной системы. Однако анализ назначений лекарственных средств при клинических формах, когда ноцицептивный компонент отсутствует, показал, что дело не в этом.
Анальгетики и НПВС назначались больным с тригеминальной невралгией и диабетической полиневропатией, то есть в таких клинических ситуациях, когда их выбор совершенно не оправдан. Остается предположить, что существует значительная инерция в мышлении врачей, когда традиционно назначавшиеся ранее фармакологические препараты остаются во врачебном арсенале как средства лечения невропатической боли, и для изменения этой ситуации требуются значительные усилия, направленные в первую очередь на повышение уровня знаний врачей. Результаты исследования EPIC позволяют сделать следующие выводы. Во-первых, врачи должны строго придерживаться европейских и отечественных рекомендаций по лечению невропатической боли, что позволит обеспечить современный уровень терапии болевых синдромов. Во-вторых, повышение уровня знаний врачей о патофизиологических механизмах невропатической боли, принципах ее диагностики и лечения позволит значительно улучшить качество медицинской помощи больным с невропатическими болевыми синдромами.
Клинические формы невропатической боли
Рассматривая клинические формы невропатической боли, следует обратить внимание на два классических варианта: болевая ДПН и ПГН. ДПН, безусловно, самый частый вариант синдрома периферической невропатической боли. В России и США ДПН наблюдается более чем у половины больных сахарным диабетом (СД), причем болевой синдром отмечается у 25% больных с ДПН, а является доминирующим синдромом в клинической картине – у 18% больных [19–21]. Болевой синдром возникает у больных с ДПН постепенно в течение месяцев (хроническая форма) или в течение нескольких дней/недель (острая форма) и локализуется в дистальных отделах ног [22]. Длительность хронического болевого синдрома может составлять десятилетия. Острая полиневропатия малых волокон (синдром Элленберга и невропатия, связанная с нормализацией углеводного обмена) при СД помимо интенсивных спонтанных болей сопровождается потерей веса (более 25% индекса массы тела), депрессией, а у мужчин – импотенцией [23]. Длительность болевого синдрома в этом случае ограничивается годом.
Острая гипергликемическая невропатия Джордана проявляется болью в ногах на фоне высокого уровня глюкозы в крови, с полным исчезновением болей при достижении нормогликемии. Продолжительность болевого синдрома колеблется от нескольких дней до 2–3 недель. Спонтанные боли при ДПН – наиболее часто стреляющие, жгучие – могут сопровождаться динамической и статической гипералгезией (стимулозависимые боли), онемением, парестезиями, зябкостью, зудом (позитивные невропатические симптомы), а также нарушениями чувствительности всех модальностей – температурной, болевой, проприоцептивной (негативная невропатическая симптоматика) [24]. Рассматривая различные предложенные схемы лечения болевого синдрома при ДПН, можно выделить три основных компонента терапевтического воздействия:
- оптимизация контроля сахарного диабета с целью минимизировать эффекты гипергликемии в отношении периферических нервов;
- улучшение сосудистого обеспечения и метаболизма периферических нервов (патогенетическая терапия);
- блокирование боли на периферическом уровне, уровне заднего рога и в ЦНС (симптоматическая терапия) [25].
По всей видимости, целесообразность применения альфа-липоевой кислоты или Актовегина при болевой форме ДПН обусловлена необходимостью улучшить функциональное состояние периферических нервов. В этой ситуации может увеличиться эффективность симптоматической терапии боли (антидепрессанты, антиконвульсанты), кроме того, создаются предпосылки для более быстрой отмены симптоматического лечения без возобновления болевого синдрома. Быстрое уменьшение выраженности болевого синдрома (дни) достигается при хронических и острых болевых формах ДПН после назначения трициклических антидепрессантов (амитриптилин) [29, 30]. Стандартная доза амитриптилина, с которой начинают лечение, – 25 мг, обычный лечебный диапазон доз препарата – 75–150 мг. По причине многочисленных и иногда тяжелых побочных эффектов использование ТЦА при невропатической боли имеет ряд ограничений, особенно у пожилых пациентов. Кроме того, показано, что длительное применение ТЦА в 2,2 раза увеличивает риск развития инфаркта миокарда [12]. В последнее время активно разрабатываются так называемые сбалансированные ингибиторы обратного захвата норадреналина и серотонина, имеющие меньше побочных эффектов, дулоксетин и венлафаксин, однако они уступают амитриптилину в обезболивающем эффекте. Избирательные ингибиторы обратного захвата серотонина имеют меньше побочных эффектов, однако недостаточно эффективны.
Габапентин в терапии невропатической боли
Перспективным направлением в лечении болевых ДПН является применение антиконвульсантов, способных блокировать патологическую импульсную активность, модулируя работу ионных каналов ноцицептивных нейронов. В рандомизированном двойном слепом плацебоконтролируемом исследовании анализировали лечение невропатической боли у пациентов с ДПН габапентином (84 пациента) по сравнению с плацебо (81 пациент) [31]. Исследование проводилось у амбулаторных больных в 20 различных медицинских центрах. Препарат или плацебо назначался больным в течение 8 недель. Титрование доз препарата осуществлялось в течение 4 недель (первая неделя – 900 мг/сут, вторая – 1800 мг/сут, третья – 2400 мг/сут и четвертая – 3600 мг/сут), причем прекращение повышения дозы зависело только от побочных эффектов, но не от исчезновения боли. Интенсивность боли оценивалась по ВАШ. Уже через 2 недели было отмечено достоверное различие в интенсивности боли между группами, а через 8 дней в группе габапентина боль уменьшилась с 6,4 до 3,9 см, в то время как в группе плацебо – с 6,5 до 5,1 см (p < 0,001). В другом двойном слепом плацебоконтролируемом исследовании эффективности габапентина при болевой ДПН использованы меньшие дозы препарата – 1200 мг, но в течение 3 месяцев. Из 17 больных с болевой ДПН интенсивность боли значительно уменьшилась у 14 человек (82,4%), а при использовании плацебо – только у 2 из 15 пациентов (13,3%) (p < 0,001) [16].
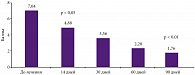
В открытом исследовании эффективности препарата Конвалис (габапентин) у 25 больных СД 2 типа (возраст – 25–70 лет) с болевой формой ДПН было показано, что лечение препаратом в течение 3 месяцев (начальная доза – 300 мг, максимальная доза – 1800 мг) прогрессивно уменьшало интенсивность болевого синдрома (рис. 3) [32]. Особо следует отметить выраженность снижения интенсивности боли по шкале ВАШ: с 7,04 ± 1,17 до 1,76 ± 0,52 см. Авторы обращают внимание на то, что ни у одного больного побочные явления не привели к отмене терапии. Продолжение лечения Конвалисом на втором месяце исследования привело к значительному снижению частоты нежелательных явлений (головокружения – с 25 до 5%, сонливости – с 15 до 5%). В рандомизированном двойном слепом плацебоконтролируемом исследовании в 16 центрах США изучали эффективность габапентина при ПГН у 225 пациентов. 109 пациентов получали габапентин и 116 пациентов – плацебо в течение 8 недель. Максимальная доза габапентина составляла 3600 мг. Показана достоверно более высокая эффективность габапентина по сравнению с плацебо (p < 0,01).
В дерматологической клинике США в пилотном открытом исследовании 133 пациентам в возрасте от 50 лет и старше (средний возраст – 64,6 лет) с острым опоясывающим лишаем и наличием средних и интенсивных болей (> 4 баллов по шкале Ликерта) назначали комбинацию валацикловира гидрохлорида 1000 мг 3 раза в день и габапентина с начальной дозой 300 мг и титрованием ее до максимальной дозы 3600 мг (в случае отсутствия побочных эффектов) с целью предупреждения развития ПГН. Через 6 месяцев болевой синдром сохранялся только у 9,8% больных, что свидетельствовало об эффекте примененного профилактического лечения в отношении развития ПГН [33].
В 2011 г. опубликованы суммарные данные рандомизированных исследований эффективности габапентина при острых, хронических и онкологических болях, проведенных в период c 1966 по 2004 г. (источниками послужили базы данных MEDLINE, EMBASE, SINGLE, CENTRAL). В обзор вошли результаты 15 исследований, в которые в общей сложности были включены 1468 пациентов в возрасте от 20 до 90 лет с невропатическими болями при ДПН, ПГН, онкологических заболеваниях, фантомном синдроме, синдроме Гийена – Барре, повреждении спинного мозга и после операций. При применении препарата отмечено уменьшение или исчезновение болей у 42% пациентов, в то время как при приеме плацебо – только у 19% больных. Число больных, которое необходимо пролечить для получения одного благоприятного результата (Number-needed-to-treat-to-benefit, NNT), во всех исследованиях составляло 4,3; при ДПН – 2,9; при ПГН – 3,9. Авторами был сделан вывод о том, что при широком спектре синдромов хронической невропатической боли, обусловленных различными заболеваниями и поражениями периферической и центральной нервной системы, габапентин показал свою эффективность и хорошую переносимость при минимуме побочных эффектов. Данных в отношении эффективности препарата при синдромах острой боли в настоящее время недостаточно [34].
Имеются отдельные работы, подтверждающие эффективность габапентина при редких вариантах головной боли. Так, японские неврологи сообщили об эффективности габапентина в суточной дозе 800 мг при SUNCT-синдроме [35]. Немецкие неврологи также отметили эффективность габапентина при SUNCT-синдроме, но в комплексной терапии с окскарбазепином (Трилепталом) [36]. В обзоре, посвященном лечению болевого синдрома при онкологических заболеваниях, подчеркиваются хорошие перспективы монотерапии габапентином и применения его комбинации с опиоидами при этой форме невропатической боли [37]. Показано также, что комплексный прием габапентина и имипрамина в небольших дозах (200 мг габапентина и 10 мг имипрамина каждые 12 часов) у больных с онкологическими невропатическими болями позволил достоверно уменьшить интенсивность болевого синдрома [38]. Сравнительная оценка различных препаратов в эффективности лечения невропатической боли проводилась редко. В двух открытых исследованиях эффективности фармакологического лечения невропатической боли у больных с полиневропатиями в течение 6 месяцев преимуществ венлафаксина и каннабиноида набилона перед габапентином не выявлено [39, 40]. Показано, что при лечении невропатической боли эффективность габапентина и трициклического антидепрессанта нортриптилина была выше при их совместном приеме, чем при использовании этих препаратов в качестве монотерапии [41].
В последние годы предпринимаются попытки создать соединения габапентина, которые имели бы высокую биодоступность и возможность линейного повышения концентрации при пероральном приеме. Фармакокинетика и эффективность препарата, содержащего энакарбил габапентина, который с помощью специальных кишечных транспортеров легко абсорбируется, при попадании в кровь подвергается гидролизу и превращается в габапентин, изучена в рандомизированном двойном слепом плацебоконтролируемом исследовании. В исследовании принял участие 101 пациент с ПГН. В течение 14 дней (дважды в день) 47 пациентов получали габапентин в дозе 1200 мг и 54 пациента – плацебо. Габапентин эффективнее уменьшал невропатическую боль (р = 0,0321), улучшал сон и настроение (р < 0,05).
Отмечена более высокая концентрация габапентина в крови при приеме энакарбила габапентина по сравнению с приемом стандартных таблеток габапентина (р = 0,005) [42]. В другом исследовании таблетки габапентина высокого высвобождения применялись в дозе 1800 мг один раз в день, при этом по сравнению с плацебо наблюдалось более значительное уменьшение боли (р = 0,032) и улучшение сна (р < 0,001) [43]. Европейские и другие международные рекомендации по лечению невропатической боли подчеркивают высокую эффективность габапентина при лечении невропатических болевых синдромов и относят его к препаратам первой линии терапии [44, 45].
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.