Современные подходы к диагностике и терапии реактивных артритов
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрена клиническая картина болезни, проанализирована значимость представленных лабораторных методик, направленных на выявление возбудителя РеА, изложены основные подходы к терапии, включая применение антимикробных препаратов.
В статье рассмотрена клиническая картина болезни, проанализирована значимость представленных лабораторных методик, направленных на выявление возбудителя РеА, изложены основные подходы к терапии, включая применение антимикробных препаратов.


Реактивные артриты (РеА) – воспалительные негнойные заболевания суставов, которые развиваются в тесной хронологической связи (обычно не позднее чем через месяц) с перенесенной преимущественно кишечной или урогенитальной инфекцией. Они относятся к группе спондилоартритов (СпА) и, как правило, ассоциируются с наличием HLA-B27-антигена. Ранее РеА отличали от постинфекционных артритов, которые могут развиваться в рамках реакции макроорганизма на любой инфекционный агент. В настоящее время некоторые авторы указывают на неактуальность такой дифференциации, поскольку выявлены общие патогенетические механизмы, а диагноз преимущественно устанавливается на основании клинических данных, анамнеза и прямого и/или косвенного выявления возбудителя [1].
Классическая триада болезни – артрит, уретрит, конъюнктивит – впервые была описана B. Brody в 1918 г. После выделения A. Neisser в 1879 г. возбудителя гонореи была установлена группа лиц с артритом в рамках диссеминированной гонококковой инфекции. В 1916 г. французские врачи N. Fiessinger и Е. Leroy описали четыре случая так называемого уретроокулосиновиального синдрома. В это же время Н. Reiter сообщил о развитии аналогичного синдрома у немецкого солдата, предположив в качестве триггерного агента спирохеты. Получивший впоследствии широкое распространение эпоним «синдром Рейтера» стали применять для обозначения артрита в сочетании с конъюнктивитом и уретритом, а также с другими симптомами, указанными ниже. Поражение позвоночника при синдроме Рейтера впервые было описано в 1953 г. [2]. Позднее, в 1960 г., установлено, что более чем у 20% пациентов с этой патологией имел место сакроилиит [3]. Термин «реактивный артрит» предложен в 1969 г. финскими авторами. Они описали РеА, индуцированный иерсиниозной инфекцией, охарактеризовали клинические симптомы, в том числе внесуставные, и верифицировали возбудителя серологическими методами [4].
В начале 2000-х гг. после публикации материалов о сотрудничестве Н. Reiter с германскими нацистами во время Второй мировой войны и его участии в экспериментах над заключенными концлагерей экспертами ряда научных медицинских обществ, включая Американскую ассоциацию спондилита, а также адвокатскими группами, представляющими интересы этих больных, было выдвинуто требование об исключении из обращения термина «синдром Рейтера» и о замене его на «реактивный артрит». В октябре 2003 г. на собрании редакторов ревматологических журналов было принято решение о замене термина [5].
Эпидемиология
Согласно данным большинства авторов, распространенность РеА составляет 4,6–13,0 и 5,0–14,0 случая на 100 тыс. населения для урогенной и энтерогенной форм соответственно. Однако эти цифры занижены. Так, в исследовании, выполненном в Южной Швеции, ежегодная частота встречаемости РеА достигла 28 случаев на 100 тыс. В Германии у 30% пациентов с асимптомной хламидийной инфекцией диагностированы РеА, при недифференцированном СпА у 42% выявляли Chlamydia trachomatis. Ретроспективный анализ данных, выполненный в Научно-исследовательском институте ревматологии им. В.А. Насоновой (НИИР им. В.А. Насоновой), показал, что хламидийная инфекция имела место у 33% стационарных пациентов с подтвержденным СпА (преимущественно у лиц мужского пола в возрасте 17–20 лет), кишечная инфекция – у 5%.
Согласно данным Минздрава России, в 2019 г. первичная заболеваемость РеА среди взрослого населения составляла 10,1–57,2 случая на 100 тыс. населения. Различная частота встречаемости патологии как в разных регионах РФ, так и в разных странах может быть объяснена рядом причин:
- разнообразие генетического фона в обследованных популяциях, в том числе частота носительства HLA-B27;
- вариабельность частоты инфекций, вызываемых одним и тем же возбудителем – потенциальным триггером РеА, в конкретном регионе в разные периоды времени;
- снижение распространенности возбудителей РеА благодаря своевременной диагностике, адекватной терапии триггерных инфекций, а также проведению профилактических мероприятий;
- отсутствие своевременной микробиологической диагностики из-за спонтанного купирования симптоматики РеА (70–80%);
- асимптомное течение урогенитальной инфекции, приводящей к возникновению РеА;
- некорректный подход к трактовке выделенного инфектогена в качестве триггера РеА;
- гипо- или гипердиагностика РеА из-за перекрестных симптомов, встречающихся при других СпА.
Поражение преимущественно отмечается среди лиц от 20 до 40 лет. Энтерогенный РеА с одинаковой частотой встречается как у мужчин, так и у женщин. Урогенная форма РеА наблюдается преимущественно у мужчин.
Этиология
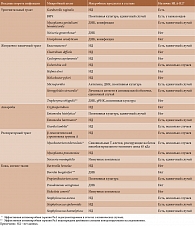
Хорошо изучены этиологические агенты РеА, относящиеся к возбудителям кишечных или урогенитальных инфекций (табл. 1) [6, 7]. Для них характерны тропность к слизистым оболочкам, высокая контагиозность, наличие обладающих перекрестной реактивностью липополисахаридов (ЛПС) в наружной мембране, а также еще полностью не идентифицированных специфических факторов вирулентности, способствующих выживанию и диссеминации возбудителя в организме. Бессимптомные триггерные инфекции регистрируются в 36% случаев при РеА, вызванных хламидиями, и в 26% случаев при РеА, вызванных кишечными микробами [8].
На сегодняшний день в качестве наиболее значимого этиологического агента урогенного РеА (УРеА) рассматривается C. trachomatis – облигатный внутриклеточный микроб с жизненным циклом, характеризующимся последовательной сменой двух высокоспецифичных форм, и адаптацией к существованию внутри и вне клетки. Элементарные тельца (ЭТ) прикрепляются к чувствительным клеткам, поглощаются ими с формированием внутриклеточной вакуоли и реорганизуются в метаболически неактивные внутриклеточные образования – ретикулярные тельца (РТ). В дальнейшем происходят бинарное деление РТ внутри образовавшейся эндосомы, вторичная реорганизация РТ в ЭТ и высвобождение инфекционных ЭТ в результате цитолиза или экзоцитоза, что приводит к заражению новых клеток. При изучении in vitro на культуре чувствительных клеток установлено, что полный цикл развития хламидий длится 48–72 часа в зависимости от штамма, природы клеток-хозяев и условий среды. Течение хламидийной инфекции как в целом, так и при РеА во многом определяется способностью возбудителя к образованию аберрантных (персистентных) форм, отличающихся от обычных (продуктивных) форм (табл. 2) [9]. С наличием этих форм связан ряд проблем при обследовании и лечении больных РеА.
В последние годы был выделен ряд возбудителей, также классифицированных в качестве триггеров РеА (табл. 3) [1, 10, 11].
Необходимо отметить, что в период пандемии COVID-19 было зарегистрировано несколько случаев развития острого артрита после перенесенной вирусной инфекции, которые классифицировались как РеА.
Патогенез
Посредством фагоцитоза макрофагами и дендритными клетками возбудитель проникает из очага первичной инфекции в суставы и другие отделы макроорганизма. В синовиальной оболочке и синовиальной жидкости обнаруживают живые формы микробов, способные к делению. Большое значение придается феномену молекулярной мимикрии, суть которого состоит в том, что у возбудителя и хозяина есть общие антигенные детерминанты. При этом иммунный ответ, инициируемый компонентами клеточной стенки возбудителей РеА, так называемыми артритогенными пептидами, может повлечь за собой развитие перекрестных реакций со схожими аутоантигенами поражаемых тканей. Персистенция антигенов триггерных микробов в макроорганизме может быть причиной длительно сохраняющегося высокого уровня антител к возбудителю.
В последние годы активно обсуждаются другие гипотезы патогенеза РеА: роль Toll-like-рецепторов, активируемых лигандами хламидий, дисбаланс цитокинов, неэффективность иммунного ответа, заключающаяся в недостаточной элиминации возбудителей и их антигенов из суставной полости, и др.
Морфологические изменения в синовиальной мембране напоминают таковые при инфекционном артрите – отек, гиперемия и инфильтрация синовии нейтрофильными лейкоцитами. При хроническом течении формируется неспецифический синовит с умеренным скоплением лимфоидных и плазматических клеток.
Клиническая картина
Независимо от этиологических факторов клиническая картина РеА однотипна. Симптомы триггерной инфекции, большей частью кишечной, стихают или полностью регрессируют к моменту развития заболевания.
Болезнь развивается через 3–60 дней после перенесенной инфекции и, как правило, начинается остро с лихорадки и развития асимметричного олигоартрита с преимущественным поражением суставов нижних конечностей: коленных, голеностопных, пальцев стоп (особенно первых). Быстрый выпот в коленный сустав может привести к образованию подколенных кист с последующим их разрывом и формированием псевдофлебитического синдрома. Суставы верхних конечностей поражаются значительно реже.
В 10–16% случаев, преимущественно при УРеА, развивается тендовагинит отдельных пальцев стоп, проявляющийся выраженной болью, отечностью и специфической багрово-синюшной окраской кожи (палец-сосиска). У 30% больных наблюдается поражение энтезисов с наиболее частой локализацией в пяточной области. Характерно наличие ахиллобурситов, подошвенных апоневрозитов и трохантеритов.
На ранней стадии болезни примерно в половине случаев выявляют признаки поражения позвоночника – боли в нижнем отделе и/или в области проекции крестцово-подвздошных сочленений, чувство скованности, спазм паравертебральных мышц. Боль, как правило, имеет воспалительный характер.
Среди внесуставных проявлений РеА наиболее типичным является поражение глаз. У 30% пациентов наблюдается двусторонний катаральный слабовыраженный конъюнктивит, который обычно возникает одновременно с артритом и угасает в течение нескольких дней даже без лечения. Примерно у 5% больных отмечается острый передний увеит, который может привести к прогрессирующему снижению зрения вплоть до слепоты. При рецидивирующем течении болезни описаны кератит, язва роговицы, эписклерит, ретробульбарный неврит.
Специфичным для РеА является поражение кожи и слизистых оболочек, в частности кератодермия ладоней и подошв (5–20% случаев), которую ранее ошибочно относили к гонорейной инфекции и обозначали как «бленноррагическая кератодермия». Эти изменения клинически и морфологически напоминают пустулезный псориаз. Кроме этого, возможно появление кератодермических псориазоподобных высыпаний на различных участках тела и волосистой части головы. У 6–12% больных отмечается поражение ногтевых пластин, преимущественно на пальцах стоп, по типу ониходистрофии (изменение цвета, повышенная ломкость, шероховатость, бугристость), подногтевого гиперкератоза, онихолизиса. В отличие от истинного псориаза упомянутые изменения исчезают после выздоровления или ремиссии РеА.
В 20–40% случаев встречается кольцевидный баланит или баланопостит.
В 5–10% случаев наблюдаются малосимптомные безболезненные эрозии в полости рта.
На долю узловатой эритемы приходится 15%, при этом чаще она развивается у больных иерсиниозным РеА.
Необходимо отметить, что симптомы со стороны урогенитального (уретрит, простатит, цервицит, сальпингоофорит) и желудочно-кишечного (колит) тракта могут быть как отражением триггерной инфекции, так и системными проявлениями РеА. В частности, у 25% пациентов с УРеА при проведении колоноскопии выявлялась патология кишечника.
Одним из проявлений УРеА может быть лимфаденопатия, особенно паховая, которая отражает реакцию регионарных лимфоузлов на тазовый очаг инфекции.
Возможно поражение скелетных мышц по типу миозита, невриты периферических нервов.
Получены сообщения о развитии аортита с формированием недостаточности аортального клапана и миокардита с нарушениями атриовентрикулярной проводимости.
При хронических формах РеА описаны тяжелый системный некротический васкулит, тромбофлебит, пурпура, сетчатое ливедо и вторичный амилоидоз.
Диагностика
К лабораторным показателям РеА относят анемию (нечасто), умеренный нейтрофильный лейкоцитоз, увеличение скорости оседания эритроцитов, уровня С-реактивного белка, протеинурию, лейкоцитурию, микрогематурию. Ревматоидные факторы и антинуклеарный фактор не выявляются. При исследовании синовиальной жидкости обнаруживают неспецифические признаки воспаления: низкую вязкость, рыхлый муциновый сгусток, лейкоцитоз с преобладанием нейтрофилов. В отличие от септического артрита высокий цитоз и снижение концентрации глюкозы не наблюдаются.
Для идентификации триггерных инфекционных агентов используют микробиологические, иммунологические и молекулярно-биологические методы. Для диагностики персистирующей хламидийной инфекции методы прямой и непрямой иммунофлуоресценции малоэффективны, поскольку в их основе лежит обнаружение светящихся комплексов антигенов возбудителя – основного белка наружной мембраны (MOMP) и ЛПС, находящихся на поверхности ЭТ, расположенных вне клеток. При персистенции продукция МОМР и ЛПС блокирована, поскольку патоген находится внутри клеток, а ЭТ выявляются лишь в 8,2% случаев. Метод культуры клеток также малоинформативен, так как при персистирующей инфекции в одном пассаже хламидии, как правило, не выделяются вследствие неинфекционности и непродуктивности аберрантных включений. Именно поэтому в настоящее время для определения персистентных форм хламидий оптимальными признаны молекулярно-генетические методы на основе амплификации нуклеиновых кислот, такие как полимеразная цепная реакция (ПЦР), в том числе в режиме реального времени, ПЦР с обратной транскрипцией, амплификация с вытеснением цепи, чувствительность и специфичность которых достигают 97,0 и 99,5% соответственно.
С учетом высокой вероятности сопутствующей инфекции целесообразно проводить исследование на наличие ВИЧ, гепатитов В и С, особенно у больных УРеА.
В случае затяжного или хронического течения с помощью лучевых методов диагностики могут быть выявлены околосуставной остеопороз, изменения в области пораженных энтезисов (тендопериоститы, рыхлые пяточные шпоры), сужение суставной щели и асимметричные эрозии, преимущественно в мелких суставах стоп. При хроническом течении у 40–60% носителей HLA-B27 обнаруживают признаки одно- или двустороннего сакроилиита.
Диагностические критерии
На сегодняшний день не существует общепринятого валидированного набора критериев, подтверждающих диагноз РеА, главным образом из-за широкого спектра клинических проявлений и трудностей определения причинно-следственной связи с инициирующей инфекцией [12].
Предложенные в 2003 г. российскими экспертами диагностические критерии РеА [13] применимы только для урогенных и постэнтероколитических форм.
Дифференциальная диагностика
Реактивный артрит следует дифференцировать от инфекционного артрита, других серонегативных СпА, подагры, ревматоидного артрита, болезни Лайма, иных воспалительных заболеваний суставов.
Лечение
На сегодняшний день роль антибактериальной терапии при УРеА остается предметом дискуссий. Диапазон мнений колеблется от необходимости длительного курса лечения (в течение нескольких месяцев) до полного его отрицания. Однако установлено, что раннее лечение триггерной урогенитальной инфекции способно предотвратить инициацию и персистенцию артрита. Так, в ретроспективном исследовании с участием 109 пациентов, получавших антибиотики против C. trachomatis, риск последующего развития артрита был снижен с 37 до 10% [14]. Назначение такой терапии приводило к регрессу симптоматики хламидий-индуцированного РеА, ремиссии заболевания и улучшению отдаленного прогноза [15].
Раннее назначение антибиотиков при остром РеА, ассоциированном с хламидийной инфекцией, признано целесообразным. Следует отметить, что санация от хламидийной инфекции представляет достаточно сложную задачу. Показано, что при УРеА практически у всех больных воспалительный процесс не ограничивается уретрой, а распространяется на вышележащие отделы, что значительно затрудняет санацию этого очага [16]. Данное обстоятельство в определенной степени может служить объяснением того, что 7–10-дневные курсы антибиотикотерапии, назначаемые при неосложненном урогенитальном хламидиозе, неэффективны при РеА, ассоциированном с хламидийной инфекцией. Даже при адекватной длительности антимикробной терапии частота бактериологических неудач при РеА может достигать 40%, что, по всей видимости, связано с биологическими особенностями возбудителя. Как указывалось выше, носители видовых признаков хламидий – ЭТ – метаболически неактивны, существуют во внеклеточной среде и могут неопределенно долгое время находиться в состоянии покоя. Более того, у пациентов с РеА, ранее получавших антибиотики, возможно персистирование инфекции, когда изначально метаболически активные РТ, локализующиеся внутри клетки, останавливаются на определенном этапе развития и не превращаются в ЭТ. По сравнению с обычными эти промежуточные формы меньше по размеру и не чувствительны к действию антибиотиков.
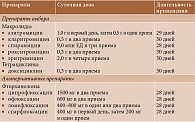
В НИИР им. В.А. Насоновой в течение более чем 25-летнего периода для лечения урогенитального хламидиоза при РеА в качестве препаратов выбора применяют антибиотики из групп макролидов или тетрациклинов (табл. 4). Их назначают на срок от 28 до 30 дней. При непереносимости или неэффективности указанных препаратов используют фторхинолоны. Как свидетельствует накопленный опыт, частота эрадикации C. trachomatis у больных РеА колеблется от 65 до 76%, что является весьма действенным стимулом к поиску новых схем и методов лечения инфекции в указанной популяции [17].
Признавая необходимость длительного применения антибиотиков при РеА, ассоциированном с хламидийной инфекцией, следует отметить, что единого мнения в отношении схем лечения пока не существует. Финскими авторами показано, что среди больных УРеА, принимавших ципрофлоксацин в дозе 1000 мг/сут в течение трех месяцев, на протяжении четырех – семи лет наблюдения хронические воспалительные ревматические заболевания, ассоциированные с HLA-B27, развивались значимо реже по сравнению с получавшими плацебо – 8 и 41% соответственно (p = 0,006). При этом ни у одного из пациентов в группе ципрофлоксацина не зафиксировано таких проявлений, как воспалительная боль в спине, хронический олигоартрит, энтезит или рецидивирующий передний увеит [18]. Поскольку хламидии в аберрантном состоянии устойчивы к традиционной антибактериальной монотерапии, для получения значимого эффекта целесообразна комбинация антибиотиков, направленных на разные метаболические процессы бактерий [12].
В связи со сказанным ранее многообещающими представляются результаты исследования J. Carter и соавт., полученные в ходе девятимесячного проспективного двойного слепого плацебо-контролируемого исследования. Эффективность комбинации доксициклина и рифампицина (12 больных) или азитромицина и рифампицина (15) сравнивали с эффективностью плацебо (15). Назначение рифампицина было продиктовано хорошей клеточной пенетрацией препарата (хламидии являются облигатным внутриклеточным патогеном), а также влиянием на хламидийные гены транскрипции, включая белок теплового шока (HSP). Комбинированная терапия продемонстрировала высокую эффективность по сравнению с плацебо в отношении 20%-ного улучшения по крайней мере четырех из шести параметров – 63 и 20% соответственно (р = 0,01). Через шесть месяцев лечения по результатам ПЦР эрадикация хламидий в группах антибиотикотерапии была более высокой, чем в группе плацебо, – 76 и 33% соответственно (р = 0,057). Отсутствие значимых различий исследователи объяснили малым количеством больных [19]. Несомненно, эти данные должны быть подтверждены в других исследованиях на более крупных выборках. Кроме того, представляется чрезвычайно важным проведение дальнейших исследований, направленных на поиск более эффективной комбинации антибиотиков с определением дозы и длительности лечения [20].
На сегодняшний день общепризнано, что назначение антибиотиков при энтерогенном РеА нерационально. Однако краткосрочный курс может быть показан в случае тяжелой диареи, ослабленного иммунитета, пожилого возраста, а также для предотвращения рецидива у пациентов с ранее перенесенным РеА [21].
Во избежание некорректных результатов контрольное исследование на хламидиоз осуществляется не ранее чем через три-четыре недели по окончании курса антибиотикотерапии.
До завершения лечения и проведения контрольного исследования всем пациентам с УРеА рекомендовано использовать презервативы. Половые партнеры должны пройти обследование у гинеколога или уролога и при необходимости получить соответствующее лечение.
В отечественной литературе для лечения урогенитального хламидиоза широко обсуждается возможность применения медикаментозной иммунокоррекции (индукторы интерферона, полиоксидоний, имунофан и т.д.). Однако их эффективность и безопасность, в том числе у больных РеА, не подтверждены данными рандомизированных контролируемых исследований. В связи с этим дать какие-либо рекомендации по их применению при УРеА не представляется возможным.
При поражении суставов назначают нестероидные противовоспалительные препараты (НПВП), такие как диклофенак, нимесулид, мелоксикам, в стандартных суточных дозах, а также глюкокортикоиды (ГК), в частности бетаметазон, триамцинолон, которые вводят внутрисуставно или периартикулярно. При выраженных прогностически неблагоприятных системных проявлениях (нефрит, кардит и др.) ГК назначают перорально в средних дозах. В случае хронического течения РеА показаны сульфасалазин, метотрексат, азатиоприн. Получены также данные об успешном применении отдельных генно-инженерных биологических препаратов, преимущественно ингибиторов фактора некроза опухоли α, при резистентных к терапии хронических РеА. Однако небольшое число наблюдений пока не позволяет дать объективную оценку этому методу лечения [22–24]. В указанных ситуациях также представляется перспективным применение ингибиторов интерлейкина 17 секукинумаба и иксекизумаба, которые в настоящее время одобрены для лечения других хронических HLA-B27-ассоциированных воспалительных поражений суставов (анкилозирующий спондилит, псориатический артрит). Так, индийские ученые описали два случая успешного применения секукинумаба у больных тяжелым хроническим РеА, рефрактерным к этанерцепту [25].
При стихании активности артрита в лечебный план включают реабилитационные мероприятия: физиотерапию, массаж, лечебную физкультуру, санаторно-курортное лечение.
Реактивный артирт и SARS-CоV-2
В период пандемии COVID-19, вызванного SARS-CoV-2, был зарегистрирован ряд случаев развития острого артрита после перенесенной инфекции, которые классифицировались как РеА. Артрит развивался в среднем в течение 21 дня после появления симптомов COVID-19. Поражение суставов было преимущественно олигоартикулярным, то есть типичным для РеА, реже наблюдались моно- и полиартрит. Отмечались также дактилит, энтезит ахиллова сухожилия и поражение кожи по типу псориаза или васкулита. Среди восьми пациентов, у которых было выполнено исследование на HLA-B27, только у одного результат оказался положительным. Исследование синовиальной жидкости с помощью ПЦР с обратной транскриптазой на наличие SARS-CoV-2, проведенное в четырех случаях, дало отрицательный результат. Артрит разрешился спонтанно на 27-й день у одного пациента. Остальные случаи регрессировали на фоне применения НПВП и введения внутрисуставных инъекций ГК [1, 26, 27].
Сообщалось также о четырех пациентах, у которых развился острый воспалительный артрит после COVID-19. Анализ синовиальной жидкости показал наличие кристаллических артропатий (подагра и болезнь депонирования кристаллов пирофосфата кальция) [28]. Острые заболевания, включая инфекции, являются хорошо известными факторами риска обострений подагры и псевдоподагры. Именно поэтому во время пандемии, вызванной SARS-CoV-2, важно при каждом случае острого артрита выполнять исследование синовиальной жидкости с помощью поляризационной микроскопии.
Прогноз
У абсолютного большинства больных полное выздоровление отмечается в течение 6–12 месяцев. Примерно у четверти пациентов, переболевших РеА, через год и более развиваются такие заболевания из группы СпА, как анкилозирующий спондилит или псориатический артрит. Рецидивы часто связаны с повторным инфицированием. В качестве прогностических факторов хронизации процесса, наблюдаемой в 20% случаев, рассматриваются мужской пол, позитивность по HLA-B27, семейный анамнез в отношении СпА и неполноценное лечение в острой фазе болезни. К особенностям течения хронического РеА относят преимущественно моно- или олигоартикулярное поражение, редкое развитие эрозивного процесса в периферических суставах и возможность трансформации в другие СпА. Описаны случаи летальных исходов, обусловленных развитием амилоидоза или тяжелым поражением сердца.
Статья подготовлена в рамках научно-исследовательских работ ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», №/№ государственных заданий 1021051503137-7 и 1021051503137-9.
Исследование не имело спонсорской поддержки.
Авторы декларируют отсутствие конфликта интересов.
B.S. Belov, MD, PhD, N.V. Muravyova, PhD, Sh.F. Erdes, MD, PhD, Prof.
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
Currently, the problem of reactive arthritis (ReA) remains important. This is due to the sufficiently high prevalence of the disease. The analysis of epidemiological data allows us to put forward a number of possible reasons explaining the different frequency of ReA in certain regions of the Russian Federation and in other countries. The article details the clinical picture of the disease, analyzes the significance of various laboratory techniques aimed at identifying the causative agent of ReA. The main approaches to the therapy of ReA, including the use of antimicrobial drugs, are described.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.