Артритогенные альфавирусные инфекции: что следует знать ревматологу
- Аннотация
- Статья
- Ссылки
- English
В статье представлены данные об эпидемиологии и патогенезе артритогенных альфавирусных инфекций, клиническая картина, методы диагностики и основные подходы к терапии.
В статье представлены данные об эпидемиологии и патогенезе артритогенных альфавирусных инфекций, клиническая картина, методы диагностики и основные подходы к терапии.


Введение
Альфавирусы представляют собой род оболочечных РНК-содержащих вирусов семейства Togaviridae, в который входят 32 вида. Все альфавирусы, для которых известен механизм передачи, являются арбовирусами, то есть передаются при участии кровососущих членистоногих. Обычным природным переносчиком и промежуточным хозяином альфавирусов являются комары.
За последние десятилетия альфавирусные заболевания превратились в серьезную проблему здравоохранения, так как приводят к разрушительным эпидемиям, особенно в развивающихся странах, ассоциируются с высокой вероятностью хронизации процесса, выраженных функциональных нарушений и снижения качества жизни.
Глобальное распространение альфавирусных заболеваний происходило быстро и неконтролируемо. В качестве причин рассматриваются различные демографические и социальные факторы, такие как увеличение численности населения в результате неконтролируемой урбанизации, темпов миграции людей, животных и переносчиков болезней, изменение моделей землепользования и ирригационных систем, обезлесение.
Генетические изменения делают вирусы более вирулентными и повышают их способность вызывать эпидемии в наивных популяциях [1].
В статье рассматриваются артритогенные представители альфавирусов, к которым относят вирус Чикунгунья (ВЧ), в настоящее время широко распространенный вирус О'Ньонг-Ньонг, обнаруженный в странах Африки к югу от Сахары, вирус Маяро – в Латинской Америке, вирус реки Росс и вирус леса Барма – в Австралии и Океании, вирус Синдбис, выявленный как причина заболевания в Карелии, Швеции (болезнь Оккельбо) и Финляндии (болезнь Погоста) [2].
В России описаны девять завозных случаев ВЧ из Индонезии, Сингапура, Индии, с острова Реюньон и Мальдивских островов [3, 4].
Патогенез
После укуса комара вирус проникает в макроорганизм с развитием краткосрочной первичной виремии. В дальнейшем он распространяется по организму с инфицированием дендритных клеток, макрофагов, фибробластов или эндотелиальных клеток. Репликация вируса в указанных клетках приводит к лизису последних и развитию вторичной виремии, совпадающей с развитием лихорадки, сыпи, артралгии и лейкопении. Затем вирус переносится по лимфатической системе и кровотоку с помощью дендритных клеток и инфицированных мононуклеаров. Главным образом вирус поражает клетки эпителиального происхождения, а именно эндотелиоциты, недифференцированные мышечные клетки, фибробласты и фибробластоподобные синовиоциты, тканевые макрофаги и, возможно, другие периферические и тканевые резидентные мононуклеарные клетки в составе синовиальной оболочки, печени и мозга. В этих местах репликация вируса продолжается, причем ее пик приходится на шестой день заражения. Именно в фазе виремии, которая обычно длится четыре – шесть дней после появления симптомов, возможно обнаружение вирусной РНК, содержание которой достигает 108–109 копий/мл [5]. Полагают, что с уровнем виремии связаны интенсивность первоначального противовирусного ответа, поддержание воспалительного процесса в подострой фазе и даже переход в хроническую форму болезни [6].
Обнаружение вирусных компонентов мононуклеарными клетками запускает иммунный ответ с продукцией интерферонов I, различных цитокинов и хемокинов, активацией цитотоксических CD8+Т-клеток. Примерно на четвертый – шестой день заболевания формируется гуморальный ответ с продукцией антител, обеспечивающих элиминацию вируса из кровотока. В ряде случаев возможна хронизация воспалительного процесса с развитием продолжительного поражения суставов. Для объяснения данного феномена предложены как минимум две гипотезы:
персистенция фрагментов вирусной РНК или белков в макрофагах и моноцитах, вызывающая клеточную активацию и последующую выработку цитокинов и антител;
индукция аутоиммунитета у генетически предрасположенных индивидуумов.
Клиническая картина
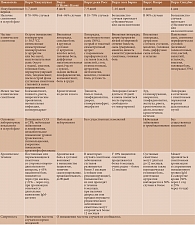
Клиническая картина представлена в табл. 1 [1].
Инкубационный период болезни составляет от трех до десяти дней. Он может варьироваться от одного до 12 дней.
В зависимости от длительности симптомов выделяют острую (до 14 дней), подострую (до трех месяцев) и хроническую (более трех месяцев) формы заболевания.
В ряде случаев болезнь протекает субклинически или асимптомно.
При острой форме клиническая манифестация наблюдается в 55–97% случаев с развитием классической триады: внезапной высокой лихорадки, артралгий/артритов и кожной сыпи. Поражение суставов обычно носит симметричный и полиартикулярный характер с развитием скованности и синовитов. Чаще в процесс вовлекаются мелкие суставы кистей и стоп, а также лучезапястные, голеностопные и коленные суставы. В 50–75% случаев наблюдается макулопапулезная сыпь, нередко с зудом и преимущественной локализацией на туловище и конечностях. Возможно также поражение кожи лица, ладоней и/или подошв. Другие неспецифичные признаки включают генерализованные миалгии, боль в спине, головную боль, выраженную слабость [7]. При наличии факторов риска (пожилой возраст, алкоголизм, фоновая респираторная или сердечно-сосудистая патология) существует вероятность тяжелого течения заболевания.
Клинические и лабораторные характеристики отдельных альфавирусных инфекций в острой фазе схожи, что затрудняет дифференциальную диагностику в этот период. Следовательно, для определения наиболее вероятной этиологии важно использовать эпидемиологические данные, географическое распространение вируса и переносчиков.
При подострой форме болезни костно-суставная система поражается у 50% больных, инфицированных ВЧ. Клинические проявления включают стойкие артралгии/артриты, бурситы, теносиновиты, утреннюю скованность и астению.
Хронические формы суставной патологии описаны при всех альфавирусных инфекциях. Наиболее изученным в этом плане является ВЧ. Так, в проспективной когорте пациентов с острова Реюньон проблемы со стороны опорно-двигательного аппарата наблюдались в 83% случаев через 32 месяца после перенесенной ВЧ-инфекции и сопровождались астенией и депрессией [8]. Согласно данным ряда исследований, к факторам риска хронизации суставного синдрома после ВЧ-инфекции относятся женский пол, возраст старше 40 лет, клинически манифестная патология при острой форме (полиартрит, теносиновит), наличие фоновых заболеваний суставов (остеоартрит) и сахарного диабета [9, 10].
Характер поражения опорно-двигательного аппарата при хронических воспалительных формах может варьироваться. Так, после одного – шести лет наблюдения артрит выявляли с частотой 0,3–5,0% случаев [11, 12]. На этой стадии, как правило, отмечаются стойкие (20–40%) или рецидивирующие (60–80%) симметричные олиго- или полиартралгии различной интенсивности с преимущественным вовлечением суставов кистей и стоп, а также голеностопных и коленных суставов. Половина пациентов жалуется на утреннюю скованность продолжительностью более 30 минут [13]. Периартикулярные воспалительные проявления включают тендовагинит, тендинит, энтезит, бурсит, капсулит и периостит. В дополнение к воспалительным симптомам могут отмечаться астения, миалгия, расстройства настроения и сна с серьезным ухудшением качества жизни [11, 14].
В систематическом обзоре, проведенном E.S. Paixão и соавт., наиболее распространенными симптомами при хронических формах были боль (артралгия, миалгия), усталость, скованность, депрессия, нарушения настроения и сна [15]. Кроме того, описаны отек мягких тканей, компрессионные синдромы, невропатии мелких волокон и феномен Рейно [14]. В некоторых случаях развивается диффузная боль, подобная боли при фибромиалгии. В исследовании с участием взрослых больных спустя шесть лет с момента заражения ВЧ-инфекцией отмечены высокая распространенность головной боли, усталости, подавленного настроения, ухудшение качества жизни и значимые расходы, связанные с оказанием медицинской помощи [16].
Учитывая актуальность рассматриваемого аспекта, E. Murillo-Zamora и соавт. предложили индекс для прогнозирования развития хронического воспалительного поражения суставов в течение 12 месяцев после острой фазы ВЧ-инфекции. Данный индекс может быть полезным для определения более агрессивной терапевтической стратегии в острой и подострой фазах с целью предотвращения перехода процесса в хронический [17].
Лабораторная диагностика
В острой фазе (преимущественно при ВЧ-инфекции) у большинства больных отмечаются высокие показатели скорости оседания эритроцитов (СОЭ) и С-реактивного белка (СРБ). Возможны лейкопения, лимфопения, гипокальциемия, повышение уровней креатинфосфокиназы и лактатдегидрогеназы, а также отклонение показателей функции печени и почек. В отличие от лихорадки Денге (ЛД) показатели коагуляции не изменены. Согласно данным M. Oliver и соавт., криоглобулинемия встречалась у 94% ВЧ-инфицированных лиц с суставной патологией [18].
Подтверждением ВЧ-инфекции на ранней стадии болезни, то есть на четвертый – седьмой день, служит выявление вирусной РНК методом полимеразной цепной реакции (ПЦР) с обратной транскрипцией. На более поздних этапах болезни чувствительность молекулярных методов снижается по причине выраженного иммунного ответа макроорганизма и, как следствие, снижения вирусной нагрузки. При этом возрастает роль серологического тестирования, которое дает значимую диагностическую информацию об иммунных реакциях макроорганизма в ответ на альфавирусную инфекцию. Специфические антитела к иммуноглобулинам (Ig) M и G вырабатываются с четвертого дня острой фазы инфекции. Уровень IgG остается повышенным на протяжении всей жизни, в то время как уровень IgM обычно снижается в период от двух до трех месяцев. Однако IgM-антитела, специфичные для ВЧ, могут определяться в течение нескольких месяцев или даже лет [19]. Показано, что после острой фазы инфекции данные антитела были выявлены у 76,2% пациентов в течение двух – шести месяцев, у 69,8% – в течение 7–12 месяцев, у 55,5% – в течение 13–18 месяцев [20]. Через год после заражения ВЧ частота персистенции IgM-антител варьировалась от 17% в районах с умеренным климатом до 51,4% в тропической зоне Камеруна [21, 22]. В когорте на острове Реюньон у 39,8% из 88 пациентов выявлены положительные IgM-антитела в среднем через 18,7 месяца без какой-либо связи с персистирующей артралгией [23].
Инструментальная диагностика
У больных в хронической фазе альфавирусной инфекции целесообразность проведения визуализирующих тестов должна быть обоснована клинической симптоматикой. Пациентам с воспалительными заболеваниями суставов первоначально следует назначить стандартную рентгенографию в зависимости от локализации поражения, чтобы определить исходный статус и наличие эрозий. Рентгенологические данные, наблюдаемые при ВЧ-ассоциированной артропатии, как правило, выявляются на снимках, выполненных в период от трех месяцев до двух лет от начала болезни [24, 25].
Ультразвуковое исследование позволяет оценить наличие синовита, степень активности воспаления, наличие эрозий костей, повреждений связок и сухожилий, а также дифференцировать воспалительные и невоспалительные состояния.
Исследования, посвященные оценке применения магнитно-резонансной томографии при хронической ВЧ-артропатии, малочисленны, носят преимущественно описательный характер, не определяют четких показаний для назначения данного метода, его превосходства над ультразвуковым исследованием и целесообразности проведения с целью динамического наблюдения. При этом рекомендуется учитывать стоимость и доступность обследования, а также опыт врача в выборе подходящего метода визуализации в каждом конкретном случае. Результаты магнитно-резонансной томографии при хронической ВЧ-артропатии большей частью аналогичны таковым при других воспалительных заболеваниях суставов, особенно при ревматоидном артрите (РА) [26].
Диагностические критерии
В 2017 г. экспертами Бразильского общества ревматологов был разработан диагностический алгоритм для ВЧ-инфекции (табл. 2) [24]. Диагноз основывается на типичной клинической картине (внезапно возникшая лихорадка с острым суставным синдромом) в сочетании с эпидемиологическими данными. Для верификации диагноза, включая случаи с атипичным течением, необходимо выполнение соответствующих лабораторных исследований.
Дифференциальный диагноз
Симптомы, типичные для острой фазы альфавирусных инфекций (лихорадка, суставной синдром, экзантема), могут наблюдаться при других вирусных нозологиях, в частности при ЛД и лихорадке Зика (ЛЗ). При ЛД лихорадка выражена в меньшей степени, кожная сыпь возникает позже (на пятый – седьмой день), значительно чаще наблюдаются одинофагия (боль в пищеводе при глотании), ретроорбитальная головная боль, кашель, рвота, диарея, абдоминальные боли, анорексия, тахикардия, нейтропения и тромбоцитопения. При ЛЗ лихорадочный и суставной синдромы протекают легче, гиперемия конъюнктивы и кожная сыпь с зудом встречаются чаще. Развитие указанной клинической картины наряду с альфавирусами может быть обусловлено другими вирусами (аденовирус, энтеровирус, парвовирус В19), а также бактериальными инфекциями (лептоспироз) и паразитарными заболеваниями (малярия).
Для ревматолога представляется важным разграничение острой формы альфавирусных инфекций с системными аутоиммунными заболеваниями. В частности, высокая лихорадка, экзантема, артралгии/артриты, повышение уровней трансаминаз входят в симптомокомплекс болезни Стилла. По мнению экспертов Бразильского общества ревматологов, наличие лихорадочного синдрома в сочетании с поражением суставов, кожи, почек, легких, нервной системы и лимфопенией требует проведения дифференциальной диагностики осложненной формы ВЧ-инфекции и системной красной волчанки [24].
При подострой и хронической формах альфавирусных инфекций клиническая симптоматика может быть аналогична таковой при ряде хронических воспалительных ревматических заболеваний. Так, наблюдаемое в рамках ВЧ-инфекции (преимущественно у женщин среднего возраста) симметричное поражение суставов кистей, коленных и голеностопных суставов в сочетании с утренней скованностью и повышением острофазовых показателей воспалительный активности ставит ревматолога перед необходимостью исключения РА [27, 28]. Согласно имеющимся данным, 5–36% больных с ВЧ-инфекцией и суставным синдромом удовлетворяли критериям Американской коллегии ревматологов для РА спустя 10–27 месяцев от момента начала инфекции [29, 30]. Дифференциальная диагностика осложняется возможностью обнаружения ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду (АЦЦП) при ВЧ-инфекции. Несмотря на низкую частоту определения АЦЦП, в большинстве случаев течение болезни было тяжелым [31]. Примечательно, что содержание РФ, повышенное при острой и хронической формах ВЧ-инфекции, может нормализоваться после разрешения клинической симптоматики.
Лечение
В современной литературе нет данных о рандомизированных исследованиях, позволяющих сделать однозначные выводы о тактике лечения поражения суставов в рамках альфавирусных инфекций. Рекомендации, представленные ниже, основаны на результатах открытых исследований, описании серии случаев, а также мнении экспертов [32]. В связи с недостатком данных будут изложены основные подходы к лечению наиболее изученной ВЧ-инфекции, которые можно экстраполировать на другие формы альфавирусных инфекций.
Поскольку эффективной противовирусной терапии до сих пор не разработано, основные усилия направлены на купирование артралгий, артритов и теносиновитов, при этом они изменяются в зависимости от фазы заболевания.
В острой фазе основная цель терапии – ликвидация или значительное уменьшение болевого синдрома, выраженность которого при оценке по стомиллиметровой визуальной аналоговой шкале нередко превышает 70 мм. Препаратами выбора являются анальгетики и опиоиды (табл. 3) [1]. С учетом трудности разграничения ВЧ-инфекции и ЛД в острой фазе применение нестероидных противовоспалительных препаратов (НПВП) не показано из-за повышенного риска кровотечений. Следует избегать приема салицилатов, так как в период острой вирусной инфекции эти препараты могут спровоцировать развитие синдрома Рея, быстропрогрессирующей угрожающей жизни острой энцефалопатии в сочетании с поражением печени. При наличии боли нейропатического характера (жжения, пульсации, пощипывания, ощущения уколов и/или покалывания и т.д.) могут быть использованы трициклические антидепрессанты (амитриптилин) или противосудорожные препараты (габапентин, прегабалин или карбамазепин).
Применение глюкокортикоидов (ГК) при острой форме, когда имеет место высокий уровень виремии, не рекомендуется в связи с отсутствием положительных отдаленных результатов. Более того, при отмене ГК возрастает риск рецидива артрита или теносиновита (rebound-синдром).
У большинства пациентов симптоматика острой фазы болезни регрессирует, как правило, в течение двух недель.
Лечение больных в подострой фазе аналогично предыдущему с использованием анальгетиков, опиоидов, противосудорожных средств и антидепрессантов, назначаемых в зависимости от преобладающих симптомов. На данном этапе представляется важным включение физиотерапевтических мероприятий, поскольку они могут помочь более быстрому восстановлению подвижности суставов.
При неэффективности вышеуказанных анальгетиков применяют НПВП. Выбор конкретного препарата осуществляется врачом в зависимости от его опыта и клинического статуса больного. V. Rosario и соавт. наблюдали 514 больных ВЧ-инфекцией со средней длительностью болезни 2,5 месяца и в большинстве (89%) случаев отметили хороший эффект различных НПВП (напроксена, целекоксиба, эторикоксиба) [33].
Эффективность НПВП оценивают на седьмой – десятый день терапии. В отсутствие положительной динамики применяют препарат из другой группы НПВП. При наличии клинической эффективности и хорошей переносимости лечение НПВП продолжают в течение нескольких недель с постепенной отменой.
Исследования, подтверждающие целесообразность назначения гидроксихлорохина (ГХ) в острой и подострой фазах болезни, в настоящее время отсутствуют.
При неэффективности анальгетиков и НПВП могут быть использованы ГК. Хотя единого мнения относительно схемы лечения нет, представляется целесообразным применять преднизолон в дозе 10 мг/сут в случаях легкой и умеренной степени тяжести и 0,5 мг/кг/сут в наиболее тяжелых случаях. По мере улучшения отмену ГК следует проводить медленно, не превышая общую продолжительность курса лечения, составляющую четыре недели. В отдельных случаях могут быть выполнены внутрисуставные инъекции ГК, а также обкалывание околосуставных мягких тканей. Необходимо соблюдать осторожность при назначении ГК пациентам с трудно контролируемой артериальной гипертензией, диабетом, ожирением третьей степени, хронической почечной недостаточностью, психическими расстройствами, аритмиями, ишемической болезнью сердца, остеопоротическими переломами, глаукомой и находящимся на диализе. По окончании терапии ГК в целях профилактики rebound-синдрома возможно назначение НПВП.
При хронической форме у большинства больных с успехом применяют ГК в дозах от 5 до 20 мг/сут, но не более 40 мг/сут, в течение периода, не превышающего шесть – восемь недель. При наличии сопутствующих заболеваний, указанных выше, необходимо назначать самую низкую дозу ГК в течение как можно более короткого промежутка времени.
При стойких умеренных или выраженных артралгиях целесообразно применение ГХ в дозе 400 мг/сут в течение шести недель.
При безуспешности указанных схем показан метотрексат (МТ) в дозе 10 мг/нед с оценкой эффективности терапии каждые четыре недели. J.K. Amaral и соавт. через четыре недели применения МТ у больных ВЧ-ассоциированным артритом отметили явную положительную динамику в виде снижения числа припухших суставов в среднем с 7,15 до 2,89 [34]. В случае необходимости доза МТ может быть повышена до 25 мг/нед, при этом длительность лечения должна составлять не менее трех месяцев. При недостаточном эффекте монотерапии МТ следует добавить сульфасалазин (СУЛЬФ) в дозе 2–3 г/сут. Последний также применяют при плохой переносимости МТ. В ходе рандомизированного открытого 24-недельного исследования в параллельных группах было показано, что применение комбинации «МТ + СУЛЬФ + ГХ» по ряду параметров значимо превосходило монотерапию ГХ при ВЧ-ассоциированном хроническом артрите [35].
Недостаточная эффективность вышеуказанной терапии у больных со стойким артритом в рамках хронической ВЧ-инфекции ставит на повестку дня вопрос о назначении генно-инженерных биологических препаратов, в частности ингибиторов фактора некроза опухоли α, по схемам, аналогичным при РА и спондилоартритах, с соблюдением всех пунктов рекомендаций и мер предосторожности. Однако малочисленность случаев применения указанных препаратов в данной популяции не позволяет сформулировать определенное мнение по этому вопросу.
При развитии ВЧ-инфекции у пациентов с системным воспалительным ревматическим заболеванием, по поводу которого проводится активная терапия (гормональная, цитостатическая, генно-инженерными биологическими препаратами). Последнюю во время острой формы рекомендуется отменить с дальнейшим возобновлением.
На всех этапах ВЧ-инфекции рекомендуются разные методы реабилитации: лечебная физкультура, массаж, физиотерапия (исключая тепловые процедуры в острой фазе) и т.д.
Профилактика
Специфическая вакцинопрофилактика в настоящее время не проводится из-за отсутствия лицензированных препаратов [36].
Неспецифическая профилактика эпидемических вспышек включает в себя мониторинг популяции переносчиков и проведение санитарно-гигиенических мероприятий противоэпидемической направленности.
Заключение
В настоящее время в связи с глобализацией, увеличением объемов торговли и путешествий, нарастающей урбанизацией и, как следствие, более широким распространением комаров вида Aedes вероятность возникновения вспышек трансмиссивных инфекций, включая альфавирусные, существенно возрастает во всем мире. Следовательно, ревматологи должны проявлять настороженность в отношении этих инфекций у лиц со стойким суставным синдромом, проживающих или недавно вернувшихся из эндемичных регионов.
Программа будущих исследований, несомненно, должна быть направлена на изучение патофизиологических процессов хронизации и формирования стойких проявлений со стороны опорно-двигательного аппарата [37]. В этом аспекте заслуживает пристального внимания и требует дальнейшего изучения широкий диапазон сходных патогенетических и клинических признаков ВЧ-артрита и РА [38]. Необходимо проведение сравнительных рандомизированных исследований для получения информации об эффективности и безопасности антиревматических препаратов, в первую очередь МТ, у пациентов с хроническим ВЧ-артритом [39]. Сохраняют актуальность работы, связанные с разработкой и быстрым внедрением в практику различных вакцин, которые позволят активно и продуктивно решать вопросы специфической профилактики альфавирусных инфекций.
Заявление о конфликте интересов
Статья подготовлена в рамках научно-исследовательской работы
ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7.
Конфликт интересов отсутствует.
B.S. Belov, MD, PhD, N.V. Muravyeva, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
Arboviruses are pathogenic viruses transmitted by the bite of blood-sucking arthropods, such as mosquitoes and ticks. Among them, the genus of alphaviruses of the Togaviridae family is considered the most arthritic, causing diseases such as Сhikungunya fever, O'nyong-nyong viral fever, Ross River viral disease, Barma Forest viral disease, Sindbis viral disease and Mayaro fever. These alphavirus diseases have had a great impact on public health in recent decades, causing large-scale epidemics, especially in developing countries, due to their high potential for chronization, functional disorders and significant impact on quality of life. This article presents data on the epidemiology and pathogenesis of arthritic alphavirus infections, describes in detail the clinical picture, diagnostic methods and basic approaches to the treatment of these diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.