Современные подходы к терапии диабетической полинейропатии
- Аннотация
- Статья
- Ссылки
- English
При ДПН показаны коррекция гликемии и модификация образа жизни, патогенетическое и симптоматическое лечение.
В настоящее время α-липоевая кислота является единственным препаратом с доказанной эффективностью для патогенетического лечения ДПН. Своевременное назначение патогенетической, а также эффективной симптоматической терапии уменьшает выраженность нейропатической боли, улучшает качество сна, подвижность пациентов и качество их жизни в целом, а также влияет на степень прогрессирования нейропатии, что способно снизить не только риск инвалидизации, но и сердечно-сосудистые риски, а также риск смерти.
При ДПН показаны коррекция гликемии и модификация образа жизни, патогенетическое и симптоматическое лечение.
В настоящее время α-липоевая кислота является единственным препаратом с доказанной эффективностью для патогенетического лечения ДПН. Своевременное назначение патогенетической, а также эффективной симптоматической терапии уменьшает выраженность нейропатической боли, улучшает качество сна, подвижность пациентов и качество их жизни в целом, а также влияет на степень прогрессирования нейропатии, что способно снизить не только риск инвалидизации, но и сердечно-сосудистые риски, а также риск смерти.

Введение
Сахарный диабет (СД) – хроническое многофакторное заболевание, которое требует мультидисциплинарного подхода, выходящего за рамки контроля и снижения гипергликемии [1]. Диабетическая периферическая нейропатия (ДПН) является наиболее частым осложнением как СД 1 типа, так и СД 2 типа и встречается более чем у половины больных [2]. В Северной Америке диабет признан основной причиной развития периферической нейропатии [3].
Если ДПН у пациентов с СД 1 типа обычно развивается через несколько лет от его дебюта, то у больных СД 2 типа может встречаться уже при постановке диагноза, а иногда на стадии предиабета [4].
ДПН – ключевой фактор трофических нарушений, возникновения диабетической стопы и наиболее частая причина нетравматических ампутаций нижних конечностей в странах с высоким уровнем дохода [5, 6]. Согласно данным экспертов Всемирной организации здравоохранения, у больных СД нижние конечности ампутируют в десять раз чаще, чем у лиц без диабета [7]. Важно отметить, что в 80% случаев развитие диабетической стопы и ампутаций можно было бы предотвратить при своевременной диагностике и лечении [5].
Наиболее частая форма ДПН – дистальная симметричная сенсомоторная полинейропатия, когда в патологический процесс вовлекаются чувствительные и двигательные нервные волокна, однако нередко выявляются и признаки повреждения тонких или вегетативных волокон, что может наблюдаться как в дебюте диабетической нейропатии, так и по мере ее прогрессирования [8]. При автономной (вегетативной) ДПН вовлекаются волокна, иннервирующие сердце, желудочно-кишечный тракт, органы мочеполовой системы, мышцу, суживающую зрачок, и потовые железы. Частота кардиальной автономной ДПН в исследовании Diadet Control and Complications Trials/Epidemiology of Diabetes Intervention and Complications достигала 30% у пациентов с СД 1 типа с катамнезом заболевания 20 лет и 60% у пациентов с СД 2 типа с катамнезом заболевания 15 лет [2]. Основными факторами риска возникновения ДПН при СД являются неадекватный гликемический контроль, ожирение, длительность заболевания, возраст пациента, артериальная гипертензия в анамнезе, курение, наличие гипогликемических состояний, гиперлипидемия [9].
Контроль гликемии может предотвратить развитие ДПН у пациентов с СД 1 типа и невыраженно замедлить ее прогрессирование у лиц с СД 2 типа [10, 11].
В настоящее время акцент делается на профилактике и раннем выявлении осложнений диабета, в первую очередь ДПН. Так, согласно рекомендациям экспертов Американской диабетической ассоциации 2022 г., всех пациентов необходимо обследовать для верификации ДПН с момента диагностирования СД 2 типа или через пять лет после диагностирования СД 1 типа, далее – не реже одного раза в год [1]. Эксперты Европейской ассоциации по изучению диабета установили, что риск наступления острого сердечно-сосудистого события (инсульта, инфаркта, внезапной сердечной смерти) вдвое выше у пациентов с СД независимо от наличия других факторов риска [1].
Нарушение вибрационной чувствительности считается предиктором трофических нарушений и образования язв стопы [1]. В некоторых исследованиях изменения тактильной чувствительности и осязания определены как предикторы сердечно-сосудистых осложнений [10]. Это имеет важное значение, так как ДПН повышает риск смертельных исходов при СД. Изменения вибрационной чувствительности и скорости передачи возбуждения по нервам у больных СД признаны независимыми предикторами смерти [11].
Таким образом, ДПН и ее осложнения являются значительным медицинским, социальным и финансовым бременем как для пациента и его семьи, так и для здравоохранения и общества в целом [2].
Диагностика
Постановка диагноза ДПН в первую очередь основывается на клинической оценке, которая включает подробный сбор анамнеза, физикальный осмотр, определение неврологического статуса. Диагностика ДПН не всегда проста, так как в 50% случаев патология протекает асимптомно. Однако раннее выявление и своевременное лечение уменьшают риск развития трофических язв стопы и ампутаций [12].
У больных необходимо установить неврологический статус, начало появления симптомов, их распределение, возникновение новых жалоб и эффективность предшествующей терапии [13]. При неврологическом осмотре особое внимание следует уделить оценке чувствительности. Вибрационная чувствительность определяется с помощью 128 Гц камертона, тактильная – с помощью 10 г монофиламента, болевая и температурная – с помощью одноразовой иголки и терморучки [14]. Обязательным является осмотр стоп на наличие дефектов кожи и трофических нарушений [2].
При ДПН могут угнетаться сухожильные рефлексы, в некоторых случаях появляться двигательные нарушения, гипотрофия мышц, походка становится атактической [15].
В начале заболевания нередко повреждаются только тонкие волокна и первыми жалобами являются боль и чувствительные нарушения (жжение, парестезии).
Для автономной нейропатии при диабете характерны такие симптомы, как скрытая гипогликемия, тахикардия в состоянии покоя, ортостатическая гипотензия, гастропарез, нарушение перистальтики ободочной кишки (запоры) и энтеропатия (диарея), эректильная дисфункция у мужчин и нарушение сексуальной функции у женщин, нейрогенный мочевой пузырь, судомоторная дисфункция с повышением или понижением потоотделения [1].
Согласно консенсусу, принятому на Восьмом Международном симпозиуме по диабетической невропатии в Торонто, предлагается выделять возможную, вероятную и подтвержденную ДПН. Изолированное повреждение тонких волокон у пациента с СД эксперты определили как субклиническую ДПН [9].
Несмотря на то что диагноз ДПН является клиническим, электронейромиографическое исследование – одно из составляющих оценки ДПН, особенно с учетом вариабельности симптомов и их прогрессирования. Электронейромиография при ДПН стандартизирована и широко применяется на практике, однако она неинформативна при нейропатии тонких волокон.
Золотым стандартом диагностики нейропатии тонких волокон является биопсия кожи с количественной оценкой плотности внутриэпидермальных нервных волокон, но, учитывая инвазивность метода, а также недоступность его во многих лабораториях, она проводится нечасто. Конфокальная микроскопия роговицы – неинвазивный метод офтальмологического осмотра, сравнимый с биопсией кожи при диагностике ДПН [16]: длина нервных волокон роговицы служит предиктором развития ДПН у пациентов с СД 1 типа [17], плотность нервных волокон роговицы имеет диагностическое значение при СД 1 и 2 типов [16, 18].
У больных СД с асимметричной нейропатией, мононейропатиями, поражением черепных нервов, преимущественно двигательными нарушениями, быстро прогрессирующими симптомами, а также с преобладанием симптоматики в руках могут иметь место недиабетические причины развития нейропатии, что требует дообследования.
Дифференциальный диагноз ДПН включает токсический генез, дефицит витамина В12, моноклональную гаммапатию, уремию, гипотиреоз, паранеопластический генез, поражение периферических артерий, воспалительные или инфекционные заболевания, а также прием нейротоксических препаратов [19, 20].
Лечение
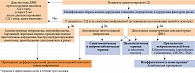
Ведение пациентов с ДПН включает:
- коррекцию гликемии, модификацию образа жизни и факторов риска;
- патогенетическое лечение;
- симптоматическую терапию.
Алгоритм терапии ДПН представлен на рис. 1.
Коррекция гликемии и модификация образа жизни
Установлено, что нормальный или близкий к нормальному гликемический индекс, поддерживаемый с ранних стадий диабета, снижал или предотвращал развитие ДПН у пациентов с СД 1 типа [21, 22]. При СД 2 типа ситуация не столь однозначна. Так, в ряде исследований показано, что поддержание нормального гликемического индекса при СД 2 типа неубедительно влияло на предотвращение или замедление прогрессирования симптомов ДПН [1, 23]. Согласно результатам других исследований, достижение целевой гликемии тормозило развитие ДПН у больных СД 2 типа [24].
Наряду с гликемией оценивалась роль других факторов в развитии и прогрессировании ДПН, в частности снижения массы тела, интенсивной тактики сахароснижающей терапии, а также сердечно-сосудистых осложнений. Модификация образа жизни, включавшая снижение массы тела, способствовала уменьшению неврологических жалоб. Интенсивная сахароснижающая терапия достоверно влияла на прогрессирование ДПН при СД 1 типа и не влияла на течение ДПН при СД 2 типа. Вклад факторов риска развития сердечно-сосудистых осложнений на течение ДПН не выявлен [20].
Патогенетическое лечение
В патогенезе ДПН выделяют несколько звеньев. Одно из них – накопление свободных форм кислорода и карбонилов ввиду нарушения функций митохондрий на фоне гипергликемии и гиперлипидемии. Активные формы кислорода и карбонилы повреждают ДНК и активируют стрессовые и воспалительные реакции, что приводит к изменению экспрессии генов и повышению выработки воспалительных хемокинов и цитокинов, что запускает апоптоз [20].
В клинической практике изучаются несколько препаратов, влияющих на окислительный стресс, – препараты из группы витамина Е, ингибиторов альдозоредуктазы, α-липоевой кислоты.
Достоверного влияния витамина Е и ингибиторов альдозоредуктазы на течение ДПН в настоящее время не выявлено [20], однако доказана эффективность α-липоевой кислоты [25]. Данная кислота относится к группе метаболических препаратов, является коферментом в реакции окислительного фосфорилирования пировиноградной кислоты и кетокислот. Она защищает клетки от токсического воздействия активных форм кислорода, а также обладает синергичным действием с инсулином [26].
Эффективность и безопасность как внутривенного (в/в), так и перорального применения α-липоевой кислоты при ДПН оценивались во многих рандомизированных плацебоконтролируемых исследованиях [27]. Эффективность внутривенного введения препарата в дозе 600 мг/сут стала предметом исследования SYDNEY, в которое было включено 120 пациентов с симптомной ДПН. Участники исследования были рандомизированы на две группы: принимавших α-липоевую кислоту (n = 60) и плацебо (n = 60). Длительность лечения составила три недели. У получавших α-липоевую кислоту по сравнению с принимавшими плацебо уменьшились симптомы ДПН (р = 0,001), оцениваемые с помощью шкалы общей оценки симптомов (Total Symptom Score, TSS) и шкалы невропатических нарушений (Neuropathy Impairment Score, NIS). В группе α-липоевой кислоты по сравнению с группой плацебо также снизилась дистальная латентность сенсорного ответа икроножного нерва. Клиническое улучшение состояния пациентов в группе α-липоевой кислоты отметили 66,7% врачей, в группе плацебо – 1,7% (р = 0,001) [28].
Эффективность пероральной терапии α-липоевой кислотой оценивалась в исследованиях SYDNEY 2 и NATHAN 1. Длительность терапии в исследовании SYDNEY 2 составила пять недель, в исследовании NATHAN 1 – четыре года. В группе α-липоевой кислоты в отличие от группы плацебо средний балл по TSS снизился на 4,5–4,9 против 2,9 балла (р < 0,05). Значительное уменьшение боли, оцениваемой по шкале невропатических нарушений и шкале нейропатических симптомов (Neuropathy Symptom Score, NSC), наблюдалось у получавших α-липоевую кислоту [29]. В исследовании NATHAN 1 в качестве дополнительных диагностических инструментов использовали шкалу симптомов нейропатии нижних конечностей (NIS-LL) и подшкалу мышечной слабости NIS-LL. Изменения на фоне терапии по NIS и NIS-LL, а также по подшкале мышечной слабости NIS-LL относительно исходного уровня были более выраженными в группе α-липоевой кислоты по сравнению с группой плацебо (р = 0,028, p = 0,05 и p = 0,045 соответственно). Клинически значимое улучшение, а также уменьшение прогрессирования симптомов ДПН оказались более выраженными среди применявших α-липоевую кислоту. Общая оценка переносимости лечения и частота прекращения терапии ввиду развития нежелательных реакций между группами не различались [30].
Комбинированная терапия (в/в и пероральная) α-липоевой кислотой оценивалась в исследовании ALADIN II, в котором приняли участие 65 пациентов с ДПН. Всем пациентам проводилась инфузия препарата или плацебо пять дней с дальнейшим пероральным приемом в течение двух лет. Амплитуда сенсорного ответа и скорость проведения возбуждения икроножного нерва значительно увеличились в группе α-липоевой кислоты по сравнению с группой плацебо (p < 0,05). Изменения нейрофизиологических параметров большеберцового нерва не отмечено. Не было также зафиксировано динамики по шкале нейропатического дисфункционального счета (Neuropathy Disability Score, NDS) [31].
Метаанализы клинических испытаний подтвердили эффективность α-липоевой кислоты в дозе 600 мг/сут при в/в введении в течение трех недель и пероральном приеме в течение пяти недель и шести месяцев. На фоне такого лечения у больных уменьшилась выраженность нейропатической боли, онемения и жжения. Статистически значимые улучшения по TSS отмечались со второй недели терапии, которые увеличивались в течение всего времени лечения. Зафиксировано также более выраженное уменьшение изменений по NIS у получавших α-липоевую кислоту по сравнению с применявшими плацебо [32].
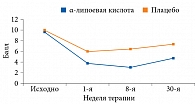
С учетом хронического, неуклонно прогрессирующего характера течения заболевания не менее важна продолжительность эффекта терапии. Согласно данным исследования SYDNEY, уменьшение симптомов, таких как боль, онемение и парестезии, а также снижение величины TSS, сохранялось в течение шести месяцев после стандартной терапии α-липоевой кислотой в дозе 600 мг/сут в/в в течение трех недель (рис. 2) [33].
В клинической практике применяются препараты α-липоевой кислоты на основе этилендиаминовой, меглюминовой и трометамоловой солей. Наиболее часто побочные эффекты отмечались при использовании препаратов на основе этилендиаминовой соли, что потребовало поиска новых лекарственных форм, обеспечивающих лучшую переносимость лечения. В 1994 г. проведено сравнительное исследование препаратов на основе этилендиаминовой и трометамоловой солей, доказавшее меньшую частоту развития местных побочных эффектов при использовании препаратов на основе трометамоловой соли [34].
Оригинальным препаратом α-липоевой кислоты для в/в введения на основе трометамоловой соли является Тиоктацид® 600 Т. Существует препарат α-липоевой кислоты для перорального применения быстрого высвобождения – Тиоктацид® БВ, позволяющий избежать высокой вариабельности концентрации в плазме крови.
Исходя из результатов проведенных исследований, можно сделать вывод об уменьшении симптомов ДПН, в особенности болевого синдрома, при в/в введении α-липоевой кислоты в дозе 600 мг/сут в течение трех недель и при пероральном применении более пяти недель. Длительная терапия α-липоевой кислотой также улучшает клинические показатели, в том числе мышечной слабости.
Симптоматическая терапия
Симптоматическая терапия складывается из лечения нейропатического болевого синдрома, коррекции вегетативной дисфункции, а также других клинических проявлений нейропатии при диабете.
Лечение нейропатической боли. Нейропатическая боль является следствием поражения соматосенсорных структур и патологической реакции нервной системы на повреждение, которая характеризуется наличием боли в отсутствие болевого раздражителя или выраженной болью при незначительной или умеренной стимуляции [35]. Нейропатическая боль может быть спонтанной или вызвана сенсорной стимуляцией (например, прикосновением). Она гетерогенна по этиологии, патофизиологии и клиническим проявлениям и встречается у 15–20% пациентов с СД [6, 33]. Нейропатическая боль при ДПН влияет на качество жизни пациентов, снижает их подвижность, способствует развитию депрессии, нарушению сна и социальной дисфункции, поэтому вопросы эффективного обезболивания являются весьма актуальными в клинической практике [36].
На данный момент времени доказательная база о влиянии модификации образа жизни или поддержания нормального гликемического профиля на снижение боли при ДПН отсутствует, поэтому лечение болевого синдрома требует фармакологической коррекции [1]. Снижение болевого синдрома сопряжено с уменьшением количества и длительности госпитализаций, частоты обращений за неотложной медицинской помощью, что значительно снижает затраты здравоохранения [37].
Таким больным рекомендована индивидуальная поэтапная фармакологическая стратегия с учетом даже незначительного улучшения состояния на фоне предшествующей терапии, приверженности лечению, потенциальных лекарственных взаимодействий и развития побочных эффектов [1].
Важнейшим аспектом является ожидание эффекта обезболивающей терапии как самим пациентом, так и его лечащим врачом. Следует признать, что 100%-ного обезболивания при ДПН, как и при многих периферических нейропатиях другого генеза, добиться сложно. Поэтому необходимо информировать пациентов о том, каких эффектов следует ожидать, а каких нет. Согласно консенсусу международных экспертов по лечению ДПН, снижение боли на 30–49% считается значимым, на 50% и более – значительно улучшающим функциональное состояние, влияющим на снижение проявлений депрессии, нарушение сна, улучшающим качество жизни и работоспособность [38].
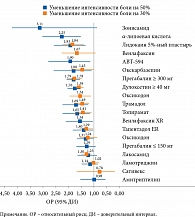
Уменьшение болевого синдрома, в частности жжения и парестезий, на фоне терапии α-липоевой кислотой доказано во многих исследованиях. Результаты метаанализа 58 исследований терапии нейропатической боли при ДПН, в том числе α-липоевой кислотой, представлены на рис. 3 [39].
Согласно рекомендациям экспертов Американской диабетической ассоциации, Европейского агентства лекарственных средств, а также Международной ассоциации по изучению боли, препаратами первой линии для купирования нейропатической боли являются лиганды α-2/δ-субъединицы потенциал-зависимых кальциевых каналов (прегабалин, габапентин), трициклические антидепрессанты (ТЦА) (в частности, амитриптилин) и ингибитор обратного захвата серотонина и норадреналина (СИОЗ, дулоксетин) [1].
Габапентин и прегабалин – одни из самых часто назначаемых препаратов при ДПН. Предполагаемый механизм их действия заключается в связывании потенциал-зависимых кальциевых каналов, уменьшении концентрации ионов Ca2+ в пресинаптической щели гипервозбужденных нейронов и высвобождении нейромедиаторов, что приводит к торможению передачи импульса и уменьшению боли. В Кокрановском обзоре 2017 г. показано существенное уменьшение боли у пациентов с умеренной и тяжелой диабетической нейропатической болью при приеме габапентина в дозе 1200 мг/сут и более [35]. Несмотря на то что частота и выраженность побочных эффектов на фоне терапии габапентином были сопоставимы с побочными эффектами плацебо [35], в других исследованиях в группе габапентина установлено более частое развитие нежелательных реакций, таких как тошнота, головная боль, снижение концентрации [40, 41]. Серьезных побочных эффектов зарегистрировано не было [35]. Учитывая отрицательное воздействие ТЦА на течение автономной нейропатии, которая часто встречается у пациентов с ДПН, эксперты Американской академии неврологии, Национального института здравоохранения и качества ухода Великобритании рекомендовали начинать лечение нейропатической боли при ДПН с габапентина или прегабалина [40]. Габапентин должен назначаться в стартовой дозе 300 мг/сут с последующим постепенным ее увеличением до момента снижения боли, но не более 3600 мг/сут [35].
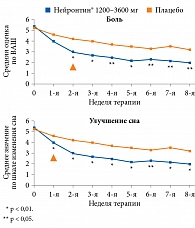
Влияние габапентина на уменьшение болевого синдрома, улучшение качества сна, общего состояния и качества жизни оценивалось в рандомизированном двойном слепом плацебоконтролируемом исследовании [41]. Выраженность болевого синдрома определяли по визуальной аналоговой шкале (ВАШ), изменение качества жизни – по опроснику качества жизни и профиля настроения (SF-MPQ). В исследование было включено 165 пациентов, 84 из них получали габапентин (Нейронтин®), 81 – плацебо. Завершили исследование 135 (82%) человек. Между группами плацебо и габапентина в точке оценки боли, улучшения качества жизни, сна были продемонстрированы достоверные различия. В группе габапентина улучшились все изучаемые параметры. У получавших габапентин по сравнению с применявшими плацебо уже с первой недели терапии выявлено улучшение качества сна (p < 0,05), со второй недели – уменьшение боли (p < 0,05). Усиление нейропатической боли отмечалось у двух пациентов с ДПН в группе габапентина и у 13 – в группе плацебо. Динамика болевого синдрома и улучшения качества ночного сна у пациентов двух групп представлена на рис. 4 [41].
Монотерапия эффективна в 50% случаев, в остальных случаях требуется комбинация обезболивающих препаратов [38]. Вопрос о назначении комбинированной терапии рассматривается при сохранении болевого синдрома на уровне пяти баллов по ВАШ или снижении болевого синдрома менее чем на 30% на фоне монотерапии в эффективных дозах в течение трех месяцев [42]. Рациональное сочетание – комбинация препаратов с разными механизмами действия, например габапентиноидов (прегабалина или габапентина) и антидепрессантов или антиконвульсантов (например, карбамазепина). При неэффективности терапии первой линии возможна комбинация габапентиноидов с трамадолом или лидокаином. Однако не рекомендовано сочетание трамадола с антидепрессантами ввиду высокого риска развития серотонинового синдрома [42]. Трамадол является препаратом второй линии и назначается редко из-за быстрого привыкания и частых побочных эффектов [43].
Опиоидные анальгетики (в частности, тапентадон и оксикодон) не рекомендованы экспертами Международной ассоциации по изучению боли как препараты первой или второй линии вследствие частого привыкания и развития побочных эффектов и невыраженного обезболивающего эффекта при ДПН [1].
Последние рекомендации по фармакотерапии болевого синдрома при ДПН и нейропатической боли представлены в таблице [38].
Коррекция проявлений вегетативной нейропатии. Для лечения ортостатической гипотензии применяются немедикаментозные меры, такие как достаточное потребление жидкости и соли, ношение компрессионного белья (на ноги и живот), физическая активность, уменьшение ортостатических поз, коррекция артериальной гипертензии препаратами короткого действия [44, 45]. В США для лечения ортостатической гипотензии одобрены флудрокортизон, мидодрин и дроксидопа, в России – мидодрин и флудрокортизон.
Лечение диабетического гастропареза должно быть комплексным и включать коррекцию диеты с уменьшением содержания клетчатки и жиров, порции пищи при увеличении кратности ее приемов, отмену препаратов, влияющих на моторику желудочно-кишечного тракта (опиоиды, антихолинергические препараты, трициклические антидепрессанты, ингибиторы рецепторов GLP-1 и др.) [1, 46]. В тяжелых случаях требуется фармакологическая коррекция. Для медикаментозного лечения диабетического гастропареза одобрен только метоклопрамид. Однако из-за частого развития экстрапирамидных нарушений его прием ограничен 12 неделями, на что указано в рекомендациях Управления по контролю качества пищевых продуктов и лекарственных средств США и Европейского агентства лекарственных средств [46]. В некоторых случаях могут быть эффективны домперидон и эритромицин [47]. В крайне тяжелых ситуациях применяется хирургическая электростимуляция желудка с помощью имплантируемых устройств, однако процедура имеет ряд ограничений и ее эффективность варьируется [1].
Имеются также основания для назначения пациентам витамина В12 в случае длительного применения метформина, блокаторов протонной помпы или нарушения функции желудочно-кишечного тракта [1].
В исследованиях, проведенных в России, подтверждены возможность и безопасность использования препаратов нейрометаболического ряда, таких как ипидакрин, антиоксидантов, содержащих янтарную кислоту, инозин, рибофлавин, никотинамид и др.
Заключение
Сахарный диабет – распространенное заболевание, требующее не только фармакологической коррекции, но и изменения образа жизни в целом. Одно из самых частых осложнений СД – ДПН. Лечение данного состояния уменьшает прогрессирование нейропатических инвалидизирующих симптомов, снижает риск развития диабетической стопы, трофических язв стопы и ампутаций, а также улучшает качество жизни пациентов. Все это подтверждает необходимость своевременной диагностики, разработки стратегии изменения образа жизни больных и модификации факторов риска, а также индивидуального подхода к патогенетической и симптоматической терапии ДПН.
I.Ye. Luneva, D.A. Grishina, PhD, N.A. Suponeva, MD, PhD, Prof., Corresponding member of the RASci.
Research Center of Neurology, Moscow
Contact person: Irina Ye. Luneva, lunevairinaneurology@gmail.com
Diabetic peripheral neuropathy (DPN) is the most common complication of diabetes mellitus and occurs in more than half of patients. DPN is a main factor in the development of foot skin ulceration, Charcot’s foot, and the most common cause of non-traumatic lower limb amputations in high-income countries, which can be avoided in 80% of cases with timely diagnosis and treatment.
DPN therapy includes glycemia correction and lifestyle modification, pathogenetic and symptomatic treatment.
Currently, α-lipoic acid is the only drug for the pathogenetic treatment of DPN with proven efficacy. The development of pathogenetic treatment and effective symptomatic treatment reduces the severity of neuropathic pain, improves sleep quality, patient mobility and quality of life in general, and also affects the degree of progression of neuropathy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.