Локальные методы терапии базально-клеточного рака кожи
- Аннотация
- Статья
- Ссылки
- English

Введение
Базально-клеточный рак кожи (БКРК) – это местно-деструирующая, медленно распространяющаяся опухоль, которая редко метастазирует, возникает из эпидермиса или волосяных фолликулов. Периферические клетки опухоли схожи с клетками базального слоя эпидермиса [1, 2]. БКРК (синонимы базалиома, базоцеллюлярный рак Кромпехера) – самая частая неоплазия у человека. Основными вариантами лечения БКРК являются различные методы локальной терапии – хирургические, лучевая и фотодинамическая терапия. Широкое распространение получили также криотерапия и местная лекарственная терапия [2].
При выборе метода лечения следует учитывать группу риска, возможности и ограничения каждого метода.
Актуальность проблемы
Оценка истинной распространенности и заболеваемости БКРК затруднительна, поскольку данная нозология не входит в анализ Международного агентства по изучению рака (МАИР) и не учитывается в большинстве соответствующих регистров. Показатели заболеваемости оценивают на основании статистических данных разных стран. Согласно обобщенным данным имеющейся литературы, заболеваемость БКРК в мире колеблется в широком диапазоне. Наиболее высокие показатели регистрируются в Австралии (более 1000/100 000), самые низкие в ряде регионов Африки (менее 1/100 000) [3]. Для сравнения: по данным МАИР, без учета немеланомных опухолей кожи в структуре онкологической заболеваемости первое место у мужчин занимает рак легкого – 33,8 на 100 000, у женщин рак молочной железы – 38,9 на 100 000 [4]. Исходя из данных Американского онкологического общества, более чем 2 млн человек прошли лечение в 2006 г. по поводу эпителиальных немеланомных новообразований кожи, почти в 75% случаев имел место БКРК [5].
В России показатель (нестандартизованный) заболеваемости всеми немеланомными эпителиальными опухолями кожи, зарегистрированными лечебными учреждениями в 2009 г., составляет 42,4 на 100 000 для обоего пола. Эти опухоли лидируют в структуре онкологической заболеваемости [6]. Показатель истинной заболеваемости скорее всего превышает регистрируемый, что обусловлено длительным и неагрессивным течением заболевания [7].
К факторам риска развития БКРК относят прерывистое интенсивное воздействие ультрафиолетового излучения (особенно в детском и подростковом возрасте), I и II тип кожи по Фитцпатрику, лучевую терапию в анамнезе, генетические синдромы (синдром Горлина – Гольтца, пигментная ксеродерма), состояние иммуносупрессии [8].
Не исключено, что увеличение продолжительности жизни, повреждение озонового слоя, изменение культуры инсоляции, мода на солярий и повышение активности миграции населения способствуют повсеместному росту заболеваемости БКРК [9–12].
Клиническая картина
БКРК обладает крайне низким метастатическим потенциалом, тем не менее способен существенно ухудшать качество жизни пациентов вследствие местно-деструирующего роста [5].
Опухоль характеризуется медленным ростом и часто развивается в течение длительного периода – от нескольких месяцев до нескольких лет. Наиболее активный рост отмечается по периферии очага с явлениями клеточного апоптоза и в результате изъязвления в центре опухоли. Поэтому при лечении данного вида опухоли особое значение приобретают полноценное воздействие на периферические зоны роста и четкое определение границ поражения, где расположены наиболее агрессивные опухолевые клетки. Способность к местно-деструирующему росту проявляется в распространении на глубокие слои дермы, разрушении мягких тканей и костных структур. Возможна инвазия опухоли вдоль слоев тканей, по надкостнице и по ходу нервов [2].
На клиническую картину и прогноз опухоли влияет ее гистотип. По макро- и микроскопическому строению БКРК подразделяют на нодулярный (узелковый), язвенный, поверхностный, склеродермоподобный (плоский), инфильтративный, метатипический, пигментный и фиброэпителиому Пинкуса [13].
Классификация
В соответствии с TNM (аббревиатура от tumor, nodus и metastasis) (Международная классификация стадий злокачественных новообразований) 2009 г. БКРК (С44.0,2–7) классифицируют по первичной опухоли (Т), статусу регионарных лимфатических узлов (N) и наличию отдаленных метастазов (M). На стадии заболевание подразделяют исходя из гистологической степени злокачественности (G) и факторов риска [14]:
- Т – первичная опухоль;
- Тх – первичная опухоль не может быть оценена;
- Т0 – отсутствие данных о первичной опухоли;
- Тis – карцинома in situ;
- Т1 – опухоль не более 2 см;
- Т2 – опухоль более 2 см;
- Т3 – опухоль с инвазией в глубокие структуры (мышца, кость, хрящ, глазница);
- Т4 – опухоль с непосредственным или периневральным распространением на осевой скелет или основание черепа. При мультицентричном поражении категорию Т классифицируют по наибольшему очагу поражения, а общее количество очагов указывают в круглых скобках;
- N – региональные лимфатические узлы;
- Nх – региональные лимфатические узлы не могут быть оценены;
- N0 – нет метастазов в региональных лимфатических узлах;
- N1 – метастаз не более 3 см в одном лимфатическом узле;
- N2 – метастаз от 3 до 6 см в одном лимфатическом узле или метастазы в нескольких узлах на стороне поражения;
- N3 – метастазы более 6 см;
- М – отдаленные метастазы;
- М0 – нет отдаленных метастазов;
- М1 – есть отдаленные метастазы;
- G – гистологическая степень злокачественности;
- Gх – степень дифференцировки не может быть определена;
- G1 – высокодифференцированная опухоль;
- G2 – умеренно дифференцированная опухоль;
- G3 – низкодифференцированная опухоль;
- G4 – недифференцированная опухоль.
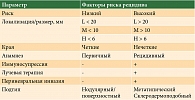
Факторы высокого риска:
- глубина инвазии более 2 мм, уровень IV или V по Кларку, периневральная инвазия, инвазия в лимфатические сосуды;
- анатомическая локализация: кожа уха или не покрытая волосами часть губы;
- дифференцировка: низкодифференцированная и недифференцированная опухоль.
При наличии двух и более признаков высокого риска параметр Т оценивается на одну категорию выше. Это определяет строгие требования к полноте гистологического заключения.
Правила классификации рака кожи века (C44.1) отличаются более жесткими параметрами оценки критерия Т [14].
Особое значение имеет зона локализации опухоли. Выделяют три основные зоны:
- Н-зону (mask area) (центральная зона лица, веки, надбровная область, периорбитальная зона, нос, губы, подбородок, околоушная область, ухо), кожа гениталий, кисти, стопы;
- М-зону – щеки, шея, лоб, волосистая часть головы, голень;
- L-зону – туловище и конечности (кроме голени, стоп, кистей и колена).
Совокупность гистологических параметров, локализации опухоли, анамнеза заболевания и статуса пациента определяет группу риска БКРК (таблица).
Лечение
Основным методом лечения БКРК является локальное воздействие:
- хирургическое лечение, в том числе Mohs-хирургия;
- электрокоагуляция и кюретаж;
- лучевая терапия;
- фотодинамическая терапия;
- криотерапия и местная химиотерапия.
При выборе метода лечения для конкретного пациента необходимо учитывать группу риска, возраст и состояние здоровья, возможные ограничения и преимущества каждого метода, стоимость лечения, материально-техническое обеспечение учреждения и предпочтения пациента. Однако решающую роль играют характеристики самой опухоли [15, 16].
Целями любого вида терапии БКРК являются полное удаление опухоли, сохранение функционального состояния органов и достижение удовлетворительных косметических результатов [2, 5, 17].
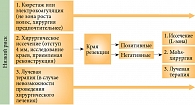
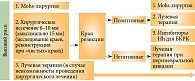
Основные подходы к терапии БКРК отражены в рекомендациях Ассоциации онкологов России и Russco, NCCN (National comprehensive Cancer Network – Национальная всеобщая онкологическая сеть) Clinical Practise Guidelines Basal Cell Skin Cancer (version 2.2016), EDF/EADO/EORTC Consensus Group 2015 (рис. 1–3).
Хирургическое лечение
Микрографическая хирургия по Mohs
Микрографическая хирургия по Mohs – специализированная процедура, которая обычно применяется при БКРК высокого риска, локализации опухоли в Н-зоне и реиссечении в случае положительных краев резекции (рис. 2–3) [18].
В европейских странах метод микрографической хирургии по Mohs считается одним из стандартов помощи в большинстве случаев БКРК и плоскоклеточного рака кожи [2]. Методика разработана в 1936 г. и опубликована в 1941 г. доктором Фридериком Мохс из Университета штата Висконсин [19]. Методика изначально заключалась в последовательном удалении опухоли с использованием прижизненной фиксации кожных тканей in situ с помощью пасты, содержащей хлорид цинка. Модификация методики с применением на неизмененных тканях привела к снижению болевых ощущений, дискомфорта и беспокойства пациентов в сравнении с использованием химической фиксации. После удаления визуально различимой опухоли она тщательно маркируется в соответствии с циферблатом. Далее выполняются горизонтальные серийные срезы с гистологическим исследованием. Позитивные края с наличием опухолевых гнезд наносятся на карту с последующим повторным реиссечением соответствующих участков. После повторного иссечения вновь выполняется гистологическое исследование серийных срезов, и весь цикл повторяется до достижения «отрицательных» краев резекции.
Преимущества Mohs-хирургии:
- строгий контроль достижения «чистых» краев резекции позволяет достигать пятилетней безрецидивной выживаемости до 95–98%;
- микрографическая хирургия дает возможность максимально сохранить не вовлеченные в опухолевый процесс ткани, что особенно важно при поражении кожи вокруг глаз, носа, ушей, рта, кожи пальцев и гениталий;
- стоимость методики сопоставима с таковой простого хирургического иссечения с интраоперационным исследованием границ резекции по замороженным срезам. При включении в анализ затрат на реконструктивный этап операции метод Mohs оказывается дешевле [20].
Хирургическое иссечение
Поскольку основной задачей является полное удаление опухоли, при хирургическом иссечении обязательно изучение краев резекции. Это позволяет хирургу убедиться в отсутствии дальнейшего опухолевого роста. Края резекции могут зависеть от размера опухоли, анатомической локализации, клинических проявлений, наличия изъязвления, видимой глубины инфильтрации [2]. Доказанная прогностическая значимость таких параметров, как гистологический тип опухоли, локализация, количество и размер очагов, определяет их обязательный учет при планировании хирургического лечения.
Несмотря на то что хирургическое иссечение является эффективным и наиболее часто применяемым методом лечения БКРК, в настоящее время нет единого мнения об оптимальных отступах в сторону здоровых тканей. Считается, что для небольших по размеру образований, первичных, благоприятного гистологического варианта, то есть для опухолей низкого риска, достаточно хирургического края 4 мм. Меньшие отступы могут рассматриваться для отдельных случаев. Но этот вопрос остается дискутабельным [21].
БКРК высокого риска и рецидивные опухоли требуют более значительных отступов – до 6–10 мм. В такой ситуации хирург должен знать не только гистологическое строение опухоли и анатомические особенности зоны поражения, но и возможные варианты реконструкции данных структур после глубоких резекций [2]. При местно-деструирующем росте требуется выполнение обширных резекций с последующим реконструктивно-пластическим этапом [22].
Весь патологический очаг должен быть полностью удален при первом хирургическом вмешательстве, поскольку при первичном БКРК достигаются лучшие отдаленные результаты лечения по сравнению с рецидивным. Кроме того, тенденция к более агрессивному течению рецидивных опухолей требует значительного расширения краев резекции.
Признаком адекватного хирургического лечения считается пятилетняя выживаемость не менее 95% [23].
Электрокоагуляция и кюретаж
Электрокоагуляция и кюретаж наиболее часто используются при лечении БКРК, хотя согласно рекомендациям NCCN Guidelines (version 2.2016) применение таких минимально инвазивных методик допустимо только при БКРК низкого риска [24, 25].
В случае экзофитной формы роста обычно выполняют удаление основной массы с коагуляцией ложа опухоли. К преимуществам этих методов относятся их простота, низкая стоимость и быстрое достижение непосредственного результата. Среди недостатков необходимо отметить отсутствие гистологического контроля полноты воздействия, возможность формирования грубых гипертрофических рубцов и зон гипопигментации, что существенно ухудшает косметические результаты лечения. Однако при надлежащем отборе пациентов удовлетворительные результаты и локальный контроль могут быть достигнуты в 95% случаев.
Большие размеры поражения, инфильтративная и склеродермоподобная формы, рецидивный БКРК являются противопоказаниями для выбора электрокоагуляции в качестве метода лечения [26]. Поражения более 10 мм с локализацией на коже лба, волосистой части головы, уха и скуловой области и образования более 6 мм на коже носа, носогубной складки, угла глаза и века считаются опухолями с высоким риском рецидива после выполнения электрокоагуляции (риск рецидива в течение пяти лет 22,7 и 17,6% соответственно) [26].
Следует отметить, что даже при сопоставимой эффективности с другими методами терапии БКРК (хирургическое иссечение, хирургия по Mohs), по данным специальных опросников, качество жизни пациентов, у которых применялись электрокоагуляция и кюретаж, было хуже, в частности, из-за неудовлетворительных косметических результатов [27].
Лучевая терапия
История лучевой терапии началась 8 ноября 1895 г., когда в лаборатории Вильгельма Конрада Рентгена было открыто излучение, впоследствии названное рентгеновским. Уже с 1896 г. рентгеновские лучи начали применять в терапии заболеваний кожи, а в 1901 г. французские врачи Э. Бенье и А. Данло впервые с лечебной целью использовали радиоактивное излучение. Лучевая терапия может использоваться как самостоятельный метод лечения БКРК с высоким лечебным потенциалом, так и в качестве дополнительного метода воздействия с целью улучшения локального контроля. Применение адъювантной лучевой терапии наиболее актуально при неблагоприятных клинических проявлениях: периневральное распространение, инвазия в скелетные мышцы, инвазия в кости и хрящи, метастазы в лимфатические узлы и экстранодальное распространение [28].
По данным разных авторов, в зависимости от клинической ситуации эффективность лучевой терапии составляет 92–99% [2, 29, 30].
Выбирая между различными вариантами лучевой терапии, необходимо помнить о возможных ограничениях (фиксированная глубина воздействия при близкофокусной рентгенотерапии, опасность лучевого повреждения смежных структур и сложности планирования фигурных полей при дистанционной лучевой терапии, необходимость соблюдения правил работы с открытыми источниками излучения при внутритканевой терапии).
Практически все задачи адекватного планирования можно решить с помощью современных лучевых установок.
Общим недостатком всех методов лучевой терапии являются побочные кожные реакции, такие как острый и хронический лучевой дерматит, дистрофия кожи, изменения пигментации, появление эритематозных полей (проявления пойкилодермии). Непосредственные хорошие косметические результаты со временем могут значительно ухудшаться. Кроме того, лучевую терапию желательно не применять у молодых пациентов из-за возможных отсроченных эффектов радиационного воздействия [31].
Следует помнить, что лучевая терапия – один из самых дорогих методов лечения онкологических заболеваний.
Фотодинамическая терапия
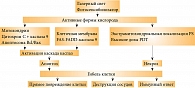
Фотодинамическая терапия (ФДТ) относительно новый трехкомпонентный (фотосенсибилизатор, лазерный свет, кислород) метод лечения злокачественных опухолей посредством реализации фотодинамической реакции. В 1903 г. в клинике профессора Германа фон Тапайнера (Hermann von Tappeiner) была проведена первая фотодинамическая терапия рака кожи с использованием эозина в качестве фотосенсибилизатора. Вскоре после этого появились первые сообщения о фототерапии рака [32, 33]. Основателем клинической ФДТ считается американский онколог Томас Догерти. Дальнейшее развитие метода долгое время было ограничено качеством используемых фотосенсибилизаторов, прежде всего их токсичностью и техническими сложностями (большой период полувыведения требовал продолжительного, в течение нескольких недель, соблюдения светового режима). Стремительное развитие фотодинамической терапии связано с появлением в 1990-х гг. фотосенсибилизаторов нового поколения с минимальной токсичностью, высокой эффективностью накопления в опухоли и коротким (12 часов) периодом полувыведения.
Введенный в организм фотосенсибилизатор накапливается в опухолевой ткани с наличием градиента концентрации «опухоль/норма». После локального облучения опухоли лазерным светом с определенной длиной волны (соответствующей спектру поглощения фотосенсибилизатора) происходит возбуждение фотосенсибилизатора с его переходом на новый энергетический уровень. Впоследствии либо молекула фотосенсибилизатора переходит в основное состояние с излучением кванта света (флуоресценцией), либо реализуется фотохимическая реакция. Выделяют два типа фотохимических реакций. При первом типе реакции возбужденный фотосенсибилизатор начинает взаимодействовать с окружающими биологическими молекулами, приводя к фотоинициированной аутооксидации. Второй тип фотохимической реакции характеризуется переносом энергии с фотосенсибилизатора на окружающий кислород с формированием особой формы синглетного кислорода с выраженной окислительной способностью. Последний взаимодействует с различными биомолекулами, прежде всего входящими в состав биологических мембран, и повреждает их. Короткий период жизни синглетного кислорода (менее 40 нс) и небольшой радиус действия (менее 20 нм) определяют локальность воздействия.
Варианты повреждения клетки зависят от микролокализации фотосенсибилизатора и параметров светового воздействия. При локализации препарата на митохондриях и мембранных структурах реализация фотохимической реакции вызывает метаболические и структурные нарушения в клетке, приводящие к запуску сигнальных каскадов каспаз через систему цитохрома С или рецептор FAS-FADD, направленных на инициализацию механизмов самоуничтожения (апоптоз) [32]. При экстрамембранной локализации фотосенсибилизатора или высоких дозах лазерного света наступает некроз клетки вследствие летального окислительного стресса. В зависимости от типа поврежденных клеток фотодинамическая терапия опухолей реализуется посредством трех основных механизмов: повреждение сосудистого русла опухоли в случае повреждения эндотелиоцитов (рассматривается как основной), непосредственная цитотоксичность в результате фотохимической реакции и формирование иммунного ответа на клетки опухоли, находящиеся в состоянии апоптоза (рис. 4).
Непосредственная эффективность ФДТ в зависимости от морфологической формы, размеров опухоли и качества используемых фотосенсибилизаторов составляет 73–95%. К безусловным преимуществам метода относятся амбулаторный характер проведения процедуры, низкий уровень болевых ощущений (в большинстве случаев не требуется обезболивания), легкость при формировании фигурных полей, возможность комбинирования с другими методами терапии, отсутствие лимитирующих доз фотосенсибилизатора и светового воздействия и, как следствие, возможность многократного повторения процедуры, удобство применения при множественном характере поражения и лучшие косметические результаты (из-за сохранения структуры коллагеновых волокон, что способствует формированию оптимальных рубцов).
Продемонстрирована высокая эффективность лечения БКРК ФДТ с местным нанесением 5-аминолевуленовой кислоты (ALA-PDT) с частотой полных ответов 63% после однократной процедуры и 90% после двукратного применения ФДТ. Косметические результаты были оценены как хорошие и очень хорошие у 91% пациентов [34].
В другом исследовании (n = 94) при сравнении ALA-PDT с хирургическим методом были получены сопоставимые результаты по частоте полных ответов (88,24 против 94,12% соответственно, р = 0,88) [34].
Получены сопоставимые результаты ALA-PDT и криотерапии с преимуществом ФДТ по срокам лечения и качеству косметических результатов [35].
Несмотря на удовлетворительные непосредственные результаты ALA-PDT, частота рецидивов в отдаленном периоде, по данным разных авторов, может достигать 30,3% [36].
В нашем исследовании (n = 397) ФДТ с внутривенным введением фотосенсибилизаторов хлоринового ряда продемонстрирована возможность достижения полного ответа у 85% пациентов с 10,4% рецидивов при сроке наблюдения от шести до 53 месяцев с медианой 28 месяцев. Ответ опухоли и частота рецидивов зависели от диаметра и толщины образования, а также от параметров флуоресценции (флуоресцентной контрастности и выгорания фотосенсибилизатора в процессе ФДТ) [37].
К недостаткам метода относятся ограниченная глубина проникновения лазерного света (4–8 мм в зависимости от длины волны), отсутствие надежной доказательной базы, трудности планирования, дозиметрии и мониторирования процессов фотодинамической терапии из-за сложного взаимодействия фотонов с биотканью и, безусловно, стоимость фотосенсибилизаторов [32, 38–40].
Дальнейшее развитие метода будет связано с синтезом новых фотосенсибилизаторов, характеризующихся более избирательным накоплением в опухоли (с большим градиентом «опухоль/норма»), большей способностью индукции синглетного кислорода, возбуждением на большей длине волны (для увеличения глубины проникновения лазерного излучения) и меньшей стоимостью. Кроме того, необходима модернизация аппаратной базы для проведения дозиметрии, планирования и мониторинга ФДТ.
Собственный опыт лечения более 1000 пациентов и опыт общения с коллегами из других регионов позволяют сформулировать некоторые аспекты организации работы службы фотодинамической терапии, несоблюдение которых, на наш взгляд, может привести к значительному снижению эффективности проводимого лечения и дискредитации перспективной методики.
- Персонал, ответственный за организацию службы и допущенный к выполнению лечебных и диагностических процедур, должен пройти специальную подготовку в сертифицированных центрах. Сложное лечебно-диагностическое оборудование и необходимость понимания физических и биологических основ фотодинамической терапии и флуоресцентной диагностики требуют расширения знаний специалиста в смежных областях.
- Палата пребывания пациентов и кабинет ФДТ должны быть оборудованы с учетом особенности методики (использование лазерного оборудования, соблюдение светового режима пациентами, создание светового режима для работы диагностического оборудования).
- Служба фотодинамической терапии помимо необходимого лечебного оборудования должна быть обеспечена диагностическим оборудованием, позволяющим оценить накопление препарата в опухоли, границы опухолевого поражения, степень выгорания препарата, и оборудованием для контроля параметров лазерного воздействия (измерители мощности).
- При выполнении ФДТ необходимо соблюдать клинические рекомендации и обсуждать методику лечения пациента на междисциплинарной комиссии с привлечением хирургов, радиологов и химиотерапевтов.
- Необходимо стандартизировать дозы используемых фотосенсибилизаторов и параметры светового воздействия (плотность мощности и плотность дозы световой энергии). Существующие на сегодняшний день широкие допустимые диапазоны затрудняют выбор параметров в каждом конкретном случае и не позволяют объективно сравнивать результаты разных центров.
- Необходим переход от эмпирического подбора параметров воздействия к разработке принципов дозиметрии на основании конкретных диагностических методик, например флуоресцентной диагностики.
- Необходимы разработка и проведение многоцентровых рандомизированных исследований ФДТ.
Криодеструкция
Одним из вариантов лечения БКРК является криодеструкция. Первое упоминание о лечении опухолей холодом относится к 1851 г., когда Amott при лечении злокачественных опухолей использовал смесь льда и солевого раствора, который обеспечил температуру охлаждения -24 °С. В 1961 г. I.S. Cooper описал аппарат с жидким азотом в качестве хладоагента (точка кипения -196 °С), который подавался к опухоли через криозонд.
Для уничтожения опухолевых клеток требуется как минимум два цикла замораживания с достижением температуры тканей -50 °С. Недостатком криотерапии является отсутствие гистологического контроля полноты воздействия. Из преимуществ необходимо отметить амбулаторный характер выполнения процедуры, низкий уровень болевых ощущений, удовлетворительные косметические результаты и стоимость. Следует избегать применения криотерапии при локализациях опухоли на коже волосистой части головы и носогубных складок из-за высокого риска рецидива. Избыточно агрессивная криотерапия может быть причиной рецидива заболевания из-за индукции роста опухоли в зоне фиброзного рубца. После проведения данного вида лечения необходим длительный регулярный контроль специалиста для исключения рецидива [41–43]. Для достижения равномерности снижения температуры тканей, увеличения глубины «промораживания» и получения лучших косметических результатов изучается роль мягких магнитных лекарственных форм и магнитоуправляемой теплопередачи при проведении криотерапии [44].
Местная химиотерапия
Для местного лечения БКРК могут быть использованы ежедневные длительные (в течение трех-четырех недель) аппликации 30%-ной проспидиновой мази или эмульсии фторурацила. Метод обладает ограниченной эффективностью при небольших поверхностных поражениях, в связи с чем не получил широкого распространения [45].
Имиквимод – препарат из группы имидазохинолинов, который при местном применении обладает иммуномодулирующим действием. В 1999 г. FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) одобрило имиквимод для лечения остроконечных кондилом наружных половых органов и перианальной области, а в 2004 г. – для лечения актинического кератоза и поверхностного БКРК. Иммуномодулирующие свойства препарата проявляются в воздействии на врожденный и адаптивный иммунный ответ прямым и косвенным путем. При этом прямое воздействие заключается в связывании с Toll-like-рецепторами 7 и 8 макрофагов, моноцитов, дендритных клеток и индукцией апоптоза. Прямое воздействие на клетки опухоли также происходит через активацию апоптоза по внутреннему пути в митохондриях. При этом высвобождаются проапоптотические молекулы, такие как апоптоз-индуцирующий фактор, СМАК, HtrA2, цитохром С и эндонуклеаза G. Эти молекулы в свою очередь повышают активность каспазы 9 с последующим запуском процесса гибели клетки [46].
Опосредованное влияние происходит через высвобождение иммуномодулирующих цитокинов, в том числе интерлейкина 12, фактора некроза опухоли альфа, интерферона гамма, которые стимулируют Т-клеточный иммунный ответ. Кроме того, имиквимод способен влиять на клетки Лангерганса посредством стимуляции их антигенпрезентирующей функции и активации приобретенного иммунитета [47].
В отношении БКРК имиквимод обладает дополнительным механизмом противоопухолевого действия, которое заключается в блокировании активации Hedgehog glioma-associated oncogene сигнального пути, играющего ключевую роль в патогенезе данной опухоли [48, 49].
В исследовании с участием 35 пациентов показана высокая эффективность 5%-ного крема имиквимод для лечения поверхностного БКРК. При этом полная резорбция опухолевых очагов, подтвержденная гистологически, достигнута при режиме дозирования, предполагавшем нанесение крема от одного до трех раз в неделю на протяжении 10–14 недель [50].
Эффективность 5%-ного крема имиквимод подтверждена при лечении первичного БКРК небольших размеров (до 2,0 см) в нескольких рандомизированных исследованиях и одном метаанализе [51]. Опубликованы единичные работы по эффективности данного подхода при БКРК большего размера [52] и при множественных БКРК, в том числе синдроме Горлина – Гольтца [53].
Интересными представляются работы по сочетанию местной химиотерапии с ФДТ. Так, в группе из 34 пациентов с БКРК продемонстрирована большая частота полных ответов при комбинации ALA-PDT и имиквимода 5% в сравнении с ALA-PDT и плацебо в виде крема (в 75 и 60% случаев соответственно) [54].
Рецидивы и наблюдение
Следует отметить, что 70–80% рецидивов БКРК после различных методов локального лечения реализуются в первые два года. У 30–50% пациентов в течение пяти лет диагностируется вторая опухоль. Это определяет тактику наблюдения за пациентами после проведенной терапии. Целесообразным представляется регулярное наблюдение в течение пяти лет, а для групп высокого риска рецидива ежегодно пожизненно.
Заключение
БКРК – разнородная группа опухолей с разной биологией, клиническим течением и риском рецидива. Многообразие методов локального воздействия с разными механизмами позволяет подобрать оптимальные подходы к индивидуализированной терапии, направленной на достижение максимального онкологического и косметического результата лечения. Ограничения каждого из доступных методов диктуют необходимость строгого соблюдения протоколов лечения и клинических рекомендаций.
S.V. Gamayunov, K.S. Korchagina
Republican Clinical Oncologic Dispensary of the Ministry of Health of Chuvashia
Contact person: Sergey Viktorovich Gamayunov, Gamajnovs@mail.ru
Basal cell cancer (BCC) is the most common neoplasia in human, and its rate was tended to increase. Here, published data regarding use of various local therapeutic methods in BCC are analyzed. Benefits and drawbacks of surgery, radiation therapy, cryotherapy, photodynamic and local drug therapy are discussed. Current recommendations on treatment management depending on risk group are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.