Спорные вопросы лечения анемии у больных с ХБП. Новые возможности
- Аннотация
- Статья
- Ссылки
- English
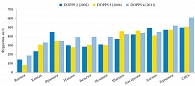
![Рис. 2. Взаимосвязь между дозой введенного в/в железа и уровнями общей и кардиоваскулярной смертности [адаптировано из 14]](/upload/resize_cache/iblock/e6b/195_350_1/Shutov2.jpg)
Анемия является одним из наиболее часто встречающихся осложнений при хронической болезни почек (ХБП) [1, 2]. Она встречается примерно у половины пациентов с ХБП четвертой стадии и более чем у 90% пациентов с терминальной стадией почечной недостаточности, находящихся на диализе [3–5]. Анемия ассоциируется с ухудшением качества жизни пациентов [6, 7] и выживаемости [8, 9]. Основными средствами терапии анемии у больных с ХБП остаются препараты железа и эритропоэз-стимулирующие средства (ЭСС). Однако применение этих препаратов хоть и способствовало улучшению контроля за анемией у этой тяжелой категории больных, но не решило эту проблему окончательно [10]. Причинами такого положения вещей являются, во-первых, отсутствие четкого понимания во врачебном сообществе алгоритмов применения препаратов железа и ЭСС, во-вторых, резистентность к проводимой терапии у больных, особенно с наличием воспалительных состояний.
Практика применения препаратов железа для коррекции железодефицита различается в разных странах, что обусловлено расхождениями в национальных клинических рекомендациях [11, 12] и отсутствием четкой позиции по этому вопросу в Международных клинических рекомендациях KDIGO [13]. В рекомендациях KDIGO предложено начинать лечение препаратами железа при уровне ферритина < 500 нг/мл и насыщении трансферрина железом (НТЖ) < 30% и прекращать лечение при достижении этих же уровней, что не представляется возможным и логичным; в рекомендациях KDOQI, 2013 (США) вообще не лимитировано применение препаратов железа у пациентов, в Японии до применения ЭСС рекомендовано начинать лечение при уровне ферритина < 50 нг/мл, а на терапии ЭСС при уровнях ферритина < 100 нг/мл и НТЖ < 20%, прекращение лечения при верхнем уровне ферритина 300 нг/мл. В результате таких расхождений в рекомендациях выявлены несоответствия средних уровней ферритина у пациентов в разных странах (рис. 1).
Кроме того, использование высоких доз препаратов железа для достижения целевых значений уровней ферритина или гемоглобина сопряжено c неблагоприятными исходами (рис. 2).
У больных с ХБП стандартом в лечении анемии является применение железа внутривенно из-за плохой его усвояемости при применении per os. При несомненной необходимости восполнения дефицита железа и использовании его для синтеза гемоглобина необходимо учитывать и возможные побочные эффекты в/в введения железа, в частности аллергические реакции, развитие оксидативного стресса, содействие росту бактерий и ряд других. Суть проблемы не в том, применять или не применять железо для лечения анемии, а в том, в каких дозах и при каком уровне ферритина у пациента это безопасно. Особенно актуальным это стало после публикации результатов исследования PIVOTAL [15], которое показало преимущество проактивного применения в/в железа, которое многие отечественные и зарубежные нефрологи сочли синонимом применения высоких доз железа. Однако при внимательном изучении результатов исследования выявлено, что медиана месячной дозы в/в железа в группе пациентов с проактивным введением препаратов составила всего 264 мг (максимум 400 мг), то есть фактически больные на гемодиализе не получали больших доз железа, в то время как пациенты группы с реактивным получением железа фактически находились в состоянии железодефицита и медиана месячной дозы в/в железа составила 145 мг, а железо вводили только при концентрации ферритина < 200 мкг/л или насыщении трансферрина < 20%. Отсутствие введения поддерживающей дозы железа привело фактически к состоянию постоянного дефицита железа у пациентов этой группы. Так, НТЖ во всех контрольных точках исследования было ниже 20%. Сравнение двух групп пациентов (c нормальным восполнением дефицита железа и его дефицитом) показало закономерный результат – применение меньших доз ЭСС в группе проактивного приема препаратов железа. I.C. Macdougall и соавт. в своей следующей публикации [16] по результатам проведенного исследования PIVOTAL еще больше запутывают врачей-нефрологов, так как делают вывод об отсутствии существенной разницы между группой, получавшей высокие дозы железа внутривенно, и группой, получавшей недостаточную дозу препаратов железа, в частоте событий для всех инфекций (46,5 в сравнении с 45,5% соответственно). При этом авторы статьи, явно нацеленной на неискушенного читателя, пишут дословно «2141 пациент был рандомизирован на режим с высокими дозами железа (400 мг в месяц)», в то время как известно, что медиана месячной дозы в/в железа в группе пациентов с проактивным введением препаратов составила всего 264 мг. Следует отметить, что спонсором проведения исследования PIVOTAL, а также последующих встреч групп экспертов по разработке практических рекомендаций по применению внутривенного железа при ХБП с учетом риска инфекции выступала компания Vifor Fresenius Medical Care Renal Pharma, которая производит несколько препаратов для заместительной терапии железом, что не исключает заинтересованности компании в применении высоких доз железа у пациентов. Вопрос о риске возникновения инфекций при применении в/в железа окончательно не изучен, но результаты метаанализа 78 рандомизированных контролируемых испытаний применения в/в железа по сравнению с пероральным железом или отсутствием добавок железа для лечения анемии показали, что в/в введение железа было связано со значительно более высокой частотой инфекций по сравнению с пероральным приемом железа или без него, относительный риск 1,33 (95%-ный доверительный интервал (95% ДИ) 1,10–1,64) [17]. Таким образом, очевидна серьезная проблема вследствие отсутствия четких рекомендаций по ведению больных с ХБП, нуждающихся в применении препаратов железа. Не определены целевые уровни ферритина, а также понятие высоких и низких доз препаратов железа.
Важность решения данного вопроса мотивирована тем, что инфекции являются ведущей причиной заболеваемости и смертности среди пациентов с ХБП и второй наиболее частой причиной смерти у пациентов с терминальной стадией заболевания почек: по сравнению с общей популяцией пациенты, получающие поддерживающий гемодиализ, примерно в 100 раз чаще умирают от сепсиса [18, 19]. Помимо прямых последствий инфекции, исследования свидетельствуют о взаимосвязи между инфекцией и сердечно-сосудистыми событиями. Инфекционные эпизоды предсказывают повышенный риск последующих сердечно-сосудистых событий у пациентов с ХБП [20]. Подобный результат был получен и в исследовании PIVOTAL. Однако недостаток железа также может приводить к негативным результатам [21]. На основе вышеизложенного и результатов ряда других исследований, свидетельствующих о корреляции высоких уровней ферритина и больших ежемесячных внутривенных доз железа (> 300–400 мг в месяц) с повышенным риском смерти у больных с ХБП [22–26], можно с уверенностью утверждать, что как избыток железа, так и его недостаток приводит к негативным результатам лечения у больных с ХБП.
На наш взгляд, наиболее разумным выходом из создавшейся ситуации было бы применение поддерживающей терапии препаратами железа, которую еженедельно или раз в две недели вводили бы в дозе, не превышающей 300 мг/мес, пациентам с ХБП без инфекции во избежание снижения уровня НТЖ ниже 20% и превышения уровня ферритина более 200–500 нг/мл. Необходимо констатировать, что для уточнения целевых уровней ферритина у больных с ХБП требуется проведение широкомасштабных контролируемых и рандомизированных исследований.
Резистентность к терапии ЭСС остается сложной проблемой в клинической практике. Поскольку единого определения не существует, распространенность гипочувствительности к ЭСС варьирует в зависимости от применяемого определения. По данным ряда исследований, у больных на гемодиализе резистентность к ЭСС варьировала от 5 до 20% [27, 28]. У больных с додиализной стадией ХБП [29] в 34% случаев наблюдали резистентность к ЭСС. Повышение доз ЭСС для достижения целевых показателей гемоглобина может способствовать повышению риска сердечно-сосудистых заболеваний, тромбообразования и, как следствие, смертности [30]. Имеется нелинейная и сложная связь между дозой ЭСС и уровнем гемоглобина. Множество факторов являются причиной возникновения резистентности к ЭСС: дефицит и избыток железа, воспаление и гепсидин, уремия, минерально-костные нарушения, дефицит витамина D, белково-энергетическая недостаточность и др. [31–34]. В последние десятилетия появились инновации в лечении анемии при ХБП, включая достижение адекватности диализа у пациентов благодаря конвективному гемодиализу, применению диализных мембран, покрытых витамином Е, и внедрению новых высокопроницаемых мембран [35–37]. Однако, несмотря на новые подходы в преодолении резистентности к ЭСС, ключевыми механизмами в развитии этого состояния остаются воспаление и нарушение доступности железа. В этой связи трудно переоценить появление нового класса препаратов – ингибиторов пролилгидроксилазы индуцируемого гипоксией фактора (ингибиторы пролилгидроксилазы HIF (hypoxia-inducible factors)).
HIF представляет собой гетеродимер, состоящий из α- и β-субъединиц [38]. Существуют три изоформы α-субъединицы: HIF-1α, HIF-2α и HIF-3α, каждая из которых может объединяться с β-субъединицей, вызывая экспрессию различных комбинаций генов-мишеней. Регуляция активности HIF происходит с помощью субъединицы HIF-α, непрерывно синтезируемой в клетках и подвергающейся гидроксилированию пролилгидроксилазой [38]. При снижении активности пролилгидроксилазы и гипоксии сниженное гидроксилирование HIF-α позволяет ему стабилизироваться и транслоцироваться в ядро, где происходит димеризация с HIF-β [39]. Активация гена эритропоэтина происходит в ядре после связывания с элементом ответа на гипоксию в регуляторных областях гена-мишени среди других генов [39]. При гипоксии повышенная стабилизация HIF-α повышает активность эритропоэза [40]. При прогрессирующей ХБП снижение диффузии кислорода в почечные клетки происходит из-за усиления фиброза с повышенной трансформацией клеток, продуцирующих эритропоэтин, в почечные миофибробласты. Гипоксия усугубляется другими факторами, такими как разрушение перитубулярной капиллярной сети и снижение перитубулярного капиллярного кровотока [38]. Однако возникающая экспрессия HIF при ХБП недостаточна для активации эритропоэза, что объясняется избыточным окислительным стрессом, уремией и продукцией воспалительных цитокинов.
Ингибиторы пролилгидроксилазы HIF дают надежду на решение этой проблемы благодаря восстановлению эритропоэза с постоянной скоростью и устранению факторов резистентности ЭСС. Регулирование гомеостаза железа для удовлетворения потребностей в железе для синтеза гемоглобина является ключевым эффектом. Механизмы, участвующие в этом процессе, повышают уровень трансферрина и рецепторов трансферрина, цитохрома В двенадцатиперстной кишки, переносчика двухвалентных металлов 1 и уровня церулоплазмина [41]. Эффекты ингибиторов пролилгидроксилазы HIF на подавление продукции гепсидина и других провоспалительных цитокинов хорошо подтверждены [42]. Ассоциации с улучшенным статусом питания и здоровьем костей наблюдаются также в исследованиях при применении ингибиторов пролилгидроксилазы HIF [42]. Роксадустат – первый препарат-ингибитор пролилгидроксилазы HIF, испытания фазы III которого завершены во многих странах, в том числе и в России, и который уже одобрен к применению в Японии, Китае, странах ЕС и в России.
Проведена программа клинических исследований фазы III, в которых приняли участие более 9600 пациентов со всего мира. Изучали эффективность и безопасность роксадустата у больных, не получающих диализ и на диализе. В исследованиях ALPS, OLYMPUS и ANDES сравнивали роксадустат с плацебо у пациентов c ХБП третьей – пятой стадий [43–46]. Интегрированный анализ (n = 4270) показал, что роксадустат эффективен в достижении и поддержании уровня гемоглобина с меньшим риском экстренной терапии. Что касается нежелательных явлений, обе группы лечения имели сопоставимые профили безопасности в отношении сердечно-сосудистых событий и смертности от всех причин [46]. В недавно опубликованном метаанализе по использованию роксадустата [47] была продемонстрирована эффективность роксадустата у больных в додиализной стадии и на диализе и отмечена его безопасность для лечения анемии у пациентов с ХБП. В исследованиях было обнаружено, что роксадустат снижал уровни гепсидина и ферритина в сыворотке, особенно у больных на додиализной стадии ХБП. Гепсидин представляет собой пептид, нарушающий всасывание железа [48] и ингибирующий экспорт железа ферропортином из клеток. Уровень гепсидина повышается при воспалении [49], что способствует развитию резистентности к ЭСС. В ряде исследований фазы III [50–52] было подтверждено, что у диализных пациентов роксадустат был эффективен для коррекции анемии независимо от наличия воспаления, он повышает утилизацию железа и снижает уровень холестерина. Так, в подгруппах пациентов с высоким уровнем С-реактивного белка роксадустат приводил к большему повышению гемоглобина (0,9 ± 1,0 г/дл), чем эпоэтин альфа (0,3 ± 1,1 г/дл). Применение роксадустата приводило к снижению применения в/в вводимого железа [53–54], что может предотвращать его негативный эффект при использовании больших доз.
Разработка и внедрение ингибиторов пролилгидроксилазы HIF в клиническую практику продолжаются, и эти исследования будут находиться под пристальным наблюдением на пострегистрационном этапе в течение следующего десятилетия. В перспективе применение ингибиторов пролилгидроксилазы HIF должно позволить решить вопрос лечения анемии у больных с резистентностью к ЭСС.
E.V. Shutov, MD, Prof.
S.P. Botkin City Clinical Hospital, Moscow
Russian Medical Academy of Continuous Professional Education, Moscow
Contact person: Evgeny V. Shutov, shutov_e_v@mail.ru
The presented article reflects the actual problem of anemia treatment in patients with chronic kidney disease. Discussed controversial approaches to the therapy of anemia with iron preparations and erythropoietin-stimulating agents (ESS). For the first time, the critical assessment of clinical recommendations and treatment results was given. Reflected the issues of resistance to ESS are considered, the factors leading to this condition, the role of iron is shown. New information about hypoxia–induced factor (HIF) activator drugs is presented, the role of these drugs in the treatment of anemia in patients with CKD is shown. Provided the researches devoted to the first drug of this class – roxadustate.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.