Эффект оксигидроксида железа на эндогенные кальций-фосфатные протеиновые частицы при хронической болезни почек: от нового понимания молекулярных механизмов до клинической значимости
- Аннотация
- Статья
- Ссылки
- English
Введение
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти пациентов с хронической болезнью почек (ХБП). У пациентов с ХБП присутствуют традиционные факторы риска развития ССЗ, такие как пожилой возраст, артериальная гипертензия, дислипидемия, сахарный диабет, ожирение, курение. Кроме того, все больше фактических данных свидетельствуют о том, что нетрадиционные факторы риска, специфичные для ХБП, играют ключевую роль в патогенезе ССЗ. К таким факторам относятся почечная анемия, хроническое воспаление, повышенный окислительный стресс, уремические токсины и минерально-костные нарушения (МКН), которые среди нетрадиционных факторов риска стали важным игроком в патогенезе ССЗ [1]. Со времени проведения первых исследований наше понимание МКН при ХБП значительно расширилось, и постепенно раскрываются новые сложные механизмы, лежащие в его основе. Однако по-прежнему существует множество нерешенных вопросов в патогенезе синдрома МКН. Одним из них является изучение механизма нарушения гомеостаза фосфатов у пациентов с ХБП, связанного с различной патологией сердечно-сосудистой системы, в первую очередь эктопической кальцификацией, гипертрофией левого желудочка, увеличением числа сердечно-сосудистых событий, а также с повреждением почек, заболеванием костей, развитием вторичного гиперпаратиреоза, которые еще больше усиливают нарушение фосфатной регуляции, и повышением летальности. Тем не менее фармакотерапия, направленная непосредственно на клинические последствия гиперфосфатемии, по-прежнему остается областью большой неудовлетворенной медицинской потребности.
Фосфат-центрическая парадигма хронической болезни почек
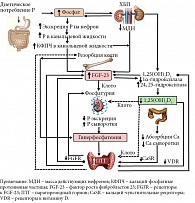
Фосфор (P) является важным микроминералом, играющим ключевую роль в клеточном метаболизме и структуре тканей. Уровни кальция и фосфатов в сыворотке крови строго регулируются в организме человека. Уровень Р в сыворотке крови поддерживается в гомеостатическом диапазоне кишечником, костями и почками. Поскольку P участвует в ряде физиологических процессов, поддержание его гомеостаза очень важно. Этот процесс координируется эндокринной системой благодаря высокоинтегрированному действию нескольких ключевых гормонов, включая фактор роста фибробластов (FGF-23), корецептор Клото, паратиреоидный гормон (ПТГ) и 1,25-дигидроксивитамин D (1,25(OH)2D), участвующих в регуляции гомеостаза фосфатов (рисунок).
Гомеостаз фосфатов поддерживается благодаря сбалансированному поступлению и выведению из организма и может быть легко нарушен при состояниях, превышающих физиологически необходимое поступление Р в организм. Перегрузка Р может быть вызвана превышением потребления фосфата с пищей. Приверженность диете с высоким содержанием белка, повышенное потребление обработанных пищевых продуктов и использование пищевых добавок с высоким содержанием неорганического Р способствовали возникновению острых скачков или преходящему повышению уровня Р в сыворотке крови. Это может быть частично объяснено высокой эффективностью абсорбции, особенно неорганического Р, присутствующего как в пищевых добавках, так и в лекарственных препаратах, а также циркадными колебаниями сывороточного Р. Было показано, что даже краткосрочные диеты с высоким содержанием Р значительно увеличивают циркулирующие уровни FGF-23. Кроме того, перегрузка Р обусловлена снижением количества функционирующих нефронов как вследствие процесса физиологического старения, так и прогрессирующей ХБП, заболеваниями костей, недостаточным диализом, но не ограничивается ими [2–4].
Однако вопросы о том, какие регуляторные процессы в первую очередь связаны с высокими нагрузками Р и как определяется степень реакции, по-прежнему являются предметом обсуждения. Открытие системы «FGF-23 – Клото» расширило представление исследователей о нарушениях, связанных с перегрузкой фосфатами. Количество экскреции фосфатов с мочой в первую очередь регулируется эндокринной системой, состоящей из FGF-23 и его облигатного корецептора Клото. На ранних стадиях повреждения почек снижается экспрессия Клото – мембранного β-гликозидазоподобного белка типа I, который придает тканевую специфичность FGF-23. Дефицит Клото повышает уровень Na+-зависимого фосфатного транспортера 2a (NaPi-2a), экспрессию NaPi-2c в почках и уровень NaPi-2b в кишечнике, которые могут инициировать нагрузку Р при нарушении функции почек [5].
У экспериментальных мышей дефицит Клото приводит к фенотипу, характеризующемуся измененным фосфорно-кальциевым обменом с гиперфосфатемией, вторичным гиперпаратиреозом, кальцификацией сосудов (КС), гипертрофией сердца, преждевременным старением и сокращением продолжительности жизни [6]. Также сообщалось, что Клото играет как FGF-23-независимую, так и FGF-23-зависимую роль в гомеостазе Р [7, 8]. FGF-23 – гормон, который секретируется остеоцитами и остеобластами и достигает своей клеточной специфичности в почках и паращитовидных железах благодаря связыванию в присутствии своего обязательного трансмембранного белка корецептора Клото, что увеличивает сродство FGF-23 к повсеместно экспрессируемым рецепторам ФРФ. Бинарный комплекс рецептора ФРФ и Kлото, экспрессирующийся в почечных канальцах, подавляет реабсорбцию Р вследствие ингибирования натрий-фосфатных котранспортеров 2-го типа, тем самым способствуя их выведению с мочой. Помимо функции фосфатурического гормона, FGF-23 действует как контррегуляторный гормон – ингибирует секрецию ПТГ, снижает синтез активного витамина D (1,25-дигидроксивитамин D3) с помощью подавления экспрессии 1α-гидроксилазы, необходимой для синтеза, и повышения экспрессии 24-гидроксилазы, необходимой для его инактивации в клетках проксимальных канальцев почек. FGF-23, ПТГ и 1,25(OH)2D3 взаимодействуют друг с другом через классические петли отрицательной эндокринной обратной связи, которые влияют на транспорт Са и Р в почках, костях и кишечнике [9]. Таким образом, два фосфатурических гормона – ПТГ и FGF-23 способствуют выведению Р с мочой в ответ на нагрузку Р для поддержания фосфатного гомеостаза в краткосрочной (часы) и в долгосрочной (дни) перспективе соответственно [4, 10, 11].
Как только количество функционирующих нефронов снижается до уровня, соответствующего ХБП четвертой-пятой стадии (скорость клубочковой фильтрации (СКФ) < 30 мл/мин/1,73 м2), происходит нарушение регуляции оси «FGF-23 – Kлото». Повышенные уровни FGF-23 и ПТГ больше не способны поддерживать фосфатный баланс через усиление экскреции Р оставшимися функционирующими нефронами, повышается концентрация Р в жидкости канальцев, что в конечном итоге приводит к развитию явной гиперфосфатемии, которая стимулирует дальнейшую секрецию FGF-23 клетками костной ткани [12]. Однако FGF-23, вероятно, не является надежным биомаркером нагрузки Р, поскольку в его регуляции также участвуют ПТГ, кальцитриол, кальций, эритропоэтин (EPO), факторы, индуцируемые гипоксией (HIF), различные воспалительные стимулы и почечный клиренс [13].
Кальций-фосфатные протеиновые частицы: протективные и патогенные эффекты
Недавно был выяснен молекулярный механизм раннего хронического повреждения почек, вызванного перегрузкой Р [14]. Кальций и фосфат, содержащиеся в рационе, всасываются путем трансклеточного и параклеточного транспорта через эпителий кишечника, концентрация Са и Р в интерстициальном пространстве увеличивается и в результате спонтанно образуются коллоидные наночастицы, называемые кальций-фосфатными протеиновыми мономерами (КФПМ), которые попадают в портальный и/или системный кровоток через лимфатическую систему, где немедленно связываются с сывороточным белком фетуином-А, секретируемым печенью, абсорбируют белки из окружающей среды и объединяют их в кластеры белка и аморфного фосфата кальция (Са3(РО4)2). КФПМ фильтруются клубочками, поступают в канальцевую жидкость и, как предполагается, запускают секрецию FGF-23 [11, 15, 16].
Несмотря на то что существуют большие индивидуальные и видовые различия в количестве нефронов и величине экскреции Р с мочой, у здоровых молодых людей на почку приходится около 1 млн нефронов и в среднем в день экскретируется около 1,0 г Р. Таким образом, экскреция Р из расчета на один нефрон оценивается примерно в 0,5 мкг в день. С уменьшением количества функционирующих нефронов в процессе прогрессирования ХБП до 0,5 млн экскреция Р из расчета на нефрон может достигать 1,0 мкг в день [17]. Как только внеклеточная жидкость перенасыщается ионами Р и Са, превышающими предел растворимости, КФПМ спонтанно подвергаются агрегации, превращаясь в первичные кальций-фосфатные протеиновые частицы (КФПЧ-I), которые имеют сферическую природу, циркулируют в плазме и функционируют как физиологический регулятор минерального гомеостаза крови, препятствуя кальцификации [2, 18]. Первичные КФПЧ подвергаются дальнейшей агрегации и созреванию под влиянием концентрации фетуина-A, фосфата, ионов кальция и магния, а также рН окружающей микросреды. В результате КФПЧ-I реорганизуются из коллоидных наночастиц во вторичные КФПЧ-II, которые содержат в своей сердцевине кристаллический гидроксиапатит, они крупнее КФПЧ-I, более плотные, с бо´льшим диаметром, нерастворимы в сыворотке крови и имеют иглообразную кристаллическую структуру.
Пересыщение сыворотки также используется для измерения половины максимального времени перехода, необходимого для трансформации из аморфного состояния в кристаллическое. Установлено, что половина времени, необходимого для спонтанного перехода от КФПЧ-I к КФПЧ-II, обозначаемая как T50, является сильным предиктором кальцифицирующих свойств сыворотки. Сыворотка с более высоким T50 менее склонна к кальцификации тканей по сравнению с сывороткой с более низким T50. Повышенная склонность сыворотки к образованию КФПЧ-II наблюдается в виде снижения T50. Вторичные КФПЧ интернализуются клетками сосудов, вызывая массовый приток ионов кальция в цитозоль, что приводит к провоспалительному ответу, клеточной дисфункции и гибели клеток [19, 20].
Образование кальций-фосфатных микрокристаллов сопровождается снижением уровня Са в крови и инактивацией кальций-чувствительного рецептора (CaSR), индуцирует секрецию ПТГ. ПТГ обладает активностью, повышающей уровень Са в крови и экскрецию Р с мочой, благодаря чему уровни Са и Р в крови восстанавливаются до базового значения. Эта негативная обратная связь для поддержания фосфатного гомеостаза возникает в течение нескольких часов после приема Р с пищей [21].
Кроме того, КФПЧ могут функционировать как переносчик, который доставляет Са и Р, всасываемые из желудочно-кишечного тракта, непосредственно в кость [18, 21].
Тем не менее неясно, как остеоциты/остеобласты воспринимают поступление Р, индуцируя экспрессию и секрецию FGF-23. Возможный механизм заключается в том, что остеобласты/остеоциты секретируют FGF-23, воспринимая постпрандиальное повышение уровня Р в крови через предполагаемый «фосфат-чувствительный рецептор». Однако фосфат-чувствительный рецептор не был идентифицирован. Эта гипотеза аналогична тому факту, что клетки паращитовидной железы секретируют ПТГ при снижении концентрации Са в крови благодаря CaSR, улавливая изменения его уровня в крови и регулируя секрецию ПТГ. Однако некоторые данные опровергают эту гипотезу. Во-первых, уровни FGF-23 в сыворотке крови коррелировали не только с уровнем Р в сыворотке, но и с уровнем Са. Во-вторых, увеличение сывороточного Р не привело к повышению уровня сывороточного FGF-23, когда уровень Са в сыворотке был низким, и наоборот. А именно, при наличии гипофосфатемии уровень FGF-23 не повышался в ответ на повышение уровня Са в сыворотке крови. Эти наблюдения указывают на то, что концентрация Са и Р в сыворотке крови должна быть выше определенного уровня, чтобы индуцировать секрецию FGF-23 [22, 23].
В культивируемых остеобластных клетках увеличение концентрации Са или Р в среде индуцировало экспрессию FGF-23, которая зависела от образования КФПЧ. Когда бисфосфонат блокировал переход аморфной фазы КФПМ в кристаллическую форму КФПЧ, экспрессия FGF-23 увеличивалась. Это позволяет предположить, что мелкие КФПЧ, содержащие аморфные кальций-фосфатные осадки, действуют как более мощный индуктор FGF-23, чем более крупные КФПЧ, содержащие кристаллические кальций-фосфатные осадки. У мышей болюсное введение Р через пероральный зонд временно увеличивало уровни циркулирующих КФПЧ с последующим умеренным повышением экспрессии ФРФ и уровней FGF-23 в сыворотке крови. Однако постоянная нагрузка Р с пищей вызывала значительное и стойкое увеличение циркулирующих КФПЧ и уровней FGF-23. Визуализация in vivo подтвердила, что КФПЧ, введенные внутривенно, проникали в костный мозг и осаждались на внутренней поверхности кости, что указывает на то, что эти частицы имеют прямой доступ к остеобластам. K.-I. Akiyama и соавт. предположили [21], что остеобласты индуцируют экспрессию и секрецию FGF-23, когда они ощущают увеличение внеклеточных КФПЧ после приема Р. На ранних стадиях заболевания почек пищевая нагрузка Р, с одной стороны, и уменьшение числа функционирующих нефронов у пациентов с ХБП, с другой, сопровождаются ростом уровня FGF-23 в сыворотке крови. FGF-23 снижает всасывание Р, поступающего с пищей, ингибируя реабсорбцию Р в проксимальных канальцах почек, что приводит к увеличению экскреции Р с мочой для поддержания фосфатного баланса прежде, чем появятся изменения в сывороточном уровне Р, и рассматривается как физиологическая реакция.
Эта серия событий указывает на то, что как Са, так и Р необходимы для индукции секреции FGF-23 и, возможно, не фосфат, а именно КФПЧ могут индуцировать секрецию и выработку FGF-23, которые являются не биологическим процессом, а физико-химическим явлением, развивающимся спонтанно с течением времени. Физиологический смысл формирования КФПЧ заключается в агрегации избыточных ионов Са и Р, их своевременном выведении макрофагами, особенно клетками Купфера в печени и предотвращении эктопической кальцификации. Таким образом, КФПЧ являются физиологическим модулятором эндокринной оси «FGF-23 – Kлото» [24–26].
Клиническая значимость формирования кальций-фосфатных протеиновых частиц
В последнее десятилетие активно проводятся работы по исследованию физиологической и патофизиологической значимости КФПЧ, поскольку, с одной стороны, данные частицы являются важным звеном минерального гомеостаза, аккумулируя избыточные ионы кальция и фосфора и выводя их из организма, а с другой – повышенные уровни циркулирующих КФПЧ ассоциированы с высоким риском неблагоприятных исходов, включая основные сердечно-сосудистые события и смертность у пациентов с додиализной и терминальной стадией почечной недостаточности (ТПН), реципиентов почечного трансплантата [27–30].
Перегрузка Р оказывает токсическое воздействие различными путями, включая прямое воздействие и косвенные эффекты, связанные с компенсаторными реакциями, такими как формирование КФПЧ, повышение уровня FGF-23 и ПТГ. Данные эпидемиологических исследований указывают на то, что перегрузка Р связана с неблагоприятными исходами, даже когда уровни Р находятся в пределах нормы, увеличивая риск смерти, сердечно-сосудистых осложнений и КС как у здоровых взрослых, так и у пациентов с ХБП. Уровни фосфатов 3,9–4,7 мг/дл были связаны с линейным увеличением числа сердечно-сосудистых событий у людей с нормальной функцией почек и пациентов с ХБП первой и второй стадии [31, 32].
Клиническая значимость КФПЧ обусловлена наблюдением повышения циркулирующих уровней у пациентов с ХБП, корреляцией с параметрами воспаления (высокочувствительный уровень С-реактивного белка), жесткостью сосудов (скорость пульсовой волны в аорте), КС (оценка кальцификации артерий) и толщиной бляшек в коронарных артериях, развитием и прогрессированием уремической артериолопатии, атеросклероза, тяжестью и прогрессированием КС, а также развитием острых сердечно-сосудистых событий и смертностью [30, 33–37].
Как только концентрация Р в жидкости канальцев превышает пороговое значение, повышаются уровень FGF-23 и концентрация Р в жидкости проксимальных канальцев, увеличивается риск образования КФПЧ в жидкости канальцев, которые вызывают повреждение канальцев с помощью связывания с экспрессируемым на поверхности клеток канальцев Toll-подобным рецептором 4 (TLR4). К. Shiizaki и соавт. [14] пришли к выводу, что TLR4-зависимое повреждение почечных канальцев in vivo было вызвано не активацией передачи сигналов TLR4 КФПЧ, а скорее взаимодействием с КФПЧ на поверхности клеток проксимальных канальцев в течение шести часов или дольше против потока канальцевой жидкости, что способствовало эндоцитозу, вызывая нарушение эндосомального транспорта и повреждение клеток канальцев. Стойкое повреждение канальцев вызывает интерстициальный фиброз, уменьшает количество нефронов и дополнительно повышает уровень FGF-23, вызывая спираль ухудшения, приводящую к прогрессирующей потере нефронов. У людей прогрессирование ХБП начиналось, когда уровень FGF-23 в сыворотке крови превышал 53 пг/мл [14].
Накапливаются данные, свидетельствующие о том, что КФПЧ, циркулирующие наноразмерные агрегаты, опосредуют некоторые токсические эффекты на многочисленные типы клеток сосудов и клапанов, включая эндотелиальные клетки сосудов, гладкомышечные клетки сосудов (ГМКС), адвентициальные фибробласты, интерстициальные и эндотелиальные клетки клапанов сердца, индуцируют экспрессию и секрецию провоспалительных цитокинов, включая интерлейкин-1β (ИЛ-1β), ИЛ-6, ИЛ-8 и фактор некроза опухоли альфа (ФНО-α) [38, 39].
Результаты исследования, проведенного К. Shiizaki и соавт. [14], показали, что КФПЧ ответственны за гибель клеток, вызванную высоким содержанием внеклеточного Р, и подтвердили, что добавление алендроната, который ингибирует переход фосфата кальция из аморфной фазы в кристаллическую, дозозависимым образом подавляет индуцируемую Р гибель клеток и, наоборот, добавление синтезированных КФПЧ в обычную среду снижало жизнеспособность клеток дозозависимым образом. Эти наблюдения указывают на то, что образование кристаллов фосфата кальция необходимо и достаточно для того, чтобы высокое содержание внеклеточного Р повреждало клетки проксимальных канальцев. Хотя обе формы КФПЧ обладают провоспалительным действием и индуцируют гиперплазию интимы ГМКС, которые были более выражены у КФПЧ-II. Это можно объяснить содержанием в них гидроксиапатита в кристаллической форме и различным сродством к связыванию с рецепторами, что запускает различные сигнальные каскады [39–43].
Кальций-фосфатные протеиновые частицы – медиаторы кальцификации сосудов
КС была признана одной из основных причин повышения жесткости артериальной стенки, приводящей к значительным механическим изменениям, которые изменяют растяжимость сосудов, вызывая увеличение скорости пульсовой волны и повышение артериального давления. Структурные изменения, вызванные КС, в свою очередь, сопровождаются артериальной гипертензией, гипертрофией левого желудочка и сердечной недостаточностью, что позволяет считать КС основным независимым фактором риска развития ССЗ и повышения общей смертности у пациентов с ХБП [44]. КC была определена как патологическое отложение кристаллов Са в сосудистой сети. У пациентов с ТПН уремическая среда характеризуется наличием большого количества уремических токсинов и КФПЧ-II, которые являются индукторами КС, и развивается раньше по сравнению со здоровыми субъектами. КС при ХБП представлена двумя основными типами кальцификации: интимальной и медиальной. Кальцификация интимы связана с атеросклерозом, при котором Ca2+ откладывается вместе с липопротеинами, а также фосфолипидами в атеросклеротических бляшках, в то время как медиальная кальцификация, более распространенная при ХБП, является результатом остеогенного процесса, сходного с внутримембранозной оссификацией, которая не зависит от атеросклероза и вызывает снижение податливости сосудистой стенки [45–47].
КС представляет собой сложный многофакторный процесс, центральную роль в котором играют трансдифференцировка ГМКС и апоптоз. Фосфат напрямую воздействует на рецептор PiT1, стимулируя ГМКС постоянно трансформироваться из сократительного в остеохондрогенный фенотип, обладающий кальцифицирующей способностью. Как только происходит эта трансформация, эти остеобластоподобные клетки начинают вырабатывать отложения гидроксиапатита, которые обычно находятся в кости. При развитии ТПН ГМКС реагируют на токсичную уремическую среду, усиливая аналогичную трансформацию, могут становиться апоптотическими и действовать как очаг инициации кальцификации [48].
В отличие от КФПМ, которые кажутся в основном инертными по отношению к клеткам сосудов in vitro [16], сформированные КФПЧ были вовлечены в качестве потенциальных медиаторов повреждения сосудов, вызывающих воспаление, эндотелиальную дисфункцию и КС [35, 38, 49]. Эндотелий представляет собой барьер между циркулирующими КФПЧ и подлежащей сосудистой тканью и является первой популяцией клеток, подвергающихся воздействию КФПЧ после их образования. Эндотелиальная дисфункция определяется как патологическое состояние, при котором происходит сужение сосудов вследствие дисбаланса относительного вклада эндотелиальных расслабляющих и сокращающих факторов. Воспалительная активация эндотелия и эндотелиальная дисфункция запускаются проатерогенными и провоспалительными сигнальными молекулами и играют ключевую роль в развитии атеросклероза и КС.
Недавние данные свидетельствуют о том, что КФПЧ являются прямыми медиаторами эндотелиальной дисфункции [50, 51]. Установлено, что последствием интернализации КФПЧ является патологическая активация эндотелия, сопровождаемая выделением провоспалительных цитокинов в микроокружение и системный кровоток, адгезией лейкоцитов к эндотелию, развитием эндотелиально-мезенхимального перехода с постепенной потерей клетками эндотелиального фенотипа в сочетании с приобретением фенотипа мезенхимального [52]. Одним из возможных механизмов, с помощью которого КФПЧ могут индуцировать эндотелиальную дисфункцию, является снижение экспрессии мРНК эндотелиальной синтазы оксида азота (eNOS) и выработки нитритов, что указывает на снижение биодоступности оксида азота (NO) путем подавления экспрессии или активности эндотелиальной eNOS либо путем опосредованного активными формами кислорода поглощения NO [52].
Митохондрии являются основным источником окислительного стресса в клетках, а высокие уровни P, воздействующие на митохондрии, увеличивают высвобождение свободных радикалов. Одним из основных эффекторов, индуцируемых P, вероятно, является внутриклеточное повышение уровня Са, которое вызывает внутриклеточное окислительное фосфорилирование. Связь между окислительным стрессом и КС была доказана, когда было обнаружено, что накопление активных форм кислорода способно индуцировать экспрессию RUNX2, поддерживающую остеобластную трансдифференцировку ГМКС. Перегрузка Р вызывает дисбаланс между антиоксидантами и активными формами кислорода в ГМКС, и еще одним свидетельством участия окислительного стресса является эффект антиоксидантов, которые являются защитными при кальцификации ГМКС [53]. Альтернативно КФПЧ могут повышать уровни асимметричного диметиларгинина, эндогенного ингибитора NO [54]. Точный механизм, с помощью которого КФПЧ индуцируют эндотелиальную дисфункцию, нуждается в дальнейшем изучении.
Вторичные КФПЧ могут индуцировать кальцификацию в культивируемых ГМКС и врожденные иммунные реакции в культивируемых макрофагах, как если бы они были патогеном. КФПЧ-II (в отличие от КФПЧ-I) непосредственно индуцируют воспаление и ускоряют фенотипические изменения в ГМКС, что приводит к кальцификации сосудистой стенки и сердечных клапанов, индуцирует синтез воспалительных цитокинов в лейкоцитах, макрофагах, ГМКС и сосудистых интерстициальных клетках. Активация инфламмасом в ответ на КФПЧ-II в настоящее время рассматривается как один из важнейших этапов сердечно-сосудистой кальцификации [55, 56].
Исследования показали, что КФПЧ-II индуцируют кальцификацию ГМКС in vitro, а также секрецию ФНО-α в макрофагах, увеличивают экспрессию костного морфогенетического белка-2, а также ядерного фактора каппа-В в ГМКС. Было также показано, что кальцификация ГМКС является результатом поглощения КФПЧ-II клетками, причем КФПЧ-II обнаруживаются внутриклеточно в кальцинированных ГМКС [39, 55]. Однако существуют разногласия относительно индукции остеохондрогенной дифференцировки с помощью КФПЧ. Для иллюстрации в некоторых исследованиях сообщается о снижении остеохондрогенной дедифференцировки, когда блокируется образование вторичных КФПЧ [57], тогда как в других исследованиях не удалось идентифицировать признаки остеохондрогенных генов в кальцинированных поражениях [58]. Механистическое понимание влияния КФПЧ на остеохондрогенную дедифференцировку ГМКС ограничено, однако элиминация КФПЧ из сыворотки крови пациентов с ТПН снижает способность сыворотки индуцировать остеохондрогенную дедифференцировку и сводит на нет ее прокальцифицирующую способность. Аналогичным образом добавление КФПЧ, полученных от пациентов с ТПН, в сыворотку крови здоровых доноров способствует остеохондрогенной дедифференцировке ГМКС [59]. КФПЧ-индуцированная остеохондрогенная дедифференцировка, по-видимому, ограничивается КФПЧ-II, поскольку ингибирование перехода из аморфного состояния в кристаллическое предотвращает кальцификацию [57].
КС происходит во внеклеточном пространстве и инициируется секрецией кальцифицирующих микровезикул (КМВ) из ГМКС и макрофагов бляшек, которые представляют собой места образования ядер для кальцификации матрикса [60–62]. КМВ клеточного происхождения отличаются от КМВ, переносимых через кровь. КМВ и КФПЧ различаются по происхождению, размеру, наличию мембранных белков и липидов и кристалличности и представляют собой гетерогенную группу секретируемых везикул, включая матриксные везикулы и экзосомы, которые функционируют для поддержания минерального гомеостаза [60, 63]. В физиологических условиях КМВ содержат ингибиторы кальцификации, тогда как в патогенных условиях присутствуют промоторы кальцификации. После высвобождения во внеклеточное пространство КМВ агрегируются и связываются с матриксными коллагенами с образованием центров зарождения кальцификации, кульминацией которых являются микрокальцификации, которые могут сливаться с образованием макрокальцификации в стенке сосуда [64–66].
КФПЧ могут влиять на кальцификацию посредством КМВ несколькими способами. Во-первых, КФПЧ индуцируют апоптоз ГМКС, и апоптотические тельца образуют очаг кальцификации. Во-вторых, КФПЧ вызывают повышение цитоплазматического Ca2+, а высокие цитозольные уровни Ca2+ в ГМКС приводят к образованию прокальцифицирующих КМВ. В-третьих, КФПЧ могут быть выделены из кальцинированных атерогенных поражений, где КФПЧ могут сливаться с развивающимися микрокальцификатами и интегрироваться в них. Механизм влияния КФПЧ на кальцификацию, опосредованную КМВ, недостаточно изучен, и полная картина отсутствует. Тем не менее склонность к кальцификации сыворотки и зрелость КФПЧ связаны с размером кальцифицированного очага, что указывает на взаимосвязь, которая заслуживает дальнейшей оценки [37, 67]. Исследования показывают, что в диализате пациентов с ТПН содержится значительное количество КФПЧ, которое также было прямо пропорционально содержанию Ca2+ в диализате. Это позволяет предположить, что КФПЧ может быть выведен из плазмы пациентов посредством гемодиализа (ГД) [68]. В то же время было обнаружено, что ГД увеличивает T50, снижая склонность к кальцификации плазмы пациента [69, 70]. По-видимому, это свидетельствует о том, что уровни КФПЧ- I и КФПЧ-II в сыворотке не подвержены влиянию стандартного ГД [71]. Во-первых, это позволяет предположить, что увеличение T50 после начала ГД связано не с клиренсом КФПЧ как таковым, а с уменьшением факторов, ускоряющих процесс их созревания, наиболее вероятно связанный с уменьшением Ca2+и P. Во-вторых, КФПЧ, хотя и не выводятся из сыворотки при стандартных условиях ГД, в некоторой степени выводятся при перитонеальном диализе (ПД). Однако, если концентрация ионов Мg в растворе для ГД повышена, КФПЧ, по-видимому, проходят через диализную мембрану и выводятся из сыворотки пациента [71]. Это объясняет значительное повышение T50 у пациентов, получавших диализный раствор, содержащий большую концентрацию Mg2+ по сравнению со стандартным раствором [72].
В дополнение к благоприятному влиянию повышенного содержания Mg2+ в диализном растворе на склонность к кальцификации сыворотки у пациентов с ХБП было обнаружено, что использование не содержащего ацетата, подкисленного цитратом диализного раствора также увеличивает T50, снижая склонность к кальцификации [73, 74]. Напротив, КФПЧ в сыворотке крови повышаются у пациентов с ХБП третьей-четвертой стадии, причем он самый высокий у пациентов на ГД [75], но с меньшим содержанием фетуина-А по мере прогрессирования ХБП. Вероятно, у пациентов с ХБП метаболизм КФПЧ ускоряется, но фетуин-А потребляется, оказывая системное противокальцифицирующее действие, необходимое для противодействия КС при ухудшении функции почек [59].
Что касается КC, то КФПЧ в сыворотке крови, по-видимому, ведут себя по-разному в отношении динамики фетуина-A у пациентов с ХБП: более высокие уровни КФПЧ связаны с повышенной жесткостью аорты [19], а у пациентов с КC был обнаружен больший диаметр КФПЧ-II [67]. Как и следовало ожидать, уровень Т50 был обратно пропорционален тяжести кальцификации коронарных артерий у пациентов с ХБП [37], таким образом, тест на Т50, по-видимому, имитирует изменения уровня фетуина-А в сыворотке крови в отношении КC, поскольку было обнаружено, что они связаны. Уровни КФПЧ обратно коррелируют с СКФ [24], а не с T50, который не зависел от СКФ [76]. Что касается потери минералов скелета, то C.N. Silaghi и соавт. не нашли убедительных исследований связи T50 КФПЧ с минеральной плотностью костной ткани [77]. Однако попытка объяснить парадокс кальцификации на оси «сосудистая сеть – кость – почка» только с точки зрения содержания КФПЧ в фетуине-А является попыткой упрощения. С учетом этой точки зрения необходимы более целенаправленные исследования, чтобы продемонстрировать, что КФПЧ, скорее всего, являются ключом к пониманию того, как физиологическое окостенение соотносится с патологическим кальцинозом.
Влияние оксигидроксида железа на эндогенные частицы кальципротеина, воспаление и сосудистые клетки у пациентов, находящихся на диализе
Лечение МКН при ХБП с использованием традиционных терапевтических подходов, которые включают ограничение потребления Р с пищей, назначение фосфат-связывающих препаратов (ФСП), использование активного витамина D и кальцимиметиков (влияние на костный метаболизм), адекватный диализ у пациентов с ТПН могут замедлить прогрессирование внекостной кальцификации, но эти подходы остаются спорными, поскольку рекомендуемые биохимические показатели труднодостижимы. Более половины пациентов, находящихся на диализе, имеют концентрацию Р в сыворотке крови выше целевых значений и нуждаются в лечении ФСП для снижения всасывания Р в желудочно-кишечном тракте и достижения контроля уровня Р в сыворотке крови. Данные перекрестных исследований показывают, что у пациентов, находящихся на диализе, получающих терапию ФСП, показатели смертности значительно ниже по сравнению с теми, кто не получает ФСП, даже после сопоставления показателей склонности и корректировки статуса питания [78, 79].
Крупные эпидемиологические исследования подтверждают, что повышенные концентрации Р в сыворотке крови идентифицированы как основной нетрадиционный фактор риска ССЗ и смертности от всех причин у пациентов с ХБП, особенно находящихся на диализе. В этом контексте можно предположить, что контроль уровня Р в сыворотке крови может привести к меньшей внекостной кальцификации и неблагоприятным исходам, и это было отличительной чертой терапевтической стратегии у пациентов с ХБП на протяжении многих лет. Недостаточность существующих стратегий регулирования уровня Р для последовательного достижения и поддержания целевых уровней хорошо задокументирована [80].
Оксигидроксид железа (ОЖ) (Velphoro®) – сильнодействующий ФСП на основе железа, состоит из смеси сахарозы, крахмалов и активного компонента, многоядерного ОЖ(III) с низкой суточной дозой таблеток, одобренный для контроля концентрации Р в сыворотке крови у пациентов с ХБП, находящихся на диализе [81].
Эффективность терапии ОЖ в реальных клинических условиях была тщательно оценена в ряде наблюдательных исследований, проведенных с участием большого числа пациентов, находящихся на ГД (> 6400) и ПД (~ 500) в США и Европе, как в ретроспективных, так и в проспективных когортах и рандомизированных клинических исследованиях (РКИ). В соответствии с данными клинических исследований, реальные наблюдательные исследования продемонстрировали, что ОЖ может эффективно снижать уровень Р в сыворотке крови при меньшем ежедневном приеме таблеток, чем большинство других ФСП. Эти исследования также показали, что ОЖ обеспечивает эффективный контроль уровня Р в сыворотке крови при различных условиях лечения, в том числе в качестве монотерапии у пациентов, не принимающих ФСП или переходящих на ОЖ с других ФСП, или при использовании в комбинации с другими ФСП, обладает высокой фосфат-связывающей способностью. Эти исследования указывают на благоприятный профиль безопасности и переносимости, а также на минимальную, если таковая имеется, системную абсорбцию железа [82].
Лечение ОЖ значительно снижало уровень FGF-23 в сыворотке крови в большей степени, чем карбонат кальция, и превосходило карбонат кальция в предотвращении развития КС, а также оказывало благоприятное влияние на метаболизм костной ткани [83–87]. Другие исследования, проведенные с применением ОЖ, показали его эффективность в снижении КC в адениновой модели ХПН. Сравнение OЖ и ФСП на основе кальция (CaCO3) показало, что оба метода лечения имели сходный эффект в снижении P в сыворотке крови, но ОЖ обладал большей эффективностью в снижении FGF-23 и предотвращении развития внекостной кальцификации [83].
Систематический обзор и метаанализ, включающие 36 РКИ и пять проспективных исследований (7590 пациентов), продемонстрировали, что ограничение Р с пищей менее 800 мг в сутки дало незначительный эффект на снижение FGF-23, в то время как среди ФСП, не содержащих кальций, включающих и ОЖ, выявлено эффективное снижение FGF-23 у пациентов с ТПН [88].
В многоцентровом РКИ с двухфакторным дизайном EPISODE проведено сравнение влияния на прогрессирование кальцификации коронарных артерий (KKA) ОЖ или карбоната лантана (КЛ) в двух различных целевых диапазонах Р (3,5–4,5 мг/дл в группе строгого контроля и 5,0–6,0 мг/дл в стандартной группе) [89]. Первичной конечной точкой было процентное (%) изменение показателей ККА по данным мультидетекторной компьютерной томографии на основе метода А. Agatston и соавт. через 12 месяцев после лечения. Вторичные конечные точки включали абсолютное изменение показателей ККА и долю пациентов, достигших целевого уровня фосфатов в сыворотке крови к концу периода лечения. В этом исследовании процентное изменение показателей ККА в группе строгого контроля Р (медиана (Ме) 8,52; межквартильный диапазон (IQR) 1,0–23,9) было значительно ниже, чем в стандартной группе (Ме 21,8; IQR – 10,0 – 36,1; p = 0,006). Этот эффект был более выражен у пожилых пациентов (65–74 лет) по сравнению с более молодыми (20–64 лет), р = 0,003. Аналогично процентному изменению абсолютное изменение показателей ККА было значительно ниже в группе строгого контроля (Ме 66,1; IQR 3,8–220,1) в сравнении со стандартной группой (Ме 125,9; IQR 66,6–321,0; p = 0,01). Следует отметить, что абсолютное изменение показателей ККА было значительно ниже в группе ОЖ (Ме 74,4; IQR 9,8–173,3), чем в группе КЛ (131,5; IQR 26,9–314,5; p = 0,03). Доля пациентов, у которых через 12 месяцев после лечения снизились показатели ККА, была больше в группе ОЖ (28,3%) в сравнении с КЛ (14,5%), группами строгого и стандартного контроля (27,6 и 14,0%) соответственно. Следует отметить, что в оценке клинически значимых различий влияния двух типов без кальциевых ФСП на КС нельзя исключить ограничения по размеру выборки.
Данное исследование продемонстрировало, что строгий контроль уровня Р в пределах нормального диапазона с использованием ФСП эффективен в замедлении КС у пациентов, находящихся на ГД.
Объяснением эффективности ФСП может послужить их влияние на образование КФПЧ, которое рассматривается как защитный механизм против нежелательного роста кристаллов фосфата кальция в крови и жидкости почечных канальцев при перегрузке Р. Как было описано выше, КФПЧ представляют собой полидисперсные коллоиды, классифицируются на основе плотности и кристалличности фосфата кальция. КФПЧ низкой плотности, содержащие аморфный (некристаллический) фосфат кальция, функционируют как индуктор экспрессии FGF-23 в остеобластах и переносчик фосфата кальция в кость. Однако после трансформации в КФПЧ высокой плотности, содержащий кристаллический фосфат кальция, КФПЧ становятся цитотоксичными, вызывая повреждение почечных канальцев, хроническое воспаление, кальцификацию ГМКС и врожденный иммунный ответ макрофагов. КФПЧ, формирующиеся при перегрузке Р, являются потенциальным ранним биомаркером МКН и представляют собой модифицируемый фактор риска. КФПЧ стали многообещающей терапевтической мишенью, в связи с чем продолжаются новаторские клинические испытания, направленные на разработку эффективных стратегий предупреждения и замедления сердечно-сосудистых осложнений у пациентов с ХБП.
Так, влияние терапии ФСП на эндогенный уровень КФПЧ прежде всего было изучено в экспериментальных моделях и рассмотрено в нескольких клинических исследованиях, четыре из которых включали диализных пациентов [90–98]. Недавнее исследование влияния OЖ на эндогенные КФПЧ на модели животных с остаточной почкой продемонстрировало защитный эффект при повреждении почек, обусловленный снижением уровня Р в крови. Следует отметить, что авторы обнаружили снижение содержания КФПЧ, несмотря на отсутствие эктопической кальцификации в почках [90]. Снижение КФПЧ может быть связано с улучшением функции почек, поскольку было продемонстрировано, что накопление именно КФПЧ-II непосредственно индуцирует воспаление и ускоряет фенотипические изменения в ГМКC, приводящие к кальцификации сосудистой стенки и клапанов сердца, и их снижение может внести положительный вклад в предотвращение кальцификации [55, 59].
Следует отметить, что в экспериментах на животных повреждение почечных канальцев и интерстициальный фиброз были предотвращены введением бисфосфонатов, которые также ингибируют созревание КФПЧ in vitro [55].
В 2023 г. U. Thiem и соавт. опубликовали результаты открытого рандомизированного контролируемого перекрестного исследования, изучавшего влияние ОЖ на уровни эндогенного мономера кальципротеина и КФПЧ, воспаление и клетки сосудов у пациентов на заместительной почечной терапии диализом [98]. Для анализа использовались образцы крови, взятые у трех групп участников: пациентов, находящихся на ГД, пациентов с ХБП третьей-четвертой стадии и здоровых добровольцев. Пациенты на ГД получали перорально низкие дозы ОЖ (250 мг/сут), затем высокие дозы ОЖ (2000 мг/сут) в течение двух недель каждая или, наоборот, с двухнедельными фазами вымывания (отсутствие ФСП) до и после каждой фазы лечения. Было выявлено снижение уровней Р в сыворотке крови при значительном увеличении T50 при терапии высокими дозами OЖ. В текущем анализе изменения сывороточного Р в ответ на OЖ сильно коррелировали с изменениями КФПЧ-I (r = 0,64 (95%-ный доверительный интервал (95% ДИ) 0,35–0,82), p < 0,001). Результаты исследования также указывают на больший кальцифицирующий потенциал уремических КФПЧ-II по сравнению с синтетическими КФПЧ-II эквивалентного размера и количества, созданными в неуремической среде, что подразумевает дополнительное кондиционирование КФПЧ, способствующее кальцификации ГМКС под воздействием уремических факторов. Частицы синтетических КФПЧ, полученных из объединенной сыворотки здоровых контрольных групп и пациентов, находящихся на диализе, индуцируют кальцификацию ГМКС in vitro. Частицы эндогенных КФПЧ у пациентов с ХБП опосредуют кальцификацию ГМКС, индуцированную сывороткой крови пациента in vitro. Как было описано выше, по результатам исследования Y. Nemoto и соавт. [90], лечение ОЖ у крыс, подвергшихся нефрэктомии 5/6 почки, ослабляло воспаление почек, но эффекты у людей и на системные маркеры воспаления остаются неизвестными.
U. Thiem и соавт. [98] впервые задокументировали влияние OЖ на маркеры системного воспаления у пациентов, находящихся на диализе, и установили значительное снижение уровней девяти из 14 цитокинов, особенно ИЛ-1, ИЛ-6 и ИЛ-8, которые могут быть вовлечены в сосудистую патологию. Так, при использовании комбинации иммуноферментных анализов и мультиплексных матриц было обнаружено, что концентрации интерлейкинов в плазме значительно снижаются при приеме высоких доз ОЖ (2000 мг/сут) в сравнении с отсутствием применения ФСП. Наибольшие изменения маркеров системного воспаления (ИЛ-1α (Ме -62% (95% ДИ от -76 до -26), p < 0,0001), ИЛ-8 (Ме -46% (95% ДИ от -73 до -17), p < 0,0001) и ИЛ-6 (Ме -31% (95% ДИ от -51 до -1), p < 0,001)) наблюдались в плазме крови у пациентов, находящихся на диализе, получавших высокие дозы ОЖ. Этот преимущественно противовоспалительный эффект был отражен в значительно более низких уровнях высокочувствительного С-реактивного белка (hs CRP) на фоне терапии ОЖ (3,90 мг/л (95% ДИ 1,95–7,18) по сравнению с 2,45 (95% ДИ 0,99–5,94); p < 0,05) среди пациентов, не получавших ФСП (вымывание). Важность влияния на цитокины в этом контексте может быть подчеркнута в недавнем РКИ, показавшем более низкую сердечно-сосудистую заболеваемость у пациентов с установленным ССЗ и повышенными уровнями hs CRP, получавших терапию анти-ИЛ-1β или анти-ИЛ-6 [99].
Эндогенные КФПЧ опосредуют эффект лечения ОЖ на активацию эндотелиальных клеток, индуцируемую сывороткой крови пациента in vitro. Тем не менее уровни мРНК оставались выше, чем в контрольной сыворотке, что еще раз подчеркивает, что терапия ФСП не полностью снижает токсичность уремической сыворотки.
При вторичном анализе рандомизированного контролируемого перекрестного исследования диализных пациентов с гиперфосфатемией, целью которого являлось изучение влияния ОЖ на склонность сыворотки крови к кальцификации, измеренную по T50-тесту [97], было продемонстрировано, что терапия высокими дозами ОЖ (2000 мг/сут) значительно снижала уровни эндогенных кальций-протеиновых мономеров, КФПЧ-I и КФПЧ-II в сыворотке крови и была связана с иммуномодулирующими эффектами. Опосредованные таким образом эффекты на сыворотку крови у диализных пациентов выражались в увеличении Т50 (52 минуты (95% ДИ 31–74 минуты, р < 0,0001)), снижении уровня Р в сыворотке крови с 2,18 ± 0,5 до 1,64 ± 0,46 ммоль/л и в снижении кальцификации ГМКС и активации эндотелиальных клеток in vitro. Также было выявлено, что КФПЧ являются потенциальными основными детерминантами. Эти результаты указывают на то, что снижение уровня Р в сыворотке крови является основным фактором, способствующим изменениям уровня Т50, вызванным терапией ОЖ. Исходя из этого, снижение уровня Р в сыворотке крови на 0,1 ммоль/л приводит к повышению уровня Т50 приблизительно на 10 минут.
Основным преимуществом анализируемых исследований был контролируемый кроссовер с прерывистыми фазами вымывания, что позволило изучить влияние мощной терапии ОЖ по сравнению с терапией без ФСП, эффективное и неэффективное (ОЖ 2000 мг/сут в сравнении с ОЖ 250 мг/сут) снижение Р, а также обратимость эффектов терапии ФСП (ОЖ 2000 мг/сут по сравнению с вымыванием) на Т50. Таким образом, показано, что высокие дозы ОЖ снижали образование эндогенных КФПЧ в сыворотке крови, значительно повышали уровень Т50, снижали способность уремической сыворотки индуцировать КС и активировать эндотелиальные клетки in vitro, ослабляли системное воспаление у пациентов, находящихся на ГД.
Вероятным представляется факт, что снижение КФПМ ОЖ может быть более чувствительным показателем острых изменений минеральной нагрузки, с учетом их кишечного происхождения и сигмоидальной взаимосвязи между сывороточным Р и КФПМ [24, 100].
Заключение
Гиперфосфатемия считается основным нетрадиционным фактором риска развития сердечно-сосудистых осложнений, и накапливается все больше данных, свидетельствующих о том, что циркулирующие КФПЧ могут быть лучшим показателем токсичности Р, чем сывороточный фосфат сам по себе. Открытие КФПЧ свидетельствует о новых возможностях профилактики КC и количественной оценки склонности к кальцификации сыворотки с помощью теста T50. Несмотря на то что различные факторы, влияющие на уровни КФПЧ в сыворотке крови, включая процесс их созревания, а также на T50 и его вариации при различных заболеваниях, изучены недостаточно, появляется все больше доказательств, свидетельствующих о том, что T50 может быть эффективным маркером при оценке КC. Более того, определение теста T50 может быть полезным при лечении внекостной кальцификации у пациентов с ХБП, особенно у пациентов на заместительной почечной терапии ГД, у которых значительно повышен риск развития ССЗ. В этих ситуациях раннее внедрение стратегии лечения, повышающей T50, могло бы смягчить очевидные осложнения, связанные с КC.
Полученные результаты исследований влияния оксигидроксида железа (Velphoro®) на КФПЧ у диализных пациентов показали, что фосфат-связывающая терапия высокими дозами ОЖ снижала сывороточные уровни кальций-фосфатных мономеров, КФПЧ-I и КФПЧ-II и была связана с иммуномодулирующими эффектами. Сыворотка пациентов, получавших лечение ОЖ, обладала более низкими прокальцифицирующими и воспалительными свойствами in vitro, и было обнаружено, что КФПЧ опосредуют эти эффекты. Таким образом, полученные данные подтверждают причинную роль КФПЧ в развитии и прогрессировании сосудистых заболеваний и свидетельствуют о снижении образования эндогенных КФПЧ и способности уремической сыворотки вызывать КС, активировать эндотелиальные клетки in vitro, а также о недооцененной роли противовоспалительного эффекта ОЖ у большинства пациентов, находящихся на диализе.
G.V. Volgina, PhD, Prof., M.Yu. Dudko
Russian University of Medicine, Moscow
S.P. Botkin City Clinical Hospital
Contact person: Galina V. Volgina, volginagv@mail.ru
Phosphate overload is the primary driver of all manifestations of bone mineral disorders in chronic kidney disease (BMD-CKD) and the development of cardiovascular complications. A new understanding of cardiovascular pathology, including the formation of newly discovered calcium phosphate protein particles (CPhPP), which are a potential biomarker of the occurrence and progression of vascular calcification, modification of this risk factor for BMD and cardiovascular pathology, will undoubtedly lead to improved therapeutic interventions and possibly improve adverse outcomes in patients with CKD. The obtained data on the effect of iron hydroxide on CPHR indicate a decrease in the formation of endodogenous CPhPP, the ability of uremic serum to cause vascular calcification, activate endothelial cells and weaken systemic inflammation in most patients receiving renal replacement therapy by dialysis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.