количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Сравнительная характеристика ингаляционных ГКС
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" №2
- Аннотация
- Статья
- Ссылки
- English
В обзоре приведена характеристика фармакологических свойств ингаляционных глюкокортикостероидов (ГКС). Показано, что будесонид обладает одним из наиболее благоприятных профилей безопасности благодаря способности к эстерификации, короткому периоду полувыведения, высокому системному клиренсу. Из представленных в России ГКС для небулайзерной терапии в качестве препарата выбора рекомендован Пульмикорт (будесонид суспензия для ингаляций дозированная), характеризующийся высокой безопасностью и широкими показаниями для лечения бронхиальной астмы, ХОБЛ и ложного крупа.
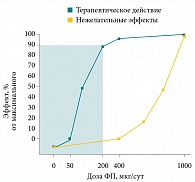
Рис. 1. График «доза – эффект» (на примере флутиказона пропионата (ФП))
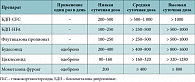
Таблица 1. Эквипотентные суточные дозы (мкг) ингаляционных ГКС для взрослых и детей старше 12 лет

Таблица 2. Эквипотентные суточные дозы (мкг) ингаляционных ГКС для детей старше 5 лет
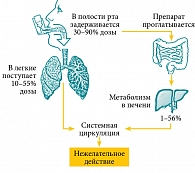
Таблица 2. Эквипотентные суточные дозы (мкг) ингаляционных ГКС для детей старше 5 лет

Таблица 3. Эквипотентные суточные дозы (мкг) будесонида суспензии для базисной терапии бронхиальной астмы у детей, в зависимости от возраста
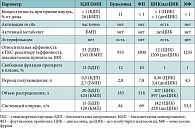
Таблица 4. Основные параметры фармакокинетики ингаляционных ГКС
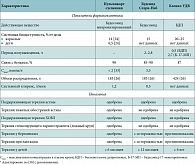
Таблица 5. Сравнительная характеристика ГКС-препаратов для небулайзерной терапии*
Место ингаляционных ГКС в современной фармакотерапии бронхиальной астмы
Ингаляционные глюкокортикостероиды (ГКС) являются наиболее эффективными противовоспалительными препаратами для терапии бронхиальной астмы (БА) и хронической обструктивной болезни легких (ХОБЛ) [1]. У больных БА эти препараты применяются как для купирования обострений, так и для поддерживающей терапии при стабильном течении заболевания [2]. Назначение ингаляционных ГКС у больных БА позволяет:
- уменьшить выраженность воспаления в дыхательных путях (уменьшение и исчезновение воспалительной инфильтрации, снижение числа эозинофилов и тучных клеток, уменьшение продукции цитокинов и медиаторов воспаления) [3];
- восстановить поврежденную структуру эпителия бронхов [4];
- обеспечить контроль над заболеванием, то есть снизить выраженность симптомов БА и уменьшить риск обострений [5]. Назначение ГКС даже в низких дозах (будесонид 200 мкг/сут) позволяет снизить риск обострений БА в два раза [6].
Геномные и внегеномные эффекты ГКС
ГКС в цитоплазме клеток взаимодействуют с внутриклеточными ГКС-рецепторами. Димеры, состоящие из активированных комплексов «ГКС – рецептор», поступают в ядро и связываются с ГКС-отвечающим элементом ДНК (GRE – glucocorticoid response elements). В этом процессе принимают участие различные коактиваторы, совместно с которыми ГКС активируют гистондеацетилазу-2 и блокируют гистонацетилтрансферазу. В результате подавляется активность генов, отвечающих за воспаление в дыхательных путях и активацию клеток, принимающих участие в иммунном ответе и аллергических реакциях. Активируя гистондеацетилазу-2, ГКС выступают в качестве антагонистов транскрипционного фактора NF-каппа-B, который контролирует экспрессию генов иммунного ответа, апоптоза и клеточного цикла [7, 8].
В конечном итоге ГКС контролируют активность примерно 200 генов. Репрессия генов, важных для воспалительных реакций (гены цитокинов, медиаторов воспаления, факторов адгезии), приводит к затуханию воспалительных процессов в дыхательных путях. Кроме того, под воздействием ГКС активируются гены, отвечающие за синтез противовоспалительных факторов.
Эффекты ГКС, опосредованные через регуляцию активности генов, получили название геномных. Они проявляются через 16–24 часа после назначения препарата, то есть тогда, когда регуляция активности генов проявляется на уровне биосинтеза белка [9]. Устойчивый лечебный эффект достигается спустя месяцы лечения.
Ряд факторов могут способствовать уменьшению противовоспалительного действия ГКС, что актуально примерно для четверти больных БА. Например, курение блокирует фермент гистондеацетилазу-2, который необходим для подавления активности «генов воспаления» [10, 11]. Высокие концентрации провоспалительных цитокинов также снижают активность ГКС: при этом активируются ферменты, фосфолирирующие ГКС-рецепторы [12]. Снижение активности ГКС преодолевается назначением более высоких доз. Истинная ГКС-резистентность, связанная с мутациями ГКС-рецепторов, встречается крайне редко.
Кроме внутриклеточных рецепторов, ГКС могут взаимодействовать с рецепторами и ионными каналами на поверхности клеток. Например, сразу после ингаляции ГКС блокируют каналы экстранейрональных транспортеров моноаминов (EMT-каналы) [13]. Эти каналы служат для транспорта катехоламинов и бета-агонистов в цитоплазму, где они разрушаются под воздействием катехоламинметилтрансферазы. Блокируя EMT-каналы, ГКС повышают активность бета-агонистов, усиливая их бронхолитическое действие. Кроме того, ГКС уже через 15 минут после ингаляции снижают объем кровотока в капиллярах [14].
У больных, которые получают бета-2-агонисты длительное время и/или в высоких дозах, чувствительность бета-2-адренорецепторов значительно снижается. Например, в случае приема короткодействующих бета-2-агонистов в течение недели чувствительность бета-2-адренорецепторов снижается примерно на 20%, а при назначении длительно действующих бета-2-агонистов больным ХОБЛ ответ на лечение за год уменьшается на 50%. Еще одним внегеномным эффектом ГКС является увеличение чувствительности бета-2-адренорецепторов. ГКС дозозависимо увеличивают активность бета-2-агонистов, в том числе и при длительном приеме, что является одним из важных аргументов для назначения ГКС и бета-2-агонистов в виде комбинированных препаратов [7].
Благодаря внегеномным эффектам ингаляционные ГКС, назначенные больным при обострениях БА, могут оказывать положительное влияние на показатели спирометрии уже в первые часы после применения [15].
Соотношение «доза – эффект»
Доза ингаляционных ГКС подбирается в зависимости от уровня контроля над астмой. Обычно лечение начинают с низких доз1. Если такая терапия позволяет поддерживать обычный уровень физической активности, нормальные показатели спирометрии и практически полное отсутствие симптомов2, больной должен продолжать принимать ГКС в низких дозах. В противном случае дозу препарата следует увеличить или усилить терапию путем присоединения препаратов других групп: бета-2-агонистов длительного действия или антилейкотриеновых препаратов.
В целом присоединение дополнительных препаратов более оправдано, нежели увеличение дозы ингаляционного ГКС. Например, в ходе клинических исследований было показано, что увеличение дозы ингаляционного ГКС в четыре раза почти не сопровождается улучшением уровня контроля над БА, в то время как присоединение формотерола (бета-2-агонист длительного действия) позволяет увеличить число бессимптомных дней почти наполовину, не прибегая к увеличению дозы ингаляционного ГКС [6, 17].
Было также показано, что вклад низких доз в общий эффект ингаляционных ГКС преобладает над вкладом высоких доз. Так, флутиказона пропионат (ФП) в дозе 250 мкг обеспечивает 90% от максимального эффекта, который можно наблюдать при назначении максимальной дозы препарата (1000 мкг в день) [18]. Другой ингаляционный ГКС будесонид в дозе 320 мкг обеспечивает 80% своего максимального эффекта [19]. Таким образом, повышение до средних и высоких доз увеличивает эффективность лечения ГКС всего на 10–20%, но сопровождается существенным увеличением риска нежелательных эффектов, связанных с применением ингаляционных ГКС (рис. 1) [18, 20].
Тем не менее высокие дозы ингаляционных ГКС применяются у больных с тяжелой бронхообструкцией, то есть в том случае, когда доставка препаратов в дыхательные пути резко снижена из-за сужения бронхов. Согласно рекомендациям GINA (Global Initiative for Asthma – Глобальная инициатива по борьбе с бронхиальной астмой), терапия высокими дозами ингаляционных ГКС показана только в тех случаях, когда контроль над БА не может быть достигнут при назначении комбинации средних доз ГКС с бета-2-агонистами длительного действия. При этом продолжительность лечения высокими дозами ГКС не должна превышать 3–6 месяцев [21].
Применение высоких доз ингаляционных ГКС (через небулайзер) при обострении БА, напротив, является достаточно безопасным, так как курс терапии ограничен коротким (7–10 суток) промежутком времени. При этом безопасность ингаляционных ГКС существенно выше по сравнению с назначением ГКС для приема внутрь. Например, 1 мг суспензии будесонида для ингаляции через небулайзер3 по клинической эффективности соответствует примерно 33 мг преднизолона для приема внутрь (6,5 таблеток), а риски нежелательных эффектов при применении одинаково эффективных доз будесонида и преднизолона соотносятся как риски при приеме 1 мг будесонида и 8,6 мг преднизолона (примерно полторы таблетки) [22, 23]. Таким образом, при терапии обострений БА будесонид характеризуется существенно более высоким профилем безопасности по сравнению с преднизолоном. Объясняется это тем, что после ингаляции будесонида системного кровотока достигает только 6,5% дозы (у детей) и 14% дозы (у взрослых) [24], в то время как весь принятый больным преднизолон, прежде чем попасть в дыхательные пути, оказывается в крови больного.
Эквипотентные дозы ГКС
Все ингаляционные ГКС при терапии БА оказывают сходное терапевтическое влияние на процессы воспаления в дыхательных путях. Но из-за различий в активности препаратов лечебный эффект достигается при использовании разных доз. Кроме того, уровень депозиции препарата в дыхательных путях зависит от средства доставки. Например, новые бесфреоновые дозированные аэрозоли, содержащие гидрофторалкан (hydrofluoroalkane, HFA), доставляют в дыхательные пути примерно в два раза больше препарата по сравнению с традиционными аэрозолями, в которых использовался хлорфторуглерод (chlorfluorcarbon, CFC). Для перевода больных с одного препарата на другой используются таблицы эквипотентных (то есть оказывающих одинаковое лечебное действие) доз ГКС. В таблицах 1–3 представлены эквипотентные дозы ингаляционных ГКС для взрослых, детей и дозы суспензии будесонида для базисной терапии БА у детей разного возраста.
Нежелательные лекарственные реакции ингаляционных ГКС
Риск появления и выраженность нежелательных лекарственных реакций увеличиваются пропорционально дозе ГКС и продолжительности лечения. К числу нежелательных эффектов относят орофарингеальный кандидоз, изменение тембра голоса (дисфония), угнетение гипоталамо-гипофизарно-надпочечниковой системы (угнетение синтеза кортизола и острая надпочечниковая недостаточность при внезапной отмене ГКС), различные проявления синдрома Кушинга, снижение костной плотности (у взрослых), развитие катаракты (у пожилых) и глаукомы, появление капилляропатий и истончения кожного покрова.
После ингаляции значительная часть препарата остается в полости рта. Если больной не использует спейсер (применение этого устройства существенно снижает орофарингеальную депозицию ГКС) и не полощет рот после ингаляции, то часть дозы, которая задержалась в полости рта, проглатывается и может поступить в системный кровоток через желудочно-кишечный тракт (ЖКТ) (рис. 2) [25]. Кроме того, определенная часть препарата абсорбируется в капиллярах бронхов и альвеол и также поступает в системный кровоток.
Таким образом, безопасность препарата для больного зависит от целого ряда фармакокинетических параметров. В первую очередь речь идет о биодоступности в ЖКТ. В этом отношении наиболее безопасными средствами являются препараты с биодоступностью менее 1% (табл. 4) [26]: ФП, циклесонид и мометазона фуроат.
Кроме того, большое значение имеет поступление ГКС в кровь через легкие. Препараты, способные задерживаться в легких, благодаря образованию эфиров с жирными кислотами (будесонид и циклесонид) в меньшей степени проникают в системный кровоток [27]. Эстерификация ингаляционных ГКС обеспечивает более длительную депозицию препаратов в клетках бронхиального эпителия, в результате такие препараты, как будесонид и циклесонид, могут назначаться один раз в день при лечении больных с легким течением БА.
Кроме того, циклесонид является пролекарством, обладающим очень низкой ГКС-активностью. В тканях легких он метаболизируется до своего активного метаболита дезциклесонида, который примерно в 100 раз активнее исходного циклесонида. Поскольку активация циклесонида происходит в тканях респираторного тракта, а не в системном кровотоке, этот процесс значимо повышает безопасность терапии [28].
Существенное значение имеют такие показатели, как период полувыведения и системный клиренс: чем короче период полувыведения и выше системный клиренс – тем более безопасным представляется ингаляционный ГКС (табл. 4) [26].
Одним из наиболее безопасных ингаляционных ГКС является будесонид. Благодаря способности к эстерификации, короткому периоду полувыведения, высокому системному клиренсу этот препарат может назначаться у детей (с возраста 6 месяцев) и беременных, страдающих БА [29]. Будесонид секретируется в грудное молоко в ничтожных количествах. Это единственный ГКС, для которого была убедительно доказана безопасность применения при грудном вскармливании [30].
Препараты для небулайзерной терапии
В Российской Федерации в настоящее время доступны три ГКС-препарата для небулайзерной терапии: Пульмикорт суспензия (будесонид – оригинальный препарат), Буденид Стери-Неб (будесонид – генерический препарат) и Кленил УДВ (беклометазона дипропионат, БДП).
Несмотря на то что Пульмикорт суспензия и Буденид Стери-Неб содержат одно и то же действующее вещество (будесонид), эти препараты существенно отличаются по своим фармацевтическим свойствам и параметрам фармакокинетики. Во-первых, Пульмикорт суспензия содержит микронизированные (то есть дополнительно измельченные до размера 2–3 микрон) кристаллы будесонида, что обеспечивает оптимальное распределение препарата в дыхательных путях.
Во-вторых, плазменная пиковая концентрация Пульмикорта суспензии после ингаляции через небулайзер не превышает 2 нмоль/л (у Буденида Стери-Неб пиковая концентрация почти в 2 раза выше: 3,5 нмоль/л) (табл. 5) [31]. После ингаляций Пульмикорта и Буденида в системный кровоток поступает примерно одинаковое количество препарата (14–15% от дозы). Однако после ингаляций Пульмикорта суспензии будесонид быстрее поступает в кровь и быстрее выводится из организма: системный клиренс (способность организма полностью «очистить» определенный объем крови от препарата за единицу времени) у Пульмикорта суспензии в 2,4 раза выше, чем у Буденида. Следовательно, Пульмикорт более безопасен в отношении системных нежелательных эффектов, чем Буденид, так как риск нежелательных эффектов (например, подавление функции надпочечников) в первую очередь зависит от продолжительности циркуляции ГКС в плазме.
Благодаря более высокому профилю безопасности Пульмикорт можно назначать детям младшего возраста (с 6 месяцев, в то время как Буденид назначается с 12 месяцев). Кроме того, Пульмикорт – это единственный ингаляционный ГКС, который можно назначать беременным и кормящим женщинам.
В сравнении с Буденидом Пульмикорт имеет более широкие показания, включая терапию стенозирующего ларинготрахеита (ложный круп), что важно для оказания неотложной помощи в детской практике.
Режим дозирования Буденида Стери-Неб у взрослых предусматривает назначение препарата только в виде поддерживающей терапии до 4 мг/сут, в то время как терапия обострений БА требует применения более высоких доз ГКС. При назначении Пульмикорта имеется возможность применения препарата в дозах выше 4 мг/сут для купирования тяжелых обострений БА.
Таким образом, Пульмикорт суспензия отличается от Буденида Стери-Неб следующими параметрами:
- лучший профиль безопасности (выше системный клиренс);
- более широкие показания (включая ложный круп);
- возможность применения у детей с 6 месяцев, а также при беременности и лактации;
- возможность применения для терапии тяжелых обострений БА.
По сравнению с препаратами, содержащими будесонид, Кленил УДВ (действующее вещество беклометазона дипропионат) отличается узким профилем использования: препарат не одобрен для терапии тяжелых обострений БА, ХОБЛ, ложного крупа, противопоказан при беременности и лактации. У детей Кленил может применяться только с 6 лет.
Беклометазона дипропионат абсорбируется в системный кровоток более активно, чем будесонид. Значительная часть препарата, поступившего в кровь, представлена активным метаболитом БДП – будесонид-17-монопропионатом (Б-17-МП), который обладает в 25 раз более высокой ГКС-активностью, чем БДП. При этом системная биодоступность Б-17-МП достигает 62% [32].
Б-17-МП активно накапливается в тканях организма: объем распределения в тканях у Б-17-МП (424 л) существенно выше по сравнению с будесонидом (183 л). Приведенные данные позволяют считать Кленил существенно менее безопасным по сравнению с будесонидом.
В целом из имеющихся в России глюкокортикостероидов для небулайзерной терапии наиболее рациональным выбором для стационарной помощи и льготного лекарственного обеспечения амбулаторных больных представляется Пульмикорт суспензия, так как именно этот препарат обладает лучшим профилем безопасности и наиболее универсальными показаниями для терапии больных БА и ХОБЛ. Кроме того, это единственный ГКС, одобренный для терапии ложного крупа.
1 Альтернативный подход, который обычно используется у больных, перенесших обострение: начать лечение с высокой дозы и потом постепенно снижать дозу до минимального уровня, способного поддерживать контроль над астмой. Оба подхода (назначение высокой дозы с последующим снижением или назначение низкой дозы и повышение дозы по необходимости) демонстрируют одинаковый терапевтический эффект [16].
1. Barnes P.J. Corticosteroids: the drugs to beat // Eur. J. Pharmacol. 2006. Vol. 533. № 1–3. P. 2–14.
2. Bateman E.D., Hurd S.S., Barnes P.J. et al. Global strategy for asthma management and prevention: GINA executive summary // Eur. Respir. J. 2008. Vol. 31. № 1. P. 143–178.
3. Barnes P.J. Corticosteroid effects on cell signaling // Eur. Respir. J. 2006. Vol. 27. № 2. P. 413–426.
4. Laitinen L.A., Laitinen A., Haahtela T. A comparative study of the effects of an inhaled corticosteroid, budesonide, and a beta 2-agonist, terbutaline, on airway inflammation in newly diagnosed asthma: a randomized, double-blind, parallel-group controlled trial // J. Allergy Clin. Immunol. 1992. Vol. 90. № 1. P. 32–42.
5. Jackson D.J., Sykes A., Mallia P. et al. Asthma exacerbations: origin, effect, and prevention // J. Allergy Clin. Immunol. 2011. Vol. 128. № 6. P. 1165–1174.
6. Pauwels R.A., Löfdahl C.G., Postma D.S. et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma. Formoterol and Corticosteroids Establishing Therapy (FACET) International Study Group // N. Engl. J. Med. 1997. Vol. 337. № 20. P. 1405–1411.
7. Barnes P.J. Pharmacologic Principles // Murray and Nadel’s Textbook of Respiratory Medicine. 5th ed. Philadelphia: Saunders Elsevier, 2010. P. 159–199.
8. Payne A.S., Freishtat R.J. Conserved steroid hormone homology converges on nuclear factor κB to modulate inflammation in asthma // J. Investig. Med. 2012. Vol. 60. № 1. P. 13–17.
9. Rodrigo G.J. Rapid effects of inhaled corticosteroids in acute asthma: an evidence-based evaluation // Chest. 2006. Vol. 130. № 5. P. 1301–1311.
10. Chaudhuri R., Livingston E., McMahon A.D. et al. Cigarette smoking impairs the therapeutic response to oral corticosteroids in chronic asthma // Am. J. Respir. Crit. Care Med. 2003. Vol. 168. № 11. P. 1308–1311.
11. Ito K., Lim S., Caramori G. et al. Cigarette smoking reduces histone deacetylase 2 expression, enhances cytokine expression, and inhibits glucocorticoid actions in alveolar macrophages // FASEB J. 2001. Vol. 15. № 6. P. 1110–1112.
12. Barnes P.J., Adcock I.M., Ito K. Histone acetylation and deacetylation: importance in inflammatory lung diseases // Eur. Respir. J. 2005. Vol. 25. № 3. P. 552–563.
13. Horvath G., Wanner A. Inhaled corticosteroids: effects on the airway vasculature in bronchial asthma // Eur. Respir. J. 2006. Vol. 27. № 1. P. 172–187.
14. Kumar S.D., Brieva J.L., Danta I. et al. Transient effect of inhaled fluticasone on airway mucosal blood flow in subjects with and without asthma // Am. J. Respir. Crit. Care Med. 2000. Vol. 161. № 3. Pt 1. P. 918–921.
15. Engel T., Dirksen A., Heinig J.H. et al. Single-dose inhaled budesonide in subjects with chronic asthma // Allergy. 1991. Vol. 46. № 7. P. 547–553.
16. Powell H., Gibson P.G. High dose versus low dose inhaled corticosteroid as initial starting dose for asthma in adults and children // Cochrane Database Syst. Rev. 2004. № 2. CD004109.
17. O’Byrne P.M., Barnes P.J., Rodriguez-Roisin R. et al. Low dose inhaled budesonide and formoterol in mild persistent asthma: the OPTIMA randomized trial // Am. J. Respir. Crit. Care Med. 2001. Vol. 164. № 8. Pt 1. P. 1392–1397.
18. Holt S., Suder A., Weatherall M. et al. Dose-response relation of inhaled fluticasone propionate in adolescents and adults with asthma: meta- analysis // BMJ. 2001. Vol. 323. № 7307. P. 253.
19. Masoli M., Holt S., Weatherall M. et al. Dose-response relationship of inhaled budesonide in adult asthma: a meta-analysis // Eur. Respir. J. 2004. Vol. 23. № 4. P. 552–558.
20. Powell H., Gibson P.G. Inhaled corticosteroid doses in asthma: an evidence-based approach // Med. J. Aust. 2003. Vol. 178. № 5. P. 223–225.
21. Global strategy for asthma management and prevention (GINA) // www.ginasthma.org/local/uploads/files/GINA_Report_2012Feb13.pdf
22. Toogood J.H. Efficiency of inhaled versus oral steroid treatment of chronic asthma // N. Engl. Reg. Allergy Proc. 1987. Vol. 8. № 2. P. 98–103.
23. Advances in the Use of Inhaled Corticosteroids / Ed. by R. Ellul-Micallef, W.K. Lam, J.H. Toogood. Hong Kong: Excerpta Medica, 1987. P. 140–149.
24. Jackson V. Pulmicort. International Product Monograph. AstraZeneca Global, 2008.
25. Allen D.B., Bielory L., Derendorf H. et al. Inhaled corticosteroids: past lessons and future issues // J. Allergy Clin. Immunol. 2003. Vol. 112. № 3. Suppl. P. S1–S40.
26. Cerasoli F. Jr. Developing the ideal inhaled corticosteroid // Chest. 2006. Vol. 130. № 1. Suppl. P. 54S–64S.
27. Edsbäcker S., Brattsand R. Budesonide fatty-acid esterification: a novel mechanism prolonging binding to airway tissue. Review of available data // Ann. Allergy Asthma Immunol. 2002. Vol. 88. № 6. P. 609–616.
28. Nave R., Meyer W., Fuhst R. et al. Formation of fatty acid conjugates of ciclesonide active metabolite in the rat lung after 4-week inhalation of ciclesonide // Pulm. Pharmacol. Ther. 2005. Vol. 18. № 6. P. 390–396.
29. Nave R., Meyer W., Fuhst R. et al. Formation of fatty acid conjugates of ciclesonide active metabolite in the rat lung after 4-week inhalation of ciclesonide // Pulm. Pharmacol. Ther. 2005. Vol. 18. № 6. P. 390–396.
30. Fält A., Bengtsson T., Kennedy B.M. et al. Exposure of infants to budesonide through breast milk of asthmatic mothers // J. Allergy Clin. Immunol. 2007. Vol. 120. № 4. P. 798–802.
31. Инструкции по медицинскому применению препаратов Пульмикорт cуспензия, Буденид Стери-Неб, Кленил УДВ.
32. Daley-Yates P.T., Price A.C., Sisson J.R. et al. Beclomethasone dipropionate: absolute bioavailability, pharmacokinetics and metabolism following intravenous, oral, intranasal and inhaled administration in man // Br. J. Clin. Pharmacol. 2001. Vol. 51. № 5. P. 400–409.
33. Bisgaard H., Nikander K., Munch E. Comparative study of budesonide as a nebulized suspension vs pressurized metered-dose inhaler in adult asthmatics // Respir. Med. 1998. Vol. 92. № 1. P. 44–49.
Comparison of inhaled corticosteroids
V.V. Arkhipov, V.K. Prozorova, D.Ye. Arkhipova
State Budgetary Educational Institution for Higher Professional Education ‘I.M. Sechenov First Moscow State Medical University’ of the Ministry of Health of Russia, Department of Clinical Pharmacology and Introduction to Internal Medicine
Contact person: Vladimir Vladimirovich Arkhipov, arkhipov@gmx.us
Pharmacological properties of inhaled corticosteroids (ICS) are reviewed. Budesonide is an ICS with a very favourable safety profile due to marked esterification capacity, short half-life period and high systemic clearance. Pulmicort suspension (budesonide) is recommended as a drug of choice for nebulization therapy of asthma, chronic obstructive pulmonary disease (COPD) and catarrhal croup.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.