количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Терапия инфекций нижних мочевых путей: точка зрения клинического фармаколога
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №5
- Аннотация
- Статья
- Ссылки
На основании результатов клинических исследований, данных о низкой устойчивости кишечной палочки, а также учитывая высокую приемлемость и безопасность терапии, автор делает вывод о том, что средством первого ряда для лечения острого цистита в нашей стране является фосфомицин.
В статье обсуждаются критерии выбора антибактериальных препаратов при терапии острого цистита. Анализируются международные рекомендации и статистика по резистентности кишечной палочки как наиболее распространенного возбудителя острого цистита.
На основании результатов клинических исследований, данных о низкой устойчивости кишечной палочки, а также учитывая высокую приемлемость и безопасность терапии, автор делает вывод о том, что средством первого ряда для лечения острого цистита в нашей стране является фосфомицин.
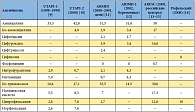
Таблица 1. Резистентность к антибиотикам штаммов E. coli, выделенных у больных с неосложненной инфекцией мочевыводящих путей (результаты российских исследований 1998–2008 гг.), %
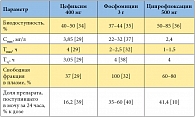
Таблица 2. Основные параметры фармакокинетики цефиксима, фосфомицина и ципрофлоксацина
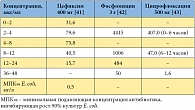
Таблица 3. Концентрации препаратов в моче после однократного назначения
Наиболее частым проявлением неосложненных инфекций мочевых путей является острый цистит. Высокая распространенность цистита среди женщин работоспособного возраста и беременных обусловливает медико-социальную значимость этого заболевания [1, 2]. Среди возбудителей острого цистита преобладает E. coli. Например, по данным ARESC (Antimicrobial Resistance Epidemiological Survey on Cystitis) [3], на долю E. coli приходится 76,3% случаев заболевания. Это обстоятельство значительно облегчает выбор эмпирической терапии, сводя его к тем препаратам, для которых в клинических исследованиях было доказана эффективность в отношении цистита, вызванного E. coli. Таких средств достаточно много. Например, пересмотренные в 2010 г. Рекомендации Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA) и Европейского общества по клинической микробиологии и инфекционным заболеваниям (European Society of Clinical Microbiology and Infectious Disease, ESCMID) [4] в качестве средств для терапии неосложненного цистита у женщин называют препараты пяти фармакологических классов.
Наиболее традиционным средством терапии цистита является нитрофурантоин. Несмотря на продолжительную историю применения, этот препарат до сих пор сохранил высокую эффективность, сопоставимую с эффективностью ципрофлоксацина и фосфомицина [5]. Однако это правомерно по отношению исключительно к макрокристаллическим формам нитрофурантоина, которые характеризуются медленным высвобождением и пролонгированным действием [6]. Макрокристаллический нитрофурантоин не только более эффективен, но и более безопасен по сравнению с обычным (ниже риск нежелательных явлений со стороны органов пищеварительного тракта) [7]. Именно поэтому макрокристаллический нитрофурантоин фигурирует в международных рекомендациях по лечению острого неосложненного цистита и пиелонефрита [4]. К сожалению, макрокристаллический нитрофурантоин недоступен для больных в РФ [8]. Сульфаметоксазол/триметоприм применяется для терапии цистита в ряде западных стран, где все еще сохраняется низкий уровень резистентности E. coli к этому препарату. Однако в нашей стране устойчивость штаммов кишечной палочки, выделенных у больных с неосложненной мочевой инфекцией, к ко-тримоксазолу достигает 30–35%, что делает препарат клинически неэффективным (табл. 1) [9–16].
Из числа фторхинолонов для терапии острого цистита применяются ципрофлоксацин, офлоксацин и левофлоксацин. С одной стороны, эти препараты высокоэффективны в терапии цистита [17]. С другой стороны, резистентность к фторхинолонам растет как в Западной Европе, так и в нашей стране, где доля устойчивых к ципрофлоксацину штаммов достигает 10–12,6% (табл. 1). Кроме того, всем препаратам этой группы присущи серьезные побочные эффекты [18]. Применение фторхинолонов противопоказано при беременности и лактации. В этой связи эксперты Американского общества инфекционных болезней и Европейского общества по клинической микробиологии и инфекционным заболеваниям считают, что эту группу антибиотиков целесообразно зарезервировать для терапии более серьезных урологических инфекций [4].
Бета-лактамные антибиотики (защищенные пенициллины и пероральные цефалоспорины 1–3-го поколения) могут применяться для терапии острого цистита в виде курсов от 3 до 7 дней. В рекомендациях Американского общества инфекционных болезней и Европейского общества по клинической микробиологии и инфекционным заболеваниям подчеркивается, что эти антибиотики следует применять в тех случаях, когда не могут быть использованы основные схемы лечения. По сравнению с препаратами других групп бета-лактамные антибиотики менее эффективны и чаще вызывают нежелательные лекарственные реакции. Например, в ряде исследований клиническая эффективность бета-лактамов оказалась существенно ниже по сравнению с эффективностью фторхинолонов [19, 20]. Именно поэтому при неосложненных циститах бета-лактамы рекомендуется назначать с осторожностью [4]. На сегодняшний день ампициллин и амоксициллин полностью исключены из современных рекомендаций по терапии острого цистита из-за высокой устойчивости E. coli (в РФ – более половины штаммов, табл. 1). В ряде стран имеется положительный опыт лечения острого цистита пивмециллином, бета-лактамным антибиотиком, который пока недоступен в РФ [8].
Фосфомицин (Монурал) – единственный препарат, который для терапии острого цистита можно назначать однократно за весь период лечения [21]. По своей эффективности однократное назначение фосфомицина не уступает стандартному семидневному курсу нитрофурантоина [22]. Метаанализ 7 сравнительных исследований фосфомицина со стандартными многодневными курсами фторхинолонов выявил у этих препаратов примерно одинаковую эффективность [20]. Имеется всего одно сравнительное исследование фосфомицина с бета-лактамами, в котором однократный прием 3 г фосфомицина сравнивался с пятидневным курсом цефалексина по 500 мг 4 р/сут. Эффективность обоих препаратов оказалась практически эквивалентной [23]. Опираясь на эти данные, новое (2010 г.) Руководство Европейской ассоциации урологов (European Association of Urology, EAU) [24] назвало фосфомицин препаратом выбора для терапии цистита.
Целый ряд исследований продемонстрировал высокую эффективность фосфомицина в отношении возбудителей, устойчивых к ряду других антибактериальных препаратов, включая штаммы E. coli, устойчивые к фторхинолонам, ванкомицин-резистентным энтерококкам, метициллин-устойчивым штаммам S. aureus и грамнегативным микроорганизмам, продуцирующим бета-лактамазы расширенного спектра [25, 26]. In vitro была доказана эффективность фосфомицина в отношении биопленок, образованных устойчивыми к антибиотикам микроорганизмами [27]. В последние годы в РФ устойчивость к фосфомицину возбудителей острого цистита всегда оставалась на уровне менее 1% (табл. 1). По мнению авторов «Международного руководства по лечению острого неосложненного цистита и пиелонефрита у женщин» [4], выбор препарата для терапии больных острым циститом должен учитывать ряд факторов:
- наличие лекарственной аллергии;
- ранее продемонстрированная приверженность пациента к лечению;
- локальные данные об устойчивости возбудителей к антибиотикам;
- доступность и стоимость препаратов.
Комментируя критерии выбора, следует сделать несколько замечаний. Во-первых, наиболее опасными в плане риска аллергических реакций являются бета-лактамные препараты [28]. Во-вторых, в целом ряде исследований больные в целом демонстрируют крайне низкую приверженность к терапии. Например, метаанализ данных 76 клинических исследований показал, что при назначении препарата один раз в день приверженность терапии составляет 79%, при дозировании дважды в день – снижается до 69%, при необходимости приема три раза в сутки – составляет всего 65% [29]. По другим данным, доля пациентов, согласных следовать предписаниям врача, среди больных, принимающих препарат один раз в день, составляет 73%, а при назначении три и четыре раза в день – 52% и 42% соответственно [30]. При назначении антибиотиков более длительными курсами приверженность терапии существенно снижается [31]. В этом плане возможность назначения фосфомицина один раз за весь период лечения представляется существенным преимуществом по сравнению с любыми альтернативными подходами к лечению.
Минимальный уровень устойчивости к E. coli – основному возбудителю острого цистита – в РФ отмечается для фосфомицина, нитрофурантоина и цефиксима. Ципрофлоксацин значительно уступает этим препаратам, так как по отношению к нему устойчивость E. coli на порядок выше (табл. 1). К сожалению, отечественные специалисты не располагают макрокристаллическим нитрофурантоином, который многие годы является стандартом лечения острого цистита в США и других западных странах. Таким образом, выбор антибиотика для терапии цистита должен проводиться, прежде всего, между фосфомицином и ципрофлоксацином. Учитывая низкий уровень устойчивости, также можно рассматривать возможность терапии цефиксимом. В отношении удобства приема среди перечисленных средств неоспоримыми преимуществами обладает фосфомицин, который назначается однократно за весь период лечения. Цефиксим применяется один раз в день. Ципрофлоксацин при остром цистите может назначаться один раз в день, но только в виде таблеток с пролонгированным действием [32], в то время как большинство препаратов ципрофлоксацина на отечественном рынке рассчитаны на прием дважды в день.
В клинических исследованиях фосфомицин не отличался по эффективности от фторхинолонов и цефалексина [20, 23], прямых сравнительных исследований фосфомицина с цефиксимом пока нет. В свою очередь, применение цефиксима при неосложненной инфекции мочевых путей продемонстрировало более высокую клиническую и микробиологическую эффективность, чем терапия ципрофлоксацином [33]. Однако фосфомицин существенно отличается от ципрофлоксацина и цефиксима параметрами фармакокинетики (табл. 2) [10, 29, 32, 34–40]. В частности, фосфомицин не связывается с белками плазмы и благодаря этому более активно секретируется в мочу (до 60% от принятой дозы за первые 24 часа после приема). Концентрация фосфомицина в моче после однократного приема на два порядка выше, чем концентрации ципрофлоксацина и цефиксима (табл. 3) [41–43]. При этом пиковая концентрация фосфомицина в моче в 440 раз выше по сравнению с минимальной подавляющей концентрацией (МПК) для E. coli. Кроме того, после однократного приема концентрация фосфомицина в моче превышает МПК для E. coli в течение примерно 80 часов [37].
Таким образом, по способности длительно поддерживать высокую концентрацию в моче фосфомицин существенно опережает и ципрофлоксацин, и цефиксим. Благодаря этому создается возможность назначать препарат однократно за весь курс лечения. С другой стороны, избыточно высокий для большинства штаммов уровень концентрации этого антибиотика позволяет ему оказывать бактерицидное действие на резистентные штаммы и биопленки, что может иметь значение для предотвращения риска рецидивов [21, 41]. Таким образом, на сегодняшний день фосфомицин остается одним из самых надежных, эффективных и удобных для больных препаратов терапии острого цистита. Фосфомицин хорошо переносится, безопасен при беременности [44] и у детей. Все сказанное позволяет считать фосфомицин средством первого ряда для терапии острого цистита в нашей стране.
1. Лоран О.Б. Хронический цистит у женщин // Врач. 1996. № 8. С. 6–9.
2. Аляев Ю.Г., Винаров А.З., Воскобойников В.Б. Острый цистит: этиология, клиника, лечение // Лечащий врач. 2002. № 4. С. 61–63.
3. Schito G.C., Naber K.G., Botto H. et al. The ARESC study: an international survey on the antimicrobial resistance of pathogens involved in uncomplicated urinary tract infections // Int. J. Antimicrob. Agents. 2009. Vol. 34. № 5. P. 407–413.
4. Gupta K., Hooton T.M., Naber K.G. et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases // Clin. Infect. Dis. 2011. Vol. 52. № 5. P. 103–120.
5. Huang E.S., Stafford R.S. National patterns in the treatment of urinary tract infections in women by ambulatory care physicians // Arch. Intern. Med. 2002. Vol. 162. № 1. P. 41–47.
6. Kalowski S., Radford N., Kincaid-Smith P. Crystalline and macrocrystalline nitrofurantoin in the treatment of urinary-tract infection // N. Engl. J. Med. 1974. Vol. 290. № 7. P. 385–387.
7. Parsons C.L. Protocol for treatment of typical urinary tract infection: criteria for antimicrobial selection // Urology. 1988. Vol. 32. № 2. Suppl. P. 22–27.
8. База данных «Обращение лекарственных средств» // www.regmed.ru.
9. Лопаткин Н.А., Деревянко И.И., Страчунский Л.С. и др. Антибактериальная терапия острого цистита и пиелонефрита у взрослых // Антибиотики и химиотерапия. 2000. № 4. С. 30–34.
10. Рафальский В.В., Ахметова Л.И., Бабкин П.А. и др. Чувствительность к пероральным антибиотикам штаммов E. coli у пациентов с внебольничными неосложненными инфекциями мочевыводящих путей (НИМП) // Клиническая микробиология и антимикробная химиотерапия. 2001. № 3. Прилож. 1. Тез. 68.
11. Stratchounski L., Shevelev A., Korovina N. et al. Resistance of E. coli isolated from children with community-acquired urinary tract infections (CAUTIs) in Russia: Results of multicenter study “ARMID”. Proceedings of 42nd Interscience Conference on Antimicrobial Agents and Chemotherapy (27–30 September, 2002, San Diego, CA, USA). P. 253.
12. Рафальский В.В., Кулаков В.И., Анкирская А.С. и др. Антибактериальная терапия инфекций мочевыводящих путей у беременных // Клиническая микробиология и антимикробная химиотерапия. 2004. № 3. С. 218–224.
13. Cagnacci S., Gualco L., Debbia E. et al. European emergence of ciprofloxacin-resistant Escherichia coli clonal groups O25:H4-ST 131 and O15:K52:H1 causing community-acquired uncomplicated cystitis // J. Clin. Microbiol. 2008. Vol. 46. № 8. P. 2605–2612.
14. Naber K.G., Schito G., Botto H. et al. Surveillance study in Europe and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology in Females with Cystitis (ARESC): implications for empiric therapy // Eur. Urol. 2008. Vol. 54. № 5. P. 1164–1175.
15. Schito G.C., Naber K.G., Botto H. et al. The ARESC study: an international survey on the antimicrobial resistance of pathogens involved in uncomplicated urinary tract infections // Int. J. Antimicrob. Agents. 2009. Vol. 34. № 5. P. 407–413.
16. Рафальский В.В., Белокрысенко С.С., Малев И.В. и др. Чувствительность возбудителей инфекций мочевыводящих путей, выделенных в Российской Федерации, к пероральному цефлоспорину III поколения цефиксиму // Лечащий врач. 2008. № 8. C. 27–29.
17. Rafalsky V., Andreeva I., Rjabkova E. Quinolones for uncomplicated acute cystitis in women // Cochrane Database Syst. Rev. 2006. Vol. 19. № 3. CD003597.
18. Liu H.H. Safety profile of the fluoroquinolones: focus on levofloxacin // Drug Saf. 2010. Vol. 33. № 5. P. 353–369.
19. Hooton T.M., Scholes D., Gupta K. et al. Amoxicillin-clavulanate vs ciprofloxacin for the treatment of uncomplicated cystitis in women: a randomized trial // JAMA. 2005. Vol. 293. № 8. P. 949–955.
20. Falagas M.E., Vouloumanou E.K., Togias A.G. et al. Fosfomycin versus other antibiotics for the treatment of cystitis: a meta-analysis of randomized controlled trials // J. Antimicrob. Chemother. 2010. Vol. 65. № 9. P. 1862–1877.
21. Michalopoulos A.S., Livaditis I.G., Gougoutas V. The revival of fosfomycin // Int. J. Infect. Dis. 2011. Vol. 15. № 11. P. e732–739.
22. Stein G.E. Comparison of single-dose fosfomycin and a 7-day course of nitrofurantoin in female patients with uncomplicated urinary tract infection // Clin. Ther. 1999. Vol. 21. № 11. P. 1864–1872.
23. Elhanan G., Tabenkin H., Yahalom R. et al. Single-dose fosfomycin trometamol versus 5-day cephalexin regimen for treatment of uncomplicated lower urinary tract infections in women // Antimicrob. Agents Chemother. 1994. Vol. 38. № 11. P. 2612–2614.
24. Grabe M., Bishop M.C., Bjerklund-Johansen T.E. et al. Guidelines on urological infections // EAU. Guidelines edition presented at the 25th EAU Annual Congress, Barcelona 2010.
25. Popovic M., Steinort D., Pillai S., Joukhadar C. Fosfomycin: an old, new friend? // Eur. J. Clin. Microbiol. Infect. Dis. 2010. Vol. 29. № 2. P. 127–142.
26. Rodriguez-Bano J., Alcala J.C., Cisneros J.M. et al. Community infections caused by extended-spectrum beta-lactamase-producing Escherichia coli // Arch. Intern. Med. 2008. Vol. 168. № 17. P. 1897–1802.
27. Tang H.J., Chen C.C., Cheng K.C. et al. In vitro efficacy of fosfomycin-containing regimens against methicillin-resistant Staphylococcus aureus in biofilms // J. Antimicrob. Chemother. 2012. Vol. 67. № 4. P. 944–950.
28. Thong B.Y., Tan T.C. Epidemiology and risk factors for drug allergy // Br. J. Clin. Pharmacol. 2011. Vol. 71. № 5. P. 684–700.
29. Claxton A.J., Cramer J., Pierce C. A systematic review of the associations between dose regimens and medication compliance // Clin. Ther. 2001. Vol. 23. № 8. P. 1296–1310.
30. Greenberg R.N. Overview of patient compliance with medication dosing: a literature review // Clin. Ther. 1984. Vol. 6. № 5. P. 592–599.
31. Синопальников А.И., Зайцев А.А. Антибактериальная терапия инфекций дыхательных путей с позиции комплаентности пациентов // Фарматека. 2009. № 5. C. 12–20.
32. Fourcroy J.L., Berner B., Chiang Y.K. et al. Efficacy and safety of a novel once-daily extended-release ciprofloxacin tablet formulation for treatment of uncomplicated urinary tract infection in women // Antimicrob. Agents Chemother. 2005. Vol. 49. № 10. P. 4137–4143.
33. Рафальский В.В., Довгань Е.В., Деревицкий А.В. Цефиксим: клиническая фармакология и место в терапии инфекций урогенитального тракта // Урология. 2011. № 2. С. 63–66.
34. Brittain D.C., Scully B.E., Hirose T., Neu Н.С. The pharmacokinetic and bactericidal characteristics of oral cefixime // Clin. Pharmacol. Ther. 1985. Vol. 38. № 5. P. 590–594.
35. Bergan T. Pharmacokinetic comparison between fosfomycin and other phosphonic acid derivatives // Chemotherapy. 1990. Vol. 36. Suppl. 1. P. 10–18.
36. Davis R., Markham A., Balfour J.A. Ciprofloxacin. An updated review of its pharmacology, therapeutic efficacy and tolerability // Drugs. 1996. Vol. 51. № 6. P. 1019–1074.
37. Patel S.S., Balfour J.A., Bryson H.M. Fosfomycin tromethamine. A review of its antibacterial activity, pharmacokinetic properties and therapeutic efficacy as a single dose oral treatment for acute uncomplicated lower urinary tract infections // Drugs. 1997. Vol. 53. № 4. P. 637–656.
38. Bergan T., Thorsteinsson S.B., Albini E. Pharmacokinetic profile of fosfomycin trometamol // Chemotherapy. 1993. Vol. 39. № 5. P. 297–301.
39. Guay D.R., Meatherall R.C., Harding G.K., Brown G.R. Pharmacokinetics of cefixime (CL 284,635; FK 027) in healthy subjects and patients with renal insufficiency // Antimicrob. Agents Chemother. 1986. Vol. 30. № 3. P. 485–490.
40. Bergan T. Pharmacokinetic comparison between fosfomycin and other phosphonic acid derivatives // Chemotherapy. 1990. Vol. 36. Suppl. 1. P. 10–18.
41. Roussos N., Karageorgopoulos D.E., Samonis G., Falagas M.E. Clinical significance of the pharmacokinetic and pharmacodynamic characteristics of fosfomycin for the treatment of patients with systemic infections // Int. J. Antimicrob. Agents. 2009. Vol. 34. № 6. P. 506–515.
42. Pharmacokinetics of fosfomycin and influence of cimetidine and metoclopramide on the bioavailability of fosfomycin trometamol // New Trends in Urinary Tract Infections / Ed. by H.C. Neu, J.D. Williams. Basel: Karger, 1988. P. 157–166.
43. Wagenlehner F.M., Wydra S., Onda H. et al. Concentrations in plasma, urinary excretion, and bactericidal activity of linezolid (600 milligrams) versus those of ciprofloxacin (500 milligrams) in healthy volunteers receiving a single oral dose // Antimicrob. Agents Chemother. 2003. Vol. 47. № 12. P. 3789–3794.
44. Reeves D.S. Treatment of bacteriuria in pregnancy with single dose fosfomycin trometamol: a review // Infection. 1992. Vol. 20. Suppl. 4. P. S313–316.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.