Тиоктовая кислота: новый подход к лечению диабетической нефропатии
- Аннотация
- Статья
- Ссылки



Диабетическая нефропатия характеризуется наличием стойкой протеинурии (более 0,5 г/сут) в сочетании с диабетической ретинопатией и повышением артериального давления (АД) и приводит к снижению клубочковой фильтрации и развитию почечной недостаточности. Длительное время ДН течет бессимптомно и выявляется на поздних стадиях заболевания. В этой связи основными задачами врача являются своевременная диагностика ДН и проведение адекватного этиологического и патогенетического лечения.
Патогенез диабетической нефропатии
До сегодняшнего дня патогенез ДН остается не до конца изученным. В развитии ДН участвуют как метаболические, так и сосудистые факторы. Согласно современным представлениям, в формировании осложнений СД ведущую роль играет блокада гексозоаминового пути утилизации глюкозы с накоплением промежуточных продуктов обмена глюкозы, в частности глюкозо-6-фосфата. Повышение концентрации промежуточных продуктов обмена запускает активацию протеинкиназы С и образование большого числа конечных продуктов гликирования белков (AGEs), что приводит к нарушению эндотелий-зависимых реакций и функций клеток. Причиной блокады обмена глюкозы является активизация специальных полимераз (PARP), возникающая в ответ на разрушение митохондриальной ДНК супероксиданион-радикалом. Таким образом, ведущее значение в патогенезе осложнений СД имеет оксидативный стресс, который развивается вследствие образования большого числа свободных радикалов на фоне недостаточности собственной антиоксидантной системы организма [4].
При ДН наблюдается усиление синтеза мезангиальными клетками таких компонентов мезангия, как коллаген 4 типа, ламинин, фибронектин, накопление которых в почечных клубочках является важным механизмом формирования гломерулопатии. Кроме того, нарушение функции клеток клубочков приводит к количественным и качественным изменениям гликопротеинов и протеогликанов базальной мембраны клубочков.
Ведущим сосудистым фактором прогрессирования ДН является повышение системного артериального давления. Было также показано, что нарушение циркадного ритма АД (недостаточный уровень его физиологического снижения в ночные часы) является патофизиологической особенностью больных СД, имеющих альбуминурию и/или диабетическую автономную нейропатию. Оказалось, что по мере роста экскреции альбумина с мочой наблюдается ступенчатое повышение отношения ночного диастолического АД к дневному. Полученные данные могут свидетельствовать о роли диабетической автономной нейропатии в патогенезе диабетической нефропатии. Предполагается, что автономная нейропатия лежит в основе нарушения нормального циркадного ритма АД, а в условиях характерной для СД внутрипочечной вазодилатации повышение уровня АД в ночное время способствует усилению альбуминурии. Кроме того, было показано, что на ранней стадии ДН экскреция альбумина значимо коррелирует с показателями ночного АД: чем больше нарушения циркадного ритма, то есть чем менее выражено снижение АД в ночные часы, тем значительнее альбуминурия, даже если она остается в пределах нормального диапазона [8].
Клинические проявления диабетической нефропатии
Первым симптомом ДН является микроальбуминурия (МАУ). При МАУ диапазон экскреции альбумина с мочой составляет от 30 до 300 мг/сутки (или от 20 до 200 мкг/мин). Появление у больного сахарным диабетом постоянной МАУ свидетельствует о скором развитии (в течение ближайших 5–7 лет) диабетической нефропатии. К факторам риска МАУ относятся: плохой гликемический контроль (HbA1c > 8,1%); начальный уровень альбуминурии; увеличение скорости клубочковой фильтрации; артериальная гипертензия; курение; генетическая предрасположенность [7]. В развитии ДН при СД 1 типа различают несколько клинических стадий (по C.E. Mogensen):
- клубочковая гиперфильтрация и гипертрофия почек: нормоальбуминурия (< 30 мг/сут), увеличение скорости клубочковой фильтрации (СКФ) (> 140 мл/мин), увеличение почечного кровотока;
- стадия начальных структурных изменений ткани почек: нормоальбуминурия (микроальбуминурия при физической нагрузке может быть единственным клиническим проявлением данной стадии), утолщение базальных мембран капилляров клубочков, расширение мезангия, сохраняется высокая СКФ;
- начальная стадия диабетической нефропатии (стадия микроальбуминурии): микроальбуминурия (от 30 до 300 мг/сут), СКФ высокая или нормальная, нестойкое повышение АД;
- выраженная диабетическая нефропатия (стадия макроальбуминурии): микроальбуминурия сменяется макроальбуминурией (более 500 мг/сут), снижение СКФ (< 10 мл/мин), нефротический синдром;
- конечная стадия с развитием почечной недостаточности: снижение СКФ (< 10 мл/мин), нефротический синдром, уремия [7].
Для более раннего выявления диабетической нефропатии у пациентов с СД рекомендуется проводить исследование мочи на наличие микроальбуминурии не реже 1 раза в год после 5 лет от начала заболевания (при дебюте СД после пубертатного периода). При выявлении микроальбуминурии необходимо исключить другие возможные причины протеинурии, такие как кратковременная гипергликемия, инфекции мочевыводящих путей, выраженная артериальная гипертензия, сердечная недостаточность и резкое повышение температуры тела [7].
Лечение диабетической нефропатии
Оптимальный контроль уровня глюкозы в крови является ключевым фактором в предотвращении всех осложнений СД, в том числе и ДН. Показано, что интенсивная терапия сахароснижающими препаратами приводит к снижению риска развития микроальбуминурии на 39% [7]. Следующим мероприятием, препятствующим прогрессированию ДН, является контроль АД. Считается, что ключевым фактором прогрессирования ДН является активация ренин-ангиотензин-альдостероновой системы. Назначение ингибиторов АПФ замедляет падение клубочковой фильтрации у пациентов с СД [9]. Именно поэтому ингибиторы АПФ являются препаратами выбора при ДН.
При повышении уровня общего холестерина более 6,5 ммоль/л (норма до 5,2 ммоль/л) и триглицеридов в крови более 2,2 ммоль/л (норма до 1,7 ммоль/л) рекомендуется назначение гиполипидемических лекарственных средств. Наряду с этим применяют препараты, которые способствуют улучшению функции клеток эндотелия, снижают гиперфильтрацию и уменьшают влияние других факторов прогрессирования ДН. Учитывая патогенетические механизмы развития ДН, в лечении пациентов используют антиоксиданты, которые уменьшают выраженность оксидативного стресса, снижая содержание свободных радикалов в плазме крови и цитоплазме клеток, улучшают реологические свойства крови и нормализуют эндотелий-зависимые реакции сосудистой стенки.
Одним из таких препаратов является альфа-липоевая (тиоктовая) кислота. Это уникальный препарат, который воздействует сразу на несколько звеньев патогенеза при формировании осложнений СД. Альфа-липоевая кислота (АЛК) является мощным естественным жирорастворимым антиоксидантом. Ее способность нейтрализовать свободные радикалы многократно подтверждена в экспериментальных и клинических исследованиях. Показано, что введение АЛК предотвращает повреждение ДНК синглетным кислородом путем увеличения концентрации глютатиона, а также генерацией других антиокcидантов – аскорбата и витамина Е; способствует улучшению нарушенного эндоневрального кровотока, снижению концентрации продуктов перекисного окисления, улучшению функции эндотелия и восстановлению NO-зависимой вазодилатации, ингибирует активность универсального фактора транскрипции Nf-kB, контролирующего экспрессию генов иммунного ответа, апоптоза и клеточного цикла; повышает хелатирующий эффект многих микроэлементов, участвующих в метаболизме нервного волокна; приводит к снижению скорости гликозилирования белков эндотелия, улучшению эндоневральной перфузии и снижению ишемии нервных волокон [1, 4].
Одним из препаратов тиоктовой кислоты является оригинальный препарат Тиоктацид (производство компании «МЕДА Фармасьютикалс Швейцария ГмбХ»). Высокая эффективность и хорошая переносимость Тиоктацида при диабетической полинейропатии (ДПН) уже давно подтверждены многими клиническими рандомизированными плацебоконтролируемыми исследованиями. Исследование ALADIN-1 (Alfa-Lipoic Acid in Diabetic Neuropathy) стало первым двойным слепым плацебоконтролируемым исследованием, подтвердившим эффективность назначения Тиоктацида у пациентов с диабетической полинейропатией. Произвольно разделенные на четыре группы, пациенты получали 100 мг, 600 мг или 1200 мг Thioctacid® T или плацебо в виде ежедневных 30-минутных инфузий 5 дней в неделю в течение 3 недель.
Интенсивность и частота невропатических симптомов, таких как боли, жжение, парестезии и онемение, оценивались с помощью шкалы невропатических симптомов TSS (Total Symptom Score). По результатам исследования ALADIN-1, доза 600 мг была признана оптимальной по соотношению польза/риск: частота побочных эффектов соответствовала уровню плацебо, а эффективность практически соответствовала дозе 1200 мг. Однако при более высокой дозе чаще наблюдались такие нежелательные реакции, как тошнота, рвота и головные боли. По результатам исследования SYDNEY-1 (Symptomatic Diabetic NEuropathY Trial), у пациентов с диабетической полинейропатией, получавших Тиоктацид внутривенно, отмечалось не только достоверное уменьшение выраженности невропатических симптомов (боли, онемение, жжение и парестезии), но и снижение чувствительных и двигательных симптомов по результатам неврологического осмотра [4, 10, 11].
Эффективность Тиоктацида при дисциркуляторной энцефалопатии (ДЭ) в уменьшении выраженности неврологических проявлений была изучена (с проведением фармакоэкономического анализа) Е.И. Чукановой. ДЭ отмечается у 60–70% больных СД, существенно ограничивая жизнедеятельность и негативно влияя на качество жизни пациентов [3]. Результаты исследования показали, что терапия Тиоктацидом предпочтительна с экономической точки зрения по сравнению с лечением пациентов контрольной группы, получавших гипотензивную и антитромботическую терапию, что связано с высокой эффективностью терапии Тиоктацидом в снижении риска возникновения транзиторных ишемических атак, инсультов и прогрессирования ДЭ [5].
Сравнительное исследование эффективности стандартного лечения и Тиоктацида у больных СД 1 типа с микроальбуминурией
Исходя из свойств АЛК и полученных результатов ее применения при ДПН и ДЭ, мы решили изучить влияние АЛК на различные процессы, наблюдаемые при прогрессировании ДН. Были сформулированы следующие цели исследования: 1) выявление клинико-патогенетического значения изменения уровня метаболитов оксида азота в мембранах тромбоцитов и активности фермента ксантиноксидазы (КСО) в сыворотке крови у больных СД 1 типа и ДН на стадии микроальбуминурии; 2) выявление взаимосвязи оксидативного стресса в тромбоцитах с изменением их коагулоактивности; 3) выявление возможного влияния АЛК на изучаемые процессы.
Нами были обследованы 60 больных СД 1 типа с микроальбуминурией, из них основная группа (30 больных) получала стандартное лечение (гипогликемическая терапия, ингибиторы АПФ) и АЛК (Тиоктацид, «МЕДА Фармасьютикалс Швейцария ГмбХ»). Тиоктацид вводили внутривенно капельно в дозе 600 мг в 200 мл физиологического раствора через 2 часа после завтрака в течение 10 дней, только в рабочие дни. В выходные дни больные получали Тиоктацид в таблетках в дозе 600 мг за 30 минут до еды. После окончания внутривенных инфузий пациенты получали препарат в таблетках в дозе 600 мг 1 раз в день утром до еды в течение 30 дней. Группу сравнения составили 30 больных СД 1 типа с микроальбуминурией и аналогичными группе сравнения клиническими показателями, получавших только стандартное лечение инсулином и ингибиторами АПФ.
Сравниваемые группы были сопоставимы по полу, возрасту, продолжительности СД и суточной потребности в инсулине. Материалы и методы. Для оценки компенсации СД наряду с общепринятыми тестами проводилось определение уровня гликированного гемоглобина (HbA1c) (анализатор NycoCard, ридер 11). Количественная оценка уровня МАУ определялась методом твердофазного иммунометрического анализа сэндвичевого типа (аппарат NycoCard, ридер 11). Для оценки тромбоцитарного звена гемостаза использовали фотометрический метод (лазерный агрегометр «Биола»), оценивая динамику изменений светопропускания плазмы (Born, 1962; O’Brien, 1962) и динамику изменения размеров агрегатов (З.А. Габбасов и др., 1989). Число тромбоцитов определяли по методу З.А. Габбасова. Как индуктор агрегации применяли АДФ в концентрации 105 мкМ. В качестве индуктора для определения фактора Виллебранда использовали ристомицин в разведении 15 мг и 0,5 мл растворителя («Технология-Стандарт», г. Барнаул). Для оценки коагуляционного гемостаза использовались активированное время рекальцификации (АВР), активированное частичное тромбопластиновое время (АЧТВ), антитромбиновая активность (АА).
Исследование конечного этапа свертывания крови и фибринолитическое звено системы гемостаза изучались по уровню фибриногена в плазме (В.П. Балуда, 1980) с использованием реактивов («Технология-Стандарт», г. Барнаул) на полуавтомате «Тромбостат-2». Тромбоциты для определения содержания NО2 выделяли по методу К.В. Чурина и соавт. (1996) с использованием среды, содержащей сывороточный альбумин. Ввиду того, что прямое измерение содержания NO фактически невозможно из-за быстрой конверсии данного радикала в нитраты и нитриты под действием активного О2, продукцию NO оценивали косвенным методом по содержанию нитритов (NО2) во взвеси тромбоцитов, выделенную из 5 мл цельной крови, взятой с гепарином, с помощью реактива Грисса – по методу В.Б. Карпюка (2000). Результаты выражали в нмоль/мл. Определение активности фермента ксантиноксидазы (КСО), обладающего выраженным прооксидантным действием, выполняли по методу М. Дьячиной и соавт. (1973). Расчет активности КСО производили по отношению к содержанию общего белка плазмы. Активность фермента в плазме крови выражали в нмольм/л/мин.
Полученные данные подвергли математической обработке методом вариационной статистики. Достоверность выявляемых различий определяли по методу Фишера – Стьюдента, за достоверные принимали различия при значениях р < 0,05. Известно, что одновременное назначение Тиоктацида и инсулина, а также пероральных гипогликемических препаратов усиливает гипогликемическое действие последних, что в некоторых случаях требует коррекции сахароснижающей терапии. На фоне внутривенного введения Тиоктацида гипогликемический эффект наблюдался и в исследованной нами группе (табл. 1).
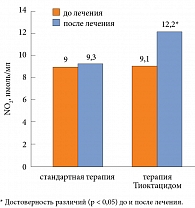
Как следует из данных таблицы 1, у больных СД 1 типа с МАУ на фоне терапии Тиоктацидом отмечена не только достоверная тенденция к снижению содержания HbA1c, уровня базальной и постпрандиальной гликемии, но и снижение показателя МАУ. Из полученных данных видно, что применение Тиоктацида оказывает положительное влияние на состояние углеводного обмена в обследуемой группе. Нарушения функции сосудистого эндотелия связаны с изменением содержания эндотелинов, фактора Виллебранда, тканевого активатора плазминогена и оксида азота (NO). Мы проанализировали динамику уровня NO2 у пациентов с СД 1 типа с МАУ на фоне назначения Тиоктацида в тромбоцитах – клетках, активно участвующих в системе гемостаза и играющих ведущую роль в развитии сосудистых осложнений у больных СД (рис. 1).
Как видно из представленных на рисунке 1 данных, у пациентов с СД 1 типа с МАУ на фоне терапии Тиоктацидом имело место достоверное повышение уровня NO2 в клеточных мембранах тромбоцитов по сравнению с пациентами, получавшими стандартную терапию. Таким образом, применение Тиоктацида при ДН благоприятно влияет на эндотелий сосудов, так как считается, что наиболее ранние нарушения эндотелиальной функции связаны преимущественно со снижением синтеза, высвобождения и/или эффектов NO.
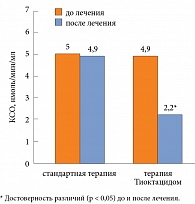
Ксантиноксидаза (КСО) рассматривается как один из наиболее важных ферментов, являющихся главной системой генерирования активных форм кислорода. Установлено, что индукция активности КСО протекает во всех случаях одновременно с индукцией активности синтазы NO. При сравнении влияния Тиоктацида на активность фермента КСО у пациентов с СД 1 типа и МАУ показано, что активность фермента КСО достоверно уменьшается в группе, получавшей Тиоктацид, по сравнению с группой сравнения (рис. 2), что еще раз свидетельствует о положительном влиянии антиоксиданта Тиоктацида на состояние тромбоцитов и целесообразности применения данного препарата в лечении ранних стадий ДН. Положительный эффект назначения Тиоктацида мы наблюдали и при исследовании функциональной способности тромбоцитов у пациентов с СД 1 типа с ДН на стадии МАУ. Представленные в таблице 2 данные свидетельствуют о заметном влиянии препарата на тромбоцитарный компонент гемостаза.
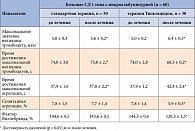
На фоне увеличения общего количества тромбоцитов у пациентов с СД 1 типа с МАУ при назначении Тиоктацида достоверно повышается АДФ-индуцированная агрегационная активность тромбоцитов, что свидетельствует об улучшении функциональной способности данных клеток крови. Другими словами, тромбоциты у пациентов с СД 1 типа с ДН на стадии микроальбуминурии в силу метаболических нарушений функционально истощаются и не могут адекватно реагировать на индукцию АДФ, в то время как применение Тиоктацида уменьшает данные нарушения и восстанавливает функциональную активность клеток. Наряду с этим применение Тиоктацида оказывает более выраженное влияние на агрегационную активность тромбоцитов, чем традиционная терапия (табл. 3).
Как видно из данных таблицы 3, у больных СД 1 типа с ДН на стадии микроальбуминурии наблюдается достоверная тенденция к увеличению времени достижения максимальной агрегации. В то же время отмечается тенденция к снижению спонтанной агрегации и показателя фактора Виллебранда. Максимальное значение величины тромбоцитов достоверно растет, а время ее достижения сокращается. Таким образом, можно предположить, что ускорение начального этапа агрегации происходит при появлении сосудистых осложнений (ДН) у больных СД 1 типа и замедляется на фоне применения антиоксидантов, в частности Тиоктацида. У пациентов с СД 1 типа с МАУ на фоне терапии Тиоктацидом также достоверно ограничиваются гемокоагуляционные сдвиги: уменьшается антитромбиновая активность (АА), сокращается активированное время рекальцификации (АВР) и активированное частичное тромбопластиновое время (АЧВ), то есть ослабляются сдвиги, которые сопровождают СД (табл. 4).
У пациентов с СД 1 типа установлено снижение в мембранах тромбоцитов метаболитов NO при одновременном увеличении содержания в плазме фермента ксантиноксидазы, что может свидетельствовать о наличии оксидативного стресса у данных пациентов. Изменение содержания метаболитов NO в мембранах тромбоцитов приводит к изменению агрегационной способности тромбоцитов, что играет важную роль в формировании и прогрессировании сосудистых осложнений. СД 1 типа характеризуется изменениями тромбоцитарно-коагуляционного гемостаза, что проявляется нарушением агрегационной функции тромбоцитов, формированием хронического внутрисосудистого свертывания крови, последнее предопределяет появление и прогрессирование ангиопатий. Таким образом, препарат Тиоктацид наряду с антиоксидантным действием обладает влиянием на тромбоцитарно-коагуляционный гемостаз.
Как уже говорилось, определенный вклад в развитие микроальбуминурии вносит автономная диабетическая нейропатия. В исследовании DECAN было показано, что назначение Тиоктацида в дозе 800 мг/сут внутрь приводило к достоверному уменьшению вариабельности сердечного ритма [2], то есть уменьшение симптомов автономной нейропатии с помощью препарата Тиоктацид приводит к уменьшению риска развития микроальбуминурии. Таким образом, полученные в исследованиях результаты свидетельствуют о целесообразности использования препарата Тиоктацид для профилактики и лечения диабетической нефропатии у больных СД 1 типа. Тиоктацид может быть рекомендован в составе комплексных лечебных мероприятий больным СД 1 типа с ДН на стадии микроальбуминурии как дополнительное средство для восстановления активности антиоксидантных ферментов, функциональной активности тромбоцитов и ограничения тромбоцитарно-коагуляционных сдвигов в мембранах тромбоцитов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.