Тримебутин – уникальный спазмолитик и прокинетик ЖКТ: научное досье и клинические исследования
- Аннотация
- Статья
- Ссылки
- English
для лечения функциональных заболеваний «балансирующего» регулятора моторики желудочно-кишечного тракта агониста опиатных рецепторов тримебутина. Экспериментальные и клинические исследования позволяют рассматривать тримебутин как таргетный препарат для коррекции висцеральной гиперчувствительности при синдроме раздраженного кишечника и функциональной диспепсии. В настоящем обзоре рассматриваются механизм лекарственного действия тримебутина и его эффективность как уникального прокинетика и спазмолитика
при функциональных заболеваниях желудочно-кишечного тракта.
для лечения функциональных заболеваний «балансирующего» регулятора моторики желудочно-кишечного тракта агониста опиатных рецепторов тримебутина. Экспериментальные и клинические исследования позволяют рассматривать тримебутин как таргетный препарат для коррекции висцеральной гиперчувствительности при синдроме раздраженного кишечника и функциональной диспепсии. В настоящем обзоре рассматриваются механизм лекарственного действия тримебутина и его эффективность как уникального прокинетика и спазмолитика
при функциональных заболеваниях желудочно-кишечного тракта.

![Рис. 1. Ноцицептивные проводящие пути и место действия опиатов в терапии боли [4]](/upload/resize_cache/iblock/79d/195_350_1/Trimedat2.jpg)
![Рис. 2. Механизмы стрессорной индукции висцеральной гиперчувствительности [8]](/upload/resize_cache/iblock/51a/195_350_1/Trimedat3.jpg)

![Таблица 1. Нормализация параметров опорожнения желудка под влиянием тримебутина у пациентов с ФД [41]](/upload/resize_cache/iblock/a4b/195_350_1/Trimedat5.jpg)




Тримебутин был синтезирован Laboratoires Jouveinal (Франция) в 1969 г. На протяжении почти 50 лет в различных странах мира тримебутин как эффективный и безопасный спазмолитик успешно используется для лечения функциональных нарушений желудочно-кишечного тракта (ЖКТ) у детей и взрослых. За время клинического применения была накоплена обширная научная база данных, позволившая уточнить механизмы действия тримебутина. Установлено, что тримебутин обладает модулирующей прокинетической активностью, оказывает «балансирующее» воздействие на моторику ЖКТ, то есть является особым спазмолитиком для ЖКТ [1, 2].
Доказано, что лекарственное действие тримебутина обусловлено взаимодействием с опиатными рецепторами (ОР) ЖКТ. Тримебутин и его активный метаболит (нортримебутин) являются неспецифическими агонистами периферических, премущественно κ- (энкефалинергических) и ноцицептивных, ОР на всем протяжении чувствительных нервных путей, проводящих сигналы от механических и болевых рецепторов ЖКТ в центральную нервную систему (ЦНС).
У пациентов с функциональными заболеваниями ЖКТ механизмы физиологической регуляции существенно изменены. В частности, при функциональной диспепсии (ФД) и синдроме раздраженного кишечника (СРК) с запором нарушена ритмическая активность ЖКТ в покое: снижены частота мигрирующего моторного комплекса (ММК) кишечника и формирование пропульсивной перистальтики. Одновременно у пациентов с функциональными заболеваниями ЖКТ резко снижена толерантность энтеральной нервной системы к растяжению и восприятию боли, ассоциированной с избыточным растяжением (феномен висцеральной гиперчувствительности). Доказано, что гиперчувствительность к растяжению и воздействиям окружающей среды является основной причиной абдоминальной боли при СРК [3].
Формирование висцеральной гиперчувствительности при функциональных заболеваниях ЖКТ большинством исследователей расценивается как результат стрессорной нейромодуляции оси «мозг – ЖКТ» – сенсибилизации энтеральной и центральной нервной системы под влиянием хронического психологического и эмоционального стресса, который с детских лет испытывают эти пациенты. Известно, что при кратковременном стрессе и у пациентов без висцеральной гиперчувствительности стрессорной нейромодуляции оси «мозг – ЖКТ» противостоят так называемые стресс-лимитирующие системы. В ЖКТ стресс-лимитирующие системы включают ряд основных нейромедиаторов – антагонистов ацетилхолина: серотонин, норадреналин, дофамин и эндогенные опиатные пептиды. Эти амины могут действовать как центрально, так и на периферии, опосредуя эффекты симпатической системы.
Подавляя активность холинергических нейронов, стресс-лимитирующие системы уменьшают секрецию, подвижность и расслабляют сфинктеры, увеличивают болевой порог в оси «мозг – ЖКТ» (рис. 1). Однако длительное воздействие хронического стресса приводит к стойкой активации гипоталамо-гипофизарной оси на фоне постепенно развивающегося относительного дефицита стресс-лимитирующих систем.
У пациентов с функциональными заболеваниями ЖКТ хронический стресс является причиной стереотипной нейромодуляции в оси «мозг – ЖКТ», направленной в сторону уменьшения толерантности к восприятию боли и формирования висцеральной гиперчувствительности (рис. 2) [5–8]. По данным клинических исследований, нарушенное восприятие нормальных стимулов от кишечника зафиксировано как минимум у 60% пациентов с СРК [7].
Таким образом, обезболивающее и спазмолитическое действие тримебутина при СРК базируется на торможении проведения импульсации от нервных окончаний энтеральной нервной системы в стенке кишки в чувствительные нейроны задних ганглиев спинного мозга. Тримебутин, как и другие опиатные пептиды, блокаторы кальциевых каналов и ГАМКергические препараты, ингибиторы обратного захвата норадреналина или серотонина, уменьшает восприятие боли, прерывая проведение болевого импульса на уровне первичных афферентов, нейронов второго порядка или вставочных нейронов спинного мозга (см. рис. 1) [9, 10]. Выраженность блокады болевой импульсации на фоне терапии тримебутином сравнима с таковой у местных анестетиков ряда лидокаина [10].
В отличие от «классических» агонистов периферических ОР в клинических исследованиях тримебутин оказался наиболее эффективен при лечении абдоминальной боли и запора у пациентов с функциональными заболеваниями ЖКТ [14, 15].
В одном из первых клинических исследований с применением тримебутина K. Lüttecke была показана сфокусированность эффектов препарата на стресс-индуцированных нарушениях моторики и абдоминальной боли у пациентов с СРК [16, 17]. Несколько позднее M. Galeone и соавт. (1986) установили, что у пациентов с СРК прием 600–800 мг тримебутина внутрь увеличивает пропульсивную перистальтику толстой кишки, нивелирует стихийные и вибрирующие сокращения – в целом нормализует моторику толстой кишки [18]. В другом исследовании того же периода S. Shannon и соавт. (1989) показали, что прием внутрь даже 200 мг тримебутина способен синхронизировать постпрандиальную двигательную активность сигмовидной кишки у пациентов с СРК с запорами, не влияя при этом на моторику ЖКТ у здоровых волонтеров [19]. J.C. Schang и соавт. (1993) также показали, что, уменьшая время кишечного транзита с 105 ± 9 до 60 ± 11 часов у пациентов с СРК, тримебутин не влияет на нормальную тощаковую и постпрандиальную моторику ЖКТ [20].
Влияние тримебутина на симптомы СРК по данным рандомизированных клинических исследований (РКИ) было впервые оценено в метаанализе T. Poynard и соавт. [21]. В метаанализе 26 РКИ была впервые показана большая эффективность и безопасность тримебутина при коррекции симптомов СРК в сравнении с другими спазмолитиками и плацебо. Таргетность тримебутина в отношении симптомов СРК, обусловленных висцеральной гиперчувствительностью, была показана в систематическом обзоре M. Delvaux и D. Wingate [1]. На основании анализа экспериментальных данных и 12 РКИ авторы продемонстрировали, что тримебутин эффективно купирует характерный для СРК болевой синдром и увеличивает порог болевой чувствительности, уменьшая висцеральную гиперчувствительность и позитивно модифицируя субъективное восприятие висцеральной боли. Позднее в ряде исследований было также показано, что одновременно с коррекцией симптомов СРК тримебутин положительно влияет на психологический статус пациентов, уменьшая их тревожность и негативную вовлеченность в свое заболевание [22].
В 2008 г. эффективность тримебутина при лечении функциональной абдоминальной боли и диспепсии была подтверждена в метаанализе 22 РКИ, посвященном применению спазмолитиков с различным механизмом действия, включившем 1778 пациентов с СРК [23]. У пациентов с СРК эффективность спазмолитиков как класса препаратов составила 53–61% и была выше, чем плацебо (31–41%). Показатель NNT (количество пациентов, которых необходимо пролечить, чтобы добиться положительного результата у одного больного) при применении спазмолитиков варьировал от 3,5 до 9.
В 2009 г. эффективность тримебутина среди прочих спазмолитиков с разным механизмом действия (гиосцина, гиосциамина, отилония бромида, пинаверия бромида, альверина, мебеверина, пиренципина и некоторых других, не зарегистрированных в России) была проанализирована рабочей группой по изучению СРК [24]. В систематический обзор вошли 22 исследования, включившие 1778 пациентов. По данным экспертов, все спазмолитики, включая тримебутин, несмотря на некоторые неизбежные при изучении фукнциональных заболеваний методологические дефекты исследований, при лечении СРК оказались более эффективны, чем плацебо (отношение шансов (ОШ) 0,68, 95% доверительный интервал (ДИ) 0,57–0,81). В 2011 г. тримебутин был включен в Кохрейновский систематический обзор препаратов различной направленности действия, применяемых для лечения СРК. По данным L. Ruepert и соавт., тримебутин является эффективным спазмолитиком для купирования абдоминальной боли у пациентов с СРК [25].
L. Rurpert и соавт. [25] анализировали влияние терапии на выраженность боли в животе при СРК (56 РКИ, 3725 пациентов). Они сравнивали эффективность плацебо, растительной клетчатки и псиллиума (12 исследований), четырех спазмолитиков (29 исследований) – дицикломина, мятного масла, пинавериума, тримебутина, двух антидепрессантов (15 исследований) – ингибиторов обратного захвата серотонина и амитриптилина. Исследователи пришли к выводу, что растительная клетчатка не влияет на выраженность абдоминальной боли при СРК. Спазмолитики эффективны у пациентов с болью в животе при СРК. Ингибиторы обратного захвата серотонина и трициклические антидепрессанты также эффективны, но эффект зависит от индивидуальных характеристик пациентов.
Соответственно в 2013 и 2015 гг. эффективность тримебутина продолжали исследовать в сравнении с наиболее широко применяемыми для лечения СРК спазмолитиками: пинавериумом (G.S. Karabulut и соавт., 2013) и мебеверином (M.Z. Rahman и соавт., 2015). По данным обоих РКИ, тримебутин не менее эффективно, чем пинаверия бромид и мебеверин, уменьшал абдоминальную боль и увеличивал частоту дефекаций у пациентов с СРК [26, 27]. В 2015 г. эти данные были подтверждены в обзоре Канадского агентства по лекарствам и технологиям в здравоохранении, где также было показано, что тримебутин более эффективно, чем оба указанных спазмолитика, улучшает качество жизни пациентов с СРК, особенно в детской популяции [28]. При этом терапия тримебутином была более безопасной – лишена неблагоприятных эффектов, характерных для спазмолитиков других классов: миорелаксантов, антихолинергических средств и пинаверия бромида. Склонность этих агентов самостоятельно вызывать запор, частое головокружение, сухость во рту, паралич аккомодации, задержку мочи и возможную спутанность сознания у пожилых пациентов ограничивает их полезность в клинической практике [29]. Таким образом, уровень доказательности исследований, в которых подтверждалась эффективность тримебутина, соответствовал I категории, уровень практических рекомендаций – категории А [30].
Во многих исследованиях были показаны влияние тримебутина на моторику верхних отделов ЖКТ и его эффективность как спазмолитика и прокинетика при лечении ФД. В уже упомянутом «раннем» систематическом обзоре M. Delvaux и D. Wingate (1997) показали, что у пациентов с ФД курсовой прием тримебутина эффективно уменьшает общее время нахождения пищи в желудке [1]. По данным A. Aktas (1999), это происходит потому, что при ФД тримебутин существенно сокращает лаг-период (VLAG) – время от начала поступления пищи в желудок до начала ее эвакуации и уменьшает объем удерживаемой в желудке пищи (R100 – процент от поступившего объема пищи, оставшегося в желудке через 100 минут) (табл. 1) [31].
Таким образом, тримебутин восстанавливает как нормальное время, через которое желудок должен начать эвакуацию пищи, так и нормальную продолжительность этого процесса посредством индукции III фазы ММК в тонкой кишке. Этот эффект не связан непосредственно с гиперацидностью в желудке и в полной мере сохраняется на фоне лечения ингибиторами протонной помпы [32]. По некоторым данным, тримебутин способен не менее эффективно стимулировать моторику выходного отдела желудка даже у коморбидных и тяжелобольных пожилых пациентов с гастропарезом на фоне цереброваскулярной патологии и сниженным уровнем сознания, а также способствовать разрешению послеоперационного пареза желудка и кишечника, гастропареза при инсулинзависимом сахарном диабете [33–35].
Метаанализ T. Hiyama и соавт. (2007), посвященный оценке сравнительной эффективности прокинетиков как основного класса препаратов для лечения ФД, включил 27 плацебоконтролируемых РКИ с применением тримебутина и других прокинетиков (1844 пациента получали лечение, 1591 – плацебо). Метаанализ продемонстрировал эффективность даже краткосрочного (семь дней в дозе 600 мг) назначения тримебутина для коррекции симптомов ФД [36].
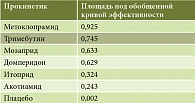
В последнем метаанализе Y.J. Yang и соавт. (2017) также сравнивали эффективность различных прокинетиков при лечении ФД (25 РКИ, 4473 пациента). Тримебутин при курсовом назначении оказался вторым после метоклопрамида по интегральной эффективности в отношении симптомов ФД [37]. Терапевтическая эффективность тримебутина почти не отличалась от эффективности метоклопрамида (OШ 1,32, 95% ДИ 0,27–6,06) и была выше эффективности мозаприда (OШ 1,99, 95% ДИ 0,87–4,72), домперидона (OШ 2,04, 95% ДИ 0,92–4,60) и итоприда (OШ 2,79, 95% ДИ 1,29–6,21) (рис. 3, табл. 2).
Согласно выводам авторов, учитывая риск нежелательных явлений на фоне терапии метоклопрамидом или домперидоном, пациентам с ФД рекомендуется назначение коротких курсов этих препаратов или безопасная альтернатива – терапия тримебутином или мозапридом.
В большинстве РКИ с применением тримебутина подчеркивается наибольшая эффективность лечения у пациентов с изначально более выраженными симптомами и перекрестом симптомов функциональных заболеваний ЖКТ. Так, в популяции пациентов с сочетанием ФД и СРК, а также высокой частотой диарейного синдрома назначение тримебутина приводило к нормализации моторики толстой кишки, ускорению пропульсивной перистальтики и толстокишечного транзита (60 против 95 и 105 часов соответственно) за счет активизации электрофизиологической активности кишечника [38].
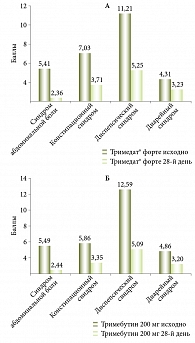
В России эффективность тримебутина у больных с ФД, СРК и пациентов с комбинацией ФД и СРК была подтверждена в наблюдательном исследовании (254 пациента, 30 – с СРК, 67 – с ФД, у 157 пациентов – сочетание СРК и ФД) [40]. Его целью было изучение практических алгоритмов фармакологического лечения и сравнительной эффективности регуляторов моторики и пробиотиков у пациентов с функциональными заболеваниями ЖКТ (тримебутин в схемах лечения применялся в стандартной дозе при курсовом приеме). Тримебутин достоверно более эффективно уменьшал выраженность каждого симптома функционального расстройства в сравнении со схемами, в которые были включены спазмолитики, за исключением запора и нарушения консистенции кала (твердый кал), в отношении этих симптомов эффективность тримебутина казалась сравнимой с таковой спазмолитиков (рис. 4).
В большинстве РКИ с применением тримебутина (за исключением исследований у пациентов отделений интенсивной терапии) проводилась оценка эффективности и безопасности курсового назначения препарата (две – четыре недели). Сравнивая эффекты курсового и краткосрочного (один – три дня) лечения тримебутина, авторы единодушно отмечают, что положительные свойства препарата в наибольшей мере проявляются не в первые дни, а после двух и более недель лечения [39]. С учетом активного пресистемного метаболизма тримебутина было высказано предположение, что при очень хорошей переносимости препарата увеличение разовой дозы тримебутина до 300 мг при сохранении суточной дозы 600 мг может привести к росту эффективности лечения при одновременном улучшении комплаентности больных, поскольку прием препарата будет сокращен до двух раз в день.
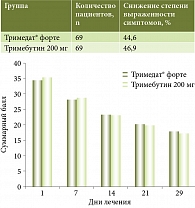
Исследование эффективности и безопасности назначения тримебутина 300 мг по одной таблетке два раза в день, суммарно 600 мг в день (Тримедат® форте, таблетки пролонгированного действия, покрытые пленочной оболочкой, АО «Валента Фарм», Россия) при курсовом (28 дней) лечении боли, обусловленной функциональными заболеваниями ЖКТ и/или желчевыводящих путей, было выполнено в ходе открытого многоцентрового проспективного рандомизированного сравнительного исследования эффективности и безопасности III фазы [40]. Эффективность и безопасность препарата Тримедат® форте сравнивали с тримебутином 200 мг производства Франции по одной таблетке три раза в день, суммарно 600 мг в день. Исследование проводилось в 2015–2016 гг. на базах 16 крупных гастроэнтерологических клиник Москвы, Санкт-Петербурга, Ярославля, Рязани, Нижнего Новгорода, Уфы, Челябинска, Пятигорска и Реутова. В исследование вошли пациенты с хронической абдоминальной болью в сочетании хотя бы с одним из симптомов диспепсии – изжогой, отрыжкой, тошнотой, метеоризмом, запором, поносом и верифицированным диагнозом одного из функциональных заболеваний ЖКТ (неэрозивная гастроэзофагеальная рефлюксная болезнь, функциональная тошнота/рвота, ФД, СРК, дисфункция желчевыводящих путей). Среди пациентов было 56 мужчин (27%) и 151 женщина (73%) в возрасте 43,3 ± 13,6 года (от 18 до 69 лет). Эффективность лечения оценивали по частоте положительного ответа на лечение – определяли долю пациентов в группе с уменьшением жалоб более чем на 30% по Шкале оценки желудочно-кишечных симптомов к 29-му дню от начала лечения (первичная конечная точка), динамике изменения суммарного балла по Шкале оценки желудочно-кишечных симптомов к 7, 14, 21 и 29-му дню от начала лечения, динамике на фоне лечения баллов Шкалы оценки желудочно-кишечных симптомов по отдельным синдромам, динамике изменения качества жизни по опроснику SF-36 к 29-му дню от начала лечения (вторичные конечные точки) (табл. 3, 4, рис. 5, 6).
Качество жизни, оцененное по физическому и психологическому компонентам опросника SF-36, к 29-му дню от начала лечения улучшилось в среднем в 1,2 раза по сравнению с исходным состоянием и также продемонстрировало не меньшую эффективность препарата Тримедат® форте и по сравнению с тримебутином 200 мг производства Франции по данному критерию.
Оценка влияния приема пищи на фармакокинетику препарата, проведенная у части пациентов в клиническом исследовании III фазы, показала, что прием препарата одновременно с высококалорийной пищей увеличивает биодоступность нортримебутина на 25,9% (отношение медиан AUC0-t) по сравнению с приемом натощак.
Данными проведенного клинического исследования была подтверждена высокая эффективность новой лекарственной формы препарата Тримедат® форте в купировании абдоминальной боли и проявлений диспепсического синдрома. Уменьшение кратности приема препарата привело к росту приверженности пациентов к назначенному лечению.
Таким образом, оказывая прокинетическое, спазмолитическое и обезболивающее действие, тримебутин занимает особое место в небогатом арсенале лекарственных препаратов для лечения функциональных заболеваний ЖКТ. Точка приложения тримебутина как периферического агониста ОР – разноуровневые афферентные нервные структуры ЖКТ. Взаимодействие тримебутина с ОР ЖКТ приводит:
- к ингибированию высвобождения ацетилхолина из нейронов энтеральных сплетений и нейромодуляции активности ацетилхолина в отношении гладких мышц ЖКТ;
- высвобождению эффектов эндогенных антихолинергических стресс-лимитирующих систем ЖКТ;
- блокировке передачи болевых и неболевых стимулов в NMDA-синапсах нейронов задних спинномозговых ганглиев на вставочные нейроны, что уменьшает передачу патологических стимулов в ЦНС с последующим уменьшением эффекторного ответа;
- увеличению толерантности к болевым и механическим стимулам – нивелированию висцеральной гиперчувствительности.
В медицинской практике соотношение центрального и периферического эффектов в лекарственном действии тримебутина часто понимают упрощенно. В механизме действия тримебутина значительную роль играет именно взаимодействие с чувствительными нервными структурами, обладающими существенно большей концентрацией ОР, чем стенка ЖКТ. По данным экспериментальных исследований, в стенке тонкой кишки содержание ноцицептивных ОР (δ-ОР) в 15–20 раз меньше, чем в задних ганглиях спинного мозга, и в 100 раз меньше, чем в головном мозге [41]. Именно широта воздействия тримебутина на разноуровневые ОР, расположенные «ниже» головного мозга (препарат не проникает через гематоэнцефалический барьер), позволяет оказывать устойчивое спазмолитическое и анальгетическое действие при функциональных заболеваниях ЖКТ, опосредованных патологией ЦНС и формированием висцеральной гиперчувствительности.
По данным многочисленных РКИ, тримебутин оказывает модулирующее влияние на ЖКТ, незаменимое при лечении заболеваний, основным звеном патогенеза которых служат висцеральная гиперчувствительность и высокий тонус гладкой мускулатуры у пациентов со стресс-индуцированной патологией: ФД, СРК с запором и смешанным вариантом СРК, хроническим идиопатическим запором. Модулирующeе влияние тримебутина на моторику и тонус мышц ЖКТ – коррекция нарушенной моторики кишечника путем индукции регуляции спонтанной активности без влияния на нормальную моторику – обусловлено различной степенью стрессорной нейромодуляции оси «мозг – ЖКТ», а следовательно, и сенситизации ОР у различных пациентов с функциональными заболеваниями. В целом ряде клинических исследований убедительно показано, что эффект тримебутина, по крайней мере характер влияния на моторику ЖКТ, зависит от вектора ее предшествовавшего нарушения. Так, влияние тримебутина на характерную для СРК абдоминальную боль вследствие растяжения кишки на фоне гиперчувствительности будет тем более выражено, чем выше чувствительность нервной системы к боли и чем ниже ее толерантность к любым периферическим проприоцептивным импульсам, которые в норме не должны осознаваться ЦНС. По мнению ряда авторов, тримебутин эффективен при СРК с запором потому, что у пациентов с висцеральной гиперчувствительностью имеют место адаптивная гиперреактивность периферических опиатергических структур, сенситизация и секреция новых ОР. Например, показано, что в кишечнике мышей экспериментальное воспаление и избыточный бактериальный рост стимулируют секрецию новых и увеличивают чувствительность μ-ОР [42]. Клинически это приводит к развитию нарушений функции ЖКТ, характерных для передозировки экзогенных опиатных анальгетиков: тошнота/рвота, анорексия, запор, чувство неполного опорожнения, вздутие живота, дискомфорт в животе, гастроэзофагеальный рефлюкс, псевдообструкция кишечника [9, 10, 43]. Причем считается, что все указанные эффекты реализуются посредством активации как центральных, так и периферических μ-ОР, поскольку их почти полностью устраняет неселективный антагонист ОР налоксон [44]. У таких пациентов тримебутин (неселективный агонист периферических ОР) демонстрирует эффекты не столько агониста, сколько конкурентного антагониста ОР, минимизируя указанные симптомы. Напротив, тримебутин ускоряет эвакуацию из желудка, индуцирует преждевременную фазу III ММК и модулирует сократительную способность толстой кишки. Вследствие гармонизации функций отдельных ОР тримебутин оказывает модулирующее (стимулирующее или расслабляющее) влияние на тонус гладкомышечных клеток и перистальтическую активность ЖКТ в зависимости от их исходного состояния. Тримебутин ослабляет рефлексы, вызванные расширением просвета кишки, и таким образом может модулировать висцеральную чувствительность и оказывать антиноцицептивное действие у больных с СРК [45]. Гипотеза о том, что периферические антагонисты ОР могут регулировать спазм и запор вследствие повышенной экспрессии ОР и/или увеличения активности опиоидергической системы ЖКТ как при хроническом стрессе, так и при длительном приеме опиатных анальгетиков, стимулирует поиск новых опиоидергических молекул [43, 46]. В исследованиях нового селективного периферического антагониста κ-ОР ЖКТ федотозина (fedotozine) были также продемонстрированы прокинетические свойства и эффективность при лечении пациентов с функциональными заболеваниями ЖКТ [47]. Однако в отличие от тримебутина большинство известных сегодня селективных агонистов ОР ЖКТ (лоперамид и новые препараты – ракекадотрил, элюксадолил, асимадолин) демонстрируют противоположное тримебутину влияние на моторику и применяются для лечения острой и хронической диареи. При СРК с диареей селективные агонисты уменьшают моторику и секрецию ЖКТ, не блокируют висцеральную гиперчувствительность и практически не влияют на абдоминальную боль, ассоциированную с растяжением кишки [29, 44, 48]. В целом на фоне несколько разочаровывающих результатов клинических исследований с применением новых селективных периферических агонистов ОР и высокоселективных модуляторов разных классов серотониновых рецепторов прокинетическое, спазмолитическое и обезболивающее лечебное действие тримебутина (Тримедат) является уникальным по критерию «эффективность/безопасность» и может быть рекомендовано как терапия первого ряда при абдоминальной боли, диспепсии и запоре у пациентов с функциональными заболеваниями ЖКТ [49, 50].
E.I. Vovk, Ch.S. Pavlov
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
I.M. Sechenov First Moscow State Medical University
Contact person: Еlena Ivanovna Vovk, shurick046@yandex.ru
Treatment of the gastrointestinal tract functional diseases is an unsolved medical problem. To date, it has been proved that visceral hypersensitivity plays a significant role in the development of this pathology, which in many cases is formed under the influence of chronic stress and marks the dysfunction of physiological anti-stress systems, in particular – the opiatergic system. In this regard, the use of an opiate receptor agonist trimebutin for the treatment of functional diseases of the "balancing" motor regulator of the gastrointestinal tract is promising. Experimental and clinical studies allow us to consider trimebutin as a targeted drug for the correction of visceral hypersensitivity in irritable bowel syndrome and functional dyspepsia. This review examines the mechanism of drug trimebutin action and its effectiveness as a unique prokinetic and spasmolytic in functional diseases of the gastrointestinal tract.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.