Цисплатин-Эбеве: актуальность вопросов применения
- Аннотация
- Статья
- Ссылки
В практической повседневной деятельности онкологи сталкиваются с широким спектром препаратов Цисплатина. Одним из наиболее распространенных и успешно применяемых является Цисплатин – Эбеве. Чем же обусловлена популярность этого препарата? Для того чтобы ответить на этот вопрос, следует рассмотреть данные уже накопленного огромного опыта. Так наиболее часто Цисплатин применяется при раке яичников. Комбинации на его основе показывают высокие результаты лечения: эффективность сочетания Цисплатина и Циклофосфана составляет более 60%, медиана времени до прогрессирования – 13%, медиана общей выживаемости – 24 месяца; комбинация же Цисплатина с таксанами демонстрирует еще более впечатляющие данные, такие как увеличение эффективности лечения до 77%, медианы времени до прогрессирования до 18 месяцев и общей выживаемости до 38 месяцев [1].
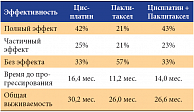
Одни из наиболее демонстративных и больших исследований, показывающих решающее значение Цисплатина в лечении рака яичников, являются исследования GOG 111 и GOG 132. Результаты этих исследований были представлены в 2000 году как совместный сравнительный анализ. 614 больных III-IV стадией рака яичников после субоптимально выполненной операции были рандомизированы на 3 группы в зависимости от схемы химиотерапии: Цисплатин в монорежиме против Паклитаксела в монорежиме, против комбинации Паклитаксел + Цисплатин соответственно. Непосредственная эффективность режимов представлена ниже (cм. табл). На основании полученных данных был сделан вывод, что Цисплатин в монотерапии или в комбинации обладает высокой частотой объективного эффекта, длительной безрецидивной выживаемостью, а комбинированная химиотерапия характеризовалась более лучшим токсическим профилем. [2] Таким образом, описанные данные позволили включить режимы на основе Цисплатина в стандарты лечения рака яичников. До настоящего времени ведущую роль в лечении рака шейки матки занимает Цисплатин.
В исследовании III фазы описаны результаты лечения 264 больных плоскоклеточным раком шейки матки с измеряемыми проявлениями заболевания. Пациенты были разделены на 2 группы: монотерапия Цисплатином и комбинация Цисплатина и Паклитаксела. Оказалось, что применение Цисплатина в комбинации с таксанами приводило к увеличению частоты объективных ответов с 19 до 36%, среднего безрецидивного периода с 2,8 до 4,8 месяцев, однако существенной разницы в продолжительности жизни не отмечено (8,8 и 9,7 месяцев). Таким образом, правомерен вывод о ведущей роли Цисплатина в лечении распространенного рака шейки матки, что в свою очередь имеет большое практическое значение [3]. Добавление Цисплатина к Доксорубицину улучшает результаты лечения больных эндометриальной карциномой. Сравнительное исследование III фазы продемонстрировало повышение частоты объективных ответов в группе комбинированной терапии Цисплатин + Доксорубицин по сравнению с монотерапией Доксорубицином. Полный эффект наблюдался у 8%, частичный – у 17% больных, получивших монотерапию Доксорубицином. В группе, в которой больные получили комбинацию Доксорубицина с Цисплатином полный эффект наблюдался в 19%, частичный – в 23% случаев. Общая частота объективных ответов, таким образом, возросла с 25% до 42% при включении в режим лечения Цисплатина. Медиана времени до прогрессирования составила 5,7 месяцев в группе, получавшей комбинацию, и 3,8 месяца в группе монотерапии.
Гематологическая и гастроинтестинальная токсичность комбинации была выше в группе больных, получавших комбинацию в сравнении с группой больных, получавших монотерапию. На основании полученных данных такая комбинация была признана высокоэффективной для больных, имеющих высокий риск метастазирования и рецидивирования [4]. Причем интересным явился факт, что назначение комбинации Цисплатина и Доксорубицина с учетом циркадных ритмов не меняет частоту объективных ответов, но увеличивает медиану времени до прогрессирования и общую выживаемость больных, демонстрируя более благоприятный спектр токсичности [5]. В настоящее время всемирно признанным стандартом лечения немелкоклеточного рака легкого являются режимы лечения на основе препаратов платины. При этом в качестве второго и третьего составляющего рассматриваются многие известные на сегодняшний день цитостатики, а также таргетные препараты [6].
Комбинация препаратов платины в сочетании с таксанами демонстрирует активность в лечении немелкоклеточного рака легкого (НМРЛ). Опубликованы данные исследования, в котором проведено сравнение комбинаций Цисплатин + Паклитаксел и Карбоплатин + Паклитаксел у 618 больных с распространенным НМРЛ. Группы были хорошо сбалансированы по всем показателям. Частота объективных ответов в обеих группах практически не отличалась и составила 28% и 25% соответственно. Однако медиана выживаемости в группе Цисплатин + Паклитаксел оказалась выше, чем в группе Карбоплатин + Паклитаксел (9,8 против 8,5 месяцев). Двухлетняя выживаемость также отличалась в обеих группах и равнялась 9% и 15% соответственно. Токсичность в обеих группах была приемлемой и хорошо управляемой. На основании полученных данных был сделан вывод о ведущей роли Цисплатина в комбинациях при лечении НМРЛ [7]. Результативными в отношении НМРЛ также являются комбинации Цисплатина с Гемцитабином и Винорельбином. Примером может служить исследование III фазы южной итальянской онкологической группы, в котором Цисплатин продемонстрировал эффективность в сочетании с Винорельбином – 25%, в сочетании с Гемцитабином – 30% и в тройной комбинации с Винорельином и Гемцитабином – 47%. При этом токсичность, наблюдаемая в данном исследовании в любой из групп, была приемлемой и управляемой [8].
Помимо перечисленных схем в лечении НМРЛ Цисплатин часто используется в сочетании с Иринотеканом. Такая комбинация демонстрирует частоту объективного ответа 28,8%, медиану общей выживаемости 9,9 месяцев, одногодичную выживаемость 37%. [9] В последнее время бурное развитие получают так называемые таргетные препараты, в том числе их сочетание с уже давно известными и успешно применяемыми цитостатиками. Примером такого сочетания может служить сообщение международной исследовательской группы CATAPULTI о применении Цисплатина в сочетании с терапией Тирапазамином у больных НМРЛ. Тирапазамин – препарат с избирательным противоопухолевым действием для клеток, находящихся в гипоксии. Было показано, что такая схема терапии не приводит к усилению токсичности. Однако было показано значительное увеличение медианы времени выживаемости с 27,7 до 34,6 месяцев и частоты объективных ответов – практически в два раза – с 13,7% до 27,5%. Это дает право рассматривать Цисплатин как перспективный препарат для создания комбинаций с новыми противоопухолевыми лекарствами [10]. В рутинной клинической практике онкологи часто используют Цисплатин-Эбеве в сочетании с лучевой терапией. Это обусловлено способностью Цисплатина сенсибилизировать клетки опухоли к воздействию ионизирующего излучения [11].
Такое свойство препарата позволяет использовать его в сочетании с лучевой терапией для различных типов опухолей. Особенно актуально это в аспекте обсуждения терапии опухолей головы и шеи. В чем причина? Дело в том, что в терапии опухолевых поражений верхних дыхательных и пищеварительных путей в основном преобладает хирургический метод лечения. Однако распространенность процесса и большой объем опухоли зачастую не позволяют выполнять органосохранные вмешательства, что в свою очередь приводит к неблагоприятному косметическому и функциональному эффекту, помимо учета прогностической ситуации. Так, например, при раке гортани III-IV стадии применение схем лечения с включением лучевой терапии и химиотерапии на основе Цисплатина показывает значительно лучшие результаты по сравнению с хирургическим лечением, при этом лечение не приводит к инвалидизации пациентов. После 3 циклов химиолучевого лечения полный клинический эффект развивается в среднем у 49% больных. В то же время частота отдаленных метастазов после хирургического лечения выше по сравнению с группой больных, получавших химиолучевое лечение – 17%, против 11%. Безрецидивное течение заболевания одинаково и составляет 53,3% и 55,9% соответственно в сроки наблюдения за больными в среднем 33 месяца. При этом у 53% больных удается сохранить гортань, что наиболее благоприятно сказывается на качестве жизни [12].
Меланома кожи – опухоль, характеризующаяся не только местным рецидивированием, но быстрым развитием отдаленных метастазов. При этом в последнее время отмечается достаточно бурный прирост заболеваемости меланомой и практически 80% летальности в структуре злокачественных новообразований. До конца не разработана четкая тактика лечения диссеминированного процесса, однако обнадеживающие результаты демонстрируют различные комбинации на основе Дакарбазина в сочетании с Цисплатином и нитрозопроизводными или винкаалкалоидами. Наиболее эффективным режимом в настоящий момент является комбинация Дакарбазина, Цисплатина и Винбластина в сочетании с интерлейкином и интерфероном. Однако токсичность данного режима высокая. На сегодняшний день мировой опыт располагает большим количеством исследований в этом направлении. В метаанализе 18 исследований описана эффективность и безопасность комбинации с включением Цисплатина. На основании проведенного анализа сделан вывод о целесообразности применения комбинаций с включением Цисплатина в лекарственной терапии диссеминированной меланомы кожи [13, 14].
В отношении распространенного рака поджелудочной железы Цисплатин активен в сочетании с Гецитабином. По результатам исследования, доложенных на ASCO в 2005 году, изучение комбинации, по сравнению с монотерапией Гемцитабином, показало увеличение медианы общей выживаемости, особенно в подгруппах, имеющих благоприятный соматический статус, что послужило своеобразным толчком для моделирования дальнейших исследований в направлении внедрения Цисплатина в схемы лечения опухолей поджелудочной железы [15]. Свою эффективность в лекарственной терапии диссеминированных стадий аденокарциномы поджелудочной железы показала другая, четырехкомпонентная схема с включением Цисплатина, Эпирубицина, Гемцитабина и пролонгированной инфузии 5-фторурацила. Было показано, что частота объективных ответов составила 58%. При этом 14 из 49 пациентов имели стабилизацию болезни. Медиана времени до прогрессирования составила 7,5 месяцев, медиана общей выживаемости – 11 месяцев. При этом токсичность оказалась предсказуемой и управляемой. Перечисленные данные позволили признать этот режим хорошо переносимым и высокоэффективным [16].
В лечении рака мочевого пузыря также применяются режимы с включением Цисплатина. Так, в качестве примера представляется возможным рассмотреть применение тройной еженедельной комбинации Цисплатин + Гемцитабин + Доцетаксел у больных распространенным раком мочевого пузыря. Этот режим демонстрирует частоту объективных ответов равную 65.6%. При этом 28,5% больных достигли полного эффекта, 37,1% – частичного эффекта. Медиана длительности эффекта составила 10,2 месяцев, медиана времени до прогрессирования – 8,9 месяцев, медиана общей выживаемости – 15,5 месяцев. Токсичность включала в себя 3-4 степени нейтропении, частично с фебрильным компонентом, 3-4 степени анемии, а также тромбоцитопению, потребовавшую в ряде случаев трансфузии тромбоконцентрата. Летальных исходов, связанных с лечением, не отмечалось. На основании этих данных режим был признан высокоэффективным в лечении данной патологии [17]. В отношении распространенного рака желудка также признаны эффективными режимы, включающие Цисплатин как один из высоко эффективных цитостатических агентов. Режим лечения Цисплатин в сочетании с Паклитакселом показал 75% объективных ответов (44% частичных эффектов). Медиана времени до прогрессирования составила 4,7 месяца, медиана общей выживаемости – 12,1 месяц. Токсичность режима: анемия различной степени – 41%, 3-4 степень нейтропении – 14%, тромбоцитопения – 3%, периферическая нейропатия – 43%, тошнота – 43% [18].
Тройная комбинация препаратов для лечения распространенного рака желудка показала еще более высокие результаты. Схема с включением Цисплатина, Эпирубицина и Доцетаксела продемонстрировала приемлемую токсичность и удовлетворительную переносимость. Частота объективных ответов в этой группе составила 50%, в которые входили как полные, так и частичные эффекты. Медиана времени до прогрессирования – 6 месяцев, медиана общей выживаемости – 11,2 месяцев [19]. Режим с включением Цисплатина, 5-фторурацила и Доцетаксела позволяет добиться частичного эффекта у 42,5% больных, стабилизации болезни у 32,5% больных. Токсичность режима – умеренная. Эти данные позволяют считать указанный режим высокоэффективным у больных с нерезектабельным раком желудка [20]. Описанные примеры свидетельствуют о том, что Цисплатин является препаратом, обладающим высокой эффективностью, широким спектром противоопухолевой активности и управляемой токсичностью. Таким образом, на основании представленных данных можно судить об актуальности применения препаратов Цисплатина, в том числе и Цисплатина - Эбеве в повседневной химиотерапевтической практике. Целесообразной в этом аспекте представляется дальнейшая разработка новых режимов химиотерапии опухолевых заболеваний на основе Цисплатина с целью улучшения результатов лечения злокачественных новообразований.