Сочетание сердечно-сосудистых заболеваний и колоректального рака у пациентов старше 60 лет: кардиоваскулярный статус и выбор тактики лечения
- Аннотация
- Статья
- Ссылки
- English
Цель. Провести комплексную оценку влияния коморбидных ССЗ на особенности течения госпитального онкохирургического периода лечения у пациентов старше 60 лет с колоректальным раком (КРР).
Материал и методы. В исследование включено 150 пациентов в возрасте от 60 до 90 лет, которым по поводу КРР было выполнено оперативное вмешательство. Для обследования функционального состояния сердечно-сосудистой системы на предоперационном этапе пациенты проходили комплексный кардиоскрининг, включавший электрокардиографию, дуплексное сканирование брахиоцефальных артерий, эхокардиографию с определением фракции выброса левого желудочка, среднего давления в легочной артерии и нарушений локальной сократимости миокарда, а также лабораторную диагностику с определением уровней NT-proBNP, тропонина I, креатинина и скорости клубочковой фильтрации, липидного профиля. Дальнейшую тактику ведения пациентов планировал мультидисциплинарный кардиоонкологический консилиум.
Результаты. В данном исследовании, включающем 150 кардиоонкологических пациентов, перенесших оперативное лечение колоректального рака, выявлена статистически значимая корреляционная и прогностическая связь между развитием послеоперационных кардиологических осложнений и следующими клинико-лабораторными параметрами: возраст (р = 0,00002, AUC 0,827), уровень NT-proBNP (p = 0,00032, AUC 0,83), фракция выброса левого желудочка (р = 0,00000006, AUC 0,97) и индекс коморбидности Чарлсона (р = 0,00017, AUC 0,815).
Заключение. КРР сопряжен с повышенным риском развития ССЗ, однако эту взаимосвязь часто недооценивают в рамках стандартных протоколов наблюдения за онкологическими пациентами. В связи с этим крайне необходимо создание комплексных программ, охватывающих модификацию образа жизни, управление факторами риска и раннюю диагностику ССЗ, для повышения эффективности лечения пациентов с КРР и сопутствующей кардиоваскулярной патологией и улучшения качества жизни.
Цель. Провести комплексную оценку влияния коморбидных ССЗ на особенности течения госпитального онкохирургического периода лечения у пациентов старше 60 лет с колоректальным раком (КРР).
Материал и методы. В исследование включено 150 пациентов в возрасте от 60 до 90 лет, которым по поводу КРР было выполнено оперативное вмешательство. Для обследования функционального состояния сердечно-сосудистой системы на предоперационном этапе пациенты проходили комплексный кардиоскрининг, включавший электрокардиографию, дуплексное сканирование брахиоцефальных артерий, эхокардиографию с определением фракции выброса левого желудочка, среднего давления в легочной артерии и нарушений локальной сократимости миокарда, а также лабораторную диагностику с определением уровней NT-proBNP, тропонина I, креатинина и скорости клубочковой фильтрации, липидного профиля. Дальнейшую тактику ведения пациентов планировал мультидисциплинарный кардиоонкологический консилиум.
Результаты. В данном исследовании, включающем 150 кардиоонкологических пациентов, перенесших оперативное лечение колоректального рака, выявлена статистически значимая корреляционная и прогностическая связь между развитием послеоперационных кардиологических осложнений и следующими клинико-лабораторными параметрами: возраст (р = 0,00002, AUC 0,827), уровень NT-proBNP (p = 0,00032, AUC 0,83), фракция выброса левого желудочка (р = 0,00000006, AUC 0,97) и индекс коморбидности Чарлсона (р = 0,00017, AUC 0,815).
Заключение. КРР сопряжен с повышенным риском развития ССЗ, однако эту взаимосвязь часто недооценивают в рамках стандартных протоколов наблюдения за онкологическими пациентами. В связи с этим крайне необходимо создание комплексных программ, охватывающих модификацию образа жизни, управление факторами риска и раннюю диагностику ССЗ, для повышения эффективности лечения пациентов с КРР и сопутствующей кардиоваскулярной патологией и улучшения качества жизни.


Введение
Несмотря на высокотехнологический прогресс в сфере здравоохранения, сердечно-сосудистые заболевания (ССЗ) и онкологические заболевания, в частности колоректальный рак (КРР), остаются лидирующими причинами заболеваемости и смертности во всем мире [1–3]. Согласно данным Всемирной организации здравоохранения, ежегодно 17,9 миллиона человек умирают от ССЗ и около 10 миллионов – от рака [4, 5]. Ранее патогенетические механизмы этих нозологий традиционно рассматривали как независимые факторы риска их развития, в т.ч. увеличения смертности. В ряде современных клинических исследований указывают на схожесть и единство превентивных мер при КРР и ССЗ. Предполагается, что модификация образа жизни, направленная на снижение факторов риска ССЗ, потенциально может приводить к снижению риска развития рака [6].
ССЗ, включая ишемическую болезнь сердца (ИБС), заболевания периферических сосудов, цереброваскулярные нарушения и хроническую сердечную недостаточность (ХСН), встречаются у более чем 40% пациентов с раком легкого, у 30% – с гематологическими злокачественными новообразованиями, у 35% – с раком почки, у 25% – с раком головы и шеи, у 25% – с КРР и у 15% – с раком молочной железы [7].
Учитывая, что выживаемость больных раком имеет тенденцию к росту благодаря внедрению современных высокотехнологичных методов онкологического лечения, врачи широкого профиля все чаще сталкиваются с необходимостью персонального мониторинга выживших после рака [8]. У таких пациентов со временем наблюдается повышенный риск развития сердечно-сосудистых осложнений (ССО) на фоне коморбидных кардиометаболических заболеваний, что вместе с кумулятивным риском и неуклонным увеличением распространенности ССЗ с возрастом оказывает негативное влияние на долгосрочный прогноз основного заболевания. Из-за вышеперечисленных факторов противоопухолевое лечение, в т.ч. и хирургическое, может быть несвоевременно назначено или неэффективно. В связи с этим необходимо внедрение медицинских подходов к изучению и лечению сердечно-сосудистой системы в процессы диагностики и лечения кардиоонкологических пациентов и последующего наблюдения за ними [9, 10].
Цель исследования – провести комплексную оценку влияния коморбидных ССЗ на особенности течения госпитального онкохирургического периода у пациентов старше 60 лет с КРР.
Материал и методы
Исследование проводилось в соответствии с действующей версией Хельсинской декларации, положениями Национального стандарта РФ (ГОСТ Р52379-2005) о надлежащей клинической практике от 01 апреля 2006 г., Приказом Минздрава России от 1 апреля 2016 г. № 200н «Об утверждении правил надлежащей клинической практики» и положениями Надлежащей клинической практики (Good Clinical Practice, GCP).
Статистическая обработка данных проводилась с помощью программного обеспечения SPSS 23.0 (SPSS Inc., Chicago, IL, USA), GraphPad Prism 7.00 (GraphPad Software, Inc., San Diego, CA), jamovi Version 1.2 (Project, 2019). Количественные переменные представлены в виде среднего значения ± стандартное отклонение в случае нормального распределения и медианы (интерквартильный размах 25–75%, Q1–Q3) для переменных с ненормальным распределением, качественные переменные – в виде числовых значений с процентной долей от общего числа.
Определение нормальности распределения переменных осуществлялось с помощью критерия Колмогорова – Смирнова (при числе исследуемых n > 50) или критерия Шапиро – Уилка (при n < 50). Для сравнения количественных переменных в обеих независимых группах t-критерий Стьюдента использовался в случае параметрического анализа и нормального распределения переменных в обеих группах. В случае ненормального распределения переменной хотя бы в одном случае использовался метод непараметрического анализа – критерий Манна – Уитни (для независимых выборок). Для оценки связи между двумя показателями с нормальным распределением использовался коэффициент корреляции rxy Пирсона. Для оценки связи между двумя показателями, распределение которых отличается от нормального, использовался коэффициент ранговой корреляции rxy Спирмена. Исходя из полученного значения rxy определялись теснота связи по шкале Чеддока и ее направление (прямая или обратная). Для сравнения качественных переменных использовался критерий χ2 Пирсона. Для оценки значимости влияния факторов на развитие ССО был проведен ROC-анализ. Статистические критерии использовались для сравнения двух выборок, достоверным считалось значение p < 0,05.
В исследование включены 150 пациентов в возрасте от 60 до 90 лет (81 мужчина и 69 женщин), которым по поводу КРР было выполнено оперативное вмешательство.
Средний возраст пациентов составил 73 ± 7,2 года (95% ДИ 71,78–74,18). Исходно из ССЗ у всех кардиоонкологических больных были диагностированы: атеросклероз аорты, артериальная гипертензия (АГ) – у 123 (82%) пациентов, атеросклероз периферических сосудов – у 128 (85,3%), нарушения проводимости сердца – у 97 (64,7%), ИБС – у 51 (34%), дислипидемия – у 72 (48%), фибрилляция предсердий (ФП) – у 37 (24,7%), клапанные пороки сердца – у 13 (8,7%), сахарный диабет 2 типа – у 47 (31,3%), перенесенный инсульт в анамнезе – у 16 (10,7%), висцеральное ожирение – у 46 (30,7%), варикозное расширение вен нижних конечностей – у 39 (26%) пациентов.
В нашем исследовании ХСН была выявлена у 92 (61,3%) пациентов. Индекс коморбидности Чарлсона (Charlson Comorbidity Index, CCI) варьировался от 3 до 13 баллов: медиана индекса Чарлсона составила 6 баллов с интерквартильным размахом 5–8 баллов. У 135 пациентов было 3 или более ССЗ. На всех этапах лечения больные получали кардиальную терапию (табл. 1).
Всем пациентам для обследования функционального состояния сердечно-сосудистой системы в предоперационный период выполняли следующие инструментальные исследования: электрокардиографию (ЭКГ); эхокардиографию (ЭхоКГ), включая определение фракции выброса левого желудочка (ФВ ЛЖ), среднего давления в легочной артерии, нарушений локальной сократимости миокарда; дуплексное сканирование брахиоцефальных артерий. По данным лабораторных исследований определяли уровни сердечного биомаркера NT-proBNP, высокочувствительного тропонина I, липидный спектр крови (уровни общего холестерина и липопротеидов низкой плотности (ЛПНП)), уровень креатинина с расчетом скорости клубочковой фильтрации (СКФ).
По данным ЭхоКГ: ФВ ЛЖ у пациентов составила 60% с интерквартильным размахом 56–64%; нарушения локальной сократимости миокарда выявлены у 28 (18,7%) пациентов; медиана систолического давления в легочной артерии (СДЛА) составила 28 мм рт. ст. с интерквартильным размахом 25–33 мм рт. ст.
Исходные показатели состояния сердечно-сосудистой системы пациентов, по данным ЭКГ покоя и суточного холтеровского мониторирования, представлены в табл. 2.
По результатам анализов плазмы крови: средний уровень NT-proBNP составил 323,2 пг/мл с интерквартильным размахом 123,08–848,7 пг/мл; медиана уровня тропонина I – 0,01 нг/мл с интерквартильным размахом 0,01–0,1 нг/мл; СКФ варьировалась от 27 до 134,1 мл/мин, со средним значением 66,09 ± 20,53 мл/мин (95% ДИ 61,53–70,65); общий холестерин варьировался от 2,5 до 9,2 ммоль/л, при этом среднее значение составило 5,14 ± 1,26 ммоль/л (95% ДИ 4,83–5,45); уровень ЛПНП колебался от 1,3 до 6,4 ммоль/л, со средним значением 2,98 ± 1,11 ммоль/л (95% ДИ 2,69–3,27).
Стратификацию 30-дневного риска развития ССО (инфаркт миокарда, остановка сердца, смерть) проводили на основании шкалы Revised Cardiac Risk Index (RCRI): 75 (50%) пациентов имели 6%-ный риск развития таких осложнений, 49 (32,7%) пациентов – 10,1%-ный риск и 26 (17,3%) пациентов – 15%-ный риск.
Решения об этапности онкохирургического лечения, целесообразности и необходимости коррекции кардиальной терапии в дооперационный период, об определении показаний к кардиоваскулярному вмешательству принимал мультидисциплинарный кардиоонкологический консилиум в составе хирурга-колопроктолога, кардиолога, сердечно-сосудистого хирурга, онколога, специалиста по эндоваскулярной диагностике и лечению, анестезиолога-реаниматолога, с привлечением других смежных специалистов многопрофильного хирургического стационара, на основании комплексной оценки данных клинических и лабораторно-инструментальных методов исследования.
Трем пациентам с впервые выявленным при плановом предоперационном обследовании бессимптомным стенозом брахиоцефальных артерий более 80% для снижения риска развития острого нарушения мозгового кровообращения (ОНМК) в периоперационный период, до оперативного лечения КРР, была выполнена каротидная эндартерэктомия.
В отношении одного пациента с клинически выраженной стенокардией напряжения высокого ФК и окклюзией передней межжелудочковой артерии, стенозом правой коронарной артерии до 70%, по данным селективной коронарографии, выполненной на этапе подготовки к онкохирургическому вмешательству по поводу КРР, кардиоонкологической командой нашего центра было принято решение о выполнении на первом этапе реваскуляризации миокарда с последующим успешным выполнением резекции КРР.
Другому пациенту с КРР и прогрессирующей ХСН на фоне ревматического митрального порока сердца на первом этапе было выполнено протезирование клапана в условиях искусственного кровообращения, через месяц – онкохирургическое лечение рака.
В предоперационный период коррекция кардиальной терапии с предоставлением двухнедельного терапевтического окна была выполнена у 94 (62,7%) пациентов.
Результаты
Из 150 пациентов были повторно госпитализированы в отделение реанимации и интенсивной терапии – 29 (19,3%), причем на долю ССО пришлось 12 случаев (8%); у 3 пациентов отмечены клинические признаки декомпенсации исходной ХСН, у 1 пациента развился инфаркт миокарда 2-го типа, у 8 – зарегистрирован тахисистолический пароксизм ФП.
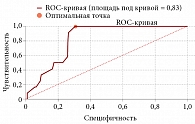
Группы статистически различались по возрасту (р = 0,00002): средний возраст пациентов без осложнений составил 72,3 ± 7,1 года (95% ДИ 71,06–73,55), с осложнениями – 80,2 ± 4,2 года (95% ДИ 77,5–82,83). Между увеличением возраста пациентов и риском возникновения ССО отмечается прямая, статистически значимая корреляционная связь умеренной тесноты по шкале Чеддока (rxy Пирсона = 0,305; p = 0,000245).
Для определения прогностической значимости влияния возраста на развитие кардиологических осложнений был использован ROC-анализ с вычислением площади под кривой, АUC (рис. 1). Площадь под кривой составила 0,827 (95% ДИ 0,754–0,902), для оптимальной точки разделения 77 лет чувствительность составила 100%, специфичность – 70%. Исходно из ССЗ у всех 12 повторно госпитализированных пациентов были АГ и атеросклероз периферических артерий. Нарушения проводимости сердца выявлены у 10 (83,3%) пациентов, ИБС – у 9 (75%), ФП – у 7 (58,3%), клапанные пороки сердца – у 2 (16,7%), сахарный диабет 2 типа – у 6 (50%), ОНМК – у 3 (25%), ожирение – у 10 (83,3%), варикозная болезнь вен у 3 (25%) пациентов. Группы больных с ССО и без таковых статистически значимо различались по заболеваемости ИБС (р = 0,0049), ФП (р = 0,0134), ожирением (р = 0,000145).
Данные анализов крови групп пациентов с ССО и без них не отличались по уровням тропонина I (р = 0,45), общего холестерина (р = 0,34), ЛПНП (р = 0,08) и СКФ (р = 0,39).
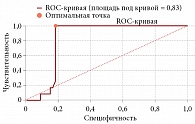
При сравнении уровня NT-proBNP в группе с ССО медиана показателя составила 900,65 пг/мл с интерквартильным размахом 835,67–1207,25 пг/мл, а в группе без них – 261,55 пг/мл с интерквартильным размахом 88,45–503,35 пг/мл. Различия показателя были статистически значимы (p = 0,00032). Между повышением уровня NT-proBNP и возникновением ССО отмечается прямая, статистически значимая корреляционная связь умеренной тесноты по шкале Чеддока (rxy Спирмена = 0,41; p = 0,00018).
Для выявления прогностической значимости влияния уровня NT-proBNP на развитие ССО был использован ROC-анализ с вычислением площади под кривой, АUC (рис. 2). Площадь под кривой составила 0,83 (95% ДИ 0,74–0,91); для оптимальной точки разделения – 704,4 пг/мл: чувствительность составила 100%, специфичность – 82%. Группы были сопоставимы по уровню СДЛА (р = 0,32) и наличию нарушений локальной сократимости миокарда (р = 0,12).
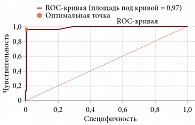
При сравнении эхокардиографических параметров групп медиана показателя ФВ ЛЖ у пациентов с осложнениями составила 45% с интерквартильным размахом 43–47%, а у пациентов без кардиологических осложнений – 61% с интерквартильным размахом 58–65%. Различия показателя были статистически значимы (р = 0,00000006). Между увеличением ФВ ЛЖ и риском возникновения ССО отмечается обратная, статистически значимая корреляционная связь умеренной тесноты по шкале Чеддока (rxy Спирмена = -0,48; p = 0,00000001).
Для определения прогностической значимости влияния ФВ ЛЖ на развитие кардиологических осложнений был использован ROC-анализ с вычислением площади под кривой, АUC (рис. 3). Площадь под кривой составила 0,97 (95% ДИ 0,94–0,99); для оптимальной точки разделения – 47%: чувствительность составила 93%, специфичность – 98%.
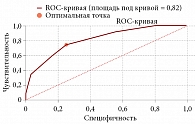
При сравнении показателя индекса коморбидности Чарлсона в двух группах различия были статистически значимы (р = 0,0002). У пациентов без осложнений медиана составила 7 баллов с интерквартильным размахом 6–8 баллов, а у пациентов с кардиологическими осложнениями медиана составила 9 баллов с интерквартильным размахом 7,8–11,3 балла. Между индексом коморбидности Чарлсона и риском возникновения ССО отмечается прямая, статистически значимая корреляционная связь умеренной тесноты по шкале Чеддока (rxy Спирмена = 0,31; p = 0,00017). Для определения прогностической значимости влияния индекса коморбидности Чарлсона на развитие кардиологических осложнений был использован ROC-анализ с вычислением площади под кривой, АUC (рис. 4). Площадь под кривой составила 0,815 (95% ДИ 0,7–0,9); для оптимальной точки – 8 баллов: чувствительность составила 75%, а специфичность – 74,6%.
Обсуждение
Уровень осведомленности о защите онкологических пациентов старше 60 лет от ССЗ на всех этапах онкологического лечения, в т.ч. хирургического, по-прежнему низок. Часть врачей рассматривает ССЗ и рак как отдельные медицинские проблемы. Сохраняется недостаток в специализированных многопрофильных кардиоонкологических командах.
В настоящее время становится очевидной взаимосвязь ССЗ и рака на всех уровнях их развития и прогрессирования, это касается как общности факторов риска, так и фундаментальных патофизиологических процессов. По данным крупномасштабного ретроспективного когортного исследования, посвященного оценке влияния ССЗ на заболеваемость раком, показано, что наличие ССЗ, в особенности атеросклеротического генеза, ассоциировано с повышенной частотой развития КРР [11]. Однако механизмы, лежащие в основе установленной ассоциации этих групп заболеваний, остаются недостаточно изученными. Предполагается, что ключевую роль могут играть хроническое воспаление, инсулинорезистентность и окислительный стресс.
Такие факторы, как ожирение, курение и дислипидемия, ассоциированы с хроническим воспалением и повышенным уровнем провоспалительных цитокинов, что потенциально может способствовать развитию КРР [12–15]. Важно отметить, что влияние курения на уровень воспалительных цитокинов может сохраняться в течение длительного периода времени после отказа от курения [16], что объясняет сходный повышенный риск КРР у бывших и действующих курильщиков, наблюдаемый в ряде исследований [17, 18]. Сахарный диабет и гиперхолестеринемия характеризуются гиперинсулинемией и повышенным уровнем свободного инсулиноподобного фактора роста 1 (ИФР-1), который участвует в патогенезе КРР. Нарушения липидного обмена также связаны с увеличением экскреции желчных кислот, что может обеспечивать энергетическую поддержку опухолевых клеток [19–24].
В нашем исследовании на дооперационном этапе у всех пациентов был диагностирован атеросклероз аорты, у более чем 80% – АГ и атеросклероз периферических сосудов, у некоторых – другие ССЗ и нарушения липидного обмена. Группы пациентов с ССО и без них статистически различались по заболеваемости ИБС, ФП, ожирением, у всех 12 пациентов с ССО, повторно госпитализированных в послеоперационный период, были АГ и атеросклероз периферических артерий. Нарушения проводимости сердца были выявлены у более чем 80% пациентов с ССО.
Дополнительным звеном в понимании коморбидности рака и ССЗ могут служить экспериментальные данные, указывающие на то, что ХСН способствует формированию и прогрессированию проонкогенной среды. Как показано в многочисленных обзорах, ХСН характеризуется активацией нейрогормональных систем, включая ренин-ангиотензин-альдостероновую и симпатическую нервную системы, играющих особо важную роль в развитии и прогрессировании КРР [25, 26].
Активация симпатической нервной системы, спровоцированная холодом или ограничением физической подвижности, способствует ускорению роста и метастазирования КРР. Кроме того, в этом процессе значимую роль играет модуляция микроокружения опухоли нейрогормональными медиаторами, такими как норадреналин и ангиотензин II [27, 28]. Системная симпатическая активация, наблюдаемая при ХСН, оказывает влияние на все клетки организма, особенно на опухолевые [29].
В нашем исследовании у 92 (63,3%) пациентов исходно была отмечена ХСН той или иной степени выраженности. Мы также установили, что между повышением уровня NT-proBNP и возникновением ССО наблюдается прямая, статистически значимая связь, а между повышением ФВ ЛЖ и возникновением ССО – обратная.
В свете установленного сходства и коморбидности ССЗ и КРР представляется закономерным, что современные кардиоваскулярные клинико-диагностические и превентивные стратегии могут найти применение и продемонстрировать существенную эффективность в кардиоонкологической практике. По данным ряда авторов, отмечено благоприятное воздействие кардиотропных препаратов на течение онкологических заболеваний. Этот положительный эффект проявляется в широком диапазоне: от обеспечения протективного влияния в отношении развития и прогрессирования КРР до потенцирования противоопухолевой активности специфической терапии [26, 30–34].
В нашем исследовании на всех этапах лечения пациенты получали кардиальную терапию, в частности блокаторы ренин-ангиотензиновой системы и статины (63 и 48% соответственно). На предоперационном этапе коррекция кардиальной терапии потребовалась 94 (62,7%) пациентам.
Данные современных метаанализов не противоречат полученным нами клиническим результатам и предоставляют доказательства в пользу потенциальной роли антигипертензивной терапии в снижении вероятности развития КРР. В частности, Y. Dai и соавт. в проведенном в 2015 г. метаанализе, включившем 11 наблюдательных исследований, выявили снижение риска КРР на 6% у пациентов, принимавших ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина, в сравнении с теми, кто не получал данную терапию [35]. В 2020 г. опубликован метаанализ, подтвердивший уменьшение риска развития КРР при использовании ингибиторов ренин-ангиотензиновой системы [36], что косвенно указывает на возможную причинную роль АГ в патогенезе этого онкологического заболевания.
Известно, что механизм действия статинов заключается в снижении синтеза холестерина в печени и уровня холестерина в сыворотке крови посредством ингибирования 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (ГМГ-КоА-редуктазы) – фермента, лимитирующего скорость биосинтеза холестерина (мевалонатного пути). В свою очередь, продукты мевалонатного пути, такие как изопреноидные молекулы (фарнезилпирофосфат и геранилгеранилпирофосфат), необходимы для посттрансляционной модификации и изопренилирования различных белков, включая RAS и RhoA, которые играют важную роль в росте, пролиферации, ангиогенезе и миграции клеток [37]. Данные белки часто имеют повышенную активность при КРР и связаны с инвазией опухоли.
Статины способны индуцировать апоптоз и подавлять β-субъединицы рецептора ИФР-1, а также активацию белков ERK/Akt, индуцированную ИФР-1 [38]. Эти широко используемые препараты, снижающие уровень холестерина, также применяются для профилактики и лечения ССЗ. Лечебные эффекты статинов могут быть обусловлены ингибированием воспаления, ангиогенеза и клеточной адгезии, а также их антиоксидантным действием. Накопленные экспериментальные данные свидетельствуют о том, что статины, вероятно, оказывают дополнительный химиопрофилактический эффект при некоторых видах опухолей, индуцируя апоптоз, ингибируя ангиогенез, усиливая противоопухолевое действие ряда цитокинов и предотвращая метастазирование [38, 39]. В двух недавних метаанализах, охватывающих 40 и 42 отдельных исследования соответственно, было продемонстрировано снижение риска КРР среди пациентов, принимающих статины [40, 41]. Однако пока вопрос о применении статинов в химиопрофилактике КРР остается предметом активных дискуссий, для изучения этого эффекта необходимы дальнейшие исследования.
Заключение
Онкологические заболевания, в частности колоректальный рак (КРР), ассоциированы с повышенным риском развития и прогрессирования широкого спектра сердечно-сосудистых заболеваний (ССЗ), таких как хроническая сердечная недостаточность, кардиомиопатия, аритмии, ишемическая болезнь сердца, инсульт, венозная тромбоэмболия, поражения клапанного аппарата сердца. Несмотря на возможность ранней диагностики и эффективного контроля ССЗ у онкологических пациентов, скрининг и лечение кардиоваскулярных патологий, как правило, не интегрированы в стандартные протоколы долгосрочного наблюдения за взрослыми пациентами, перенесшими рак.
По результатам исследования, к факторам риска, увеличивающим вероятность возникновения сердечно-сосудистых событий после хирургического вмешательства по поводу КРР, относят возраст старше 75 лет, показатель индекса коморбидности Чарлсона и наличие сопутствующих заболеваний, таких как ишемическая болезнь сердца и фибрилляция предсердий. Кроме того, настоящее исследование подтверждает высокую прогностическую ценность уровня NT-proBNP и фракции выброса левого желудочка в определении риска развития послеоперационных сердечно-сосудистых осложнений.
Эти данные свидетельствуют о необходимости проведения комплексной оценки кардиоваскулярного статуса таких пациентов с внедрением программ по профилактике и коррекции кардиологических нарушений. Эффективные программы должны включать модификацию образа жизни, контроль факторов риска, а также своевременное выявление и лечение сопутствующих ССЗ как для оптимизации тактики ведения больных, так и для определения этапности кардиоонколечения.
Совместное использование кардиологического и онкологического подходов при ведении пациентов с КРР и ССЗ является ключевым фактором повышения эффективности лечения, улучшения долгосрочных результатов и качества жизни коморбидных пациентов старше 60 лет.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проведено при поддержке Минобрнауки России (FURG-2023-0002).
S.A. Tsatsurova, A.L. Bedzhanyan, E.A. Tyurina, O.V. Dymova, K.N. Petrenko, A.V. Butenko, Yu.V. Frolova
Petrovsky National Research Center of Surgery, Moscow
Contact person: Sabrina A. Tsatsurova, tsatsurova99@list.ru
Despite advances in modern medicine, cardiovascular diseases (CVD) and cancer, particularly colorectal cancer (CRC), remain leading causes of mortality worldwide. Contemporary research highlights shared risk factors and preventative interconnections between these conditions, suggesting that lifestyle modifications aimed at CVD prevention may reduce cancer risk. Given the increasing survival rates following cancer diagnosis, monitoring patients for, and identifying, cardiovascular complications is a critical task requiring an interdisciplinary approach and integration of cardiac considerations into oncological practice.
Aim. To conduct a comprehensive assessment of the impact of comorbid cardiovascular diseases on the characteristics of the in-hospital onco-surgical period in patients over 60 years of age with colorectal cancer.
Material and methods. The study included 150 patients aged 60 to 90 years who underwent surgical intervention for colorectal cancer. To assess the functional status of the cardiovascular system preoperatively, patients underwent a comprehensive cardiac screening that included: electrocardiography, duplex scanning of the brachiocephalic arteries, echocardiography with determination of left ventricular ejection fraction, mean pulmonary artery pressure, and detection of regional myocardial wall motion abnormalities, as well as laboratory diagnostics with determination of NT-proBNP, troponin I, creatinine with calculation of glomerular filtration rate, and lipid profile. Further management strategies were determined by a multidisciplinary cardio-oncology team.
Results. In this study, involving 150 cardio-oncological patients who underwent surgical treatment for colorectal cancer, a statistically significant correlation and prognostic relationship were identified between the development of postoperative cardiac complications and the following clinical-laboratory parameters: age (p = 0.00002, AUC 0.827), NT-proBNP level (p = 0.00032, AUC 0.83), left ventricular ejection fraction (p = 0.00000006, AUC 0.97), and Charlson comorbidity index (p = 0.00017, AUC 0.815).
Conclusion. Although colorectal cancer is associated with an increased risk of developing cardiovascular disease, this association is often underestimated within standard oncological patient follow-up protocols. Therefore, it is critically necessary to create comprehensive programs encompassing lifestyle modification, risk factor management, and early diagnosis of CVD to improve treatment effectiveness and enhance the quality of life for patients with CRC and concomitant cardiovascular pathology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.