Упругие и гиперупругие свойства молочной железы в норме и при патологии
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Модуль упругости ткани в нормальной ткани молочной железы при различных частотах и уровнях предкомпрессионной деформации [10]](/upload/resize_cache/iblock/386/195_350_1/Muslov1.jpg)
![Рис. 1. Модуль Юнга тканей молочной железы (кПа), полученный при различных значениях скорости деформации (0,1; 1,0 и 4,0 Гц) и степени предварительной компрессии (5 и 20%) [10]](/upload/resize_cache/iblock/dc1/195_350_1/Muslov2.jpg)

![Таблица 3. Свойства материалов модели [13]](/upload/resize_cache/iblock/71f/195_350_1/Muslov4.jpg)
![Таблица 4. Результаты исследований упругих свойств тканей молочной железы in vivo, опубликованные в литературе [19]](/upload/resize_cache/iblock/190/195_350_1/Muslov5.jpg)
![Рис. 2. Поведение тканей молочной железы при различных уровнях предварительной компрессии. Адаптировано из исследований [4, 35, 36]](/upload/resize_cache/iblock/ad2/195_350_1/Muslov6.jpg)
![Рис. 3. Столбчатая диаграмма, показывающая значения модуля Юнга для нормальной жировой и нормальной железистой тканей, составленная на основе различных работ. Сделана Van Houten E.E. и соавт. [24]](/upload/resize_cache/iblock/3de/195_350_1/Muslov7.jpg)
![Таблица 5. Расчет средних значений и стандартных отклонений гиперэластичных параметров жировой и фиброгландулярной тканей молочной железы с использованием полиномиальной функции энергии деформации 2-го порядка (Samani A. и соавт.) [43]](/upload/resize_cache/iblock/23c/195_350_1/Muslov10.jpg)
![Таблица 6. Расчетное среднее значение, полученное для каждой константы полиномиальной функции энергии деформации [44]](/upload/resize_cache/iblock/bc0/195_350_1/Muslov11.jpg)
![Таблица 7. Средние значения и стандартное отклонение результатов измерения параметров гиперэластичности для образцов доброкачественных тканей [45]](/upload/resize_cache/iblock/151/195_350_1/Muslov12.jpg)
![Таблица 8. Материальные константы в расчетах [44]](/upload/resize_cache/iblock/9a9/195_350_1/Muslov13.jpg)
Упругие свойства твердых биологических тканей – кости скелета, эмаль, дентин зубов и др. достаточно хорошо изучены благодаря относительной простоте измерений [1, 2]. Как итог, упругие модули и коэффициент Пуассона этих материалов известны. Что касается мягких биологических тканей, то для их описания часто требуются дополнительные, по сравнению с твердыми тканями, измерительные процедуры и материальные параметры, а также более сложные деформационные модели. Среди последних на смену линейному гуковскому закону с одним параметром – модулем Юнга в последние десятилетия пришли нелинейные вязкоупругие и гиперупругие модели с двумя и более параметрами. Сказанное в полной мере относится к тканям молочной железы, которые у человека в основном состоят из жировой, соединительной и железистой тканей. Однако, к сожалению, знания о механических свойствах тканей молочной железы ограниченны и часто противоречивы. По мнению Phipps S. и соавт. [3], наблюдаемая дивергенция данных в основном вызвана отсутствием/наличием разного рода патологии в тканях железы, их структурной неоднородностью, различными методами и протоколами испытаний, касающимися как подготовки образцов, величины и частоты предкомпрессии и компрессии, так и других экспериментальных факторов. Например, известно, что предварительная компрессия существенно влияет на результаты эластографии [4]. Кроме того, предположение о конкретной реологической модели ткани может сильно повлиять на оценку параметров свойств ткани.
Параметры упругости
Существуют различные способы обнаружения раковых тканей, и один из них – проверка меры жесткости тканей (модуля Юнга). То есть параметры механических свойств тканей можно рассматривать как биомаркеры для раннего выявления рака и содействие разработке новых методов лечения. Кроме того, знание механических свойств необходимо при подборе материалов для конструкций имплантов и биопротезов, например молочной железы [5]. Первым диагностическим методом, выполняемым либо пациентами, либо врачами, является пальпация. Это качественный метод, позволяющий обнаружить крупные и поверхностные опухоли. Однако этот метод нечувствителен к небольшим или глубоким опухолям молочной железы. Более того, он носит субъективный характер, поскольку его точность зависит от опыта специалиста, проводящего обследование. В связи с этим потребовались вспомогательные и альтернативные методы [6]. Методы биомедицинской визуализации явились полезными инструментами для диагностики аномалий в тканях, поскольку достаточно просты в выполнении и неинвазивны. В итоге исторически упругие свойства молочной железы исследовались с помощью четырех методов: ультразвуковой эластографии [7], магниторезонансной эластографии [8], оптической когерентной томографической эластографии [9] (все – методы визуализации деформаций и упругих свойств in vivo), а также применяли метод индентирования ex vivo.
Результаты изучения механических параметров образцов тканей молочной железы [10] представлены в табл. 1. При механической компрессии образца ткани молочной железы производилась нагрузка на часть его поверхности. В ходе испытаний регистрировались нагрузка, а также максимальное смещение под индентором, и эти данные использовались в уравнении для определения модуля упругости образцов:
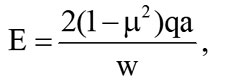 (1)
(1)
где E – модуль упругости, μ – коэффициент Пуассона, q – плотность нагрузки (сила на единицу площади), a – радиус нагруженной области, w – максимальное смещение в направлении нагрузки. Предполагалось, что образцы тканей почти несжимаемы с коэффициентом Пуассона μ = 0,495.
Авторам удалось дифференцированно подойти к изучению деформационных свойств тканей как с точки зрения их структуры, так и с точки зрения параметров проведенных испытаний. Для изучения вязкоупругого поведения тканей образцы подвергались синусоидально изменяющимся деформациям на трех различных частотах: 0,1, 1,0 и 4,0 Гц. Поскольку модуль упругости ткани был непостоянен и зависел от величины предварительной компрессии, для использования в исследовании были выбраны два диапазона деформации – 5 и 20%. Начальная предварительная компрессия, приложенная к образцам ткани, соответствовала деформации, приложенной к молочной железе при использовании диагностической сонографии.
Данные показали, что жировая ткань молочной железы имеет почти постоянный модуль в тестируемом диапазоне деформаций (18–24 кПа), в то время как другие ткани имеют модуль, зависящий от уровня деформации. Образцы фиброзной ткани из молочной железы оказались на 1–2 порядка жестче жировой ткани (до 244 кПа). Было обнаружено, что нормальная железистая ткань молочной железы имеет эластический модуль, подобный модулю жира при низких уровнях деформации, но модуль железистой ткани увеличивается на порядок выше, чем жировой при высоких уровнях деформации (рис. 1). Карциномы молочной железы были жестче, чем другие ткани, на более высоком уровне деформации; внутрипротоковые карциномы in situ были похожи на жировую ткань на низком уровне деформации и намного жестче, чем жировая и железистая ткани, при высоких деформациях. Инфильтрирующие протоковые карциномы были намного жестче, чем любые другие ткани груди (до 558 кПа). Этот факт говорит о высокой информативности измерений упругих свойств молочной железы при диагностике онкологических заболеваний пациентов (рака груди). Как отмечалось в работе Azar F.S. и соавт. [11], сегодня рак молочной железы является второй по значимости причиной смерти от рака у женщин (после рака легких) и самым распространенным видом рака среди женщин, за исключением немеланомных раков кожи.
Samani и соавт. отмечали, что понимание и количественная оценка механических свойств тканей молочной железы являются предметом исследований в течение последних двух десятилетий[12]. Это отчасти мотивировано интересом к моделированию реакции мягких тканей при планировании хирургической операции и хирургической подготовки на основе виртуальной реальности. Интерпретация эластографических изображений в диагностических целях также требует хорошего понимания механических свойств нормальных и патологических тканей. Надежных данных об упругих свойствах тканей очень мало, а доступные, как правило, противоречивы, отчасти из-за методологии измерений. Авторы разработали специализированные методы для измерения эластичности тканей нормальных тканей молочной железы и опухолевых образцов и применили их к 169 свежим ex vivo образцам тканей, включая жировую и фиброгландулярную ткани, а также к ряду доброкачественных и злокачественных опухолей молочной железы. Результаты показывают, что при условиях небольшой деформации модули упругости нормальной жировой и фиброгландулярной тканей молочной железы одинаковы, в то время как фиброаденомы имеют примерно вдвое большую жесткость. Фиброзно-кистозная болезнь и злокачественные опухоли демонстрируют 3–6-кратное увеличение жесткости, а инвазивная протоковая карцинома высокой степени злокачественности демонстрирует до 13-кратного увеличения жесткости по сравнению с фиброгландулярной тканью. Статистический анализ показал, что различия между модулями упругости большинства этих тканей статистически значимы.
Это показывает, что жировая и фиброгландулярная ткани обладают одинаковой жесткостью при небольших деформациях. Авторы обнаружили, что фиброаденомы примерно в два раза жестче фиброгландулярной ткани, в то время как высокозлокачественные опухоли инфильтрирующей протоковой карциномы (IDC) в 13 раз жестче нормальных тканей. Остальные доброкачественные и раковые ткани оказались в 3–6 раз жестче нормальной фиброгландулярной ткани. Данные измерений модуля Юнга тканей представлены в табл. 2.
В таблице 1 указано, что 169 образцов тканей включали: 71 – образцы жировой ткани, 26 – фиброгландулярных тканей, 16 – фиброаденоматозных тканей, 4 – тканей с фиброзно-кистозной болезнью (FSD), 4 – образцы с инфильтрирующей дольковой карциномой (ILC), 4 – с протоковой карциномой in situ (DCIS), 12 – с инфильтрирующей протоковой карциномой (IDC) низкой степени злокачественности, 21 – с IDC промежуточной степени злокачественности, 9 – с IDC высокой степени злокачественности, 1 – с инвазивной муцинозной карциномой (IMC) и 1 – с жировым некрозом. За исключением небольшого количества образцов нормальной ткани все остальные образцы были получены от разных пациентов.
В исследовании Nazri N.N.A. и соавт. [13] оценивались напряжение и деформация тканей молочной железы, вызванные одиночной злокачественной опухолью. В качестве тканей рассматривали три основных слоя: железистую, жировую ткань и кожу. Результаты показали, что железистая ткань, имеющая наибольшую плотность материала, испытывает большие напряжение и деформацию, чем другие. При моделировании авторы использовали данные о свойствах материалов из табл. 3.
Galbreath S. и соавт. [14] удалось измерить модуль Юнга связки Купера, его величина оказалась равной 30 кПа, при этом линейный участок деформации связки простирался до 30%, тогда как для жировой и железистой он был < 10%.
В работах Wellman P.S. и соавт. [15, 16] экспоненциальные кривые использовались для описания кривых напряжение-деформация в нелинейной модели молочной железы, полученной при интерпретации одноосного нагружения ткани [17] :
E = b·emε,
где b и m – параметры, определяемые экспериментально для каждого типа ткани:
bжелез = 15,1 кПа, mжелез = 10,0;
bжир = 4,46 кПа, mжир = 7,4.
Кривые напряжение-деформация в этой модели были построены путем подгонки квадратичных и полиномов третьего порядка к данным о зависимости модуля Юнга от деформации жировой и железистой ткани, соответственно, а затем интегрирования по деформации. Подогнанные кривые зависимости модуля Юнга (E в ГПа) от деформации (ε) были следующими:
Eжелез = 123,8889ε3 – 11,7667ε2 + 0,6969ε + 0,0121;
Eжир = 0,5197ε2 + 0,0024ε + 0,0049.
Жесткость ткани зависит от ее микро- и макроскопической структур, которые меняются при патологическом процессе. Молочная железа имеет гетерогенную структуру, состоящую из различных тканей, таких как жировая, железистая и фиброзная (рис. 1), в различных пропорциях, зависящих от возраста [13]. Каждая молочная железа состоит из долей, которые погружены в фиброзную и жировую ткани вместе с нервами, кровеносными и лимфатическими сосудами. Для поддержания формы и контура груди и удержания ее на месте существуют фиброзные поддерживающие связки, называемые связками Купера. При старении наблюдается растяжение и ослабление связок Купера. Что касается других тканей молочной железы, помимо морфологии и структуры меняются также механические их свойства на протяжении жизни женщины из-за таких факторов, как лактация, возраст, менструальный цикл, беременность, менопауза и т.д. Более того, патологии также оказывают значительное влияние на механические свойства тканей молочной железы [6], потому как их эластичность – это свойство, которое изменяется при наличии заболевания [6, 10].
Результаты in vivo экспериментов по измерению модуля Юнга тканей молочной железы в норме и при наличии заболеваний авторы [19] представили в табл. 4.
Судя по имеющейся информации о поведении тканей молочной железы при механическом воздействии, исследователи сосредоточены на измерении модуля упругости. Действительно, модуль Юнга является наиболее распространенным показателем при количественной оценке жесткости тканей. В простейшем случае его можно получить через наклон кривой зависимости напряжения от деформации, рассматривая упругую область. Как правило, мягкие ткани предполагаются изотропными и несжимаемыми, что обусловлено высоким содержанием в них жидкости (в основном воды). Условие несжимаемости подразумевает, что коэффициент Пуассона равен 0,5; это означает, что, если сжимающая нагрузка приложена в осевом направлении, материал расширяется в двух других направлениях в отношении 1 : 2 относительно оси сжатия. Вследствие этого коэффициент Пуассона биотканей близок к 0,5, и с учетом этой особенности их можно механически охарактеризовать, используя только модуль Юнга.
Детальный обзор исследований упругих свойств жировых и фиброгландулярных тканей молочной железы представлен в работе Ramião N.G. и соавт. [6].
В нескольких исследованиях [10, 12, 15, 16, 27, 28, 29] были количественно оценены механические свойства компонентов молочной железы (модуля Юнга), чтобы связать жесткость ткани и ее тип. Эти работы показали, что опухоли значительно жестче, чем нормальные ткани. В понимании авторов исследований это происходит потому, что опухолевые ткани подвергаются ремоделированию коллагена, что приводит к повышению их жесткости. Также, по мнению Lopez J.I. и соавт. [30], «ориентированные, утолщенные коллагеновые волокна, вдоль которых, как было замечено, мигрируют клетки опухоли молочной железы, действительно являются источником повышения жесткости ECM – внеклеточного матрикса».
При этих предположениях в 1994 г. российские биофизики из Пущино [31] представили результаты, в которых они измерили модуль упругости 168 ex vivo образцов нормальной, фиброаденоматозной и опухолевой тканей молочной железы. Полученные значения модуля Юнга они позиционировали от 2,0 кПа для нормальной ткани до 15,0 кПа для инвазивной протоковой карциномы. Однако исследователи подробно не описали свою систему измерений, поэтому сейчас трудно определить источник обнаруженных различий.
Также в 1995 г. они же [32] сообщили об исследовании 150 образцов нормальной, фиброаденоматозной и раковой тканей молочной железы. Было показано, что фиброаденомы обычно в четыре раза жестче, чем нормальная ткань, в то время как опухоли могут быть жестче нормальной ткани в семь раз. Интересно, что Сарвазян А.П., заведующий лабораторией Института теоретической и экспериментальной биофизики РАН, в «Размышлениях об Андрее Сковороде и его вкладе в биомедицинскую механику» отмечал: «… крайне нелегко найти модуль Юнга мягких тканей тела».
Samani A. и соавт. [12] предложили два различных метода измерения эластичности ткани. Они протестировали ex vivo 169 образцов ткани молочной железы, включая жировую и фиброгландулярную ткани, доброкачественные и злокачественные опухоли молочной железы. Было установлено, что при небольших деформациях жировая и фиброгландулярная ткани обладают идентичными механическими свойствами с одинаковым модулем Юнга, равным 3,25 кПа. Полученные данные показали существенно более высокий модуль Юнга у опухолевой ткани , чем у фиброгландулярной ткани, по сравнению с данными Sarvazyan A.P. и соавт. [32]. Авторы также наблюдали общее увеличение модуля упругости при более инвазивном раке по сравнению с другими типами опухолей. Так, злокачественные инвазивные протоковые карциномы были самыми жесткими, демонстрируя модуль Юнга примерно в 13 раз больше, чем у жировой или фиброгландулярной ткани, в то время как другие типы опухолей имели жесткость ткани в три – шесть раз больше. Хотя в этой работе есть сходство с результатами Sarvazyan A.P. и соавт. [32], корреляция с данными, полученными Bakic P. и соавт. [33], а также Krouskop T.A. и соавт. [10], отсутствует. В целом, авторы получили меньшие значения модуля Юнга по сравнению со значениями, полученными Krouskop T.A. и соавт. [10], что наглядно демонстрирует вариацию модуля Юнга, наблюдаемую в исследованиях. Эти разногласия могли возникнуть как вследствие различий в предварительной нагрузке и подготовке образцов, так и по другим методическим причинам.
Matsumura T. и соавт. [34] измерили ex vivo модули упругости при различных предварительных деформациях 60 образцов нормальной и 27 образцов патологических тканей молочной железы. Они подтвердили нелинейность эластичности ткани и разницу в модуле Юнга тканей в зависимости от уровня сжатия. Например, протоковая карцинома in situ (DCIS) показала большую жесткость, чем нормальная жировая или железистая ткань, при небольшом напряжении, но соотношение между ними менялось при увеличении нагрузки. IDC и муцинозная карцинома продемонстрировали значительно большие модули Юнга, чем нормальные ткани (жировая и железистая) и DCIS. Авторы также подтвердили, что эластичность IDC варьируется в широком диапазоне сжатия.
Umemoto T. и соавт. [35] измерили упругие модули 86 образцов тканей, из них 33 – опухоли и 53 – нормальные ткани (жир: 29 участков, железистая: 24 участка). Модули Юнга тканей молочной железы различались в условиях небольшой нагрузки (< 1 кПа), и порядок возрастания их по эластичности был следующим: жировая ткань, нормальная железистая ткань, протоковая карцинома in situ (DCIS) и инвазивная протоковая карцинома (IDC). Скорости увеличения упругости нормальных тканей молочной железы по напряжению от 0,0 до 1,2 кПа были значительно выше, чем у злокачественных тканей, особенно для IDC. В итоге модули Юнга нормальных тканей нелинейно увеличивались до такой степени, что они приблизились к таковым значениям у злокачественных тканей или превышали их. Авторы также подтвердили значительную разницу в нелинейности между DCIS и IDC, особенно в зависимости напряжения от деформации в условиях небольших напряжений (рис. 2).
Lawrence A.J. и соавт. [20] были одними из первых, кто применил in vivo магнитно-резонансную эластографию (МРЭ) молочной железы. В общей сложности девять здоровых женщин-добровольцев были обследованы и продемонстрировали, что МРЭ осуществима и может адекватно характеризовать упругие биомеханические свойства железистой ткани (2,45 ± 0,2 кПа) и жировой ткани (0,43 ± 0,07 кПа) (табл. 4).
Kruse S. и соавт. [37] представили предварительные результаты исследования МРЭ in vivo пациента с подтвержденной биопсией карциномой и показали, что локализованная область, которая примерно в два-три раза более жесткая, чем окружающая фиброзная ткань, соответствует подтвержденной биопсией опухоли.
Аналогичным образом Sinkus R. и соавт. [38] сообщили, что карцинома демонстрирует анизотропное распределение упругости, в то время как окружающая доброкачественная ткань выглядит изотропной. Результаты, полученные in vivo, выявили увеличение жесткости фоновой ткани более чем в три раза по сравнению с очагами поражения (табл. 4).
Van Houten E.E. и соавт. [24] разделили объемы жировой и фиброгландулярной тканей в молочной железе путем ручной сегментации. Авторы пришли к выводу, что жировая ткань имеет более низкие модули Юнга по сравнению с другими тканями (рис. 3).
Srivastava A. и соавт. [9] измерили механические свойства нормальной, злокачественной и доброкачественной тканей молочной железы. Эти авторы сообщили, что модуль Юнга для образцов злокачественной ткани молочной железы примерно в четыре раза выше, чем у нормальных тканей, тогда как для образцов доброкачественной ткани он примерно в два раза выше, чем у нормальных образцов (табл. 4). Приведенные данные согласуются с предыдущими исследованиями таких авторов, как Krouskop T.A. и соавт. [10], Wellman P.S. и соавт. [15, 16], Samani A. и соавт. [12].
McKnight A.L. и соавт.[23] исследовали шесть здоровых добровольцев и шесть пациентов с подтвержденными биопсией пальпируемыми злокачественными новообразованиями молочной железы и пришли к выводу, что средняя жесткость при сдвиге опухолей составляла 33 кПа (диапазон – 18–94 кПа), что примерно в четыре раза больше, чем у жировой ткани (среднее – 8 кПа, диапазон – 4–16 кПа) пациентов с раком молочной железы. У здоровых добровольцев среднее значение для жировой ткани составляло 3,3 ± 1,9 кПа, что меньше, чем для их фиброгландулярной ткани (7,5 ± 3,6 кПа) более чем в два раза (табл. 3).
Xydeas T. и соавт. [21] изучали вязкость и эластичность тканей молочной железы у пяти пациенток с шестью злокачественными новообразованиями, одиннадцати пациенток с доброкачественными новообразованиями и четырех пациенток без новообразований с помощью МРЭ. Целью исследования было изучение потенциальной ценности МРЭ для улучшения дифференциации доброкачественных и злокачественных опухолей. Средние параметры эластичности составляли: рак молочной железы – 3,1 ± 0,7 кПа, фиброаденома – 1,4 ± 0,5 кПа, фиброзно-кистозные изменения – 1,7 ± 0,8 кПа и окружающие ткани – 1,2 ± 0,2 кПа. Согласно исследованию, злокачественные опухоли демонстрировали более высокие значения жесткости, чем доброкачественные, в соответствии с интенсивностью сигнала и морфологическими данными (табл. 4).
Sayed A. и соавт. [39] использовали мульти-компрессионную 3D–ультразвуковую эластографию и продемонстрировали способность этого метода диагностировать жесткие образования в ткани молочной железы. Результаты, полученные in vivo, показали, что образования были примерно в 6,3 раза жестче, чем окружающие мягкие ткани. Эти результаты были сопоставлены с результатами биопсии и показали хорошее соответствие. Следует отметить, что было подтверждено, что обычно распределение напряжений неравномерно в теле, а эластичность тканей – нелинейна. Вследствие нелинейности тканей модуль Юнга имеет тенденцию к увеличению при усилении сжатия, что соответствует рис. 2.
В исследовании, проведенном Barr R.G. и соавт. [4], были протестированы четыре области предварительной компрессии (области: 0–10%, 10–25%, 25–40% и > 40%), которые объясняют клинические эластографические результаты. Был сделан вывод, что при небольшой степени компрессии, приблизительно 10% от общей массы ткани, разница в модуле Юнга между тканью молочной железы и опухолевой тканью велика, и, следовательно, опухолевая ткань четко идентифицируется в области относительно низкой деформации. Но при высоких уровнях компрессии (около 40% и больше) жесткость ткани молочной железы увеличивается, а разница с опухолевой тканью становится меньше.
Чтобы противостоять этому эффекту, Chen J. и соавт. [22] разработали предварительное исследование с использованием новой некомпрессионной магнитно-резонансной томографии (МРТ) молочной железы. Это исследование проведено с участием семи здоровых женщин-добровольцев и одной пациентки с подтвержденной биопсией инвазивной протоковой карциномой. У семи добровольцев жесткость жировой ткани варьировалась от 0,25 до 0,41 (среднее 0,33) кПа, а железистой – от 0,46 до 0,9 (среднее 0,64) кПа. У 41-летней пациентки жесткость жировой ткани составила 0,41 ± 0,10 кПа, а железистой – 0,90 ± 0,18 кПа. Инвазивная протоковая карцинома была еще более жесткой – 1,42 ± 0,17 кПа, как показано в табл. 4. Таким образом установлено, что инвазивная протоковая карцинома примерно в три раза жестче, чем жировая ткань, и в 1,5 раза жестче, чем железистая ткань.
На основании данных, полученных в результате анализа исследований, были сделаны следующие выводы:
- кривые напряжение-деформация тканей молочной железы, описывающие механическое поведение ткани при различных уровнях напряжения, имеют экспоненциальный характер, причем злокачественные опухоли демонстрируют более крутую кривую, чем доброкачественные ткани;
- модули упругости фиброзной, железистой и опухолевой тканей значительно выше, чем у жировой ткани, и не постоянны вдоль исследуемых вариаций деформации. Поведение жировой ткани ближе к линейному по сравнению с другими исследованными тканями.
В исследованиях Wellman P. и соавт. [15, 16], а также Krouskop T.A. и соавт. [10] обнаружена зависимость механических свойств от используемой методики: если изображение распределения модуля упругости по всей молочной железе было получено при одном уровне деформации, а затем уровень деформации был удвоен, вся сжатая ткань увеличивала свою жесткость. Таким образом, модуль Юнга тканей молочной железы сильно зависит от уровня предварительной нагрузки, а относительная жесткость является хорошим предиктором гистологического диагноза.
Результаты этих исследований ясно указывают на широкий диапазон модулей не только между различными типами тканей, но и внутри каждого типа. Эти различия были наиболее очевидны в нормальной жировой и фиброгландулярной тканях.
В рассмотренных исследованиях использовались различные методы для оценки распределения жесткости тканей в молочной железе. Однако в литературе имеется очень мало информации о механических свойствах, которая позволила бы сделать выводы о гистологической природе ткани непосредственно из оцененной жесткости.
Одним из новейших методов определения модуля Юнга в биологических тканях является использование атомно-силовой микроскопии. В 2024 г. Taheri M. и соавт. [40] исследовали модуль Юнга тканей с раком молочной железы с помощью атомно-силовой микроскопии, применяя различные типы кантилеверов. В данном исследовании атомно-силовой микроскоп был впервые использован для определения модуля Юнга у ткани рака молочной железы MCF-10 с использованием трех различных кантилеверов с прямоугольной, V-образной и кинжальной геометрией. Диаграмма зависимости силы от глубины индентирования была построена путем усреднения экспериментальных результатов для каждого из кантилеверов отдельно. Модуль Юнга тканей для всех кантилеверов был получен с помощью контактной модели Герца. Было обнаружено, что использование V-образного кантилевера предсказывает более точный диапазон модуля Юнга, главным образом из-за приложения меньшей силы к ткани. При использовании V-образных кантилеверов модуль Юнга раковой ткани молочной железы продемонстрировал значения в диапазоне от 1200 до 1250 Па.
O'Hagan J.J. и соавт. [41] утверждают, что упругие и гиперупругие свойства биологических мягких тканей представляют интерес для медицинского сообщества, поскольку существует ряд приложений, где параметры, характеризующие эти свойства, имеют решающее значение для надежного клинического результата. Сюда входят такие приложения, как планирование хирургии, пункционная биопсия и диагностика рака с использованием медицинской визуализации. Хотя были приложены значительные усилия по измерению линейного модуля упругости небольших образцов тканей, было выполнено мало исследований для измерения параметров, характеризующих нелинейную упругость тканей, включенных в образцы срезов. Эта работа была посвящена методу измерения гиперупругих параметров образцов срезов тканей с опухолями. В представленном методе для измерения гиперупругих свойств опухоли внутри образца среза опухоль вдавливалась для получения ее реакции на силу-смещение, в то время как срез оставался нетронутым. В измерениях использовался цилиндрический индентор с плоским концом диаметром 5 мм. Параметры нагружения на индентор включали частоту 0,1 Гц, 5 циклов нагружения, предварительную нагрузку 1–3 г, для фантомных образцов вдавливание составляло примерно 30% от общей высоты образца. Для расчета гиперупругих параметров из полученных данных были разработаны два метода инверсии, которые используют нелинейную модель конечных элементов среза в качестве решателя прямой задачи. Один из этих методов основан на нелинейной оптимизации, а другой представляет собой новый итерационный метод, обрабатывающий переменные наклоны кривой зависимости силы от смещения для расчета гиперупругих параметров. Последний метод разработан специально для модели Йео и полиномиальной гиперупругой модели 2-го порядка, поскольку обнаружено, что другой метод инверсии, основанный на оптимизации, неэффективно работает с этими моделями. Для валидации предложенных методов проведены численные и фантомные эксперименты. Достигнута сходимость в широком диапазоне параметров начальных предположений с погрешностью в пределах 1% в экспериментах с численным моделированием и с погрешностью около 5–10% в фантомах, имитирующих ткань. Более того, эти методы были успешно применены к данным, полученным при исследовании 44 образцов патологических срезов ткани молочной железы, где целью было определение гиперупругих свойств опухоли в срезах ткани молочной железы. Был проведен статистический анализ для попытки установить корреляцию между специфическими гиперупругими свойствами и патологией ткани. Был сделан вывод о необходимости дальнейших исследований для подтверждения надежности использования гиперупругих параметров для классификации рака. Также были сделаны выводы, что на основании имеющихся данных может быть сложно идентифицировать конкретные патологии исключительно на основе отдельных гиперэластичных параметров и что может потребоваться рассмотрение всего набора параметров, а также, что на жесткость тканей могут влиять и другие факторы, помимо тканевой патологии, например возраст.
Однако существуют публикации, где авторы утверждают, что итоги моделирования вмешательств на молочной железе слабо зависят от параметров ее упругих свойств. Roose L. и соавт. [42] выполнили валидацию различных методов моделирования мягких тканей для увеличения груди. Авторы представили вычислительную модель, способную моделировать послеоперационную форму груди с точностью до 1 см после субгландулярной имплантации. В трех протестированных моделях упругости модуль Юнга варьировался от 1,7 кПа до 500 кПа (!), но максимальная погрешность между различными симуляциями составляла всего 5% от общего смещения и была менее 2,5 мм. Следовательно, авторы заключили, что модуль Юнга мало влияет на конечный результат и что можно использовать при моделировании однородную ткань с произвольно выбранной упругостью ткани.
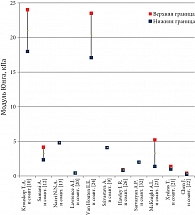
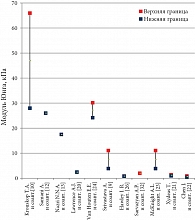
Представленные численные данные по модулю Юнга жировой и железистой тканей молочной железы сгруппированы на рис. 4 и 5. Среднее значение модуля составило 4,38–5,94 кПа и 9,24–14,18 кПа соответственно. То есть по данным литературы железистая ткань оказалась примерно в 2 раза жестче. А опухолевая ткань еще жестче: в несколько и даже десятки и сотни раз – до 18–94 кПа (McKnight A.L. и соавт. [23]) и 22–558 кПа (Krouskop T.A. и соавт. [10]).
Гиперупругие свойства
За последнее десятилетие возрос интерес к моделированию деформации мягких тканей [12]. Эта тема имеет ряд биомедицинских приложений – от медицинской визуализации до роботизированной телехирургии. Однако нелинейные механические параметры мягких тканей, критически важные для разработки надежных моделей деформации тканей, недостаточно известны. Для решения этой проблемы авторы разработали систему для измерения гиперупругих параметров небольших образцов тканей ex vivo. Этот метод измерения заключается в индентировании небольшого блока ткани с помощью управляемой компьютером системы нагружения с одновременным измерением результирующего усилия индентирования. Нелинейная реакция сила – смещение ткани использовалась для расчета гиперупругих параметров. Возможности системы продемонстрированы на двух образцах тканей молочной железы и представлены типичные результаты гиперупругости. Авторы показали, что гиперэластичные параметры нормальных тканей молочной железы можно измерить независимо. Рассчитанные средние значения и стандартные отклонения гиперэластичных параметров двух образцов жировой и фиброгландулярной тканей представлены в табл. 5. В таблице 5 значения C10 и C01 указывают на то, что начальный модуль Юнга исследованных образцов ткани составляет E = 6 (C10 + C01) = 3,6 кПа. Гиперэластичные параметры более высокого порядка указывают на то, что при более высоких деформациях фиброгландулярная ткань более жесткая, чем жировая. То же самое наблюдали и Krouskop T.A. и соавт. [10].
В молочной железе взрослой женщины железистая и жировая ткани перемешаны и не могут быть четко разделены [44]. В данной работе изучается, можно ли рассматривать эту смесь как гомогенизированную ткань. Предлагается механическая модель для смеси тканей в зависимости от содержания жира. Для проверки корректности модели смеси были опробованы различные распределения отдельных тканей и геометрий. Многомасштабный подход к моделированию был применен в конечно-элементной модели репрезентативного объемного элемента (RVE) ткани, сформированного путем случайного распределения жировых или железистых элементов в сетке. Оба типа тканей предполагались изотропными, квазинесжимаемыми гиперупругими материалами, моделируемыми полиномиальной функцией энергии деформации, как и гомогенизированная модель. RVE подвергалась нескольким вариантам нагрузки, из которых константы полиномиальной функции гомогенизированной ткани были подобраны методом наименьших квадратов (табл. 6). Результаты подтверждают, что соотношение объема жира с общим объемом является ключевым фактором, определяющим свойства гомогенизированной ткани, но пространственное распределение жира не столь важно. Таким образом была разработана упрощенная модель молочной железы, чтобы проверить корректность гомогенизированной модели в геометрии, близкой к реальной.
В работе O’Hagan J.J. и соавт. [45] представлены результаты гиперэластичных измерений 44 патологических образцов ткани молочной железы ex vivo. Для исследований использовалось нагружающее устройство, состоящее из компонентов: программируемого линейного серводвигателя, тензодатчика, компьютерной системы для управления движением и сбора данных. Линейный привод имел разрешение 5 мкм в диапазоне 25 мм. Нагрузка тензодатчика составляла 5 фунтов, диаметр индентора с плоским концом – 5 мм, а управление системой осуществлялось с помощью программы LabView. Нагружение было синусоидальным по времени, с 5 циклами частотой 0,1 Гц. Для предварительной подготовки было применено 20 циклов нагружения. Предварительная нагрузка осуществлялась с усилием ~1,0 г для обеспечения полного контакта между тканью и индентором. Для каждого образца использовались пять гиперэластичных моделей, включая модели Йео, полиномиальную 2-го порядка, Огдена 1-го порядка, Арруда – Бойс и Веронда – Вестманн (табл. 7). Результаты показали, что модели Йео, полиномиальная и Огдена являются наиболее точными с точки зрения подгонки экспериментальных данных. Установлено, что почти все параметры, соответствующие патологическим тканям, от двух раз до более чем на два порядка больше, чем параметры нормальных тканей, причем постоянная C11 полиномиальной модели показывает наиболее существенное различие. Кроме того, статистический анализ продемонстрировал, что C02 модели Йео и C11 и C20 полиномиальной модели имеют очень хороший потенциал для классификации рака, поскольку они показывают статистически значимые различия для различных форм рака, особенно для инвазивной дольковой карциномы (рака молочной железы, встречающегося в 15% случаев).
По мнению авторов, в отдаленном послеоперационном периоде эстетический результат в значительной степени обусловлен гравитационным птозом и смещением тканей. В этом плане учет эластических свойств тканей молочной железы может позволить более точно прогнозировать стабильность результата и внести коррективы в планирование оперативного вмешательства и необходимость повторной коррекции в дальнейшем.
Большинство хирургических операций в пластической хирургии груди являются либо реконструктивными операциями после онкологических вмешательств (туморэктомия, квадрантэктомия, мастэктомия и т.д.), либо эстетическими, как увеличивающими, так и уменьшающими. При современных методах результаты таких процедур не могут быть полностью гарантированы. Обычно хирургическое планирование основано только на фотографическом и антропометрическом исследовании груди. Среди прочего, одной из трудностей, с которыми сталкиваются пластические хирурги, является заметное изменение формы груди в зависимости от положения пациента. Таким образом, необходимо планировать предоперационную методику, чтобы помочь пластическому хирургу и гарантировать пациентке успешный результат вмешательства. Чтобы разработать надежный метод моделирования, который мог бы предсказать индивидуальный для пациента результат после операции на груди, исследование del Palomar A.P. и соавт. [46] начато с попытки коррелировать пространственные характеристики груди в положениях лежа и стоя. Предложена и внедрена в контекст конечных элементов биомеханическая модель груди для прогнозирования деформаций и, на их основе, определения формы груди в различных положениях.
В таблице 8 представлены материальные константы для различных функций плотности энергии деформации, предложенные несколькими авторами для жировой и фиброгландулярной тканей и использованные авторами при расчетах: E соответствует модулю Юнга в моделях упругости, C1 является константой для определения неогуковской модели, константы C10, C01, C11, C20, C02 определяют полиномиальную модель, а константы b и m определяют экспоненциальную модель для модуля Юнга E = bemε.
Классификация тканей, основанная на их жесткости, полезна для ранней диагностики рака. В частности, здоровье тканей молочной железы диагностируется по их жесткости. В статье Zaeimdar S. и соавт. [48] предлагается метод определения механических характеристик различных мягких тканей, который может быть полезен при выявлении аномалий мягких тканей. Исследование было сосредоточено на характеристике тканей и выявлении взаимосвязи между патологическими изменениями и механическими свойствами тканей с использованием метода эластографии (метод диагностики рака с использованием реакции мягких тканей на деформацию), основанного на гиперупругой модели Йео. Применимость модели Йео была подтверждена путем компрессионных испытаний фантомов молочной железы, тканей животных и тканей человека in vivo.
Биомеханики Пермского национального исследовательского политехнического университета совместно с учеными ЮАР в детальном обзоре [49] отмечали, что, как и многие биологические ткани, ткани молочной железы проявляют гиперупругие свойства при деформировании. Для описания сжимаемого материала они использовали двухпараметрическую гиперупругую модель Муни – Ривлина. С учетом исходных модулей упругости (20, 35 и 100 кПа для жировой, железистой и опухолевой тканей соответственно) были определены параметры модели:
- C01 = 1,333 кПа, C10 = 2 кПа для жировой ткани;
- C01 = 2333,3 кПа, C10 = 3500 кПа для железистой ткани;
- и C01 = 6,667 кПа, C10 = 10 кПа для опухолевой ткани. Авторы обзора констатировали, что в литературе предложено большое количество гиперупругих моделей для имитации поведения биологических материалов, однако по-прежнему отсутствует глобальная математическая модель, способная точно воспроизвести механическое поведение мягких тканей при различных условиях нагружения.
В заключение отметим, что, несмотря на большое количество литературных, экспериментальных и расчетных данных, первоочередной задачей в этой области остается установление корреляции между специфическими упругими и гиперупругими свойствами и патологией тканей, в том числе тканей молочной железы.
Выводы
Результаты исследования упругих свойств молочной железы крайне вариабельны и зависят от ряда факторов, разнятся даже в рамках одной методики и сильно зависят от наличия/отсутствия патологических изменений тканей, например при наличии опухолей – от их вида.
Современный уровень механических испытаний позволяет измерить параметры упругих свойств in vivo и ex vivo у каждого типа ткани железы отдельно.
Как правило, в исследованиях неизменной является последовательность тканей молочной железы, упорядоченная по возрастанию значений модуля Юнга: жировая – 4,38–5,94 кПа, фиброгландулярная (железистая) – 9,24–14,18 кПа и опухолевая –
18–558 кПа. По данным различных авторов, фиброгландулярная ткань примерно в 2 раза жестче жировой, опухолевая ткань еще жестче в несколько и даже десятки – сотни раз.
Относительная жесткость тканей и ее основной количественный показатель модуль Юнга коррелируют с патологическими изменениями в тканях и являются предиктором гистологического диагноза и раннего выявления болезни.
Анализ механических свойств мягких тканей груди может быть использован при разработке замещающих материалов при реконструктивно-восстановительных вмешательствах и пластических операциях на молочной железе, при оценке гравитационного птоза груди и пр.
Параметры гиперупругих моделей имеют хороший потенциал для классификации рака, поскольку они могут показывать статистически значимые отличия при его различных формах. Однако чтобы связать жесткость тканей молочной железы с их типом, исследование гиперупругих свойств тканей должно быть продолжено.
В литературе предложено большое количество упругих и гиперупругих моделей для имитации поведения тканей молочной железы, однако по-прежнему отсутствует универсальная математическая модель, способная точно воспроизвести механические свойства мягких тканей железы при различных условиях.
Применение метода конечных элементов позволяет описать отклик тканей молочной железы на внешнее воздействие.
S.A. Muslov, PhD, P.Yu. Sukhochev, S.A. Plaksin, PhD, V.V. Shadrin, S.S. Pertsov, PhD
Russian Medical University, Moscow
Lomonosov Moscow State University
E.A. Wagner Medical University, Perm
Institute of Continuum Mechanics, Perm
National Research University, Perm
P.K. Anokhin Research Institute of Normal Physiology, Moscow
Contact person: Sergey A. Muslov, muslov@mail.ru
The stiffness of the tissue depends on its structure, which changes during the pathological process. Therefore, the mechanical behavior of tissues plays an important role in research related to clinical applications, for example, for cancer diagnosis or the creation of surgical simulations. Clinical examination methods use breast examinations to identify lesions that have been proven to be tougher than normal tissues. Therefore, it becomes important to study breast tissue using experimental methods in vivo and ex vivo for their mechanical characterization.
The article provides data from the world literature on the study of the deformation properties of the human mammary gland and its response to external influences. Based on experimental data, it has been established that the stiffness of the gland tissues is a good predictor of the histological diagnosis. In addition to possible use in cancer classification, the presented data are important for planning surgical interventions and in a virtual reality-based medical training system, when accurate nonlinear modeling of tissue response is required.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.