Некоторые аспекты противоопухолевого иммунитета при раке молочной железы
- Аннотация
- Статья
- Ссылки
- English
Основные направления иммунологических исследований касаются прогностического и предиктивного значения иммунологического ответа с точки зрения патоморфологии и общей иммунологии, включая инфильтрирующие опухоль лимфоциты (TILs CD3, CD4, CD8) и их количественное соотношение и корреляцию с регуляторными генами (PD-1, PD-L1, FOXP3).
Появляется все больше сообщений о встречаемости и абсолютном количестве TILs при различных фенотипах РМЖ. Имеются сообщения о непосредственных и трехлетних результатах анти-PD-L1-иммунотерапии в комбинации с химиотерапией у пациентов с метастатическим и местнораспространенным трижды негативным и HER2-позитивным РМЖ, а также при неоадъювантной терапии этих опухолей.
В Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова в 2018–2020 гг. было проведено исследование «Изучение основных механизмов противоопухолевого иммунитета при РМЖ». Фрагменты исследования представлены в статье.
Основные направления иммунологических исследований касаются прогностического и предиктивного значения иммунологического ответа с точки зрения патоморфологии и общей иммунологии, включая инфильтрирующие опухоль лимфоциты (TILs CD3, CD4, CD8) и их количественное соотношение и корреляцию с регуляторными генами (PD-1, PD-L1, FOXP3).
Появляется все больше сообщений о встречаемости и абсолютном количестве TILs при различных фенотипах РМЖ. Имеются сообщения о непосредственных и трехлетних результатах анти-PD-L1-иммунотерапии в комбинации с химиотерапией у пациентов с метастатическим и местнораспространенным трижды негативным и HER2-позитивным РМЖ, а также при неоадъювантной терапии этих опухолей.
В Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова в 2018–2020 гг. было проведено исследование «Изучение основных механизмов противоопухолевого иммунитета при РМЖ». Фрагменты исследования представлены в статье.


Введение
На примере различных типов солидных опухолей показано значение лимфоцитарной инфильтрации в прогнозировании прогрессирования заболевания [1–3]. Она особенно заметна при раке толстой и прямой кишки, а также раке яичников, когда присутствие опухоль-инфильтрирующих Т-клеток связано с уменьшением частоты рецидивов и более продолжительной выживаемостью. Кроме того, модуляция Т-клеточного ответа продемонстрировала клиническую эффективность у пациентов с солидными опухолями, а туморицидный эффект трастузумаба напрямую зависел от иммунного ответа при раке молочной железы (РМЖ).
Некоторые аспекты иммунобиологии РМЖ, в частности роль лимфоцитарной инфильтрации опухоли, начали изучать в Научно-исследовательском институте (НИИ) онкологии им. Н.Н. Петрова в 1967 г. Результаты этого исследования были опубликованы в 1970 г. [1, 2].
Будучи важным элементом адаптивной иммунной системы, цитотоксические Т-клетки (CD8+) могут стать потенциальным биомаркером иммунного ответа на опухоль. В большинстве ранних исследований Т-клеток CD8+ у больных РМЖ сообщалось о связи с благоприятным исходом. Однако в других исследованиях это не подтвердилось. В отличие от Т-лимфоцитов Т-регуляторные лимфоциты (Treg) оказывают иммуносупрессивный эффект, уменьшая ответ на аутоантигены. В связи с этим в ходе научно-исследовательской работы предстояло решить следующие задачи:
- в условиях неоадъювантной системной терапии оценить уровни иммунного ответа опухоли у пациентов с РМЖ (стадии IIA, IIB, IIIA) по данным трепанбиопсии и исследования операционного препарата;
- изучить прогностическое значение Т-клеточной (CD8+, CD3+) лимфоцитарной инфильтрации опухоли и уровня Т-регуляторных (CD4+) лимфоцитов (Treg);
- с помощью иммуногистохимического (ИГХ) исследования проанализировать прогностическое и предиктивное значение экспрессии белков Forkhead Box Protein 3 (FOXP3), ингибиторов контрольных точек PD-1, PD-L1.
Материал и методы
Кроме клинической стадии РМЖ основным требованием при определении прогностических групп РМЖ для стратификации больных групп высокого и низкого риска, исходя из последних представлений (AJCC-8 (American Joint Committee on Cancer), 8-я классификация Американского объединенного онкологического комитета), является установление степени гистологической злокачественности и рецепторного статуса опухоли.
В результате исследования архивного материала канцер-регистра пациентов, проходивших лечение в НИИ онкологии им. Н.Н. Петрова с 2000 по 2009 г., в исследование включено 1240 пациентов. Распределение по стадиям было следующим:
- Т1 – 668 пациентов, из них 47 (7,0%) имели метастазы в лимфатических узлах (Т1а – 9, Т1b – 17, T1c – 132, у оставшихся 511 разделение на подкатегории не проводилось);
- Т2 – 560 пациентов, в том числе 58 (10,3%) c метастазами;
- Т3 – 10 пациентов, в том числе 5 (50%) с метастазами;
- Т4 – 2 пациента с метастазами в аксиллярных лимфоузлах.
Таким образом, РМЖ с метастазами в регионарных лимфатических узлах выявлен у 110 больных. Иными словами, согласно международной классификации TNM, у подавляющего большинства изученных пациентов (n = 1116 (90%)) выявлен ранний РМЖ.
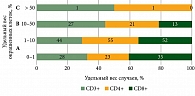
Степень инфильтрации опухоли лимфоцитами определяли количественно, согласно рекомендациям International TILs Working Group 2014 [4]. Критерии оценки: группа A (слабое окрашивание) – 0–10% лимфоцитов в опухоли, группа B (умеренное окрашивание) – 11–59%, группа C (выраженное окрашивание) – 60–100%.
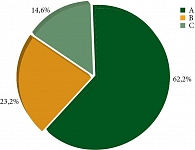
Всего TILs были оценены в 1172 случаях, в частности в 729 (62,2%) внутриопухолевая инфильтрация лимфоцитами была слабой (А), в 272 (23,2%) – умеренной (B) и в 171 (14,6%) случае – выраженной (C) (рис. 1).
Распределение степени инфильтрации TILs по стадиям (категория Т) было следующим:
- Т1 (оценено в 665 случаях) – 449 (67,5%) случаев – группа A, 129 (19,3%) случаев – группа B, 87 (13%) случаев – группа C;
- Т2 (оценено в 498 случаях) – 276 (55,4%) случаев – группа A, 140 (28,1%) случаев – группа B, 82 (16,4%) случая – группа С;
- Т3 (оценено в 9 случаях) – 4 случая – группа A, 3 случая – группа B, 2 случая – группа С.
В Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова первоначально использовали визуальный полуколичественный метод определения статуса TILs: 0–10% позитивно окрашенных лимфоцитов – 0 баллов, до 50% – 2 балла, свыше 50% позитивно окрашенных лимфоцитов – 2 балла (то есть высокий уровень окрашивания). Этот метод наряду с другими применяется при оценке выживаемости.
Для более подробной характеристики иммунного статуса и соотношения различных показателей проводится цифровой анализ изображений для каждого из исследуемых маркеров, включая процентное содержание CD3+, CD4+, CD8+-T-лимфоцитов в строме опухоли по отношению к общей клеточности опухоли (перерасчет в мм2).
Градация уровня CD3+-лимфоцитов представляется в трех группах: группа 1 – 0–5%, группа 2 – 5–20%, группа 3 – более 20%. Градация уровня CD4+-лимфоцитов представляется также в трех группах: группа 1 – 0–4%, группа 2 – 4–20%, группа 3 – более 20%. Уровень CD8+-лимфоцитов в строме опухоли также подразделяется на три группы: группа 1 – 0–2,5%, группа 2 – 2,5–10%, группа 3 – более 10%.
Оценка экспрессии иммунных «регуляторов» PD-L1 и FOXP3 представляется в двух группах: для PD-L1 группа 0 означает отсутствие экспрессии, определяемой методом ИГХ, группа 1 – наличие экспрессии. Для FOXP3 группа 0 означает любой уровень экспрессии, группа 1 – отсутствие экспрессии.
Классификация подтипов РМЖ (трижды негативный РМЖ (тнРМЖ), HER2-позитивный и люминальный HER2-негативный) была основана на ИГХ-исследовании и гибридизации in situ (для HER2 2+).
При реализации способа прогнозирования использовали автоматизированную обработку и анализ цифровых изображений исследуемых гистологических препаратов с помощью компьютерных программ. Процедура определения прогностического параметра является практически оператор-независимой, что повышает точность и объективность способа. На указанный способ прогнозирования РМЖ получен патент № 2697709.
Результаты
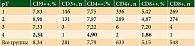
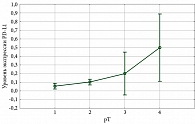
Статус СD3/CD4/CD8+-Т-лимфоцитов изучен в 281, 633, 548 случаях соответственно. Средние значения удельного веса СD3/CD4/CD8+-лимфоцитов на единицу площади опухоли представлены в таблице и на рис. 2. Как видно из таблицы, достоверной связи уровня инфильтрации CD3+, CD4+, CD8+ с размером опухоли категории pT не прослеживается (p = 0,78).
Подавляющее большинство пациентов (около 80%) имели низкие и средние показатели инфильтрации опухоли CD8+ и CD3+-Т-лимфоцитами.
Для оценки значимости иммунологических аспектов противоопухолевого ответа было изучено 638 случаев с регуляторными генами – PD, PD-L1 и FOXP3. В 281, 633, 548 случаях соответственно были также изучены маркеры Т-клеточного ответа CD3, CD4 (регуляторные лимфоциты) и CD8 (цитотоксические).
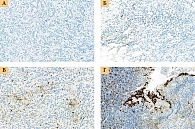
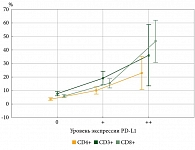
Проанализированы данные 638 пациентов с диагнозом инвазивного РМЖ. С помощью ИГХ-исследования для каждого больного определена экспрессия генов PD, PD-L1. Результаты ИГХ-окрашивания представлены на рис. 3.
Экспрессия белка PD-L1, который связывается с цитотоксическими лимфоцитами и блокирует их активность, является предметом пристального внимания. В нашем исследовании у 108 (8,7%) из 1240 больных выявлена экспрессия PD-L1. В 77 (71,2%) случаях одновременно обнаружена экспрессия CD8, в том числе в 50% случаев выраженная (более 50% от TILs).
Имеется достоверная связь (p = 0,02) увеличения частоты PD-L1+ опухолей с увеличением стадии заболевания. Среди исследуемых больных у 16,92% установлена экспрессия гена PD, PD-L1 в стромальных лимфоцитах, у 9,09% (58 пациентов) – экспрессия гена PD, PD-L1 в эпителиальных клетках опухоли. Анализ показал, что экспрессия гена PD, PD-L1 в эпителиальных клетках опухоли в 5% случаев от общего числа исследованных сопровождалась экспрессией гена PD, PD-L1 в лимфоцитах опухолевой стромы (рис. 4).
Экспрессия регуляторного гена PD-L1 при различных фенотипах РМЖ оценена у 333 пациентов. При люминальном подтипе A экспрессия PD-L1 выявлена лишь у 3 (1,5%) из 202 пациентов, у 199 (98,5%) тест оказался отрицательным.
При тнРМЖ экспрессия PD-L1 наблюдалась у 28 (29,5%) из 95 пациентов, у 67 (70,5%) тест отрицательный. У больных HER2-позитивным РМЖ экспрессия PD-L1 наблюдалась у 8 (18,2%) из 44 пациентов. У 36 (81,8%) PD-L1-тест отрицательный. Таким образом, экспрессия гена PD-L1 выявлена в 39 (11,7%) случаях из 333, реже (1,5%) при люминальном подтипе A, чаще (29,5%) при тнРМЖ (рис. 5).
Достоверно (p < 0,05) на уровень внутриопухолевых лимфоцитов во всех фракциях Т-клеточного ответа (CD3+, CD4+ (регуляторные лимфоциты) и CD8+ (цитотоксические)) влияет наличие экспрессии PD-L1 как на мембранах опухолевых клеток, так и на самих лимфоцитах (рис. 6).
Выживаемость и маркеры иммунологического ответа
Анализ показателей десятилетней выживаемости проведен у 1066 пациентов. В настоящее время известно, что биологическое поведение злокачественной опухоли, которое характеризует скорость ее роста, способность к инвазии и распространению, зависит от причин, связанных как с особенностями самой опухоли, так и с эффективностью или неэффективностью системных защитных механизмов, прежде всего иммунных. В связи с этим актуальным представляется поиск новых подходов к прогнозированию течения заболевания с помощью параметров, учитывающих качественный и количественный состав иммунокомпетентных клеток, в частности различных видов Т-лимфоцитов и их субпопуляций.
Используя высокопроизводительную систему тканевых матриц с одномоментным и однообразным исследованием панели маркеров, мы установили, что процентное содержание CD4+-Т-лимфоцитов в строме опухоли служит прогностическим признаком. При значении процентного содержания менее 20% прогноз можно расценивать как благоприятный. Другие типы оценок CD4+ не оказывали существенного влияния на прогноз заболевания.
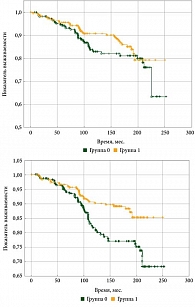
У 296 из исследуемых больных определено процентное содержание CD4+ ≤ 20% (группы 1 и 2). Десятилетняя общая выживаемость в указанных группах достигла 93%. При РМЖ (стадии T1, Т2, N0) такие группы считаются статистически благоприятными. У 98 пациентов процентное содержание CD4+ превысило 50%. Десятилетняя общая выживаемость была достоверно ниже 82% (рис. 7).
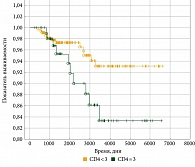
Высокая степень (группа 3) лимфоидной инфильтрации, представленная CD3+, связана с более выраженной тенденцией к повышению безрецидивной выживаемости (р = 0,06) (рис. 8).
Лимфоидная инфильтрация, представленная CD8+, увеличивает безрецидивную и общую выживаемость, особенно при высоком уровне (> 10%).
Экспрессия PD-L1 (влияние на выживаемость)
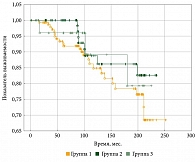
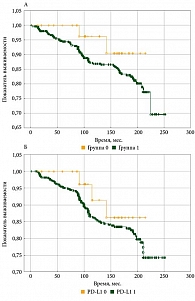
Нами был предпринят анализ как безрецидивной (n = 122), так и общей выживаемости (n = 145) (рис. 9).
Безрецидивная выживаемость была достоверно (р = 0,0027) выше в группе опухолей без экспрессии PD-L1 – 70 против 41%, расхождение кривых выживания по кривой Каплана – Майера (р = 0,02).
Общая выживаемость оказалась выше в группе опухолей без экспрессии PD-L1 – 75 против 50% (p = 0,04) (рис. 9).
В многоцентровом исследовании NeoTRIPaPDL1 с участием Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова (результаты исследования были представлены на ESMO-2020) сравнивали эффективность неоадъювантной терапии, включавшей ингибитор контрольных точек PD-L1 атезолизумаб в комбинации с химиотерапией карбоплатином и наб-паклитакселом, и эффективность только химиотерапии при тнРМЖ [5]. При промежуточной трепанбиопсии в первый день второго цикла терапии отсутствие опухолевых клеток регистрировалось у 28,8% больных, получавших атезолизумаб, и у 13,6% больных, получавших только химиотерапию карбоплатином и наб-паклитакселом.
Отсутствие опухолевых клеток при промежуточной биопсии можно считать предиктивным маркером достижения полного патоморфологического ответа (рСR) на неоадъювантную терапию.
В исследовании NeoTRIPaPDL1 достижение полного патоморфологического регресса (рCR) наблюдалось у 77,7% пациентов с отсутствием опухолевых клеток в промежуточной биопсии против 45,3% при их наличии (p = 0,023). Атезолизумаб «конвертировал» PD-L1-негативные опухоли, наблюдавшиеся у 45,4% больных, в позитивные у 74,6% пациентов. У тех, кто получал только неоадъювантную химиотерапию карбоплатином и наб-паклитакселом, выявлено снижение PD-L1-позитивности с 52,1 до 37,9% [5, 6].
Достижение полного патоморфологического регресса (pCR) на фоне применения атезолизумаба было наиболее высоким (86,9%) у пациентов «иммунообогащенной» группы (PD-L1-позитивные иммунные клетки (PD-L1-IC+)) или со стромальными TILs либо интратуморальными TILs по сравнению с пациентами той же группы, но получавшими только химиотерапию (72,0%; p = 0,02) [7–12].
Прогностическое значение экспрессии FOXP3
Экспрессия FOXP3 (показатели выживаемости) представлена на рис. 10.
Инфильтрация FOXP3-регуляторных Т-клеток в инвазивную опухоль ассоциируется с прогнозом и выживаемостью при многих опухолях. Прогностическое значение FOXP3-инфильтрирующих-опухоль лимфоцитов (TILs) при РМЖ остается противоречивым. FOXP3 TILs оценивали с помощью ИГХ-исследования на тканевых матрицах.
Проанализированы данные 620 больных инвазивным РМЖ. С помощью ИГХ-исследования в каждом случае определяли экспрессию гена FOXP3 (рис. 11).
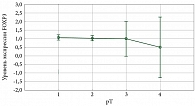
Показано, что экспрессия регуляторного гена FOXP3 практически не изменяется при увеличении стадии заболевания, остается стабильной на всех стадиях – от рТ1 до рТ4 (рис. 12).
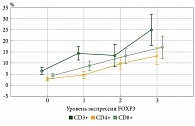
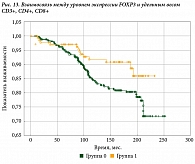
У 296 (47,74%) пациентов из 620 выявлена экспрессия FOXP3 в стромальных лимфоцитах, у 171 (27,5%) – в клетках опухоли. Только у 56 (9,03%) больных обнаружена ко-экспрессия гена FOXP3 как в опухоли, так и в окружающих ее стромальных лимфоцитах. Удельный вес CD3+, CD4+, CD8+ увеличивался по мере повышения уровня FOXP3 (рис. 13).
Наибольший интерес вызывает оценка соотношения цитотоксических лимфоцитов CD8 и регуляторного гена FOXР3. В нашем исследовании CD8+-лимфоциты выявлены в 201 (67,9%) из 296 FOXP3-позитивных случаев. Полученное соотношение 201:296 (0,68) свидетельствует о неблагоприятном прогнозе. Одновременная экспрессия регуляторных генов PD, PD-L1 и FOXP3 обнаружена у 66 (11,6%) из 569 больных.
Оказалось, что наличие экспрессии FOXP3 при ER+ РМЖ на внутриопухолевых лимфоцитах достоверно связано с более низким показателем общей выживаемости (p = 0,06).
Анализ литературы также показывает, что FOXP3 служит маркером неблагоприятного прогноза исхода заболевания, особенно в группе ER+ карцином, и фактором благоприятного прогноза в группе HER2+/ER-.
Как показано на рис. 14, при ко-экспрессии CD8+ и FOXP3 у пациентов с ER+/HER2+ РМЖ наблюдаются более низкие показатели десятилетней общей выживаемости (80 против 92% по сравнению с группой без ко-экспрессии; p = 0,048).
При многовариантном анализе показателей выживаемости высокий уровень FOXP3 TILs достоверно ассоциировался с низкой выживаемостью при ER+ РМЖ с отсутствием CD8+-T-клеточного инфильтрата (относительный риск 1,3). Однако при ER-негативных опухолях FOXP3 TILs отмечалась тенденция к улучшению выживаемости в HER2+/ER-подгруппе, особенно с высоким уровнем (> 20%) CD8+-Т-клеточного инфильтрата.
FOXP3-регуляторные TILs являются отягчающим прогностическим индикатором при HER2+/ER+ РМЖ, но благоприятным прогностическим фактором при HER2+/ER-подтипе РМЖ. Таким образом, прогностическая ценность FOXP3 TILs зависит от экспрессии и статуса ER и HER2 и инфильтрации CD8+-T-клетками.
Обсуждение результатов
Использование в качестве прогностического биомаркера лимфоцитарной инфильтрации опухоли (TILs) позволяет понять биологию тнРМЖ и HER2-позитивного РМЖ.
Были получены высокие результаты в исследовании пациентов с тнНРМЖ и оценкой соотношения CD8/FOXP3 на исходном уровне и в резидуальной опухоли. Показатель пятилетней безрецидивной выживаемости составил 72% у пациентов с высоким соотношением CD8/FOXP3 и 40% – у пациентов с низким соотношением CD8/FOXP3 (p = 0,009) [13].
В нашем исследовании при высоком соотношении (> 2) показатель безрецидивной выживаемости превысил 80%. При низком соотношении CD8/FOXP3 (0,68) показатель десятилетней безрецидивной выживаемости снизился до 47% (p = 0,02).
Патогенетический путь через экспрессию PD-1 и лиганда PD-L1 является главным регулятором иммунного ответа на растущую опухоль. В последние годы были разработаны моноклональные антитела, блокирующие иммунные checkpoint-белки. При РМЖ наиболее исследован препарат атезолизумаб (анти-PD-L1-антитело) [7–12, 14].
В исследовании Impassion 130 на фоне применения атезолизумаба (ингибитора лиганда PD-L1) в комбинации с наб-паклитакселом при метастатическом тнРМЖ отмечалось увеличение показателей двухлетней общей выживаемости в группе с позитивным PD-L1 [10–12].
В исследовании фазы III NeoTRip при нашем участии [14] при первом анализе статистически достоверной зависимости показателя pCR от добавления атезолизумаба не выявлялось во всей группе. Тем не менее частота pCR была выше у пациентов с PD-L1+ (p < 0,0001). Более поздняя оценка исследования NeoTrip, представленная на ESMO-2020 G. Bianchini [14], показала, что применение атезолизумаба в комбинации с карбоплатином и наб-паклитакселом увеличивает достижение полного патоморфологического ответа (pCR) более чем на 10% по сравнению с неоадъювантной химиотерапией.
Выводы
На основании полученных результатов было сформулировано несколько важных выводов.
Во-первых, выраженная (> 10%) лимфоцитарная инфильтрация CD8+, а также CD3+ при низкой экспрессии PD-L1 и FOXP3 улучшает безрецидивную и общую выживаемость пациентов с РМЖ.
Во-вторых, около 80% больных РМЖ имеют низкие уровни инфильтрации опухоли CD8+ цитотоксических Т-лимфоцитов и CD3+ TILs.
В-третьих, экспрессия гена PD-L1 чаще (29,5%) выявляется при тнРМЖ, в 1,5 раза реже (18,2%) при HER2+ РМЖ и крайне редко (1,5%) при люминальном подтипе A.
В-четвертых, подтверждена возможность достижения полного патоморфологического регресса опухоли (pCR) у 2/3 пациентов с экспрессией PD-L1 и экспрессией TILs, получавших атезолизумаб и неоадъювантную химиотерапию (карбоплатин + наб-паклитаксел).
A.I. Tseluiko, V.F. Semiglazov, PhD, Prof., A.G. Kudaybergenova, PhD, A.S. Artemyeva, PhD, V.O. Smirnova, PhD, V.S. Apollonova, R.V. Donskikh, PhD
N.N. Petrov National Medical Research Center of Oncology, St. Petersburg
Contact person: Andrey I. Tseluiko, tselalex@rambler.ru
Breast cancer (BC) treatment planning is based on standard principles: cTNM stage, patient age, molecular subtype (based on IHC determination of ER, PR, HER2, Ki-67 receptors and grade (G). An increasing stream of breast cancer immunology and immunotherapy research in the last few years actually did not concern the practical use
of assessment of the immunological status in the planning of breast cancer treatment (even at the international level: ASCO, ESMO, EBCC, St. Gallen). The main areas of immunological research concern the prognostic and predictive value of the immunological response from the point of view of pathomorphology and general immunology, including tumor-infiltrating lymphocytes (TILs CD3, CD4, CD8) and their quantitative ratio and correlation with regulatory genes (PD-1, PD-L1, FOXP3). There are more and more reports on the occurrence and absolute number of TILs in different breast cancer phenotypes. There are reports of immediate and 3-year results of anti-PD-L1 immunotherapy in combination with chemotherapy in patients with metastatic and locally advanced triple-negative and HER2-positive breast cancer, as well as in neoadjuvant therapy of these tumors. At the N.N. Petrov National Medical Research Center of Oncology in 2018–2020, the study ῾Study of the main mechanisms of antitumor immunity in breast cancer’ was carried out. Fragments of research are presented in the article.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.