Урологический болевой синдром: применение геля Катеджель
- Аннотация
- Статья
- Ссылки




Данная классификация хронической тазовой боли использует осевую структуру классификации международной ассоциации по изучению боли (IASP).
Структура хронической боли характеризуется тремя составляющими (2):
- зарождение хронической боли в разных органах и тканях;
- вовлечение в болевой процесс разных отделов (соматического и вегетативного) нервной системы;
- участие эмоциональной сферы человека и его психики в субъективном восприятии боли.
Таким образом, боль – это сочетанная патология периферических тканей, нервной системы и эмоциональной сферы человека.
Патофизиологической основой хронической боли (не связанной с повреждающим воздействием) является образование и деятельность в системе болевой чувствительности генераторов патологического усиленного возбуждения (ГПУВ) и формирование на их основе патологической алгической системы (ПАС) – дисрегуляторная патология. При заболеваниях периферических тканей и органов каждый болевой синдром начинается с развития патологического процесса вследствие разных причин. Патологический процесс играет роль триггерного механизма, приводящего к нарушению нервной регуляции болевой чувствительности тканей в очаге поражения – формирование периферической боли. Возникающие вследствие прогрессирования заболевания структурные изменения в очаге поражения представляют одну сторону патогенеза патологического состояния в организме. Другой стороной является высвобождение в очаге поражения алгогенных химических агентов, которые вызывают постоянное раздражение чувствительных рецепторов. По избирательности и характеру влияния на нервные окончания их разделяют на несколько групп. Различают тканевые алгогенные вещества (серотонин, гистамин, ацетилхолин, ионы калия и натрия), плазменные агенты (брадикинин, каллидинин и другие вещества), субстанции, выделяющиеся из нервных окончаний (субстанция Р), и целый ряд других химически активных веществ. Это приводит к появлению в системе болевой чувствительности триггерного пункта с последующим разноуровневым формированием в структурах спинного и головного мозга патологических по своей природе и результатам деятельности интеграций нервных клеток и образований.
Хронический характер периферическая боль приобретает в двух случаях:
- при сохранении действия на периферии источника ноцицептивных раздражений;
- при появлении в структурах болепроводящей системы спинного и головного мозга генераторов патологически усиленного возбуждения, способных развивать самоподдерживающую активность и без дополнительной болевой импульсации с периферии.
Клинический опыт показывает, что ключевое значение в возникновении хронической боли имеют процессы, происходящие в периферических тканях и органах, включая сосуды и нервы. Триггерные (пусковые) механизмы играют роль «возмущающих воздействий». Эти механизмы моноголики и могут быть и в отсутствии возмущающего механизма. Пусковым механизмом в развитии хронической боли может стать нарушение проницаемости гисто-гематических барьеров. К этому же результату может привести дизрегуляция физиологических процессов отдельно на уровне нервной системы и отдельно на гуморально-эндокринном уровне. При болевом синдроме триггерные механизмы через многие промежуточные звенья участвуют в регуляции болевой чувствительности периферических тканей. Деятельность триггерных механизмов приводит к гипервозбудимости нейронов. Формируются генераторы патологически усиленного возбуждения сначала на уровне ганглиев, а затем (если деятельность триггерных механизмов продолжается) и в вышележащих отделах болепроводящей системы. Эти генераторы объединены в единую патологическую алгическую систему с присущими ей особенностями. В отличие от болей центрального генеза, для которых характерна устойчивая связь системы с центральной болевой доминантой, алгическая система при болях периферического генеза ориентирована исключительно на периферический фактор. Адекватные по характеру и направленности лечебные мероприятия на периферический аппарат способны у абсолютного большинства больных устранить их. Применение медикаментозной терапии оправдано в случаях, когда их назначают в качестве средств патогенетической терапии для устранения отдельных проявлений патологического процесса в зоне болезненности (например, воспаления). Без применения специфической медикаментозной терапии нельзя представить лечение болевых синдромов, которые имеют вторичное происхождение, являясь по сути осложнением самых разных по своему характеру заболеваний органов и систем (вирусного, микробного, аллергического происхождения, эндокринных, метаболических нарушений, аутоиммунной патологии соединительной ткани, болезней крови и других поражений) (3).
Известны хорошо определенные состояния, вызывающие хроническую тазовую боль (таблица 1).
Интерстициальный цистит (ИЦ) – наиболее частая причина хронической тазовой боли в практике врача уролога (ИЦ – сборное понятие, включает различные состояния).
Диагностические критерии, предложенные NIDDK (рабочей группой по ИЦ в августе 1987 г.) (1), были описаны в основном для исследовательских целей, так как диагноз ИЦ устанавливается методом исключения других заболеваний. Эти критерии не приемлемы в клинической практике, они созданы не с диагностической целью, но вследствие неопределенности описания заболевания они становятся стандартными критериями исключения, используемыми при постановке диагноза. Легче исключить диагноз, чем сделать положительное заключение (1).
Наиболее полно отражает состояние термин «болезненный мочевой пузырь» (ICS, 2003) или «синдром боли в мочевом пузыре». Этиология неизвестна. Есть много предложенных гипотез, но ни одна из них не доказана. Диагноз базируется на симптомах, осмотре, анализах мочи и данных цистоскопии с гидродистензией и биопсией. Все пациенты описывают боль, частое мочеиспускание и ноктурию. Боль, которая может быть очень сильной, обычно увеличивается с наполнением мочевого пузыря и локализуется над лонным сочленением, может иррадиировать в окружающие ткани, облегчение боли возможно после опорожнения мочевого пузыря, хотя она вскоре возвращается. Классическая язва Hunner’а и неязвенные формы ИЦ имеют разные клинические проявления. Классический язвенный ИЦ – это деструктивное воспаление, которое у некоторых пациентов приводит к сморщиванию, фиброзу мочевого пузыря и обструкции верхних мочевых путей. Такого прогрессирующего состояния не отмечается у больных с не язвенными формами мочепузырного болевого синдрома. Эти два состояния различаются по их гистопатологическим, иммунологическим и нейробиологическим данным. Биопсия слизистой мочевого пузыря помогает в постановке диагноза и с целью исключения карциномы in situ, туберкулезного цистита.
На ежегодной конференции ESSIC (Германия, 2007) принят термин «мочепузырный болевой синдром» вместо термина «интерстициальный цистит», однако временно предложено использовать оба термина. Мочепузырный болевой синдром / интерстициальный цистит (BPS / IC) диагностируется на основании хронической тазовой боли (> 6 мес.), давления или дискомфорта, связанных по ощущениям с мочевым пузырем и сопровождаемых по крайней мере одним из мочевых симптомов, таких, как сильное, упорное желание мочиться или учащенное мочеиспускание. При этом должны быть исключены другие заболевания, имеющие похожие симптомы. Дальнейшее определение и классификация BPS / IC могут быть предприняты на основании данных цистоскопии с гидробужированием и морфологических исследований биоптатов.
Часто необходимо дифференцировать боль с уретральным синдромом. Этот симптом включает боль и дискомфорт в области таза, позади лонной кости, частые позывы к мочеиспусканию, чувство неполного опорожнения мочевого пузыря и периодическое жжение после мочеиспускания. Некоторые пациентки отмечают трудность начала мочеиспускания, прерывистую струю мочи и капанье после мочеиспускания. В культуральных анализах мочи микроорганизмов не выявлено, а при осмотре отмечается только незначительная напряженность при осмотре уретры и влагалища. Полагают, что уретральный синдром может вызываться спазмом мышц на уровне тазового дна (4).
Лечение болевого синдрома представляет большие трудности и далеко от доказательных данных. Большинство предлагаемых методов лечения не излечивают, а лишь облегчают симптомы. Необходимо предупредить пациентку, что симптомы заболевания могут продолжаться длительное время, но облегчить такие симптомы, как болевой, частые позывы и неотложность мочеиспускания, можно очень эффективно. Если обострение повторяется, необходимо объяснить пациентке, что симптомы находятся под контролем, хотя и не полностью ликвидированы. Лечение может быть разбито на поведенческую терапию; физиотерапевтические методы воздействия; инстилляции медикаментов в мочевой пузырь через катетер; пероральные лекарственные препараты; нейромодуляторы и оперативное лечение.
Несмотря на большое количество предлагаемых медикаментов, мы до сих пор не умеем управлять этим заболеванием. Мы можем пока только предложить симптоматическое лечение. Но даже назначая лечение для облегчения симптомов, мы помогаем страждущим. Некоторым пациентам удается надолго избавиться от этих симптомов, другим лечение дает временное облегчение, но во всех случаях достигается некоторая польза путем попыток применения разных вмешательств до тех пор, пока не будет найдена правильная комбинация.
Материал и методы
В НИИ Урологии Росмедтехнологий в 2008 г. проведено клиническое несравнительное исследование препарата Катеджель с лидокаином (фирма-производитель MONTAVIT, Австрия) у пациентов с мочепузырным болевым синдромом / интерстициальным циститом (BPS / IC), уретральным болевым синдромом, простатическим болевым синдромом.
Целью исследования было оценить эффективность, безопасность и толерантность применения препарата Катеджель с лидокаином для лечения пациентов с урологическим болевым синдромом.
Гель для наружного применения в гофрированных разовых шприцах 12,5 г – Катеджель с лидокаином – это комбинированный препарат, в 100 г которого содержатся 2 г лидокаина гидрохлорида и 0,05 г дигидрохлорида хлоргексидина. Это стерильный, водорастворимый, бесцветный, прозрачный гель для интрауретральной и интравагинальной инстилляции. Лидокаина гидрохлорид обладает местно-анестезирующим действием. Хлоргексидин влияет на многие грамотрицательные бактерии, но не оказывает действия на кислостойкие бактерии, споры, грибы и вирусы. В данной концентрации хлоргексидин выполняет профилактическую функцию против восходящей инфекции уретры и мочевого пузыря. Адекватная анестезия развивается через 5-10 мин. после применения препарата. Водоpаствоpимый пpозpачный гель обеспечивает четкий оптический обзор при различных эндоскопических пpоцедуpах. Необходимо помнить, что при повышенной чувствительности к компонентам препарата возможны аллергические реакции. Способ применения, продолжительность и концентрация лидокаина, как правило, не приводят к кардио-сосудистым эффектам. При многократном применении при введении в мочевой пузырь или при сильном воспалении в уретре в связи с увеличенной резорбтивной поверхностью возможно уменьшение частоты сердцебиения. Рекомендуется избегать совместного применения с препаратами йода. Ингибиторы МАО усиливают местноанестезирующее действие лидокаина. Не совместим с мылом, а также детергентами, содержащими анионную группу (сапонины, натрия лаурилсульфат, натрия карбоксиметилцеллюлоза). Совместим с препаратами, содержащими катионную группу (бензалкония хлорид).
В исследование были включены взрослые пациентки:
- 1 группа – пациентки с хроническим бактериальным циститом (n = 4);
- 2 группа – пациентки с мочепузырным болевым синдромом / интерстициальным циститом (n = 18);
- 3 группа – пациентки с уретральным болевым синдромом (n = 11).
Средний возраст пациенток в группах: уретральный синдром – 39,2 лет; интерстициальный цистит – 41,79 лет; хронический бактериальный цистит – 46,18 лет.
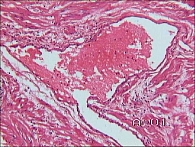
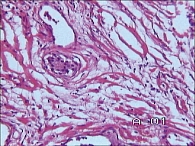
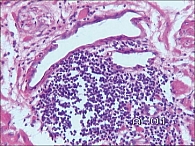
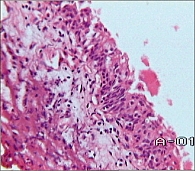
Средняя длительность заболевания до обращения составила 5,32 года. В данной статье мы подробно не рассматриваем анамнез и данные обследования пациенток, включая биопсию мочевого пузыря. У всех пациентов основной жалобой была боль над лоном, в уретре, не купирующаяся медикаментами. У некоторых больных с мочепузырным болевым синдромом / интерстициальным циститом в анамнезе была персистирующая мочевая инфекция, длительное время леченная антимикробными препаратами. У большинства же – отсутствие бактериальной инфекции, а по данным биопсии мочевого пузыря выявлены различные морфологические изменения. Анатомические диспропорции сосудистой стенки как кровеносных, так и лимфатических сосудов приводят к уродливым деформациям сосудов, отеку – один из вариантов развития цисталгии (рисунок 1). Нарушение состояния сосудистой стенки приводит к нарушению ее проницаемости и выраженному интерстициальному отеку – сдавлению нервных окончаний, их деформации, дистрофическим изменениям и болевому синдрому (рисунок 2). Развитие массивных периваскулярных или интерстициальных лимфогистиоцитарных инфильтратов приводит к склерозу подслизистого слоя, деформации нервных стволов и цисталгии (рисунок 3). Альтерация и некроз эпителия при ИМП, выброс биоактивных веществ – серотонин, гистамин, воздействуя на нервные стволы, вызывают боль (рисунок 4).
Гель вводили местно в уретру или во влагалище. После обработки наружного отверстия уретры дезинфицирующим раствором, раскрывают блистер, удаляя бумагу с прозрачного корпуса (по возможности только до перетяжки), далее необходимо отломить кончик без значительного усилия (по возможности еще в упаковке), при этом необходимо проследить, чтобы кончик был полностью удален, во избежание повреждения слизистой мочеиспускательного канала. Для облегчения ввода аппликационного конуса рекомендуется предварительно выдавить каплю Катеджеля. Инстилляция проводится посредством легкого давления на гофрированный шприц. После опорожнения шприца необходимо держать его в сжатом состоянии до изъятия из канала. При этом происходит покрытие гелем всей длины мочеиспускательного канала. Кроме того, у женщин препарат вводили интравагинально, на ночь, устанавливая после введения мини-тампон на 4-6 ч (который утром пациентка удаляла). Введение препарата пациенткам всех групп проводили в течение 10 дней, вводя препарат ежедневно.
Всем пациенткам проводили клинические и лабораторные исследования: физикальный осмотр; сбор анамнеза, термометрию; общеклинические исследования мочи и крови; бактериоскопию мазков из уретры, влагалища и шейки матки; биохимические исследования крови; бактериологические исследования мочи; осуществляли регистрацию выраженности болевого синдрома с использованием визуальной аналоговой шкалы боли (VAS) (таблица 2).
При сборе анамнеза максимально подробно мы выясняли выраженность болевого синдрома у пациенток в группе наблюдения (таблица 3), для объективизации данных мы использовали визуальную аналоговую шкалу боли (VAS) с 10-балльной шкалой. При оценке выраженности болевого синдрома с использованием VAS нами были использованы следующие критерии: 0-2 балла – слабая боль, 3-5 баллов – средняя боль, 6-8 баллов – сильная боль, 8-10 баллов – очень сильная боль.
Выраженность болевого синдрома у всех пациентов была достаточно сильной. Наибольшее количество пациенток с очень сильной болью было в группе с мочепузырным болевым синдромом – 8-10, в группе с уретральным синдромом превалировала сильная боль – 7-9.
Побочные эффекты и аллергические реакции: зуд и жжение в уретре через 2-3 мин. после введения отмечено у 2 пациенток с интерстициальным циститом, которые самостоятельно прекратили лечение (6%), 2 пациентки с бактериальным циститом отметили заметное снижение боли в ходе лечения, однако после 10 инстилляций они вновь отметили боли над лоном.
Системных побочных эффектов нами отмечено не было.
Таким образом, хорошая и отличная клиническая эффективность препарата Катеджель с лидокаином при лечении болевого синдрома у пациентов с мочепузырным болевым синдромом / интестициальным циститом, уретральным болевым синдромом отмечена у 29 (87,87%) пациентов.
Выводы
Гель Катеджель с лидокаином (MONTAVIT, Австрия) зарекомендовал себя как эффективное и безопасное средство для купирования болевого синдрома при мочепузырном болевом синдроме / интестициальном цистите, (цисталгии), уретральном болевом синдроме, хроническом бактериальном цистите.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.